季戊四醇硬脂酸酯(pentaerythritol stearate,PETS)属醇酸酯类润滑剂,内外润滑性能均良好、能提高制品热稳定性、无毒,而且在高温下具有良好的热稳定性、低挥发性,以及脱模和流动性能,在橡胶、塑料行业用作增塑剂、润滑剂,特别适用于同时要求热稳定性和优异脱模性的工况.作为聚碳酸酯(polycarbonate, PC)、聚氯乙烯(polyvinyl chloride, PVC)和其他聚合物体系的外润滑剂时,典型用量为0.1%~1%,低于大多数传统的润滑剂[1-5].
PETS是由季戊四醇和硬脂酸酯化而来,影响其成分组成的因素主要包括以下两个方面[2]:(1)原料因素:工业级季戊四醇(季戊四醇质量分数为87%~90%)—般包括单季戊四醇(monopentaerythritol,MPE)、二季戊四醇(dipentaerythritol,DPE)和三季戊四醇(tripentaerythritol,TPE)及微量的多季戊四醇,工业生产方式主要是甲醛和乙醛缩合反应,可通过控制乙醛和甲醛的投料摩尔比,来调整MPE、DPE和TPE的含量;硬脂酸通常以甘油酯的形式存在于动物脂肪、油及一些植物油中,工业上主要通过分馏法和压榨法得到脂肪油(硬质油),然后水解得到粗硬脂酸,再经水洗、蒸馏、脱色,即得成品,其主要成分为十六烷酸和十八烷酸组成的混合物,对于工业硬脂酸产品的分级,通常来源于植物油酯的分为一级(三次压榨)、二级(二次压榨)和三级(一次压榨)硬脂酸,来自动物油脂的为氢化硬脂酸[6].(2)PETS通常是在酸性催化条件下的简单酯化反应,不同的酯化反应条件,所得产物中季戊四醇四酯(PETS-A)、季戊四醇三酯(PETS-B)、季戊四醇二酯(PETS-C)及季戊四醇单酯(PETS-D)的含量不尽相同[2, 3],根据应用邻域及基础材料的不同,可控制酯化反应的条件,从而得到不同规格的产品.
本文应用核磁共振(nuclear magnetic resonance,NMR)技术,包括1H NMR、定量13C NMR(quantitative 13C NMR,13C qNMR)、DEPT135、1H-1H COSY、1H-1H NOESY、1H-13C HSQC和1H-13C HMBC,对客户提供的组成未知的季戊四醇硬脂酸酯样品,从化学组成角度进行了系统的表征[7].
1 实验部分 1.1 仪器与试剂所有NMR实验均在布鲁克AVANCE Ⅲ HD 600型NMR谱仪上完成,所用探头型号为5 mm PABBO 600S3 BBF-H-D-05 Z SP(Z114607),温控原件及实验控制和数据处理均由Topspin 3.2软件完成[8],溶剂为CDCl3(美国CIL Inc.);所用样品为PETS润滑剂,样品名为PETS-1(主要成分结构式如图 1所示).

|
图 1 PETS-1主要成分结构式(A、B、C、D、E、F用来区分PETS中由酯化程度不同而产生的各个组分;A1、A2、B1、B2等是用来标记每种组分季戊四醇单元的碳.所有的取代基R均为硬脂酸,RA、RB、RC、RD分别表示A、B、C、D组分的硬脂酸基团的羰基碳;R1~R10为硬脂酸基团中除羰基碳以外的碳原子的编号) Figure 1 Main ingredients structures of PETS-1 (A, B, C, D, E, F are used to distinguish the ingredients rooted from the esterification degree; A1, A2, B1, B2, etc. are used to label the carbon of pentaerythritol unit in each ingredient; RA, RB, RC and RD are used to label the carbonyl carbons of ingredients A, B, C and D, respectively; R1~R10 are used to label the stearic acid group carbon except of the carbonyl carbon) |
约30 mg样品溶于CDCl3,以四甲基硅烷(tetramethylsilane,TMS)为内标,在303 K温度下对样品PETS-1进行了1H NMR、13C qNMR、DEPT135、1H-1H COSY、1H-1H NOESY、1H-13C HSQC和1H-13C HMBC测试.1H NMR和13C qNMR的工作频率分别为600.17 MHz和150.92 MHz,1H NMR的谱宽为5 376.34 Hz,脉冲序列为zg30,弛豫延迟D1为2s;13C qNMR的谱宽为36 764.71 Hz,脉冲序列为zgig,弛豫延迟D1为60 s,采样次数ns为3 000;DEPT135的谱宽为36 764.71 Hz,脉冲序列为deptsp135,弛豫延迟D1为2 s,采样次数ns为1 024;二维谱包括梯度场1H-1H COSY、1H-13C HSQC、1H-13C HMBC及1H-1H NOESY谱,均采用标准脉冲程序.1H-1H COSY和1H-1H NOESY的F2维(1H)和F1维(1H)谱宽均为2 590.67 Hz,采样数据点阵t2×t1 = 2 048×128;1H-13C HSQC的F2维(1H)和F1维(13C)谱宽分别为2 923.98 Hz和28 621.27 Hz,采样数据点阵t2×t1= 1 024×256;1H-13C HMBC的F2维(1H)和F1维(13C)谱宽分别为2 923.98 Hz和32 051.06 Hz,采样数据点阵t2×t1 = 4 096×128.
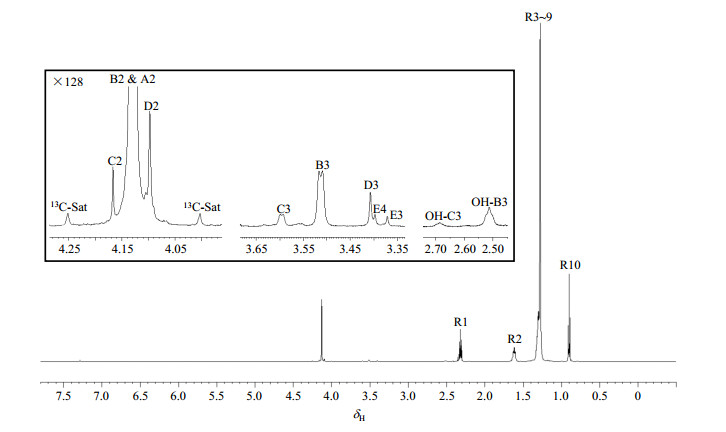
2 结果与讨论 2.1 PETS-1中PETS同系物的结构分析及信号归属从样品PETS-1的1H NMR(图 2)谱中,根据基本的化学位移信息及硬脂酸(ccas: 57-11-4)的标准谱,可对其季戊四醇单元和硬脂酸单元的质子信号进行初步的归属:δH 3.90~4.30和δH 3.30~3.70为季戊四醇单元的质子信号;δH 0.76~2.48为硬脂酸单元的质子信号,其中δH 1.20~2.40为硬脂酸上亚甲基的质子信号,δH 0.88(t, J=6.9 Hz)处的三重峰为硬脂酸末端甲基上的质子信号.
|
图 2 PETS-1的1H NMR谱图 Figure 2 1H NMR spectra of PETS-1 |
在其13C qNMR和DEPT135(图 3)谱中,δC 171~175为酯羰基信号,δC 60~71为季戊四醇单元的亚甲基(CH2)信号,δC 41~45为季戊四醇的季碳信号,δC 20~35为硬脂酸的亚甲基信号,δC 14.1硬脂酸的末端甲基信号.

|
图 3 PETS-1的13C qNMR和DEPT135谱 Figure 3 13C qNMR and DEPT135 spectra of PETS-1 |
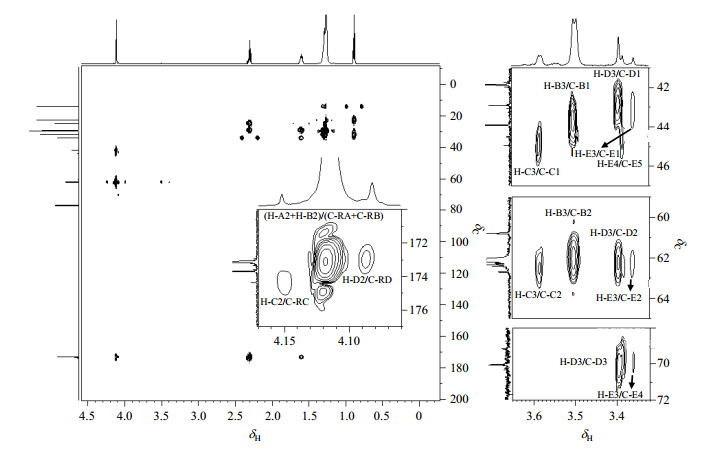
在1H-13C HMBC谱(图 4)中,只有δH 3.90~4.30的质子信号与硬脂酸羰基碳相关,从而确定该处信号是与硬脂酸成酯的亚甲基上的质子信号,则δH 3.30~3.70为成醚亚甲基和羟甲基信号.从1H-13C HSQC谱(图 5)可确认δC 69~71为季戊四醇单元的醚键亚甲基碳信号,δC 60~65为酯键亚甲基和羟甲基碳信号,δH 2.67(br.s)和δH 2.50(br.s)处宽单峰信号在1H-13C HSQC谱中没有相关的碳信号,从而归属为残留羟基上的质子信号.
|
图 4 PETS-1的1H-13C HMBC谱 Figure 4 1H-13C HMBC spectra of PETS-1 |

|
图 5 PETS-1的1H-13C HSQC谱 Figure 5 1H-13C HSQC spectra of PETS-1 |
由于四酯成分A含量最高,故从1H NMR、13C qNMR和DEPT135很容易对其季戊四醇单元的信号进行归属,即H-A2为δH 4.11,C-A1为δC 41.9,C-A2为δC 62.1.
PETS产品中,除主要的成分A、B、C来源于酯化程度外,D、E、F则主要来源于原料季戊四醇,故从反应的难易程度判断,A→B→C和D→E→F,其含量会依次降低,从而根据定量碳谱的信号强弱可初步区分各类季戊四醇单元;1H-1H COSY谱(图 6)中,δH 2.50的羟基质子与δH 3.50相关,在1H-13C HSQC中,δH 3.50与δC 60.8相关,在1H-13C HMBC中,δH 3.50和δC 62.0、43.9相关,从13C qNMR谱的强度来看,δC 62.0基本上是δC 60.8的3倍,从而确定了成份B的结构,且δH 2.50为OH-B3信号,H-B3为δH 3.50,C-B3为δC 60.8,C-B2为δC 62.0,C-B1为δC 43.9;在1H-1H NOESY谱(图 7)中,δH 4.15的质子信号与δH 3.58相关,且在1H NMR谱中,其积分面积接近1:1,同时在1H-1H COSY谱中,δH 3.58与δH 2.67的羟基质子信号相关,故确认δH 2.67为OH-C3,δH 3.58为H-C3,δH 4.15为H-C2,据1H-13C HSQC谱,δH 3.58与δC 62.7相关,δH 4.15与δC 62.4相关,在1H-13C HMBC谱中,δH 3.58与δC 62.7、44.9相关,在13C qNMR谱中,δC 62.7和δC 62.4的强度相当,从而确定了成份C的结构,进而归属δH 4.15为H-C2,δH 3.58为H-C3,δH 2.67为OH-C3,C-C3为δC 62.7,C-C2为δC 62.4,C-C1为δC 44.9;同样在1H-1H NOESY谱中,δH 3.39与δH 4.08相关,且其氢信号的积分面积接近1:3,在1H-13C HSQC中,δH 3.39与δC 70.0相关,在1H-13C HMBC谱中,δH 3.39除与δC 62.3、42.9相关外,还与δC 70.0有强的相关信号,从而确定了成份D的结构,进而归属了其相应的信号,即δH 3.39为H-D3,δH 4.08为H-D2,δC 70.0为醚键亚甲基C-D3,δC 62.4为C-D2,δC 42.9为C-D1;同样,δH 3.36和δH 3.38的信号强度相当,在1H-13C HSQC谱中,δH 3.36与δC 69.7相关,在1H-13C HMBC谱中,除δH 3.38与δC 69.7、69.2相关外,也出现了δH 3.36只与δC 69.7的相关,说明是对称的结构,同时,据1H-13C HMBC归属了与δH 3.38相邻的季碳为δC 44.5,更接近于成份C的季碳C-C1(δC 44.9),说明δC 44.5为中间的具有两个醚键的季戊四醇单元的季碳(C-E5),而δH 3.36相邻的季碳为δC 43.1,位于成份B的季碳C-B1(δC 43.9)与成份D的季碳C-D1(δC 42.9)之间,说明δC 43.1为成三酯的季戊四醇单元的季碳(C-E1),从而确定了成份E的结构,进而归属δH 3.36为H-E3,δH3.38为H-E4,C-E5为δC 44.5,C-E4为δC 69.7,C-E3为δC 69.2,C-E2为δC 62.3,C-E1为δC 43.1.

|
图 6 PETS-1的1H-1H COSY谱 Figure 6 1H-1H COSY spectra of PETS-1 |

|
图 7 PETS-1的1H-1H NOESY谱 Figure 7 1H-1H NOESY spectra of PETS-1 |
在1H-13C HMBC谱中,H-A2及H-B2(δH 4.11, overlapped)与δC 173.1和δC 173.7相关,结合碳谱中季碳区A与B的含量关系,可确定δC 173.1为C-RA、δC 173.7为C-RB;H-C2(δH 4.15)与δC 174.4相关,H-D2(δH 4.08)与δC 173.0相关,可归属δC 174.4为C-RC、δC 173.0为C-RD.
以上分析完成了对主要成分的信号准确归属,其详细归属信息见表 1.
| 表 1 样品PETS-1中季戊四醇硬脂酸酯同系物的1H和13C NMR信号归属(CDCl3, 600 MHz) Table 1 1H and 13C NMR assignment of Pentaerythritol Stearate Homologs in PETS-1 (CDCl3, 600 MHz) |
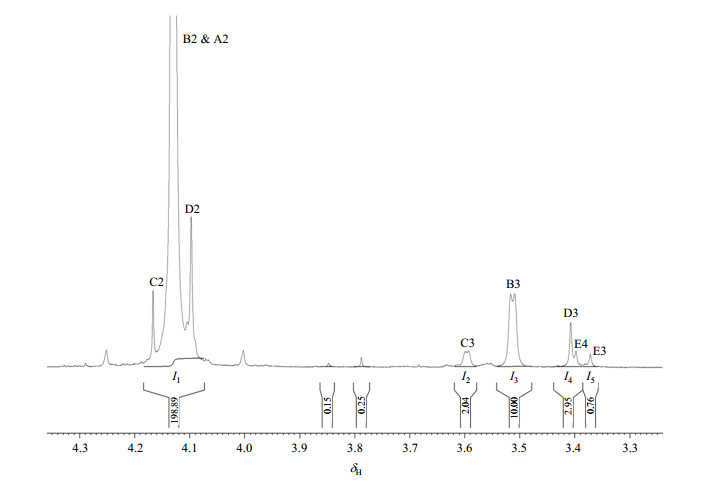
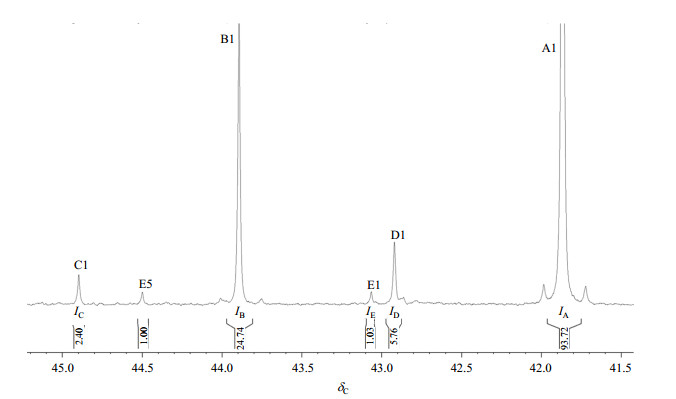
不同酯化程度的产品,其与基础树脂的相容性有显著的差异,所以其酯化产物的组成信息就变的尤为重要,通过上述各酯化成分的结构解析及信号归属,发现δH 3.0~4.5的季戊四醇单元亚甲基质子信号和δC 41~45的季戊四醇单元季碳信号非常适合PETS同系物组成的定量分析(图 8和图 9).
|
图 8 PETS-1的局部放大1H NMR谱 Figure 8 Partial enlarged 1H NMR spectrum of PETS-1 |
|
图 9 PETS-1的局部放大13C qNMR谱 Figure 9 Partial enlarged 13C qNMR spectrum of PETS-1 |
方法一:通过质子信号计算
各组成成份的相对摩尔数(mol)为:
| $ \eqalign{ &{\text{A}}:{\text{ }}[{\mathit{I}_1}-3{\mathit{I}_3}-{\mathit{I}_2}-3({\mathit{I}_4} - {\mathit{I}_5}) - 2{\mathit{I}_5}]/8 = 19.84;{\text{ B}}:{\mathit{I}_3}/2 = 5.00; \cr &{\text{C}}:{\mathit{I}_2}/4 = 0.51;{\text{ D}}:{\text{ }}\left( {{\mathit{I}_4}-{\mathit{I}_5}} \right)/4 = {\text{ }}0.55;{\text{ E}}:{\mathit{I}_5}/4 = 0.19 \cr} $ |
方法二:通过季碳信号计算
各组成成份的相对摩尔数(mol)为:
| $ \begin{array}{*{20}{l}} {{\rm{A}}:{I_{\rm{A}}} = 93.72;{\rm{ B}}:{I_{\rm{B}}} = 24.74;}\\ {{\rm{C}}:{I_{\rm{C}}} = 2.40;{\rm{ D}}:{I_{\rm{D}}}/2 = 2.88;{\rm{ E}}:{I_{\rm{E}}}/2 = 0.51} \end{array} $ |
根据上述两种方法得到的相对摩尔数,可计算出该PET-1中所含主要成分的摩尔百分比组(表 2).
| 表 2 样品PETS-1中PETS同系物的组成信息(摩尔百分比) Table 2 The compositional information of PETS homologs in PETS-1 (molar percentage) |
由于寡聚物组分F的含量太低,特征信号更弱,噪音干扰较大,未计算在内;但少量组分F的信号会和A、E的信号重叠,而在13C qNMR谱中,其重叠或干扰相对较小,故根据1H NMR谱计算出的A和E组分的含量比13C qNMR谱计算值略微偏高.
2.3 PETS-1所用硬脂酸来源的判定工业硬脂酸各个规格及来源的硬脂酸组成见表 3,可见其平均碳含量存在着较明显的差异[6, 9].
通过质子信号的积分值,计算出该样品(PETS-1)的平均碳含量为17.01,同时未见不饱和质子信号,从而可判断所用硬脂酸的来源为氢化动物油脂.
2.4 讨论相对于其他检测分析手段,NMR技术的优势主要体现在两个方面:(1)能够提供更全面的结构组成方面的信息,在初次建立相应的分析方法时,能够提供多个特征信号供选择,对工业品分析而言是一个较好的选择;(2)一旦方法建立,该途径能够快速给出准确的结果,比如用1H NMR技术分析样品,从制样到完成数据采集大概只需5 min,而且0.5 mL的试剂用量相对于液相色谱技术来说更环保.
PETS是一个在工业上被广泛应用的添加剂,该类物质的NMR数据报道较少,本工作运用2D NMR技术,详细的分析了PETS样品的组成,同时对4种主要成分的化学位移进行了准确归属,对微弱的三季戊四醇硬脂酸酯的信号也进行了部分指认.该工作有助于下游客户,特别是穆斯林用户,根据原料来源信息回避动物油脂来源的产品;根据酯化程度的不同,筛选符合特定基础树脂加工需求的牌号.对于上游的添加剂生产企业来说,在质量检测时,可基于各主要成分特征氢信号的良好分离度,开发出同时检测多种成分的快速方法.
季戊四醇和硬脂酸成酯时,会有少量的醇羟基残余,再加上原料因素,导致商品PETS的组成相当复杂.通常双季、三季及多季戊四醇在季戊四醇原料中的含量很低,其未完全酯化的成分含量更低,从而在该实验中未检测出其未完全酯化的成分.
3 结论本文通过NMR(包括1H NMR、13C qNMR、DEPT135、1H-1H COSY、1H-1H NOESY、1H-13C HSQC和1H-13C HMBC)技术,对样品PETS-1的主要成分进行了系统的分析表征,结果表明:(1)酯化程度方面,主要成分为季戊四醇四硬脂酸酯,同时还含有季戊四醇三硬脂酸酯、季戊四醇二硬脂酸酯、双季戊四醇硬质酸酯及多季戊四醇硬脂酸酯;(2)硬脂酸来源方面,该产品所用硬脂酸为来源于氢化动物油酯.
| [1] |
LI J, BAI X G. The study of pentaerythritol fatty acid ester in synthesis and application)[J].
Plastic Additives, 2003, 5: 21-24.
李杰, 白向革. 季戊四醇四脂肪酸酯合成工艺及应用研究[J]. 塑料助剂, 2003, 5: 21-24. |
| [2] |
HE C H, LI S, XIAO Z H, et al. Synthesis of mono-, di-and tri-pentaerythritol[J].
Chemical Industry Times, 2005, 19(1): 11-13.
贺楚华, 李珊, 肖志海, 等. 单、双、三季戊四醇的合成[J]. 化工时刊, 2005, 19(1): 11-13. DOI: 10.3969/j.issn.1002-154X.2005.01.004. |
| [3] |
LI K, WANG X G, SHAN L, et al. Synthesis of pentaerythritol oleate[J].
China Oils and Fats, 2007, 32(12): 53-56.
李凯, 汪兴国, 单良, 等. 季戊四醇油酸酯的合成工艺[J]. 中国油脂, 2007, 32(12): 53-56. DOI: 10.3321/j.issn:1003-7969.2007.12.015. |
| [4] |
ZHANG L T, CAI G X, TU J, et al. Synthesis and characterization of antioxidant-modified pentaerythritol esters as lubricating base oil[J].
Lubricating Oil, 2012, 27(1): 22-26.
张乐涛, 蔡国星, 涂晶, 等. 抗氧化性季戊四醇酯润滑油基础油的合成与表征[J]. 润滑油, 2012, 27(1): 22-26. DOI: 10.3969/j.issn.1002-3119.2012.01.006. |
| [5] |
CHU H, LIU Q F, YAN H B, et al. Synthesis and application of esters with fatty acid and pentaerythritol[J].
Modern Plastics Processing and Applications, 2006, 18(3): 52-55.
褚衡, 刘庆丰, 严海彪, 等. 脂肪酸季戊四醇酯的合成及应用[J]. 现代塑料加工应用, 2006, 18(3): 52-55. DOI: 10.3969/j.issn.1004-3055.2006.03.015. |
| [6] | 中华人民共和国国家质量监督检验检疫总局. GB/T 9104-2008: Test methods for industrial stearic acid(工业硬脂酸试验方法)[S]. 2008-05-28. |
| [7] |
ZHANG B F, ZHU X R. NMR analyses of two polyether modified organic silicone surfactants[J].
Chinese J Magn Reson, 2016, 33(3): 432-441.
张彬峰, 朱雪荣. 两种聚醚改性有机硅表面活性剂的NMR数据分析[J]. 波谱学杂志, 2016, 33(3): 432-441. |
| [8] |
LIU Y, GAO Y L, CHENG J, et al. A processing method for spectrum alignment and peak extraction for NMR spectra[J].
Chinese J Magn Reson, 2015, 32(2): 382-392.
刘悦, 高运苓, 程吉, 等. 一种核磁共振波谱谱峰对齐及谱峰提取的方法[J]. 波谱学杂志, 2015, 32(2): 382-392. |
| [9] | FULMER M S. Lubricants and additives for polymer compounds[OL]. http://www.struktol.com/pdfs/Lubricants.pdf. |
 2018, Vol. 35
2018, Vol. 35 
