2. 中国科学院大学, 北京 100049;
3. 武汉大学 生命科学学院, 湖北 武汉 430072;
4. 中国科学技术大学, 安徽 合肥 230026
2. University of Chinese Academy of Sciences, Beijing 100049, China;
3. College of Life Science, Wuhan University, Wuhan 430072, China;
4. University of Science and Technology of China, Hefei 230026, China
神经元是构成神经系统的基本单位之一,是动物产生情感、运动、意识和智力等一切神经活动的基础[1].大脑中的神经元通过突触连接形成复杂的神经网络,一般情况下,这些神经元可通过树突分支和树突棘等结构接收和整合上游传入的信号,并通过轴突分支和其终末向下游神经元传递神经冲动[2-4],因此,研究神经元的胞体形态和分布、树突分支和树突棘形态、轴突分支及轴突终末分布等精细形态结构是了解神经网络构筑方式和研究大脑功能的基础.
传统标记方式如高尔基染色等可高亮度地标记神经元的精细形态,然而,由于大脑中神经元数目庞大、形态各异并且结构复杂,这些方法会产生很高的背景干扰,不利于对单个神经元完整精细形态全貌的描绘[5].随着转基因和基因靶向技术的不断革新,基于病毒载体和位点特异性重组酶的表达调控策略等技术已被广泛应用于稀疏神经元精细结构的高亮度标记[6-9].目前常用于稀疏标记神经元的主要方法有:(1)通过沉默大多数神经元,仅使少量神经元随机表达的方法实现稀疏标记.例如基于Thy1-XFP基因在染色体位点上随机插入导致的沉默表达,导致只有约10%的Thy1神经元产生荧光表达[10];(2)基于特异性启动子驱动Cre表达的动物,并通过子宫电穿孔法导入Cre依赖的质粒表达系统,可以在单细胞水平实现特定类型神经元精细结构的标记[11, 12];(3)利用四环素诱导系统中的TRE启动子泄漏表达和循环自放大表达机制,Luo等[13]开发的“Supernova”可结合病毒载体工具,对少量神经元实现稀疏度可控的高亮度标记;(4)利用布尔逻辑操控方式,基于携带Cre/Loxp控制系统的病毒载体,将表达Cre重组酶的腺相关病毒(adeno-associated virus, AAV)进行梯度稀释之后与携带Dio表达元件的AAV病毒混合,通过调整病毒的注射量也可以控制目标区域的神经元稀疏度及亮度可控的标记[14, 15].这些标记方法和其他可视化成像技术的结合可使人们能够对大脑中单个神经元的精细形态进行描绘,包括其轴突分支、树突棘等细节,这些新技术的出现有效地促进了神经细胞解剖学的研究.然而,上述方法大多不易用于对多种不同的特定类型神经元的稀疏标记,此外,即便同一区域的相同类型神经元也可能因为其下游输出网络的不同而具有不同的功能[16, 17],目前也缺乏对具有特定投射特征的特异类型神经元的稀疏高亮标记方法的报道.
水泡性口炎病毒(vesicular stomatitis virus,VSV)是一种具有囊膜结构的负链RNA病毒. VSV的基因组长约12 kb,编码5种蛋白质,依次为核蛋白(N)、磷酸化蛋白(P)、基质蛋白(M)、糖蛋白(G)和聚合酶(L)[18]. VSV对中枢系统的感染具有高度的神经元特异性,并且在感染神经元后能够快速、高丰度的表达外源目的基因,因此VSV可被应用于神经元结构的标记[19]. Van den Pol等[20]将VSV基因组改造为囊膜糖蛋白缺失型,并插入报告基因GFP,该重组病毒感染体外培养神元1 h之后可检测到绿色荧光蛋白(green fluorescent protein, GFP)的表达,并且在感染小鼠大脑皮层后两天观察到神经元的清晰形态. Beier等[21]通过禽类肉瘤病毒(avian sarcoma leukosis virus, ASLV)囊膜糖蛋白(EnvA)的膜外区与狂犬病毒(rabies virus, RV)囊膜糖蛋白跨膜及胞内区融合形成的囊膜蛋白来包装VSV病毒,这种重组囊膜蛋白包装的VSV不能直接感染哺乳动物细胞.若利用AAV等将EnvA的受体Tva表达在哺乳动物的特异类型神经细胞膜上,并在这些神经元的特定下游区域注射该VSV病毒,则可特异性感染并标记这些具有特定投射特征的表达了Tva的神经元.
然而,由于VSV具有非常大的细胞毒性,随着感染时间的增加可能损害神经元的形态结构,以往有研究[22]表明,VSV核蛋白与基因组的结合是病毒衣壳化以及起始转录的第一步,因此在病毒转录和复制中扮演着重要角色. Chen等[23]通过对N基因进行多种突变,得到了几种使得病毒基因组合成减少的突变株,其中突变型R7A表现出病毒复制速度多个数量级的降低.由此推测N基因很可能为VSV病毒的毒力相关基因,因此,本研究拟通过在VSV核蛋白上引入突变降低其细胞毒性,制备EnvA包裹的G蛋白基因缺失的VSV假病毒颗粒,并结合AAV病毒工具和D2R-Cre/DAT-Cre等特定转基因工具鼠,利用上述轴突末梢端注射的方法展示其在具有特定投射特征的特异类型神经元稀疏、高亮标记中的应用.
1 实验部分 1.1 重组VSV工具病毒的制备在质粒pVSV-EGFP-DG(购自Addgene组织,编号31842)的基础上,将其N基因的第7个密码子由编码天冬氨酸(N)突变为编码丙氨酸(A),并将获得的质粒命名为pVSV-ΔG-NR7A-EGFP.用试剂盒分别提取pVSV-ΔG-NR7A-EGFP及辅助质粒(分别表达VSV结构蛋白N、G和非结构蛋白P、L),五质粒共转染BHK-21细胞,同时感染表达T7 RNA聚合酶的痘病毒,于35 ℃、3%(v/v)CO2培养箱中培养,3天后收集上清.将收集的上清用孔径0.22 μm的滤膜过滤,去除痘病毒后感染已预先瞬转质粒pMD2.G的BHK-21细胞.待细胞病变,收集上清,此时得到的病毒即为VSV-ΔG-NR7A-EGFP.用VSV-ΔG-NR7A-EGFP感染BHK-EnvA细胞,收集上清可得VSV-ΔG- EnvA-NR7A-EGFP.
1.2 基于微流控芯片的体外神经元感染采用软光刻方法制备聚二甲基硅氧烷(polydimethylsiloxane,PDMS)材料的微通道,并与铺设多聚赖氨酸的培养皿键合制得微流控芯片.原代神经细胞取自胎鼠(胚胎期第14天,小鼠)皮质,经剪碎、消化、过滤、收集和计数调整后,接种至微流控芯片胞体侧.神经元体外生长8天左右,其长突起经中间栅栏通道生长至轴突侧.于胞体侧加入VSV病毒,取特定时间点成像观察.
1.3 动物手术操作及样品制备 1.3.1 实验动物成年雄性和雌性C57BL/6小鼠均从湖南斯莱克实验动物中心购买. DAT-Cre转基因小鼠购买自Jackson Laboratories [B6.SJL-Slc6a3tm1.1 (Cre) Bkmn/J, stock number 006660]. D2R-Cre(Drd2-Cre, ER44, Gensat)转基因小鼠由中国科学院神经科学研究所熊志奇研究员馈赠.所有的实验小鼠均饲养在本实验室无特定病原(special pathogen free,SPF)动物房,并且通过转基因小鼠与C57BL/6小鼠杂交繁殖经过基因鉴定为阳性子代后用于实验.
1.3.2 病毒痕量注射在动物实验中,所有的手术和实验流程都是按照中国科学院武汉物理与数学研究所动物保护和使用委员会制定的指导方针进行的,并且所有的手术操作过程均在生物安全二级实验室进行.首先小鼠被400 mg/kg剂量的水合氯醛溶液麻醉,然后被放在立体定位仪上(货号:68030,RWD,深圳,中国),然后将微量注射器连接到一个针尖直径为10~15 mm的玻璃微吸管上并整体固定在注射泵上(货号:53311,Stoelting,美国)进行病毒注射,待病毒注射完成后再放置10 min后缓慢退出.手术完成后缝合切口,再用盐酸林可霉素和盐酸利多卡因对小鼠进行止痛消炎.
腹侧海马(ventral hippocampus, VHPC)病毒注射:将100 nL的VSV-ΔG-NR7A-EGFP单侧注射于C57BL/6成年雄性小鼠的VHPC脑区,坐标为前后(anterior-posterior, AP):-3.16 mm,侧偏(medial-lateral, ML):-2.95 mm,深度(dorsal-ventral, DV):-4.10 mm.病毒注射后,按照时间点3天、5天、7天对小鼠实施心脏灌流取样.
尾壳核(caudate putamen,CPU)病毒注射:首先将100 nL的rAAV-EF1α-Dio-His-Bfp-Tva(来自武汉枢密脑科学技术有限公司)双侧注射于D2R-Cre转基因小鼠的CPU脑区,坐标为AP:+1.50 mm,ML:±1.10 mm,DV:-3.0 mm,AAV病毒经过14天的表达后,在相同的位置注射150 nL的VSV-ΔG-EnvA-NR7A-EGFP,经过5天的表达后对小鼠进行心脏灌流取样.
伏隔核(nucleus accumbens, NAc)到下丘脑外侧区(lateral hypothalamic area, LH)神经网络的标记:首先将100 nL的rAAV-EF1α-Dio-His-Bfp-Tva单侧注射于D2R-Cre转基因小鼠的NAc脑区,坐标为AP:+1.50 mm,ML:±1.10 mm,DV:-4.60 mm,AAV病毒经过21天的表达后,再分别将100 nL、200 nL的VSV-ΔG-EnvA-NR7A-EGFP注射于LH脑区,坐标为AP:-1.10 mm,ML:±1.05 mm,DV:-5.00 mm,经过5天的表达后对小鼠进行心脏灌流取样.
腹侧被盖区(ventral tegmental area, VTA)到NAc神经通路的标记:首先将100 nL rAAV-EF1α-Dio-His-Bfp-Tva单侧注射于DAT-Cre转基因小鼠的VTA脑区,坐标为AP:-3.20 mm,ML:-0.40 mm,DV:-4.30 mm,AAV病毒经过21天的表达后,再分别将50 nL的VSV-ΔG-EnvA-NR7A-EGFP注射于NAc脑区,坐标为AP:-1.10 mm,ML:±1.05 mm,DV:-5.00 mm, 经过5天的表达后对小鼠进行心脏灌流.
1.3.3 小鼠脑片制备首先小鼠腹腔被注射5%的水合氯醛0.4 mL进行深度麻醉,接着用磷酸盐缓冲液(phosphate buffer saline,PBS)和4%的多聚甲醛(paraformaldehyde,PFA, 158127 MSDS, Sigma)依次进行心脏灌流,时间各为5 min,剥离出小鼠脑区样品后用4% PFA再固定12 h,然后,再用30%的蔗糖溶液对其进行脱水处理,直到小鼠脑区样品沉入溶液底部.用冰冻切片机将小鼠脑区样品切成40 μm厚的脑片,并按照一定的顺序放入装有防冻液(含50%PBS、30%乙二醇、20%丙三醇)的24孔平板中,并保存于-20 ℃冰箱中.
将C57BL/6以及D2R-Cre小鼠的脑切片贴在玻片上,并用4', 6-二脒基-2-苯基吲哚(4', 6-diamidin -2-phenylindol,DAPI)染色(1:4 000,用PBS配制)7 min,然后用PBS洗去多余的DAPI,再将70%的甘油(PBS配制)置于玻片上封片并用指甲油密封.选取DAT-Cre小鼠VTA区域的脑切片,用酪氨酸羟化酶(tyrosine hydroxylase, TH,2552365,1:1 000,Abcam)荧光免疫组化染色,TH被染成红色,然后封片处理.
1.3.4 成像及数据分析经过处理的小鼠脑玻片,用Lecia TCS SP8荧光共聚焦显微镜进行图像采集,或者利用奥林巴斯的VS120玻片扫描仪进行清晰的高通量成像.然后,利用Adobe Photoshop CC 2017软件和Adobe Illustrator CS6软件对获得的脑片图像进行处理.
1.4 小鼠脑样品透明化实验灌流获得的脑组织样品,切片后浸泡于浓度为4%丙烯酰胺、PFA溶液(4 ℃)中后固定24 h,后将脑片放置于37 ℃水浴4 h,使丙烯酰胺单体与样品内的蛋白质上的氨基发生交联聚合反应,在样品内部形成致密的蛋白质、水凝胶聚合物;进一步将样品放置于37 ℃下4%的十二烷基磺酸钠(sodium dodecyl sulfonate,SDS)溶液中,透明化处理样品24 h;接着用0.2%的Triton/PBS溶液在37 ℃下清洗样品24 h,中间换液4次;之后采用折射率匹配溶液浸泡样品,使样品内部折射率变得均一;然后采用光片照明荧光显微镜进行脑片的快速三维荧光显微成像,通过三维重建,重构出病毒所标记细胞的形态结构.
2 结果与讨论 2.1 病毒构建及体外验证为了获得可进行稀疏高亮标记且细胞毒性相对较低的VSV病毒株,首先,我们在G蛋白基因缺失的VSV-ΔG-EGFP病毒的基础上对其可能的毒性蛋白N蛋白基因进行突变,并将突变株命名为VSV-ΔG-NR7A-EGFP[图 1(a)].为了探究其细胞毒性及神经元标记特性,我们随后利用VSV-ΔG- NR7A-EGFP感染离体培养的原代神经元,并观察不同感染时间该病毒对神经元的标记情况.

|
图 1 重组VSV-ΔG-NR7A-EGFP的构建以及原代神经元感染. (a)重组VSV基因组构建示意图;(b)基于微流控芯片的神经细胞培养和病毒感染示意图,SC(胞体腔),M(微通道),AC(轴突腔);(c)病毒感染体外神经元比较,时间分别为感染后(pi)第4 h、24 h和72 h;(d)病毒感染24 h后,3个微通道中的神经元结构 Figure 1 Construction of recombinant VSV-ΔG-NR7A-EGFP and primary neuron infection. (a) The schematics of VSV constructed; (b) A schematic diagram of primary neurons culture and virus infection in microfluidic chip. SC (somal compartment), M (microchannel), AC (axonal compartment); (c) Fluorescence changes of VSV infected neurons for various duration of 4 h, 24 h and 72 h; (d) Neuronal structure in microchannels at 24 hours post infection (hpi) |
结果显示,病毒感染4 h时培养物中即可观察到少量被GFP标记的神经元,表明VSV-ΔG-NR7A-EGFP能快速标记离体神经元,可作为神经细胞快速标记和外源基因转导的工具病毒;随着病毒感染时间延长,病毒感染24 h左右可观察到大量被GFP高亮度标记的形态清晰的神经元,表明在体外神经元培养物中,该病毒的确可以实现神经元的快速高亮度标记;但是,当感染时间延长至72 h左右时,培养物中可观察到的具备完整形态的GFP阳性神经元数量显著减少,并且出现大量疑似细胞病变解体的残留绿色结构[图 1(c)],表明虽然突变VSV病毒的N蛋白基因可降低其复制和转录速度,但该VSV病毒仍然具有较大的细胞毒性,在离体培养物中利用其进行神经元高亮度标记的窗口期不宜超过3天,且以1天左右为佳.本研究结果显示仅对VSV的N蛋白进行突变不能达到预期较大幅度减毒的效果,表明VSV病毒较大的细胞毒性很可能与其他更为关键的毒性蛋白(如M蛋白等[24, 25])的作用有关,将来在此基础上对这些蛋白进一步的改造可能有效降低VSV病毒的细胞毒性.为检测VSV-ΔG-NR7A-EGFP病毒对离体培养神经元的精细形态标记情况,我们在基于微流控芯片的体外神经元三腔培养系统中进行了病毒感染实验[图 1(b)].将病毒粒子加入三腔系统中神经元胞体端,在病毒感染24 h左右,我们观察到胞体腔中大量的胞体都被高亮度标记,同时可观察到轴突投射(中间腔体)和轴突分支及终末(右侧腔体)等细节形态的标记[图 1(d)],表明VSV-ΔG-NR7A-EGFP病毒在离体培养的神经元中可在较短感染时间内实现神经元精细形态结构的快速高亮的标记.
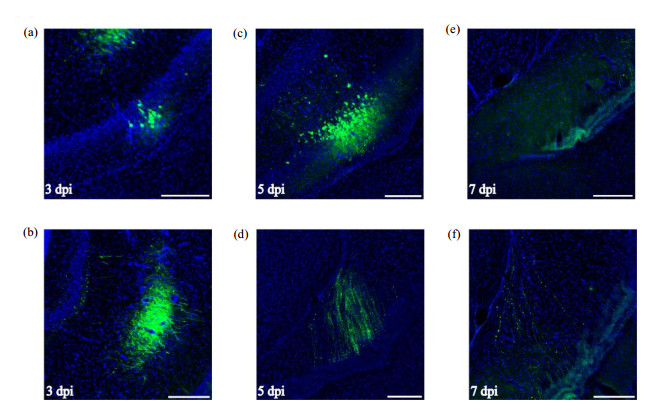
2.2 利用重组病毒进行活体标记体外实验表明VSV-ΔG-NR7A-EGFP病毒可以感染神经元并展示其精细形态结构,我们进一步检测其在在体条件下对神经元的标记情况.我们在成年C57BL/6小鼠VHPC区域注射VSV-ΔG- NR7A-EGFP病毒,并观察不同注射时间点(3天、5天和7天)实验动物神经元的标记情况,结果显示,VSV-ΔG-NR7A-EGFP病毒在3天左右可清晰、高亮度地标记神经元的胞体[图 2(a)]和轴突投射[图 2(b)];在5天左右可见大量被高亮度标记的神经元胞体[图 2(c)]和轴突[图 2(d)],但是胞体形态不完整,其周围有点状的细胞碎片结构,并且神经轴突纤维也表现出不连续的点状分布;7天左右在病毒注射位点附近几乎无可见的GFP阳性胞体[图 2(e)],只可检测到少量呈不连续点状分布的神经轴突[图 2(e, f)].在体检测的结果同样表明VSV-ΔG-NR7A-EGFP可用于实现神经元精细形态的快速高亮度标记,并且其存在较大的细胞毒性,该结果与离体培养神经元检测一致.但是在体实验结果表明该病毒在感染3天左右毒性较低,仍可实现神经元完整精细形态的标记,其毒性主要在5天左右开始表现出来,7天左右对感染的神经元的毒性更大,其标记的神经元胞体可能已经裂解或者被机体免疫机制清除,在体与离体情况下该病毒对细胞产生毒性的速度不同,这可能与两种条件下神经元的生长环境和活性差异有关,因此利用该病毒进行在体神经元的精细形态标记时其窗口期最长可延伸至病毒感染后3天左右.由此证明VSV-ΔG-NR7A-EGFP可作为一种新的靶向大脑神经元的基因载体,其EGFP基因可被替换,如一种MRI报告基因——铁蛋白基因(Ferritin),从而得到病毒VSV-ΔG-NR7A-Ferritin,其结合铁蛋MRI造影功能,可在极短的时间检测被VSV-ΔG-NR7A- Ferritin感染的神经元群体[26].
|
图 2 VSV-ΔG-NR7A-EGFP的在体标记情况检测.病毒注射C57BL/6小鼠的腹侧海马,感染后(pi)第3、5、7天分别取样观察. (a)和(b)、(c)和(d),以及(e)和(f)分别展示了不同时间段神经元胞体和轴突的标记效果; 绿色为VSV-ΔG-NR7A-EGFP,蓝色为DAPI染色;标尺为250 μm Figure 2 In vivo infection by VSV-ΔG-NR7A-EGFP. The ventral hippocampus of C57BL/6 mice was infected by the virus, and the brain slices were observed at 3, 5 and 7 days post infection (dpi). (a) and (b), (c) and (d), as well as (e) and (f) demonstrated the results of the labeled somas and axons of neurons at different time points, respectively; the green color indicated VSV-ΔG-NR7A-EGFP labeled cells, and the blue color showed the nucleus stained by DAPI. Scale bar=250 μm |
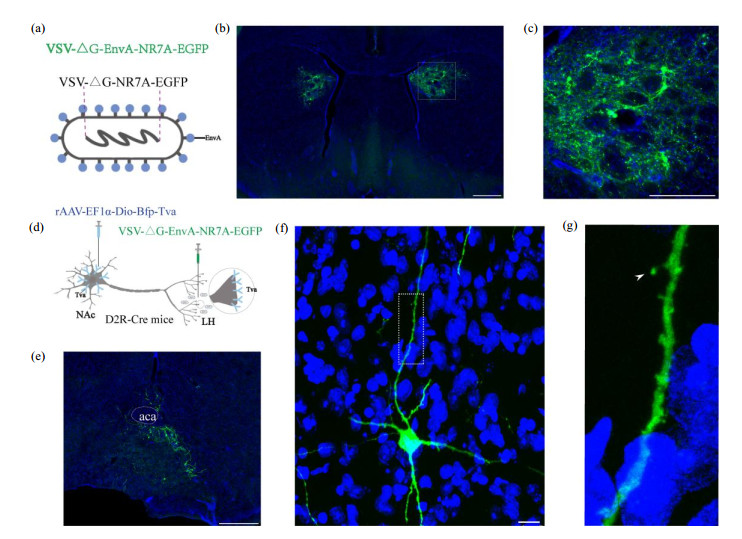
由于上述原始形态的VSV-ΔG-NR7A-EGFP病毒无法实现神经元特异性和神经通路选择性标记,VSV可对注射位点的大多数神经元实现无差别的标记,为了实现神经元类型特异性标记,我们将该病毒的包膜糖蛋白替换EnvA使其只能特异性感染表达Tva的哺乳动物细胞,并将病毒命名为VSV-ΔG-EnvA-NR7A-EGFP [图 3(a)].为了检验VSV-ΔG-EnvA-NR7A-EGFP病毒的感染情况,我们将rAAV-EF1α-Dio-Bfp-Tva通过立体定位注射于D2R-Cre转基因小鼠的CPU区域,经过病毒14天的表达后,再将VSV-ΔG-EnvA-NR7A-EGFP注射于相同的区域.由图 3(b)显示EnvA包装的VSV-ΔG-NR7A-EGFP病毒能够通过识别辅助病毒表达的Tva感染神经元,并高亮度地标记神经元的形态[图 3(c)],这表明通过利用AAV在特异类型神经元中表达Tva,VSV-ΔG-EnvA-NR7A-EGFP神经元可以实现神经元特异类型的高亮度标记.
|
图 3 重组VSV-ΔG-EnvA-NR7A-EGFP标记NAc中D2R神经元. (a) VSV-ΔG-EnvA-NR7A-EGFP的结构模式图;(b)病毒感染D2R-Cre转基因小鼠双侧CPU,标尺:500 μm;(c)为(b)图中白色虚线区域的放大图像,标尺:250 μm;(d)利用VSV-ΔG-EnvA-NR7A-EGFP病毒标记小鼠NAc中投射到LH的D2R神经元的病毒注射策略图;(e) D2R-Cre转基因小鼠NAc中D2R神经元可被重组VSV病毒特异性逆行标记,标尺:500 μm;(f)高倍放大图显示NAc脑区中单个神经元的标记情况,标尺:250 μm;(g)为(f)图被标记的单个神经元树突上白色虚线区域的放大图,白色箭头所示为被标记的树突棘形态.图中绿色均为VSV-ΔG-EnvA-NR7A-EGFP表达,蓝色为DAPI染色. Figure 3 D2R Neurons in NAc labeled by VSV-ΔG-EnvA-NR7A-EGFP. (a) Structural model of VSV-ΔG-EnvA-NR7A-EGFP; (b) Viral infection in bilateral CPU of the D2R-Cre transgenic mice, scale bar=500 μm; (c) The magnified view of the white dashed box in (b), scale bar=250 μm; (d) The labeled strategies of the D2R neurons in NAc with projection to LH using VSV-ΔG-EnvA-NR7A-EGFP; (e) The D2R neurons of NAc in D2R-Cre transgenic mice can be retrogradely labeled by the recombinant VSV, scale bar=500 μm; (f) A single neuron in NAc was visualized (scale bar=250 μm), and its high magnification view in white dashed box was shown in (f); The white arrow showed the dendritic spine. The green color indicated VSV-ΔG-NR7A-EGFP labeled cells, and the blue color showed the nucleus stained by DAPI |
为了利用该病毒进一步实现具有特定投射特征的特异类型神经元的稀疏高亮标记,我们使用了基于EnvA和Tva的特异性识别的轴突末端逆行标记策略[图 3(d)].首先将rAAV-EF1α-Dio-Bfp-Tva通过立体定位注射于D2R-Cre转基因小鼠的NAc区域,由于NAc的D2R神经元到LH存在投射关系,AAV病毒表达21天后,在LH注射VSV-ΔG-EnvA-NR7A-EGFP,使VSV病毒特异性感染表达Tva的NAc中D2R神经元的轴突末梢并逆行标记胞体. VSV病毒注射之后,我们观察到NAc脑区有少量的神经元被标记[图 3(e)],更高倍率的荧光共聚焦显微镜成像结果显示,NAc中被标记的神经元具有清晰的精细形态结构[图 3(f)],其树突上的树突棘等细节形态清晰可见[图 3(g)].这表明基于VSV-ΔG- EnvA-NR7A-EGFP的此种标记策略能够实现投射特定的特异类型神经元的稀疏高亮标记.
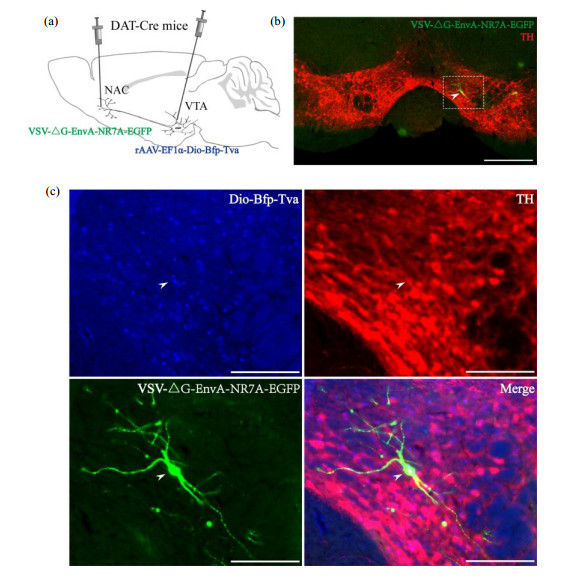
2.3 免疫组织化学荧光验证神经元类型特异性为了验证VSV-ΔG-EnvA-NR7A-EGFP标记特定投射特征的特异类型神经元的广泛适用性及其特异性,我们进一步基于DAT-Cre转基因小鼠利用此方法标记具有NAc投射特异性的VTA中的多巴胺能神经元[图 4(a)],并对VTA中被病毒标记的神经元进行了TH红色荧光免疫组织化学特异性染色,TH是多巴胺能神经元的特征标识物,结果显示,VTA中只有较少的神经元被VSV-ΔG-EnvA- NR7A-EGFP病毒标记成绿色[图 4(b)],其均为TH阳性,并且均与辅助病毒rAAV-EF1α-Dio-Bfp-Tva的蓝色信号共定位表达[图 4(c)],从放大图中还可观察到被标记的TH神经元的精细形态结构,对被标记区域的组织透明化处理之后进行3D成像,结果显示被标记的神经元具有完整清晰的立体形态结构[视频附件可在该文网络版页面上观看].这表明利用该方法的确可以特异性标记VTA中支配NAc且表达Bfp-Tva的多巴胺能神经元,并且可对这些神经元实现稀疏、高亮度的精细形态标记.因此,利用VSV-ΔG-EnvA-NR7A-EGFP病毒稀疏、高亮度地标记具有特定投射特征的特异类型神经元具有较为广泛适用性及较高的特异性.
|
图 4 利用VSV-ΔG-EnvA-NR7A-EGFP特异性标记VTA中投射到NAc的多巴胺能神经元. (a)病毒注射策略示意图;(b) VTA区域被VSV-ΔG-EnvA-NR7A-EGFP标记(绿色)及TH免疫荧光共染色标记(红色)的信号分布情况,标尺:500 μm;(c)为(b)图中白色虚线区域的放大图,蓝色信号为辅助病毒rAAV-EF1α-Dio-Bfp-Tva的表达,红色信号为TH免疫红色荧光染色,绿色为VSV-ΔG-EnvA-NR7A-EGFP的信号,白色箭头指的是三种颜色共定位于胞体,标尺:250 μm Figure 4 Specifically labeled dopaminergic neurons projected to NAc in VTA by VSV-ΔG-EnvA-NR7A-EGFP. (a) The strategy schematic of viral injection; (b) Signal distribution of VTA region labeled by VSV-ΔG-EnvA-NR7A-EGFP (green) and TH immunofluorescent co-staining (red), scale bar=500 μm; (c) The magnification of the white dashed line area in the (b); The blue signal was the expression of the rAAV-EF1α-Dio-Bfp-Tva; red signal was TH immunofluorescence staining; the green was VSV-ΔG-EnvA-NR7A-EGFP; The white arrow indicated the neuron that was co-labelled with three fluorescents; scale bar=250 μm |
VSV病毒编码核蛋白的N基因的突变并不能大幅度地降低其细胞毒性,但其在一定时间窗口内仍能实现神经元精细形态的高亮度标记.在此基础上,我们利用VSV-ΔG-EnvA-NR7A-EGFP病毒,基于特定品系的转基因动物及辅助病毒rAAV-EF1α-Dio-Bfp-Tva,展示了一种可用于稀疏、高亮地标记具有特定投射特征的特异类型神经元精细结构的新方法.
| [1] | KOCH C, REID R C. Observatories of the mind[J]. Nature, 2012, 483: 397-398. DOI: 10.1038/483397a. |
| [2] | LLINAS R. The intrinsic electrophysiological properties of mammalian neurons:insights into central nervous system function[J]. Science, 1988, 242(4886): 1654-1664. DOI: 10.1126/science.3059497. |
| [3] |
WU R Q, LI B, LIU Y, et al. Current state and future of optogenetic functional magnetic resonance imaging[J].
Chinese J Magn Reson, 2014, 31(2): 295-305.
吴瑞琪, 李博, 刘悦, 等. 光激活磁共振脑功能成像的研究现状及前景[J]. 波谱学杂志, 2014, 31(2): 295-305. DOI: 10.3969/j.issn.1000-4556.2014.02.017. |
| [4] |
ZHU X T, HE X B, LIU Y, et al. A convenient semi-automatic method for analyzing brain sections:registration, segmentation and cell counting[J].
Chinese J Magn Reson, 2018, 35(2): 133-140.
朱续涛, 何晓斌, 刘悦, 等. 一种简易的脑片图像的半自动区域划分及细胞计数方法[J]. 波谱学杂志, 2018, 35(2): 133-140. |
| [5] | JEFFERIS G S, LIVET J. Sparse and combinatorial neuron labelling[J]. Curr Opin Neurobiol, 2012, 22(1): 101-110. DOI: 10.1016/j.conb.2011.09.010. |
| [6] | NERN A, PFEIFFER B D, RUBIN G M. Optimized tools for multicolor stochastic labeling reveal diverse stereotyped cell arrangements in the fly visual system[J]. Proc Natl Acad Sci U S A, 2015, 112(22): E2967-E2976. DOI: 10.1073/pnas.1506763112. |
| [7] | WU H, WILLIAMS J, NATHANS J. Morphologic diversity of cutaneous sensory afferents revealed by genetically directed sparse labeling[J]. eLife, 2012, 1: e00181. DOI: 10.7554/eLife.00181. |
| [8] | ECONOMO M N, CLACK N G, LAVIS L D, et al. A platform for brain-wide imaging and reconstruction of individual neurons[J]. eLife, 2016, 5: e10566. DOI: 10.7554/eLife.10566. |
| [9] | HOLTMAAT A, BONHOEFFER T, CHOW D K, et al. Long-term, high-resolution imaging in the mouse neocortex through a chronic cranial window[J]. Nat Protoc, 2009, 4(8): 1128-1144. DOI: 10.1038/nprot.2009.89. |
| [10] | FENG G, MELLOR R H, BERNSTEIN M, et al. Imaging neuronal subsets in transgenic mice expressing multiple spectral variants of GFP[J]. Neuron, 2000, 28(1): 41-51. DOI: 10.1016/S0896-6273(00)00084-2. |
| [11] | LU X H, YANG X W. Genetically-directed sparse neuronal labeling in BAC transgenic mice through mononucleotide repeat frameshift[J]. Sci Rep, 2017, 7: 43915. DOI: 10.1038/srep43915. |
| [12] | AKO R, WAKIMOTO M, EBISU H, et al. Simultaneous visualization of multiple neuronal properties with single-cell resolution in the living rodent brain[J]. Mol Cell Neurosci, 2011, 48(3): 246-257. DOI: 10.1016/j.mcn.2011.08.005. |
| [13] | LUO W, MIZUNO H, IWATA R, et al. Supernova:A versatile vector system for single-cell labeling and gene function studies in vivo[J]. Sci Rep, 2016, 6: 35747. DOI: 10.1038/srep35747. |
| [14] | MADISEN L, ZWINGMAN T A, SUNKIN S M, et al. A robust and high-throughput Cre reporting and characterization system for the whole mouse brain[J]. Nat Neurosci, 2010, 13(1): 133-140. DOI: 10.1038/nn.2467. |
| [15] | KUHLMAN S J, HUANG Z J. High-resolution labeling and functional manipulation of specific neuron types in mouse brain by Cre-activated viral gene expression[J]. PLoS One, 2008, 3(4): e2005. DOI: 10.1371/journal.pone.0002005. |
| [16] | LAMMEL S, LIM B K, RAN C, et al. Input-specific control of reward and aversion in the ventral tegmental area[J]. Nature, 2012, 491(7423): 212-217. DOI: 10.1038/nature11527. |
| [17] | KIM C K, YANG S J, PICHAMOORTHY N, et al. Simultaneous fast measurement of circuit dynamics at multiple sites across the mammalian brain[J]. Nat Methods, 2016, 13(4): 325-328. DOI: 10.1038/nmeth.3770. |
| [18] | LUO M. The nucleocapsid of vesicular stomatitis virus[J]. Sci China Life Sci, 2012, 55(4): 291-300. DOI: 10.1007/s11427-012-4307-x. |
| [19] | HABERL M G, VIANA DA SILVA S, GUEST J M, et al. An anterograde rabies virus vector for high-resolution large-scale reconstruction of 3D neuron morphology[J]. Brain Struct Funct, 2015, 220(3): 1369-1379. DOI: 10.1007/s00429-014-0730-z. |
| [20] | VAN DEN POL A N, OZDUMAN K, WOLLMANN G, et al. Viral strategies for studying the brain, including a replication-restricted self-amplifying delta-G vesicular stomatis virus that rapidly expresses transgenes in brain and can generate a multicolor golgi-like expression[J]. J Comp Neurol, 2009, 516(6): 456-481. DOI: 10.1002/cne.v516:6. |
| [21] | BEIER K, CEPKO C. Viral tracing of genetically defined neural circuitry[J]. J Vis Exp, 2012, 68: 4253. |
| [22] | GREEN T J, ZHANG X, WERTZ G W, et al. Structure of the vesicular stomatitis virus nucleoprotein-RNA complex[J]. Science, 2006, 313(5785): 357-360. DOI: 10.1126/science.1126953. |
| [23] | CHEN L Y, YAN Q, LU G L, et al. Several residues within the N-terminal arm of vesicular stomatitis virus nucleoprotein play a critical role in protecting viral RNA from nuclease digestion[J]. Virology, 2015, 478: 9-17. DOI: 10.1016/j.virol.2015.01.021. |
| [24] | STOJDL D F, LICHTY B D, TENOEVER B R, et al. VSV strains with defects in their ability to shutdown innate immunity are potent systemic anti-cancer agents[J]. Cancer Cell, 2003, 4(4): 263-275. DOI: 10.1016/S1535-6108(03)00241-1. |
| [25] | FANG X K, ZHANG S K, SUN X D, et al. Evaluation of attenuated VSVs with mutated M or/and G proteins as vaccine vectors[J]. Vaccine, 2012, 30(7): 1313-1321. DOI: 10.1016/j.vaccine.2011.12.085. |
| [26] | GENOVE G, DEMARCO U, XU H Y, et al. A new transgene reporter for in vivo magnetic resonance imaging[J]. Nat Med, 2005, 11(4): 450-454. DOI: 10.1038/nm1208. |
 2018, Vol. 35
2018, Vol. 35 
