2. 波谱与原子分子物理国家重点实验室, 武汉磁共振中心(中国科学院 武汉物理与数学研究所), 湖北 武汉 430071
2. State Key Laboratory of Magnetic Resonance and Atomic and Molecular Physics, National Center for Magnetic Resonance in Wuhan(Wuhan Institute of Physics and Mathematics, Chinese Academy of Sciences), Wuhan 430071, China
脊椎动物体内含有非常丰富的白蛋白,而人血清白蛋白(Human Serum Albumin,HSA)在人体血清中含量高达血清蛋白总量的60%~65%,其主要作用是调节渗透压.功能上,白蛋白作为转运蛋白可以广泛运载和短暂存储各种内源性与外源性的化合物,例如转运脂肪酸、影响多种药物的代谢动力学、清理有毒代谢物、提高血清抗氧化能力等[1].早在1941年,Kendall等人[2]就首次发现HSA结合脂肪酸(Fatty Acid,FA)的现象,当时提出“血清中某些染料使白蛋白重结晶4次之后仍然呈现黄色,怀疑这些染料本质上可能是类脂”.随后的几十年中,随着科学技术的进步,不断有研究进一步揭示白蛋白结合脂肪酸的能力.晶体结构显示[3],白蛋白表面以非对称的形式分布着7个当量的中长链脂肪酸结合位点,并有着不同的结合强度,表明白蛋白与脂肪酸的作用形式复杂多样.在正常的人生理条件下,每摩尔HSA大约可以结合0.1~2.0 mol脂肪酸[4].目前,人们对脂肪酸的摄取主要是饱和脂肪酸,越来越多的研究表明,脂肪酸与许多疾病,包括癌症的产生都有着密切关系,且游离脂肪酸对机体脂代谢的反应比甘油三酯和胆固醇更为灵敏,一些重要游离脂肪酸含量的异常变化是病情发展的重要依据.然而由于游离脂肪酸的水溶性极差,通常需要结合血清白蛋白进行储存和运输,因此对人体血液中白蛋白与脂肪酸的相互作用研究具有非常重要的意义.
研究表明,在蛋白质与配体的相互作用中,组氨酸(Histidine, His)是常见的活性中心,具有重要的功能,并发挥着不可替代的作用.这主要得益于其独特的分子结构,组氨酸有一个咪唑侧链,咪唑环侧链的pKa约为6.0,使得组氨酸的pKa相对中性,这就意味着在细胞中很小的pH变化都会引起组氨酸的电荷变化[5].正因为如此,组氨酸在各种蛋白中常作为配体结合位点,同时也作为酶催化的活性中心,例如促胰凝素的催化功能[6].从本质上讲,咪唑侧链上有两个性质不同的氮原子,其中一个结合氢原子呈弱酸性,另一个含孤电子对呈碱性,因此组氨酸既可以作为酸提供质子,又可以作为碱接受质子,还可以同时作为氢键供体和氢键受体.在生理条件下,组氨酸同时以3种不同的状态存在:一种质子化状态,两种不同的中性互变异构体状态,多样化的存在形式使组氨酸可以作为亲核试剂、酸碱催化剂、质子梭子等,因此可作为研究蛋白质动态结构和蛋白配体相互作用的一个理想探针.
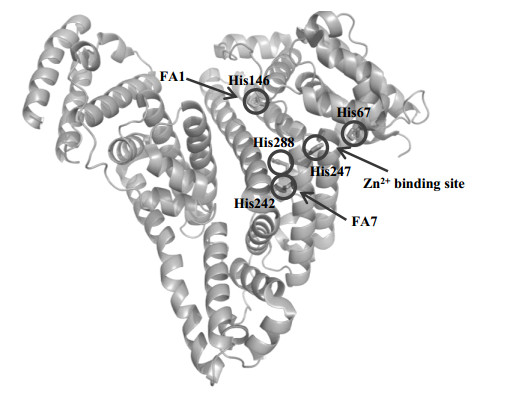
在构成白蛋白的585个氨基酸中,共有16个组氨酸,其中5个位于结构域表面,分别为domain Ⅰ的His67、His146和domain Ⅱ的His242、His247、His288[7].这些组氨酸不仅涉及白蛋白的构象变化,而且参与锌离子、脂肪酸等配体的相互作用[7-9](如图 1所示).不同物种血清白蛋白的序列比对显示组氨酸位点和数目都高度保守,这更进一步说明了组氨酸在白蛋白生物活性中扮演重要的角色.因此,研究蛋白质表面组氨酸与配体的相互作用对于我们了解白蛋白结合脂肪酸的作用机制至关重要.
|
图 1 白蛋白表面的5个组氨酸及相关配体作用位点(PDB ID: 1E7H) Figure 1 5 histidines on the surface of albumin and the acting sites of related ligands (PDB ID: 1E7H) |
近些年来,除了晶体衍射,液体核磁共振(Nuclear Magnetic Resonance,NMR)技术在白蛋白多结合位点研究中应用广泛[10, 11].有人通过使用13C标记的长链脂肪酸,采用1D13C NMR[12]和2D 1H-13C HSQC[13]等方法观测小分子以表征不同脂肪酸与白蛋白的结合位点及结合强度.然而,对于白蛋白这样分子量较大的天然同位素丰度蛋白质,常规手段依然很难直接对其进行观察.一些用于研究配体与蛋白之间的相互作用的技术,如WaterLOGSY[14](Water-Ligand Observed via Gradient SpectroscopY),STD(Saturation Transfer Difference)技术等,直接观测参与相互作用的小分子,能够很容易区分出小分子是否能够结合靶标大分子,因此在高通量药物筛选方向应用非常广泛[15],但是此类方法难以获得关于大分子的作用信息,如结合位点等.
本课题组前期研究中,在WaterLOGSY的基础上,使用水的辐射阻尼(Radiation Damping,RD)效应取代选择性脉冲或组合脉冲来完成对水磁化矢量的选择性激发,降低由此产生的弛豫效应、扩散效应和饱和效应,以提高WaterLOGSY实验的灵敏度[16].对于单一大分子体系,同时结合横向弛豫加权(T2 Weighted,T2W)技术,通过调节自旋回波的时间来滤掉蛋白主链宽包信号,从而保留蛋白分子表面与溶剂分子有快交换或强核Overhauser效应(Nuclear Overhauser Effect,NOE)的信号,进而获得蛋白质表面组氨酸的信号,并通过观测其化学位移等随配体浓度的变化,获得相互作用信息.这些工作表明T2W-RD-WaterLOGSY技术能够大大简化HSA 1D 1H NMR谱,且低场区域信号大部分来自于白蛋白结构域表面的组氨酸[17].本文在上述工作基础上,对检测到的HSA表面组氨酸信号进行了部分归属,并将T2W-RD-WaterLOGSY技术应用于HSA与脂肪酸的相互作用研究.
1 实验部分 1.1 实验试剂HSA固体粉末(去脂肪酸,纯度 > 98%)、无水磷酸氢二钠(Na2HPO4)、二水合磷酸二氢钠(NaH2PO4·2H2O)、二硫苏糖醇(Dithiothreitol, DTT)、十六碳饱和脂肪酸(C16:0)、二甲亚砜(Dimethylsulphoxide, DMSO)和重水(D2O)均购于Sigma-Aldrich公司.
1.2 样品配制脂肪酸储液制备:使用分析天平准确称量25.6 mg脂肪酸(C16:0)粉末溶于500 μL DMSO中,得到200 mmol/L的脂肪酸储液,放入4 ℃冰箱存储备用.
HSA-FA复合物制备:配制终浓度为0.5 mmol/L的HSA于100 mmol/L且pH为7.40的PBS缓冲溶液中,并与脂肪酸储液一同放入37 ℃恒温水浴锅中温浴5 min,随后在500 mL HSA样品中分别滴加不同量脂肪酸储液使其最终与HSA的比例(FA:HSA)为0:1、0.4:1、0.8:1、1.2:1、1.6:1、2.0:1、2.4:1和2.8:1,补加DMSO使其终量均为5 μL以消除DMSO可能对HSA产生的影响,低频超声后放入37 ℃恒温水浴锅孵化2 h.
将所有样品装入直径为5 mm的NMR样品管中,实验前置于4 ℃冰箱待用.
1.3 NMR实验所有实验均在Bruker Avance Ⅲ 850型NMR谱仪上采集,对应质子共振频率为850.3 MHz,实验温度为298 K.
T2W-RD-WaterLOGSY实验在采样之前采用WATERGATE W5序列抑制水峰,T2W采用CPMG脉冲序列,CPMG总的自旋回波时间为62 ms,极化转移的混合时间为800 ms,W5脉冲串的时间间隔为60 μs,辐射阻尼效应调控延迟时间(Δ)为22 ms,等待时间为1 s,采样点数为64 k,累加次数为512,谱宽为10 204.08 Hz.
2D 1H-1H TOCSY实验的间接维采样模式为States-TPPI,两维谱宽均为8 503.40 Hz,采样数据点阵t2×t1 = 2 048×256,累加次数为32,所有实验的中心频率均为3 987.92 Hz.
1.4 实验数据处理实验数据处理均使用Bruker Topspin V3.2软件完成(Bruker Biospin,Germany),1D自由感应衰减(Free Induction Decay, FID)信号在进行傅里叶变换之前采用指数窗函数进行处理,线宽因子为1 Hz.
2 结果与讨论 2.1 HSA表面部分组氨酸的信号归属由于质子灵敏度非常高,且天然丰度同位素含量丰富,因此1H NMR在各种有机大小分子的结构及动力学研究上应用非常广泛.然而对于分子量较大的蛋白质例如HSA(分子量为66.5 k),由于各个信号之间重叠严重,谱峰变宽,普通1D 1H NMR谱很难得到有用的信息.而T2W-RD-WaterLOGSY技术能够大大简化分子量较大的蛋白质的1D 1H NMR谱,获得天然丰度蛋白质表面的组氨酸信号.位于HSA结构域表面的5个组氨酸不仅涉及白蛋白的构象变化,而且参与锌离子、脂肪酸等配体的相互作用.因此通过选择性检测这些蛋白表面的组氨酸可以简化谱图,进而对蛋白与配体的相互作用进行研究表征.
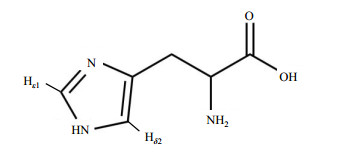
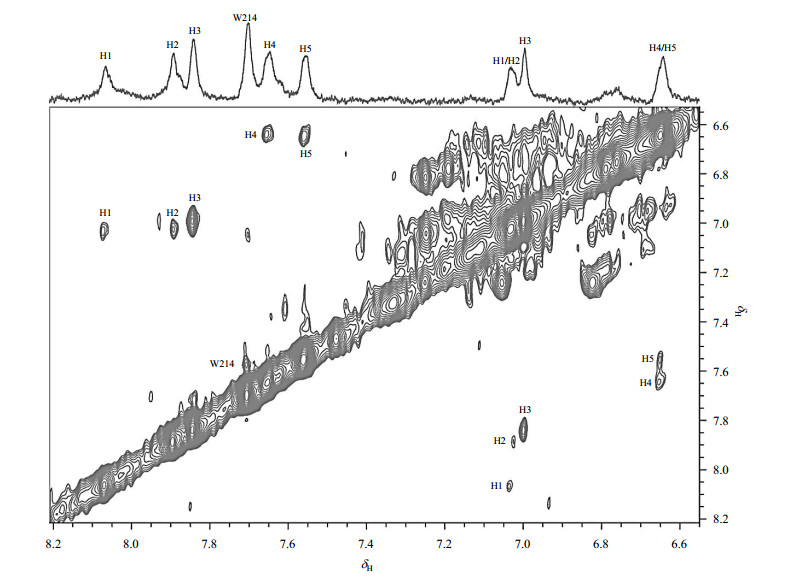
分子量较大的蛋白质的横向弛豫时间(T2)较短,2D TOCSY谱适用于检测大分子量的蛋白质中构象灵活多变的区域,尤其是活泼的氨基酸侧链.组氨酸咪唑环上的Hδ2和Hε1组成特征自旋相关网络(如图 2所示),这两个氢核在1H-1H TOCSY谱图中表现为一组处于NMR谱低场区的交叉耦合信号.我们采集了HSA的2D TOCSY谱图,并将其低场区域的信号与1D T2W-RD-WaterLOGSY NMR谱图进行比对,结果如图 3所示.从图 3可以看到,1D 1H NMR谱中每个峰(H1~H5)在二维谱中都有相对应的交叉峰.本课题组曾经运用T2W-RD-WaterLOGSY方法对HSA做过正常血清pH 7.35~7.45范围滴定和锌离子滴定实验[17, 18].结果显示当pH逐渐升高时,除了δ7.7处峰无任何变化外,其他峰的化学位移均向高场发生不同程度的移动.而锌离子滴定实验结果则显示,随着锌离子的不断滴加,H4/H5峰强度逐渐减小至消失.结合组氨酸特性及我们的TOCSY图谱,不难得出H1~H5即为白蛋白结构域表面的五个组氨酸His67、His146、His242、His247和His288.其中His67/His247由于参与锌离子的配位,当锌离子结合时,N-H交换受限制,信号消失,因此我们推断H4/H5是来自锌离子结合位点的His67/His247两个残基.
|
图 2 组氨酸示意图 Figure 2 The diagram of Histidine |
|
图 3 HSA的1H-1H TOCSY谱图.图中H表示组氨酸, HN(N=1~5)表示同一个组氨酸咪唑环上两个质子(图 2中的Hε1与Hδ2)的交叉峰 Figure 3 1H-1H TOCSY spectrum of HSA. H represents His, HN (N=1~5) represents the cross peak between Hε1 and Hδ2 showed in Fig. 2 |
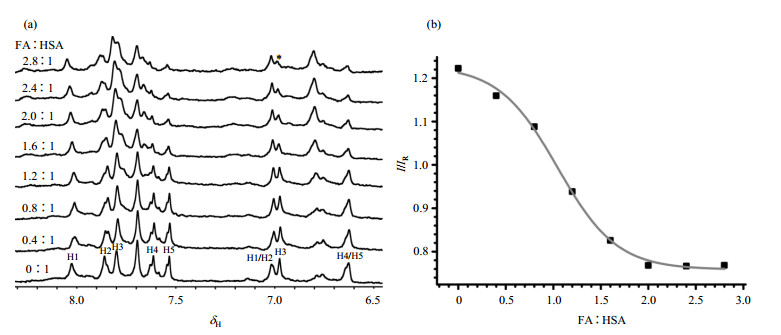
正常成年人血清中十六烷酸(C16:0)和十八烷酸(C18:0)含量最高,我们选用C16:0为代表,对HSA与游离脂肪酸的结合进行研究,使用T2W-RD-WaterLOGSY技术对HSA进行了脂肪酸滴定实验,结果如图 4所示.
|
图 4 脂肪酸滴定HSA的(a)T2W-RD-WaterLOGSY谱及(b)其对应的特征谱线(*)相对强度随FA:HSA浓度比变化曲线 Figure 4 T2W-RD-WaterLOGSY spectra of fatty acid titrated HSA (a) and peak intensity of the characterized His (*) versus FA:HSA concentration ratio (b) |
晶体结构表明HSA表面以非对称的形式分布着7个亲和力不同的脂肪酸结合位点,其中结合位点FA1和FA7分别涉及到两个组氨酸His146和His242的参与[7, 19].根据WaterLOGSY的机制,当脂肪酸逐渐占据HSA中结合位点的疏水腔,组氨酸侧链质子与周围水分子的交换会受到影响,在谱图上反映为信号强度的降低.由图 4(a)可以看到,随着脂肪酸比例的增加,5个组氨酸残基中,H1化学位移和强度均未发生变化,H2和H3的强度逐渐降低,经TOCSY确认,H4和H5的化学位移从δ6.63移至δ6.79,向低场方向发生了非常明显的位移.因此我们推断信号强度受脂肪酸结合影响的H2/H3很可能是来自His 146或His 242.我们进一步选择低场H1的信号强度作为参照IR,选择峰形相对清晰独立的H3 [图 4(a)中*位置]的信号强度与其对比得到相对峰强(I/IR),并对该相对峰强的变化与FA:HSA比例做了拟合曲线.从图 4(b)可以看出,在脂肪酸含量相对较少的时候,该峰强度稍有降低;随着脂肪酸比例的不断增加,在FA:HSA超过1:1时,峰强度变化比较明显;当比例超过2:1时,峰强度变化再次趋于平缓.表明HSA有2个高亲和的脂肪酸结合位点优先结合脂肪酸,当脂肪酸添加比例达到2:1时,该位点对脂肪酸的结合趋于饱和,在其饱和后,才可能有其他结合位点与脂肪酸进一步发生相互作用.上述结果与Wosilait等人[20]通过理论分析结果基本相符.Wosilait等人模拟发现,当FA:HSA的生理浓度范围在0.5:1~1:1时,绝大多数脂肪酸是结合在高亲和结合位点,随着脂肪酸含量的增加会有部分脂肪酸分布到稍弱的结合位点.其中结合优先次序的差异可能是由于HSA的酸碱浓度以及构象变化不同而引起的.此外,通过读取目标峰的相对强度值并对应滴定曲线,我们可以大致判断脂肪酸与HSA的结合比例,进而推断游离脂肪酸的含量,为一些疾病的诊断提供参考依据.
除了峰强度的变化,从图 4(a)中我们也可以看到随着脂肪酸含量的滴加,表征锌离子结合位点的His67和His247[18]信号化学位移往低场方向发生了很明显的位移.这是由于FA1和FA7处于白蛋白结构域Ⅰ和结构域Ⅱ之间,同时又与锌离子结合位点和药物结合位点Ⅰ临近,因此这块区域的构象变化非常灵活,脂肪酸的结合可能引起了白蛋白的构象变化,间接影响了锌离子结合位点化学环境的变化,导致化学位移的变化.晶体结构同样也表明当脂肪酸结合在HSA之后,蛋白分子的不同结构域之间发生明显转动,此外脂肪酸的结合还导致一些氨基酸疏水侧链发生移动,从而开放了一些以前被这些氨基酸疏水侧链禁锢的结合位点[21].
3 结论我们将组氨酸选择性检测技术T2W-RD-WaterLOGSY技术应用于研究HSA与脂肪酸的相互作用,该技术可以检测HSA结构域表面比较活泼的5个组氨酸,其中位于FA1和FA7结合位点的His146/His242可以用来表征HSA对脂肪酸的结合.通过脂肪酸滴定前后谱图的变化我们发现脂肪酸优先进入亲和力高的结合位点,当脂肪酸结合比例达到2.0时,该位点对脂肪酸的结合趋于饱和,表明HSA表面有两个高亲和力的脂肪酸结合位点.同时,我们可以参考该曲线判断未知样品中HSA结合脂肪酸的比例,进而有助于测定血清中脂肪酸的相对含量.
| [1] | SLEEP D. Albumin and its application in drug delivery[J]. Expert Opin Drug Deliv, 2015, 12(5): 793-812. DOI: 10.1517/17425247.2015.993313. |
| [2] | KENDALL F E. Studies on human serum proteins[J]. J Biol Chem, 1941, 138(1): 97-109. |
| [3] | SUGIO S, KASHIMA A, MOCHIZUKI S, et al. Crystal structure of human serum albumin at 2.5Å resolution[J]. Protein Eng Des Sel, 1999, 12(6): 439-446. DOI: 10.1093/protein/12.6.439. |
| [4] | FREDRICKSON D S, JR R S G. The metabolism of albumin-bound C14-labeled unesterified fatty acids in normal human subjects[J]. J Clin Invest, 1958, 37(11): 1504-1515. DOI: 10.1172/JCI103742. |
| [5] | LIAO S M, DU Q S, MENG J Z, et al. The multiple roles of histidine in protein interactions[J]. Chem Cent J, 2013, 7(1): 44. DOI: 10.1186/1752-153X-7-44. |
| [6] | SCHNEIDER F. Histidine in enzyme active centers[J]. Angew Chem Int Ed Engl, 1978, 17(8): 583-592. DOI: 10.1002/(ISSN)1521-3773. |
| [7] | BLINDAUER C A, HARVEY I, BUNYAN K E, et al. Structure, properties, and engineering of the major zinc binding site on human albumin[J]. J Biol Chem, 2009, 284(34): 23116-23124. DOI: 10.1074/jbc.M109.003459. |
| [8] | KANEKO K, CHUANG V T, MINOMO A, et al. Histidine146 of human serum albumin plays a prominent role at the interface of subdomains ⅠA and ⅡA in allosteric ligand binding[J]. IUBMB Life, 2011, 63(4): 277-285. DOI: 10.1002/iub.v63.4. |
| [9] | BHATTACHARYA A A, GRüNE T, CURRY S. Crystallographic analysis reveals common modes of binding of medium and long-chain fatty acids to human serum albumin[J]. J Mol Biol, 2000, 303(5): 721-732. DOI: 10.1006/jmbi.2000.4158. |
| [10] |
DAI C Y, ZHANG Z T, LIU M L, et al. Application of NMR in the studies of structure and interactions of α-synuclein[J].
Chinese J Magn Reson, 2016, 33(1): 153-167.
戴晨晔, 张则婷, 刘买利, 等. NMR在α-Synuclein的结构及相互作用研究中的应用[J]. 波谱学杂志, 2016, 33(1): 153-167. |
| [11] |
CHENG K, YAO C D, XU G H, et al. Interaction of GB1 with metal ions studied by NMR spectroscopy[J].
Chinese J Magn Reson, 2018, 35(1): 1-7.
成凯, 姚陈叠, 徐国华, 等. GB1与金属离子相互作用的NMR研究[J]. 波谱学杂志, 2018, 35(1): 1-7. |
| [12] | SIMARD J R, ZUNSZAIN P A, HAMILTON J A, et al. Location of high and low affinity fatty acid binding sites on human serum albumin revealed by NMR drug-competition analysis[J]. J Mol Biol, 2006, 361(2): 336-351. DOI: 10.1016/j.jmb.2006.06.028. |
| [13] | HAMILTON J A. NMR reveals molecular interactions and dynamics of fatty acid binding to albumin[J]. Biochim Biophys Acta, 2013, 1830(12): 5418-5426. DOI: 10.1016/j.bbagen.2013.08.002. |
| [14] | DALVIT C, PEVARELLO P, TATÒ M, et al. Identification of compounds with binding affinity to proteins via magnetization transfer from bulk water[J]. J Biomol NMR, 2000, 18(1): 65-68. DOI: 10.1023/A:1008354229396. |
| [15] | DALVIT C, FOGLIATTO G, STEWART A, et al. WaterLOGSY as a method for primary NMR screening:practical aspects and range of applicability[J]. J Biomol NMR, 2001, 21(4): 349-359. DOI: 10.1023/A:1013302231549. |
| [16] | SUN P, JIANG X W, JIANG B, et al. Biomolecular ligands screening using radiation damping difference WaterLOGSY spectroscopy[J]. J Biomol NMR, 2013, 56(3): 285-290. DOI: 10.1007/s10858-013-9748-4. |
| [17] |
CHEN Y, SUN P, LIU M L, et al. Effects of metal ions on human serum albumin studied by radiation damping water-ligand observed via gradient spectroscopy[J].
Chinese J Magn Reson, 2017, 34(3): 266-274.
陈瑶, 孙鹏, 刘买利, 等. 离子对人血清白蛋白影响的1H NMR研究[J]. 波谱学杂志, 2017, 34(3): 266-274. |
| [18] | 陈瑶. 人血清白蛋白与配体之间相互作用的核磁共振研究[D]. 武汉: 中国科学院武汉物理与数学研究所, 2016. http://cdmd.cnki.com.cn/Article/CDMD-80020-1016090697.htm |
| [19] | FANALI G, DI MASI A, TREZZA V, et al. Human serum albumin:from bench to bedside[J]. Mol Aspects Med, 2012, 33(3): 209-290. DOI: 10.1016/j.mam.2011.12.002. |
| [20] | WOSILAIT W D, SOLER-ARGILAGA C. A theoretical analysis of the multiple binding of palmitate by bovine serum albumin:The relationship to uptake of free fatty acids by tissues[J]. Life Sci, 1975, 17(1): 159-166. DOI: 10.1016/0024-3205(75)90252-0. |
| [21] | VAN DER VUSSE G J. Albumin as fatty acid transporter[J]. Drug Metab Pharmacokinet, 2009, 24(4): 300-307. DOI: 10.2133/dmpk.24.300. |
 2018, Vol. 35
2018, Vol. 35 
