核磁共振扩散序谱(Diffusion Ordered Spectroscopy,DOSY)是目前测量液体样品的自扩散系数(D,简称扩散系数)的一个重要的方法,它通过脉冲梯度场(Pulsed Field Gradient,PFG)对溶液中分子的平移运动进行空间编码,在分子的扩散运动(扩散系数D)与梯度场强度g之间建立起明确的数学关系[1]:
| $ I = {I_0}{{\rm{e}}^{ - D{\gamma ^2}{g^2}{\delta ^2}(\Delta - \frac{\delta }{3})}} $ | (1) |
其中,I表示加上梯度场脉冲之后测得的信号强度;I0是未加梯度场脉冲时测得的信号强度;D为自扩散系数;γ为所观测核的磁旋比;g为梯度场强度;δ为梯度场脉冲宽度;Δ为脉冲序列中一对梯度场脉冲之间的时间,即扩散时间.将实验中不同梯度场强度下测得的谱峰强度I代入(1)式,通过指数曲线的拟合便可求得D值.
一维谱中的谱峰产生于溶液中相同或不同的分子,通过谱峰积分面积随梯度场强变化拟合出的D值就是其对应的分子在该溶液体系中的扩散系数.与分别拟合出各个谱峰的D值不同,另一种呈现D拟合值的方式是二维DOSY谱[2].二维DOSY图谱中的其中一维是普通的化学位移轴,另一维则是扩散系数轴,相关峰所对应的扩散系数则是从该谱峰的最高点在扩散系数维的投影值(lgD)读出并换算而得,如图 1所示.相关峰的产生首先是通过对其化学位移轴上相应数据点的峰强度变化拟合出,再对D值在一个预设的范围内进行反拉普拉斯变换后模拟生成的[2].虽然在一张DOSY谱上能够读取所有谱峰所对应的扩散系数,但是在DOSY图谱的数据处理时有2个人为设置的参数,即扩散系数的取值范围和数据点[3].扩散系数取值范围和数据点决定了该维读数的数字分辨率(数字分辨率r=扩散系数的取值范围/数据点),而数字分辨率的大小直接影响到DOSY实验中扩散系数读数的偏差.

|
图 1 乙基苯样品的DOSY实验图谱(CDCl3) Figure 1 DOSY spectrum of ethyl benzene (CDCl3) |
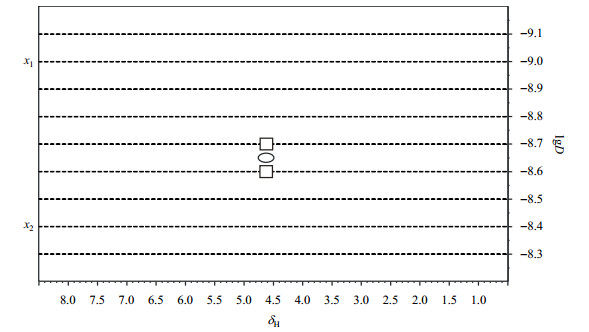
如图 2所示,这是一张有关DOSY谱上扩散系数维的数据点及其数字分辨率r的示意图,纵坐标表示扩散系数维的取值,每一条虚线即代表该维的一个数据点,两条虚线间的间隔为该维的数字分辨率.当真实的谱峰最高点(lgD)出现在介于相邻的数据点之间时(如图 2中的椭圆形所示),由于数字分辨率的原因,图谱上实际的谱峰最高点会出现在其临近的数据点上(如图 2上的矩形所示),因此图谱上扩散系数维设置的数字分辨率r(与扩散系数的取值范围和数据点相关)的设定影响了谱峰最高点读数的准确性,即为扩散系数维读数的最小偏差.当数字分辨率不够高时,有可能成为实验偏差的主要来源.
|
图 2 DOSY数字分辨率示意图 Figure 2 Diagram of digital resolution on F1 dimension (diffusional coefficient dimension) of DOSY spectrum |
从最初的自旋回波序列(Spin Echo,SE)序列[4]到后来的刺激回波(STimulated Echo,STE)序列[5]的衍变,以及纵向涡流延迟(Longitudinal Eddy current Delay,LED)技术[6]和偶极梯度场脉冲对(Bipolar Pulse Pairs,BPP)[7]技术的运用,大大提高了DOSY实验的可重复性和准确性,也大大拓展了DOSY实验的应用范围.DOSY谱中不同扩散速率分子产生的谱峰可以依据它们扩散的快慢沿着扩散系数维展开(谱峰不重叠的情况下),因此被广泛应用于复杂混合物的分析测试[8-10].更多的应用则是将溶液体系中扩散系数的变化用于表征分子间的相互作用[11, 12],包括分子组装[13]、研究药物分子的包裹作用[14-17]以及聚合物分子量的测定等[18].在已发表的用扩散系数变化表征分子间相互作用的研究文献中,扩散系数的相对变化值通常在百分之几十~百分之十几之间[19-21],也有仅百分之几的变化[22],但提及扩散系数维的数据点数,以及考虑该维数字分辨率对研究结果的影响的研究并不多见.早期研究DOSY实验方法的文献曾经提及能观察到的扩散系数最小变化值在2%左右[20],而本文的研究结果表明如果数字分辨率运用得不合适,偏差会远大于2%(见本文的研究结果与讨论),因此有必要对DOSY图谱扩散系数维数字分辨率的影响做一个较系统的研究,避免由此引起的实验偏差增加.
数字分辨率的大小只是DOSY实验结果的偏差来源之一,它源于对实验数据的处理,而实验数据本身也会产生一个偏差范围.为了区分和比较两者的差别,本文首先研究了DOSY实验本身的重复性及偏差范围,继而分析研究了数字分辨率对扩散系数检测值的影响,阐述了实验偏差与数字分辨率的关系.
1 实验部分 1.1 仪器与测试样品测试仪器为Bruker公司的AvanceⅢ HD谱仪,配有BBFO 5 mm探头,1H核的共振频率为500.13 MHz.Z方向最大梯度场强度为53.5 Gauss/cm.测试样品为Bruker公司提供的标样,即0.1%乙基苯/氘代氯仿(EB/CDCl3)样品.
1.2 NMR实验DOSY实验使用Bruker公司的标准脉冲序列stebpgp1s[4],谱宽为4 006.41 Hz,激发中心为2 250.59 Hz,1H通道射频脉冲脉宽为10 μs,功率为21.8 W,弛豫延迟时间(D1)为2 s.累加次数为16,空采次数为16.脉冲序列中的扩散时间(Δ)为40 ms;梯度场脉冲宽度(δ)为1 800 μs,脉冲形状为梯形.每个DOSY实验中梯度场脉冲的强度(g)变化范围为5%~95%,采用线性方式在该范围中选取16个变化值.采样数据点为16 k,采样时间为2 s.
1.3 数据处理所得的实验数据处理软件为Bruker公司提供的TopSpin 3.5pl7.通过其中的“DOSY”程序对实验得到的数据进行扩散系数拟合和反拉普拉斯变换,进而得到相应的DOSY图谱.处理过程中扩散系数维数据点为1 k,该维的取值范围(lgD)为-8 ~ -10,这两个处理参数其它的选值将在后面的讨论部分中加以具体说明.谱峰所对应的扩散系数值D是由该峰的最高点在扩散系数维的投影值(lgD)读出并换算而得.
2 结果与讨论 2.1 DOSY实验偏差范围为了更准确地区分DOSY实验导致的偏差与数字分辨率引入的偏差,首先采用同样的样品与实验条件测试了6组DOSY实验以确定实验导致的偏差范围.每组实验连续测试5次,而1~6组实验依次之间的时间间隔为1天.图 1为实验得到的DOSY图谱,其中以样品乙基苯中CH2峰(图中虚线所示位置)的数值代表乙基苯分子的扩散系数,共30个扩散系数值列于表 1.
| 表 1 DOSY实验测得的乙基苯分子扩散系数 Table 1 Self-diffusion coefficients of ethylbenzene measured by DOSY experiments |
由于测试样品的溶剂为低粘度的氘代氯仿,有研究[23, 24]表明这样的稀溶液在室温下只要存在控温的加热气流,就会产生沿NMR样品管方向的温度梯度,进而产生对流,影响扩散系数的测量.为避免此类现象对实验测量值造成偏差,上述所有实验都是在无温控和无温控气流的条件下进行的,实验室温度为(288±1)K.
为了更好地呈现实验的偏差范围,采用了平均偏差(
| $ \bar d = \frac{{\sum\nolimits_{i = 1}^n {|{D_i} - \bar D|} }}{n} $ | (2) |
| $ {\bar d_r} = \frac{{\bar d}}{{\bar D}} \times 100\% $ | (3) |
其中
表 1中最后两列给出了每组5次连续实验的平均偏差(
上述DOSY图谱的处理中在扩散系数维的取值范围(lgD)在-8 ~ -10之间,该取值范围是有机化合物在溶液中常见范围[25],而该维所用的数据点是1 024,那么相邻两个数据点间lgD的差值为:
当扩散系数维是以对数形式(lgD)取值时,所有数据点间的间隔(即数字分辨率r)是相同的,而换算成D值时,则数据点间隔是不等的.如图 2所示,x1数据点与相邻数据点间的间隔为(
根据上述所用的处理参数,图 1中DOSY谱的数字分辨率r为0.001 95,相对数字分辨率R则为0.45%.为更明确地表明DOSY实验中数字分辨率的设置所引入的偏差,对表 1中的第2组实验数据进行了不同数据点的处理,其结果列于表 2.当取值范围(lgD)不变(-8 ~ -10),数据点为64和256时,它们所对应的相对数字分辨率R分别为7.46%和1.82%,表 2中列出的5个数据之间只观察一个差值,其相对数据与相对数字分辨率基本一致,表明D值的偏差主要由数字分辨率不够高导致的.当数据点增加至1 024时,5个数据之间主要有2个差值(其中0.001的差值对于我们的研究没有意义,故舍去),其中一个的相对数据差值大于相对数字分辨率(约为2倍),说明此时的主要偏差不是来源于数字分辨率,因为数字分辨率引入的偏差只来源于相邻数据点的差别,不会大于相对数字分辨率本身.此外,由相对平均偏差的变化可知,随着数据点的增加,实验的精度也会逐渐提高.
| 表 2 不同数据点处理时扩散系数的偏差范围 Table 2 Deviation range of self-diffusion coefficients when processing DOSY data with different data points |
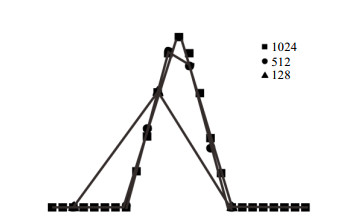
图 3更直观地显示了数据点的多少对谱峰最高点(对应于扩散系数的读数)的影响,图中的谱峰来自于图 1 DOSY图谱中虚线(通过CH2谱峰最高点)所在的化学位移位置(δ 2.67)对应的纵向一维谱.三角形、圆形和方形分别代表DOSY数据处理时所用数据点分别取128、512和1 024.从图中可以观察到当有足够多的数据点(如1 024)时,这些数据点能较准确地描述出完整的峰型,包括谱峰的最高点;而数据点不足时不仅峰型描述得不够准确,更重要的是谱峰最高点的位置会随数据点移动,引起读数的偏差.
|
图 3 不同数据点处理时扩散系数维示意图 Figure 3 Sketch diagram of F1 dimension processed with different data points |
上述的研究结果表明DOSY图谱数据处理时如果设置的数据点不够多,导致数字分辨率不够高时,将会对实验所得的扩散系数测量值造成偏差,应当在设置相应的处理参数时予以充分考虑,并在成果发表时予以明确的陈述.当需要用扩散系数的变化值来表征分子结构或状态的变化时,相对数字分辨率应小于对应的相对变化值;当需要考虑扩散系数值的数据重复性时,建议相对数字分辨率R小于1%.从本文的研究结果中可知:扩散系数(lgD)取值范围为-8 ~ -10时,64、256和1 024个数据点对应的相对数字分辨率为7.46%、1.82%和0.45%.如果取值范围改变,则相对数字分辨率
理论上如果相对数字分辨率为R,则由分辨率导致的读数偏差范围应该为(±R/2),由于数值范围上没有差别,为方便和容易理解,本文在所有的研究结果讨论中直接用R代替了±R/2.
| [1] | JOHNSON C S. Diffusion ordered nuclear magnetic resonance spectroscopy:principles and applications[J]. ChemInform, 1999, 30(33): 203-256. |
| [2] |
LV J, SHAN L, TU G Z. The integrated DOSY acquisition/processing module for TopSpin NMR software[J].
Chinese J Magn Reson, 2008, 25(1): 133-143.
吕娟, 单璐, 涂光忠. TopSpin核磁共振软件中集成的DOSY采集/处理模块DOSYmTM[J]. 波谱学杂志, 2008, 25(1): 133-143. DOI: 10.3969/j.issn.1000-4556.2008.01.019. |
| [3] | ANTALEK B. Using pulsed gradient spin echo NMR for chemical mixture analysis:How to obtain optimum results[J]. Concept Magn Reson A, 2010, 14(4): 225-258. |
| [4] | STEJSKAL E O, TANNER J E. Spin diffusion measurements:spin echoes in the presence of a time-dependent field gradient[J]. J Chem Phys, 1965, 42(1): 288-292. DOI: 10.1063/1.1695690. |
| [5] | TANNER J E. Use of the stimulated echo in NMR diffusion studies[J]. J Chem Phys, 1970, 52(5): 2523-2526. DOI: 10.1063/1.1673336. |
| [6] | WU D H, CHEN A, JOHNSON C S. Flow imaging by means of 1D pulsed-field-gradient NMR with application to electroosmotic flow[J]. J Magn Reson, 1995, 115(1): 123-126. DOI: 10.1006/jmra.1995.1156. |
| [7] | WIDER G, DOTSCH V, WUTHRICH K. Self-compensating pulsed magnetic-field gradients for short recovery times[J]. J Magn Reson, 1994, 108(2): 255-258. DOI: 10.1006/jmra.1994.1120. |
| [8] | BARJAT H, MORRIS G A, SMART S, et al. High-resolution diffusion-ordered 2D spectroscopy (HR-DOSY)-a new tool for the analysis of complex mixtures[J]. J Magn Reson, 1995, 108(2): 170-172. DOI: 10.1006/jmrb.1995.1118. |
| [9] | Ca2+ assisted DOSY NMR: An unexpected tool for anomeric identification for D-glucopyranose[J]. ChemistrySelect, 2018, 3, DOI: 10.1002/slct.201800316 http://www.researchgate.net/publication/324522959_Ca_2_-Assisted_DOSY_NMR_An_Unexpected_Tool_for_Anomeric_Identification_for_d_-Glucopyranose |
| [10] | TOUMI I, CALDARELLI S, TORRÉSANI B. A review of blind source separation in NMR spectroscopy[J]. Prog Nucl Magn Reson Spectrosc, 2014, 81(8): 37-64. |
| [11] | PASTOR A, MARTÍNEZ-VIVIENTE E. NMR spectroscopy in coordination supramolecular chemistry:A unique and powerful methodology[J]. Coordin Chem Rev, 2008, 252(21, 22): 2314-2345. |
| [12] |
MA E Q, LI Y X, ZHAO R G, et al. Interactions between NP-10 and single/double chain quaternary ammonium salts studied by NMR spectroscopy[J].
Chinese J Magn Reson, 2017, 34(1): 16-24.
马二倩, 李永肖, 赵瑞格, 等. NP-10与单链、双链季铵盐三种复配体系相互作用规律的NMR研究[J]. 波谱学杂志, 2017, 34(1): 16-24. |
| [13] | KHODOV I A, ALPER G A, MAMARDASHVILI G M, et al. Hybrid multi-porphyrin supramolecular assemblies:Synthesis andstructure elucidation by 2D DOSY NMR studies[J]. J Mol Struct, 2015, 1099: 174-180. DOI: 10.1016/j.molstruc.2015.06.062. |
| [14] |
WANG L M, QIU R C, HUANG S H. Quantitative analysis of active ingredients in compound acetylsalicylic acid tablets by DOSY[J].
Chinese J Magn Reson, 2016, 33(3): 415-421.
王丽敏, 仇汝臣, 黄少华. 复方乙酰水杨酸片中有效成分的DOSY技术分析[J]. 波谱学杂志, 2016, 33(3): 415-421. |
| [15] | TREFI S, GILARD V M M, MARTINO R. Generic ciprofloxacin tablets contain the stated amount of drug and different impurity profiles:A 19F, 1H and DOSY NMR analysis[J]. J Pharmaceut Biomed Anal, 2007, 44(3): 743-754. DOI: 10.1016/j.jpba.2007.02.031. |
| [16] | 崔艳芳, 刘买利. 应用DOSY-NMR分析血浆脂蛋白扩散系数的分布[C]. 南京: 第十一届全国波谱学学术会议, 2000. |
| [17] |
ZHOU Q J, XIANG J F, TANG Y L. Applications of nuclear magnetic resonance spectroscopy in drug discovery[J].
Chinese J Magn Reson, 2010, 27(1): 68-79.
周秋菊, 向俊锋, 唐亚林. 核磁共振波谱在药物发现中的应用[J]. 波谱学杂志, 2010, 27(1): 68-79. DOI: 10.3969/j.issn.1000-4556.2010.01.006. |
| [18] | MONAKHOVA Y B, DIEHL B, DO T X, et al. Novel method for the determination of average molecular weight of natural polymers based on 2D DOSY NMR and chemometrics:Example of heparin[J]. J Pharm Biomed Anal, 2017, 149: 128-132. |
| [19] | BEDNAREK E, SITKOWSKI J, BOCIAN W, et al. An assessment of polydispersed species in unfractionated and low molecular weight heparins by diffusion ordered nuclear magnetic resonance spectroscopy method[J]. J Pharm Biomed Anal, 2010, 53(3): 302-308. DOI: 10.1016/j.jpba.2010.03.037. |
| [20] | ANTALEK B. Using pulsed gradient spin echo NMR for chemical mixture analysis:How to obtain optimum results[J]. Concept Magn Reson A, 2010, 14(4): 225-258. |
| [21] |
ZHAO B, LI Y L, LI M, et al. An NMR study of capsaicin/β-cyclodextrin complex[J].
Chinese J Magn Reson, 2013, 30(4): 576-584.
赵兵, 李艺蕾, 李明, 等. 辣椒碱与β-环糊精包合物的核磁共振研究[J]. 波谱学杂志, 2013, 30(4): 576-584. DOI: 10.3969/j.issn.1000-4556.2013.04.011. |
| [22] | CHEN X J, HU R Q, FENG H J, et al. Intradiffusion, density, and viscosity studies in binary liquid systems of acetylacetone + alkanols at 303.15 K[J]. J Chem Eng Data, 2012, 57(9): 2401-2408. DOI: 10.1021/je3000553. |
| [23] | LOENING N M, KEELER J. Measurement of convection and temperature profiles in liquid samples[J]. J Magn Reson, 1999, 139(2): 334-341. DOI: 10.1006/jmre.1999.1777. |
| [24] | LAPPA M. Thermal convection: patterns, evolution and stability[M]. Wiley, 2009. |
| [25] | ANTALEK B. Using pulsed gradient spin echo NMR for chemical mixture analysis:How to obtain optimum results[J]. Concept Magn Reson A, 2010, 14(4): 225-258. |
 2018, Vol. 35
2018, Vol. 35 
