2. 北京大学 化学与分子工程学院, 北京 100871;
3. 北京大学 生命科学学院, 北京 100871
2. College of Chemistry and Molecular Engineering, Peking University, Beijing 100871, China;
3. College of Life Sciences, Peking University, Beijing 100871, China
蛋白质溶液体系中的表观分子量(Mprotein)更加真实的反映了蛋白质在接近生理状态下的聚集状态,而该聚集状态与许多蛋白质的功能直接相关,也是导致一些疾病的直接原因[1-3].核磁共振(NMR)脉冲梯度场扩散序谱(DOSY)实验可以测定溶液体系中化合物的自扩散系数(
| $ {D_t} = kT/6{\rm{ \mathsf{ π} }}\eta {r_H} $ | (1) |
其中k为玻尔兹曼常数,T表示实验温度,η表示溶液粘度,
| $ {r_H} = \sqrt[{{}^A}]{{M/[N\rho (4/3{\rm{ \mathsf{ π} }})]}} $ | (2) |
其中N是阿伏加德罗常数,ρ是分子密度,A是分子形状相关的常数,对于球形分子来说,A的值为3.在实际的测定中,
| $ \ln E = - {\gamma ^2}{G^2}{\delta ^2}{D_t}(\Delta - \frac{\delta }{3}) $ | (3) |
其中,E表示NMR信号强度,γ表示观测核的旋磁比,G表示使用的脉冲梯度场强度,δ是脉冲梯度场时间,
根据(1)式和(3)式可知,
引入内标物质是消除环境因素影响的简单且有效的方法.对内标物质的基本要求是内标物质的测定可以完全独立于溶质分子完成.由于内标物质和溶质分子处于同一环境中,根据具体测定参数的公式就能够较大降低甚至消除环境对测定值的影响.本文蛋白质体系以常用的化学位移定标内标物质——3-(三甲基硅基)丙磺酸钠(DSS)作为
| $ {D_r} = {D_{t{\rm{ - protein}}}}/{D_{t{\rm{ - DSS}}}} = {r_{H{\rm{ - DSS}}}}/{r_{H{\rm{ - protein}}}} $ | (4) |
| $\lg {M_{{\rm{protein}}}} = - A\lg {D_r} + \lg ({M_{{\rm{DSS}}}}{\rho _{{\rm{protein}}}}/{\rho _{{\rm{DSS}}}}) $ | (5) |
其中MDSS是DSS的表观分子量,
基于以上分析,本文首先以DSS为内标物质,在500 MHz和700 MHz NMR谱仪器上测定了不同缓冲体系中不同浓度的标准蛋白质卵清蛋白相对于DSS的
肌红蛋白和卵清蛋白购买于北京欣经科生物技术有限公司,分子量分别为17.1 kDa和43.1 kDa.细胞色素C和碳酸酐酶购买于Sigma-Aldrich Inc.,分子量分别为12.3 kDa和29.0 kDa.其他化学试剂购买于北京化学试剂公司,均为分析纯. Mpro-C的表达纯化方法与文献[18]一致,Mpro-C存在稳定的单体和二聚体,实验中使用的是二聚体样品,分子量为26.8 kDa.
NMR样品的制备方法:标准蛋白质样品是将蛋白质粉末溶于400 μL 50 mmol/L磷酸盐缓冲溶液(PBS,pH 7.0)中,不同的样品的PBS缓冲溶液中加入有一定量的氯化钠和甘油,具体见表 1和表 2,Mpro-C纯化后交换到50 mmol/L PBS(pH 7.0)缓冲溶液,然后所有样品加入40 μL重水用于锁场和10 μL DSS(2%)作为内标物质.
| 表 1 不同测试体系下卵清蛋自扩散系数和相对扩散系数的测定 Table 1 Dt-protein and Dr determination for albumin egg obtained with different conditional experiments |
| 表 2 不同分子量标准蛋白和Mpro-C蛋白自扩散系数和相对扩散系数的测定(700 MHz,100 mmol/L NaCl) Table 2 Dt-protein and Dr determination for standard proteins with different molecular weight and Mpro-C (700 MHz, 100 mmol/L NaCl) |
DOSY实验在配备QCI超低温探头的Bruker AVANCE Ⅲ 700型和配备TCI超低温探头的Bruker AVANCE Ⅲ 500型NMR谱仪上完成,实验温度为298 K,所使用的脉冲程序为stebpgp1s19,该脉冲采用stimulated-echo的方式测定
| 表 S1 DOSY实验采样参数和Dt拟合参数 Table S1 Acquisition parameters of DOSY experiments and parameters used for Dt fitting |
卵清蛋白是单体球状蛋白质,分子量为43.1 kDa,常用来进行分子量校准.我们分别在700 MHz和500 MHz NMR谱仪上测定了不同浓度、不同盐离子浓度和不同粘度的卵清蛋白样品(表 1的1~6号样品和表 2的10号样品)的
同一台仪器不同缓冲体系测得的结果表明,当向蛋白样品中增加200 mmol/L的NaCl(No.1 vs. No.2,No.4 vs. No.5),提高溶液离子强度后,卵清蛋白的
分别比较不同仪器上测得的相同样品的结果发现,相比700 MHz NMR谱仪测得的
总的来说,卵清蛋白在两台仪器上测得的7组数据中,
上述结果显示
我们又在700 MHz NMR谱仪上测定了标准蛋白质细胞色素C(12.3 kDa)、肌红蛋白(17.1 kDa)、碳酸酐酶(29.0 kDa)相对于DSS的
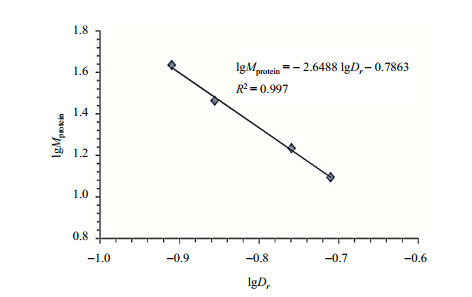
|
图 1 四种标准蛋白质在溶液中的表观分子量与相对扩散系数的相关关系曲线 Figure 1 The linear fit of apparent molecular weight and relative diffusion coefficients in solution of four standard proteins |
得到拟合曲线后,我们将卵清蛋白1~6号的数据代入公式,可以计算得到的其分别为40.5 kDa、41.3 kDa、41.0 kDa、37.9kDa、38.6 kDa和38.8 kDa,其中700 MHz NMR谱仪得到的不同缓冲体系的卵清蛋白的Mprotein为(40.9±0.4)kDa,500 MHz NMR谱仪得到的不同缓冲体系的卵清蛋白的Mprotein为(38.4±0.5)kDa.由此可见,同台仪器不同缓冲体系测定的Mprotein值标准偏差较小,不同仪器测定的Mprotein值误差增加到2.5 kDa.虽然在不同仪器上测量时按照
为了验证拟合公式的实用性,我们表达纯化得到了Mpro-C.已有文献[18]表明,Mpro-C单体是近似球形蛋白,形成二聚体后分子结构会明显偏离球体,凝胶体积排阻色谱测得的Mprotein值为38.2 kDa,与其理论分子量26.8 kDa存在较大的差异.DOSY实验使用二聚体Mpro-C,浓度为0.5 mmol/L,采用浓度为50 mmol/L、pH值为7.0的磷酸钠缓冲体系.DOSY实验测得的
本文使用DOSY方法,证实了
| [1] | DOIG A J, DERREUMAUX P. Inhibition of protein aggregation and amyloid formation by small molecules[J]. Curr Opin Struct Biol, 2015, 30: 50-56. DOI: 10.1016/j.sbi.2014.12.004. |
| [2] | YANG-HARTWICH Y, SOTERAS M G, LIN Z P, et al. p53 protein aggregation promotes platinum resistance in ovarian cancer[J]. Oncogene, 2015, 34(27): 3605-3616. DOI: 10.1038/onc.2014.296. |
| [3] |
CHEN Y H, ZHANG Z T, BAI J, et al. Inhibition mechanisms of protein disulfide isomerase on α-synuclein Fibril aggregation[J].
Chinese J Magn Reson, 2017, 34(2): 131-136.
陈艳华, 张则婷, 白佳, 等. PDI抑制α-synuclein纤维化聚集作用机制研究[J]. 波谱学杂志, 2017, 34(2): 131-136. |
| [4] | JOHNSON JR C S. Diffusion ordered nuclear magnetic resonance spectroscopy:principles and applications[J]. Prog NMR Spect, 1999, 34: 203-256. DOI: 10.1016/S0079-6565(99)00003-5. |
| [5] |
KE E F, CHEN Z, YE J L, et al. 2D diffusion-ordered nuclear magnetic resonance spectroscopy for structure analysis of mixtures[J].
Journal of Xiamen University-Natural Science, 1999, 38(3): 366-370.
柯恩烽, 陈忠, 叶剑良, 等. 混合物溶液结构的二维扩散排序核磁共振谱[J]. 厦门大学学报(自然科学版), 1999, 38(3): 366-370. DOI: 10.3321/j.issn:0438-0479.1999.03.009. |
| [6] | DEHNER A, KESSLER H. Diffusion NMR spectroscopy:folding and aggregation of domains in p53[J]. Chem Bio Chem, 2005, 6(9): 1550-1565. DOI: 10.1002/cbic.v6:9. |
| [7] | MACCHIONI A, CIANCALEONI G, ZUCCACCIA C, et al. Determining accurate molecular sizes in solution through NMR diffusion spectroscopy[J]. Chem Soc Rev, 2008, 37(3): 479-489. DOI: 10.1039/B615067P. |
| [8] | FLOQUET S, BRUN S, LEMONNIER J F, et al. Molecular weights of cyclic and hollow clusters measured by DOSY NMR spectroscopy[J]. J Am Chem Soc, 2009, 131(47): 17254-17259. DOI: 10.1021/ja9052619. |
| [9] | MALLOL R, RODR GUEZ M A, HERAS M, et al. Particle size measurement of lipoprotein fractions using diffusion-ordered NMR spectroscopy[J]. Anal Bioanal Chem, 2012, 402(7): 2407-2415. DOI: 10.1007/s00216-011-5705-9. |
| [10] | ZHANG F, YU X Y, CHEN Z, et al. Characterizations of some N-substituted-salicylhydrazide in mixtures by NMR diffusion ordered spectroscopy[J]. Chinese J Struct Chem, 2003, 22(3): 287-292. |
| [11] | MANSFIELD S L, JAYAWICKRAMA D A, TIMMONS J S, et al. Measurement of peptide aggregation with pulsed-field gradient nuclear magnetic resonance spectroscopy[J]. Biochim Biophys Acta, 1998, 1382(2): 257-265. DOI: 10.1016/S0167-4838(97)00162-3. |
| [12] | YAO S, HOWLETT G J, NORDON R S. Peptide self-association in aqueous trifluoroethanol monitored by pulsed field gradient NMR diffusion measurements[J]. J Biomol NMR, 2000, 16(2): 109-119. DOI: 10.1023/A:1008382624724. |
| [13] |
CHEN C G, ZHANG M M, LIU Y P. Study on the Interaction between β-Cyclodextrin and naproxen by two-dimensional diffusion ordered NMR Spectroscopy[J].
J Instrum Anal, 2011, 30(9): 959-963.
陈昌国, 张明明, 刘渝萍. 二维扩散排序核磁共振谱法研究β-环糊精/萘普生的相互作用[J]. 分析测试学报, 2011, 30(9): 959-963. DOI: 10.3969/j.issn.1004-4957.2011.09.002. |
| [14] | PRICE W S, NARA M, ARATA Y. A pulsed field gradient NMR study of the aggregation and hydration of parvalbumin[J]. Biophys Chem, 1997, 65(2, 3): 179-187. |
| [15] | LIN M, LARIVE C K. Detection of insulin aggregates with pulsed-field gradient nuclear magnetic resonance spectroscopy[J]. Anal Biochem, 1995, 229(2): 214-220. DOI: 10.1006/abio.1995.1405. |
| [16] | AUGEx S, SCHMIT P, CRUTCHFIELD C A, et al. NMR measure of translational diffusion and fractal dimension. Application to molecular mass measurement[J]. J Phys Chem B, 2009, 113(7): 1914-1918. DOI: 10.1021/jp8094424. |
| [17] |
WANG L M, QIU R C, HUANG S H. Quantitative analysis of active ingredients in compound acetylsalicylic acid tablets by DOSY[J].
Chinese J Magn Reson, 2016, 33(3): 415-421.
王丽敏, 仇汝臣, 黄少华. 复方乙酰水杨酸片中有效成分的DOSY技术分析[J]. 波谱学杂志, 2016, 33(3): 415-421. |
| [18] | ZHONG N, ZHANG S N, ZOU P, et al. Without its N-finger, the main protease of severe acute respiratory syndrome coronavirus can form a novel dimer through its C-terminal domain[J]. J Virol, 2008, 82(9): 4227-4234. DOI: 10.1128/JVI.02612-07. |
 2018, Vol. 35
2018, Vol. 35 
