根据甘油碳骨架上结合的脂肪酸数目不同,甘油酯可分为甘油三酯(triglyceride, TG)、甘油二酯(diglyceride, DG)和甘油一酯(monoglyceride, MG).其中,天然动植物油脂中富含多种TG,而DG、MG既是天然油脂代谢的中间产物,又因其独特的物理化学性质和生理作用,广泛应用于食品、医药、化妆品等工业中[1, 2].另外,无论是在食用油脂的脂质重构,还是DG、MG的生产过程中,其反应进程的控制及产物组成的分析都是必不可少的环节.因此,甘油酯(包括TG、DG和MG)的分析历来是一个研究的热点.
目前甘油酯的分析方法主要以离线分析为主,常用分析方法包括化学法、柱层析法、酶法、薄层色谱、气相色谱法和高效液相色谱法等[3, 4],但仍需探索新型、高效的快速分析方法,为研究甘油酯提供技术支持.低场核磁共振技术(low field-nuclear magnetic resonance, LF-NMR)[5]具有分析速度快、样品制备简单、对操作人员的健康和环境无影响等诸多优点,是一种颇具潜力的在线检测技术,目前已在烃类化合物分子结构检测、石油开采的油层分析中得到应用[6, 7].在脂质分析方面,Lu等人[8]的研究发现,植物油的LF-NMR弛豫图谱中弛豫时间短的峰可能与饱和脂肪酸含量有关,弛豫时间长的峰则代表不饱和脂肪酸的含量.Bertram等人[9]的研究发现富含长链脂肪酸的奶油具有相对较宽的LF-NMR多组分弛豫图谱分布.此外,Berman等人[10]发现,当油酸与油酸甲酯形成不同的液晶状态,其弛豫时间和峰面积都会发生变化.以上研究均表明脂质弛豫特性与内部结构和外部环境相关.
只有在对甘油酯体系的LF-NMR弛豫特性变化规律系统研究的基础上,才有可能应用LF-NMR技术实现脂质重构进程的快速监测,但文献调研表明,目前关于甘油酯体系的LF-NMR弛豫特性的系统研究仍相对缺乏.因此,本文以油酸甘油酯体系为研究对象,在研究了其组成单元及不同酯化程度的油酸甘油酯的LF-NMR弛豫特性后,进一步分析了不同温度、不同混合程度的油酸甘油酯混合体系的LF-NMR弛豫特性.
1 材料与方法 1.1 材料与试剂油酸(oleic acid, OA)、三油酸甘油酯(glycerol trioleate,GTO)和甘油(glycerol, GL)均为化学纯,购于上海国药集团化学试剂有限公司;单油酸甘油酯(glycerol monooleate,GMO)(含量≥99.5%)、二油酸甘油酯(glycerol dioleate,GDO)(含量≥99%)为优级纯,购于济南东润精化科技有限公司.
二元甘油酯混合体系:按质量比例向GMO或GDO中添加0~100%的GTO,浓度间隔为20%,构成GMO/GTO及GDO/GTO体系.
三元甘油酯混合体系:以不同配比的GDO/GMO体系(GDO:GMO = 1:4、2:3、3:2、4:1)为基础,向其中按比例添加GTO构成三元甘油酯(GTO/GDO/GMO)混合体系,GTO比例为0~100%,浓度间隔为20%.
将以上样品充分混合后,密封置于4 ℃冷藏备用.
1.2 仪器与设备LF-NMR分析仪(NMI20,上海纽迈电子科技有限公司),磁场强度为(0.5±0.08)T,质子共振频率为21.3 MHz,配套直径为15 mm的NMR样品管和T-Invfit反演拟合软件;恒温水浴锅(HH-S21,上海博讯实业有限公司);微型旋涡混合仪(XW-80A,上海沪西分析仪器厂有限公司).
1.3 横向弛豫时间(T2)测量移取2.5 mL待测样品于NMR样品管中,待其温度稳定后,置于LF-NMR分析仪中进行检测.选择CPMG序列,采样参数如下:采样频率(SW)= 250 kHz、重复扫描次数(NS)= 4、回波个数(Echo Count)= 5 000、半回波时间(DL1)= 0.25 ms、重复采样等待时间(TW)= 2 000 ms.在研究温度(4 ℃~82 ℃)对油酸甘油酯体系弛豫特性的影响中,4 ℃为在冰箱冷藏室中预冷,25 ℃为室温处理,32 ℃~82 ℃均在相应温度下水浴10 min.其他各部分的研究中,温度均固定为32 ℃.
1.4 数据处理利用T-Invfit软件对LF-NMR测量得到的CPMG指数衰减曲线进行反演拟合,得到样品中处于各个环境的质子(多组分)的弛豫信息,如各峰的弛豫时间T2i(i = 1, 2, …)及归一化后求得的峰面积比例S2i(i = 1, 2, …).当把样品看作一个整体组分进行反演时,可得到样品的单组份弛豫时间(T2w,单位为ms),其为被测样品所含质子弛豫信息的平均值,可反映样品整体的LF-NMR弛豫特性.
对于三元甘油酯混合体系,为了更好的分析变化规律,利用SPSS 18.0对LF-NMR数据进行主成分分析(principal components analysis,PCA),并用Origin 8.0软件绘制PCA得分图.
每个试验设置三个平行样品,每个样品重复检测3次,以保证结果的可靠性.
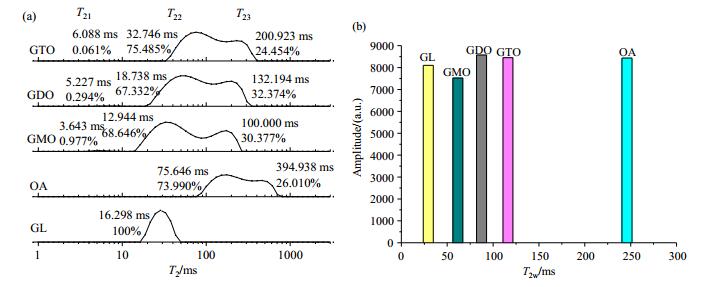
2 结果与讨论 2.1 油酸甘油酯及其组成单元的LF-NMR弛豫特性在一定温度下,当主磁场强度稳定时,T2分布与样品的内部化学结构及其整体运动状态,如分子大小、结构、聚集状态等特性密切相关.不同酯化程度的油酸甘油酯及其组成单元(甘油、油酸)的LF-NMR多组分及单组分弛豫图谱如图 1所示.
|
图 1 油酸甘油酯及其组成单元的(a)多组分和(b)单组份LF-NMR弛豫图谱 Figure 1 Multi- (a) and single (b) component LF-NMR relaxation map of glyceryl oleate and its component units |
图 1表明,不同酯化程度的油酸甘油酯及其组成单元在LF-NMR图谱上有所区别,这与其分子结构特征、分子间相互作用力的强弱密切相关.由图 1(a)可知,甘油多组分弛豫图谱中只出现了位于16.298 ms的一个响应峰(T21),说明其内部质子的NMR响应相对均匀.由于甘油有三个自由羟基,极性较大,分子间作用力也相对越大,弛豫速率相对较大,表现为较短的弛豫时间,这在图 1(b)的单组份弛豫图谱中也得以印证,其T2w也最小.油酸为含有不饱和双键的长链脂肪酸,其分子内部质子NMR响应不均,在T2谱上呈现为可区分的双弛豫峰,其中T21位于75.646 ms,T22则位于394.938 ms.由于其相对分子质量较小(M = 282),分子间作用力较弱,布朗运动较大,质子自由度较高,弛豫速率相对较小,弛豫时间相对较长[11],图 1(b)亦显示其T2w亦最大.油酸与甘油酯化形成的甘油酯(GMO、GDO、GTO)的NMR响应与甘油和油酸有明显区别.如图 1(a)所示,油酸甘油酯的多组分弛豫图谱显示三处响应峰(T21、T22和T23);且随甘油骨架上结合油酸数目的增加,各峰弛豫时间均相对增大.按弛豫时间由小到大排列依次为:GMO < GDO < GTO,这与图 1(b)中T2w分布相符.一方面这是由于与甘油或油酸相比,油酸甘油酯的分子结构相对复杂,其结构中的油酸所含有的双键有屏蔽电子的作用,双键周围的氢电子云密度减小,使其与远离双键中心的质子的NMR响应明显区别,质子NMR响应的不均匀度增大,从而出现了新的弛豫分布.另一方面,甘油酯极性大小与羟基数量密切相关[12],GMO、GDO、GTO的自由羟基数分别为2、1、0,其分子极性大小为:GMO > GDO > GTO.分子极性越大,分子间作用力越强,体系内氢键缔合强度越大,质子所受束缚力增大,弛豫速率相对增大,从而使其核磁共振弛豫时间相对缩短.
比较GMO、GDO、GTO的多组分弛豫峰的相对面积比例(S2i)可以发现,S21均相对较小,且随甘油骨架上结合油酸数目的增加而减小(GMO、GDO和GTO的S21分别为0.977%、0.294%以及0.061%),这是由于T21峰为体系中受束缚力最强的质子的响应,随着自由羟基数量的减少,其极性相对降低,体系中该部分的质子数量相对减少,S21相对减少.S22和S23的变化与S21有一定区别.与GMO的S22(68.646%)相比,GDO的S22(67.332%)稍有减小,而GTO的S22则高达75.485%.这与其分子结构及体系的紧密程度有关,GMO一般为双分子层结构,而液态的GTO则以碳氢键的堆叠方式自组装为具有一定的顺序(如薄层结构)的结构实体[13, 14],体系中存在分子间或分子内氢键,且GTO分子中无自由羟基,而酯基的给电子能力相对较弱,电子云分布较GMO更为均匀,体系内氢核受到的束缚力较大且均匀,因此表现为T22峰组分的增多,S22相对较大.与GMO、GTO相区别的是,GDO存在两个同分异构体,即1, 2-GDO和1, 3-GDO,结构存在不对称性,空间排布相对松散,因此,GDO体系内自由度相对较高的质子比例相对较大,表现为S23相对较大,而S22相对较小.
2.2 温度对油酸甘油酯LF-NMR弛豫特性的影响对油酸甘油酯而言,温度不仅可以改其变晶型结构,同时也会改变分子间作用力的强弱,从而影响LF-NMR弛豫响应特征.图 2为GMO、GDO和GTO在不同的温度下的LF-NMR多组分弛豫图谱.

|
图 2 (a) GMO、(b) GDO和(c) GTO在不同温度下的多组分弛豫图谱 Figure 2 Multi-component relaxation maps of GMO (a), GDO (b) and GTO (c) at different temperatures |
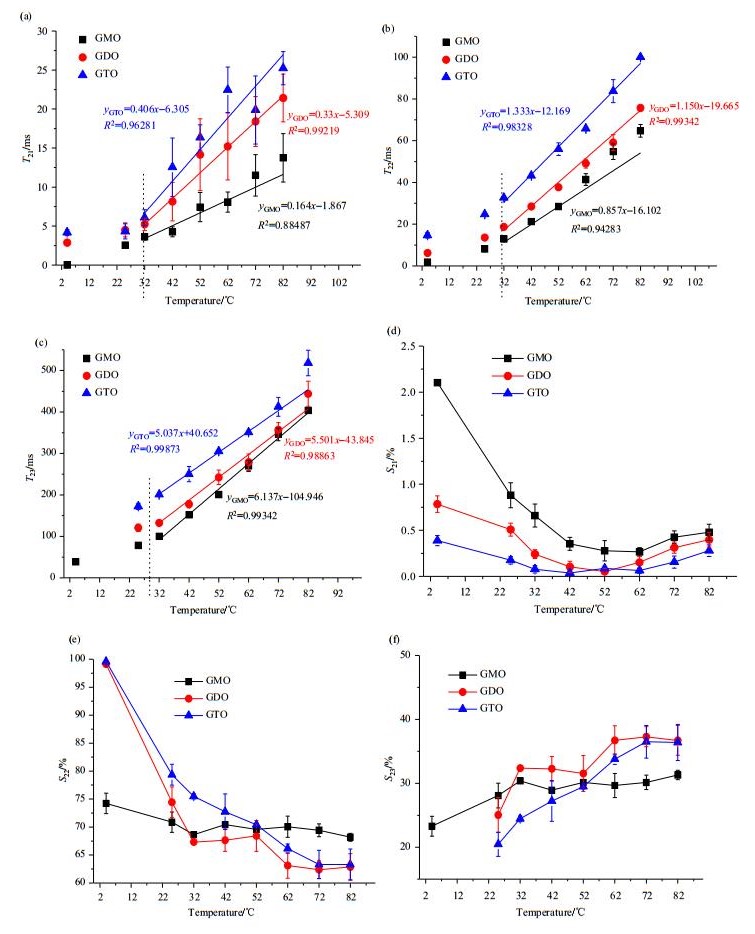
由图 2可知,随温度的升高,各油酸甘油酯的多组分弛豫图谱整体右移,这是由于温度的升高使分子间作用力减弱,破坏了分子间氢键,体系中质子的自由度相对增大,弛豫过程变缓,表现为弛豫时间的增加.进一步分析油酸甘油酯的多组分弛豫时间(T21、T22、T23)和峰面积比例(S21、S22、S23)随温度的变化,结果如图 3所示.
|
图 3 GMO、GDO和GTO的多组分弛豫时间(a) T21、(b) T22和(c) T23以及峰面积(d) S21、(e) S22和(f) S23随温度的变化 Figure 3 The multi-component relaxation times T21 (a), T22 (b) and T23 (c), and the peak area proportions S21 (d), S22 (e) and S23 (f) of GMO, GDO and GTO at different temperatures |
由图 3(a)~(c)可知,在一定温度下,随着甘油骨架上结合的油酸数目的增加,各峰的弛豫时间均相对增大,即T2iGTO > T2iGDO > T2iGMO;另一方面,低于32 ℃时,各样品的弛豫时间的变化相对缓慢;高于32 ℃后,随温度的升高,GMO、GDO和GTO各峰的弛豫时间(T21、T22、T23)均呈线性增大,且随着甘油骨架上结合的油酸数目的增加,T21、T22曲线的斜率相对增大,说明其变化幅度增大.GMO、GDO和GTO的T21曲线斜率分别为0.164、0.33和0.406;T22曲线斜率分别为0.857、1.150和1.333;而T23曲线的斜率相对减小,变化幅度减小,分别为6.137、5.501和5.037.当酯化的脂肪酸相同时,甘油酯熔点由高到低依次为:单甘酯 > 甘二酯 > 甘三酯,GDO和GMO在4 ℃时处于结晶状态,形成排布非常紧密的双分子层结构,分子间作用力相对较大,故弛豫时间相对较小.常温(25 ℃)下,GTO、GDO和GMO的黏度仍相对较大,分子间作用力较大,故弛豫时间的变化相对较小.32 ℃以上时,温度的升高使分子间氢键的破坏程度增加,质子自由度增大,表现为弛豫时间的整体增加;Nicolass等人[15]在研究甘油黏度和T2随温度(-35 ℃~60 ℃)的变化中亦发现,随黏度/温度比值的增大,T2相对减小.这也说明了在温度较低时,因甘油黏度较大,分子间作用力较大,分子运动受到的限制增大,弛豫速率增大,弛豫时间缩短.另一方面,从分子极性来看,GMO > GDO > GTO.分子极性越大,氢键越多,分子间作用力越强,因此,温度升高对分子极性较小、分子间作用力相对较弱的分子的作用更大,在NMR响应上表现为弛豫时间的较大改变.
各油酸甘油酯样品的弛豫峰面积比例(S2i)也随温度的升高而有所改变.如图 3(d)~(f)所示,4 ℃时,GMO呈现三个弛豫峰(T21、T22和T23),而GDO和GTO主要呈现两个响应峰(T21和T22).在4 ℃时,结晶态的GMO排布非常紧密,体系内的部分氢核的自由度较小,呈现为弛豫时间很短的弛豫峰(约0.01 ms处),比例仅为2.103%,与此相类似,GDO和GTO也出现了T21峰,但比例更小;随温度继续升高,氢核的自由度均相对增加,体系中被紧密束缚的氢核比例相对减小,表现为GMO、GDO和GTO的S21均先下降后再稳定于0.5%左右;而由图 3(e)可知,与GDO或GTO相比,GMO的S22的整体变化较小,随温度升高,S22仅从74.233%减少至68.646%后保持相对稳定;而GDO和GTO的S22均随温度的升高而减少,且GDO的降低幅度较大.S23的变化恰恰与此相反[图 3(f)].随温度升高,体系氢键相对减少,氢核自由度增加,使体系中柔性相对较大的氢核的比例增大,S23呈增大的趋势,其变化幅度依次为GDO > GTO > GMO.
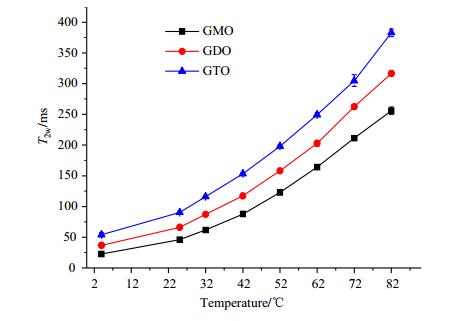
GMO、GDO和GTO的T2w随温度的变化如图 4所示.
|
图 4 GMO、GDO、和GTO的T2w随温度的变化 Figure 4 T2w of GMO, GDO and GTO at different temperatures |
由图 4可知,随体系温度的增加,GMO、GDO和GTO的T2w均呈增加趋势,这与多组分弛豫时间的变化相似.T2w反映的是体系整体的NMR弛豫特性,在相同温度时,T2w与甘油酯的分子极性及分子间作用力的强弱密切相关,T2w的大小依次为:GTO > GDO > GMO;随着温度的升高,体系自由度均增大,流动性增强,使T2w相对增大,以GMO为例,4 ℃时,其T2w仅为22.718 ms,当温度升至82 ℃时,T2w已增大至255.987 ms.
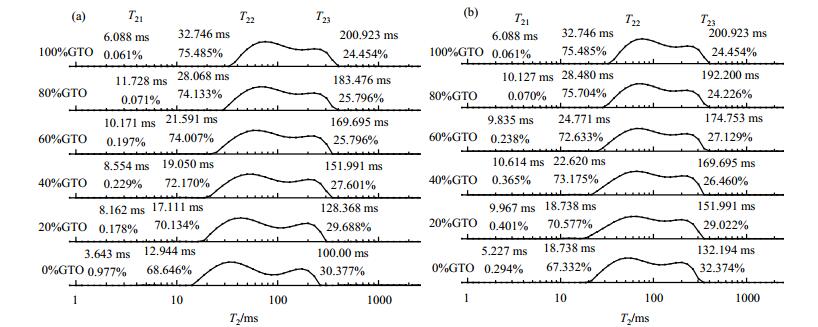
2.3 油酸甘油酯二元混合体系的LF-NMR弛豫特性两种甘油酯二元混合体系的多组分、单组份弛豫特性随GTO比例的变化如图 5和图 6所示.
|
图 5 油酸甘油酯二元混合体系的多组分弛豫图谱. (a) GTO/GMO; (b) GTO/GDO Figure 5 Multi-component relaxation maps of binary glyceryl oleate systems. (a) GTO/GMO; (b) GTO/GDO |

|
图 6 油酸甘油酯二元混合体系的T2w随GTO比例的变化 Figure 6 T2w of binary glyceryl oleate systems at different GTO ratios |
由图 5可知,GTO/GMO、GTO/GDO二元混合体系的多组分弛豫图谱中均出现了三个弛豫峰.如前文所述,GTO分子间氢键及范德华力等作用力相对减弱,分子结构相对松散,氢核弛豫响应时间相对较长,因此,随GTO比例的增加,二元混合体系的弛豫图谱均相对右移.相比之下,GTO/GMO体系的弛豫时间变化幅度相对较大.例如纯GMO体系的T22为12.944 ms,当体系含有20%GTO时,T22增加至17.111 ms;而同比例的GTO/GDO的T22仍与GDO体系相同,均为18.738 ms.此外,对GTO/GMO而言,随体系中GTO比例逐渐增加至40%以内,S22相对增加,S23相对减小,GTO/GDO体系的峰面积比例变化与此类似,但在GTO比例介于40%~60%时,变化幅度相对较小.当GTO比例大于60%后,各峰面积比例的变化幅度减小,而S21均小于1%,且变化较小.
由图 6可知,随三油酸甘油酯比例的增大,GTO/GMO和GTO/GDO二元体系的T2w均呈线性增加趋势,且GTO/GMO体系的斜率相对较大,为0.529,说明随体系中GTO比例的增加,体系的T2w的变化幅度相对较大,这与图 5中多组分弛豫特性的变化相符;这是由于随GTO的添加,GTO/GMO二元体系的自由羟基数量相对减少,使整个体系的分子间作用力也随之改变,体系整体的弛豫时间相对增大.这也表明LF-NMR技术在脂质重构反应进程中产物变化监测中有潜在的应用前景.
2.4 油酸甘油酯三元混合体系的LF-NMR弛豫特性进一步以不同配比的GDO-GMO体系为基础,向其中按比例添加GTO构成三元甘油酯混合体系,各体系的多组分弛豫特性随GTO比例的变化如图 7所示.

|
图 7 不同油酸甘油酯三元混合体系多组分弛豫图谱随GTO比例的变化. (a) GDO:GMO=1:4;(b) GDO:GMO=2:3;(c) GDO:GMO=3:2;(d) GDO:GMO=4:1 Figure 7 Multi-component relaxation map of ternary glyceryl oleate systems at different GTO ratios. (a) GDO:GMO=1:4; (b) GDO:GMO=2:3; (c) GDO:GMO=3:2; (d) GDO:GMO=4:1 |
如图 7可知,GTO/GDO/GMO三元混合体系的多组分弛豫特性与二元或单一体系均有所不同.随GTO比例的增大,不同配比的GDO/GMO的LF-NMR弛豫特性均有一定程度的改变,具体而言,向GDO/GMO二元体系添加GTO后,均使体系的弛豫图谱整体右移,弛豫时间增大.相比之下,GDO:GMO比例为2:3时,体系的弛豫时间变化幅度较大,添加20%GTO时,T22已由最初的16.298 ms增大至19.050 ms [图 7(b)].而当三元混合体系中GTO的比例从20%继续逐渐增加至80%时,GDO:GMO比例为1:4的三元体系的弛豫时间变化幅度相对较大,T22从17.653 ms逐渐增加至28.480 ms [图 7(a)].
另一方面,伴随着弛豫时间的改变,三元混合体系的峰面积比例也呈现一定变化,其中,在整个过程中各体系的S21均小于1%,且变化幅度较小;而随着GTO比例逐渐增加至80%,S22相对增加,S23相对减少,且变化幅度与GDO:GMO比例有关,当GDO:GMO比例为3:2时,峰面积比例的变化幅度相对较大[图 7(c)],体系的S22从最初的65.245%增加至75.565%,而图 7(a)中,GDO:GMO = 1:4时,S22的变化幅度相对较小,从68.824%增加至76.073%.
为了更好的提炼油酸甘油酯三元混合体系单组分的LF-NMR弛豫特性变化规律,利用SPSS软件进行PCA分析后,得到了一个特征值大于1且贡献率高达94.281%的主成分,记为PC1,进而计算得到各样品的主成分得分,绘制主成分得分图(图 8),图中圆圈代表不同GTO添加比例的整体变化,而每一个圆圈中不同标识代表不同比例的GDO/GMO.

|
图 8 不同油酸甘油酯三元混合体系的单组分弛豫分布图 Figure 8 Principal component score plot for the single component relaxation time of ternary glyceryl oleate systems (GTO/GDO/GMO) |
由图 8可知,整体而言,GTO位于主成分分布图的右上角,而GDO/GMO二元体系位于左下角,且四种配比的分布可清晰区分,随GTO比例的增加,GTO/GDO/GMO体系沿对角线从左下向右上角移动,GTO比例越高,三元混合体系间的区分度增大,当GTO比例高于40%后,各比例间无重叠;同时,体系中GTO比例越高,四种GDO/GMO配比之间的区分度相对减小,分布位置也发生一定的改变,尤其是GDO:GMO=4:1时,在GTO比例≤60%时,其均位于其他三个配比样品相对右上方的位置,而当GTO比例为80%时,其位于相对左下方的位置,说明组分的改变使其NMR弛豫响应发生了明显改变.在GTO比例较小时,GDO/GMO比例的变化对体系的核磁共振弛豫响应有较大影响,故GDO/GMO不同配比间的区分度较大,而当GTO比例增大时,其对体系核磁共振弛豫响应的影响增大,使各GTO比例间的区分度增大,而各GDO/GMO不同配比间的区分度相对减小.
油酸甘油酯三元混合体系的单组份弛豫时间(T2w)随GTO比例的变化如图 9所示.

|
图 9 GMO/GDO/GTO三元混合体系的T2w随GTO比例的变化 Figure 9 T2w of ternary system (GMO/GDO/GTO) at different GTO proportions |
由图 9可知,随体系中GTO比例的增加,GMO/GDO/GTO三元混合体系的T2w均呈线性增加趋势,且随体系中GDO比例的增加,三元混合体系的斜率相对降低,GDO:GMO=4:1时,其斜率仅为0.331,这是由于在GTO比例相同时,随GDO比例的增大,体系整体的自由羟基数量减少,使分子间氢键数目减少,则分子间作用力变化幅度相对减弱,从而使T2w的变化幅度相对减少.
3 结论本文重点对不同酯化程度的单一或混合油酸甘油酯体系的LF-NMR弛豫特性进行了较为系统的研究,得到的主要结论如下:油酸甘油酯呈现三个弛豫峰,随酯化程度增加或温度升高,单组分和多组分弛豫时间均增大,各峰面积比例有一定改变,且酯化程度越高,弛豫时间的变化幅度越大;对二元和三元油酸甘油酯体系而言,随GTO比例增加至40%,单组分和多组分弛豫时间均增大,峰面积比例S22增加,而S23减小;三元混合体系的LF-NMR弛豫特性相对复杂,但经PCA分析后,混合体系在主成分得分图上随GTO比例及GDO/GMO配比的变化而呈规律性分布.通过本实验揭示了油酸甘油酯在不同的酯化程度、温度、混合程度时的LF-NMR弛豫特性的变化规律,为应用LF-NMR技术进行脂质重构反应进程的控制及产物组成的快速分析提供了理论依据.
| [1] | ROXANA R, MAMORU Y, YUGO I, et al. Enzymatic synthesis of symmetrical 1, 3-diacylglycerols by direct esterification of glycerol in solvent-free system[J]. J Am Oil Chem Soc, 1999, 76(7): 839-843. DOI: 10.1007/s11746-999-0074-7. |
| [2] | FELTES M M C, DE OLIVEIRA D, Block J M, et al. The Production, benefits, and applications of monoacylglycerols and diacylglycerols of nutritional interest[J]. Food Bioprocess Tech, 2013, 6(1): 17-35. DOI: 10.1007/s11947-012-0836-3. |
| [3] | GUNSTONE F D. Lipid synthesis and manufacture[M]. Boca Raton: CRC Press, 1999. |
| [4] | HAMMOND E W. Chromatography for the analysis of lipids. Chapter3. Thin layer chromatography[M]. Boca Raton: CRC Press, 1993. |
| [5] | BLUMICH B, PERLO J, Casanova F. Mobile single-sided NMR[J]. Prog Nucl Mag Res Sp, 2008, 52(4): 197-269. DOI: 10.1016/j.pnmrs.2007.10.002. |
| [6] |
WANG Z Z, QIN L M, GAI S S, et al. The effects of oil-mixed drilling fluid on oil layer identification studied by NMR spectroseopy[J].
Chinese J Magn Reson, 2014, 31(4): 579-586.
王志战, 秦黎明, 盖姗姗, 等. 利用NMR技术判识混油钻井液条件下钻遇的油层[J]. 波谱学杂志, 2014, 31(4): 579-586. DOI: 10.11938/cjmr20140412. |
| [7] |
DENG F, XIAO L Z, TAO Y, et al. Low-field and on-line NMR detection for fluid molecular structure[J].
Chinese J Magn Reson, 2017, 34(2): 214-222.
邓峰, 肖立志, 陶冶, 等. 低场核磁共振流体分子结构在线探测技术[J]. 波谱学杂志, 2017, 34(2): 214-222. DOI: 10.11938/cjmr20170211. |
| [8] | LU R S, ZHOU X L, WU W P, et al. Development of the miniature NMR apparatus for edible oil quality control[J]. Appl Magn Reson, 2014, 45(5): 461-469. DOI: 10.1007/s00723-014-0536-4. |
| [9] | BERTRAM H C, WIKING L, NIELSEN J H, et al. Direct measurement of phase transitions in milk fat during cooling of cream-a low-field NMR approach[J]. Int Dairy J, 2005, 15(10): 1056-1063. DOI: 10.1016/j.idairyj.2004.10.005. |
| [10] | BERMAN P, MEIRI N, LUIZ A C, et al. Study of liquid-phase molecular packing interactions and morphology of fatty acid methyl esters (biodiesel)[J]. Biotechnol Biofuels, 2015, 8(1): 12. DOI: 10.1186/s13068-014-0194-7. |
| [11] | CHALAND B, MARIETTE F, MARCHAL P, et al. H-1 nuclear magnetic resonance relaxometric characterization of fat and water states in soft and hard cheese[J]. J Dairy Res, 2000, 67(4): 609-618. DOI: 10.1017/S0022029900004398. |
| [12] | DI NICOLA G, PACETTI M, POLONARA F, et al. Development and optimization of a method for analyzing biodiesel mixtures with non-aqueous reversed phase liquid chromatography[J]. J Chromatogr A, 2008, 1190(1, 2): 120-126. |
| [13] | HARTEL R W. Crystallization in Foods[M]. The United States: Aspen Publishers, 1988. |
| [14] | LARSSON K, FRIBERG SE, LARSSO K, et al. Molecular organization in lipids and emulsions[M]. UK: CABI press, 2004. |
| [15] | NICOLAAS B, PURCELL E M, POUND R V. Relaxation effects in nuclear magnetic resonance absorption[J]. Phys Rev, 1948, 73(7): 679-712. DOI: 10.1103/PhysRev.73.679. |
 2018, Vol. 35
2018, Vol. 35 
