N-杂环卡宾前体的多样化合成为催化剂设计提供了新的维度,氮原子及杂环上取代基不同,对催化活性有较大影响.手性N-杂环卡宾是研究者竞相追逐的热点,手性N-杂环卡宾前体也得到广泛的研究[1-6].氮原子上取代基为糖基的手性N-杂环卡宾是一类重要的研究对象,这种配体由于糖基的存在,通常能够修饰其空间或电子性质以满足特定的不对称催化反应需求,同时表现出丰富的立体化学效应和空间位阻效应,使其呈现出很好的不对称催化性能[7-10].但是,通常很多手性N-杂环卡宾前体相关化合物的表征往往仅限于一维核磁共振氢谱(1H NMR)和核磁共振碳谱(13C NMR),或结合相关经验对其特征信号峰进行归属[9-15].而含糖基的手性N-杂环卡宾前体相关化合物通常含有多个手性碳原子,化学结构相对复杂,在NMR谱中的化学位移较为相近,而且构象也会对化学位移产生微妙的影响[8].但是要设计高效的不对称催化反应的催化剂,需要详细的理解催化剂的手性环境及取代基对不对称催化结果的影响.故而,对手性催化剂的结构进行NMR研究,特别是2D NMR研究,以及1H和13C NMR的详细归属是非常有必要的.要对手性N-杂环卡宾的1H NMR和13C NMR数据详尽归属,仅通过1D NMR技术难于分辨和归属,通常必须辅以2D NMR数据[16, 17].
周中高等人[18]报道溴化1-(2, 3, 4, 6-四-O-乙酰基-β-D-吡喃葡萄糖基)-3-正丁基咪唑盐(化合物2)是一种高效的钯催化Suzuki偶联反应的辅助配体,目前文献仅对化合物2及其结构类似物的1H NMR和13C NMR特征信号峰进行了部分归属[6, 8, 14, 18],但是并未对化合物2的结构进行分析和详尽归属.本文参考文献[18]的合成方法,首先利用溴代正丁烷与1-(2, 3, 4, 6-四-O-乙酰基-β-D-吡喃葡萄糖基)咪唑(化合物1)为原料合成了化合物2,用元素分析、红外吸收光谱(IR)以及液相色谱-高分辨质谱(LC-HRMS)等方法对其组成进行了确认,然后用液体1D和2D NMR谱(包括1H NMR、13C NMR、DEPT135、DEPT90、DEPT45、COSY、1H-13C HSQC和1H-13C HMBC).在NMR解析时,通过对比研究发现,化合物1与2在结构上存在一些共性,但糖基咪唑与溴代正丁烷反应生成溴化糖基咪唑盐后,1H NMR与13C NMR均有较大变化,变化最大的是咪唑环上的1H NMR与13C NMR,均往低场移动,同时糖基骨架和乙酰基对应的1H NMR与13C NMR也存在较为明显的变化,说明糖基咪唑和溴化糖基咪唑盐的化学环境发生了很大的变化.本工作对葡萄糖衍生的手性N-杂环卡宾及其过渡金属配合物的合成、结构解析及不对称催化性能研究的考察等均具有很好的参考价值.
1 实验部分 1.1 仪器与试剂化合物1和化合物2按文献[19]和[18]方法合成,全乙酰基溴代葡萄糖、咪唑、1-溴代正丁烷、乙腈、二氧六环、甲醇和二氯甲烷等试剂均购于国药集团化学试剂有限公司,二氧六环现蒸现用,GF薄层层析硅胶板和柱层析硅胶(300~400目)购于青岛海洋化工有限公司.直径5 mm的NMR样品管(ST-500,NORELL)和溶剂CDCl3(99.8%氘代)购于青岛腾龙微波科技有限公司.
IR光谱在Nicolet FT-IR型傅里叶变换红外光谱仪器上完成,KBr压片;元素分析使用德国Elementar公司vario MICRO cube元素分析仪测试;LC-HRMS测试在H-Class/Xevo G2-S QTof型超高效液相色谱/四极杆飞行时间串联质谱仪上进行.1H NMR、13C NMR、DEPT、COSY、1H-13C HSQC和1H-13C HMBC谱图均在Bruker Avance Ⅲ-400型超导NMR谱仪测定,使用BBO-5 mm多核宽带探头.
1.2 NMR实验室温条件[(293.0 ± 0.1) ℃]下对化合物2进行NMR测试,溶剂为CDCl3(99.8%氘代),以四甲基硅烷(TMS)为内标.1H NMR和13C NMR的工作频率分别为400.13和100.76 MHz,谱宽分别为8 223.69 Hz和24 038.46 Hz. DEPT135、DEPT90和DEPT45采用仪器自带的标准脉冲序列,谱宽为16 129.0 Hz,采样累加次数为256. COSY、HSQC及HMBC谱图采集,均采用标准脉冲程序. COSY的F2(1H)和F1(1H)维谱宽均为6 009.61 Hz,采样数据点阵t2×t1 = 2 048×256;HSQC的F2(1H)和F1(13C)维谱宽分别为6 398.86 Hz和22 136.58 Hz,采样数据点阵t2×t1 = 2 048×256;HMBC的F2(1H)和F1(13C)维的谱宽分别为6 393.86 Hz和22 138.80 Hz,采样数据点阵t2×t1 = 4 096×256.化合物1和化合物2的NMR测试条件相同.
2 结果与讨论 2.1 化合物1和2的合成 2.1.1 化合物1的合成参考文献[19]方法,氮气保护下,将4.11 g(10.0 mmol)全乙酰基溴代葡萄糖与0.68 g(100.0 mmol)咪唑在二氧六环中回流3 h,将二氧六环旋干,往固体中加入二氯甲烷,将其倒入冰水中,搅拌,用二氯甲烷萃取3次,将有机相合并,用饱和碳酸氢钠和饱和氯化钠溶液抽洗有机相,收集有机相,用无水硫酸镁干燥,旋干二氯甲烷,固体用无水甲醇重结晶3次,得到1-(2, 3, 4, 6-四-O-乙酰基-β-D-吡喃葡萄糖基)咪唑(化合物1)2.16 g,产率为45%,化合物1的NMR结构解析见文献[17].
2.1.2 化合物2的合成参考文献[18]方法(图 1),氮气保护下,将1.0 g(2.5 mmol)化合物1、25.0 mL干燥乙腈和1-溴代正丁烷(0.4 g,3.0 mmol)加入到50 mL两口烧瓶中,回流12 h,用薄层色谱法(TLC)监测,待反应完成后,真空条件下旋转蒸发除去乙腈,残余物通过柱色谱法(二氯甲烷/甲醇,体积比为20/1或10/1)纯化,减压除去溶剂,然后真空干燥,得淡黄色粉末(即化合物2)1.28 g,产率为96%.
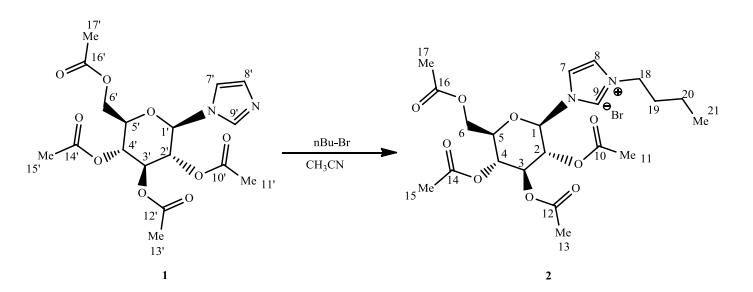
|
图 1 溴化1-(2, 3, 4, 6-四-O-乙酰基-β-D-吡喃葡萄糖基)-3-丁基咪唑盐(化合物2)的合成 Figure 1 Synthesis of 1-(2, 3, 4, 6, 6-tetra-O-acetyl-β-D-glucopyranosyl)-3-butylimidazolium bromide (compound 2) |
化合物2的元素分析、IR和MS谱图都表现出手性N-杂环卡宾类结构特征[18, 19].
化合物2的元素分析C21H31BrN2O9,理论值(%):C 47.11,H 5.84,N 5.23;与实测值(%):C 47.01,H 5.90,N 5.26一致.
化合物2的IR光谱(图 2)中3 054.4 cm-1处的吸收峰为咪唑环=CH键伸缩振动峰,2 958.8和2 867.7 cm-1处的吸收峰应分别归属于饱和C-H键的不对称和对称伸缩振动吸收峰,1 749.9 cm-1是咪唑环C=N双键的特征吸收峰,1 437.3 cm-1处的吸收峰为饱和C-H键的弯曲振动,1 369.3和1 218.8 cm-1处的吸收峰为C-N键伸缩振动峰,760~1 174 cm-1处也出现了糖苷的特征峰,应该对应碳水化合物骨架信号峰,符合化合物2分子结构的特征.
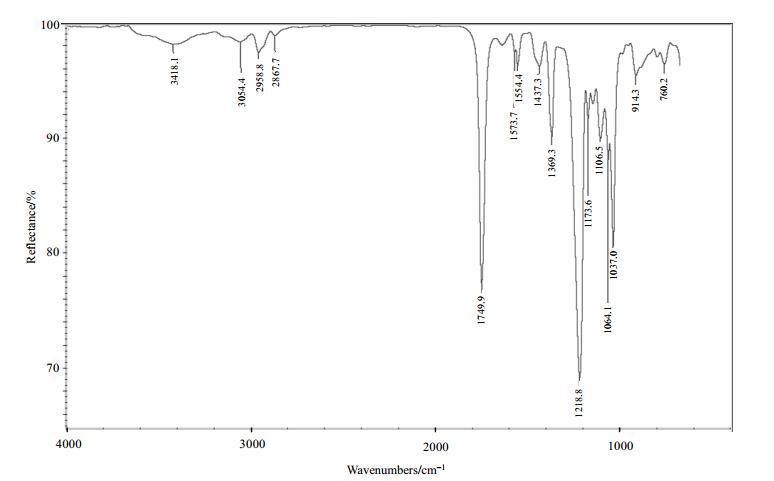
|
图 2 化合物2的红外光谱 Figure 2 IR spectrum of compound 2 |
对其HRMS谱图进行分析,在正离子检测模式下,得到质荷比(m/z)为536.120 6的准分子离子峰[M+H]+,与计算值536.121 3(化合物2的分子式为C21H31BrN2O9,分子量计算值为535.121 3)一致.
化合物2的比旋光度为[α]D28.5 = +35˚(C = 0.5,甲醇).
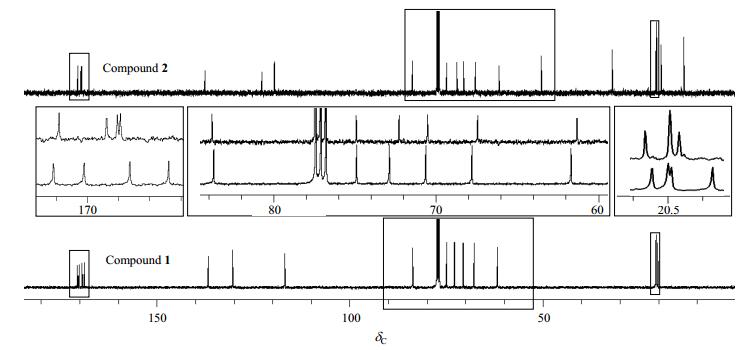
2.3 NMR谱图分析 2.3.1 1D NMR谱图分析从化合物1与化合物2的1H NMR谱(图 3)发现两者的结构存在一定的共性,同时也存在一定的差异,在此以化合物2的NMR谱为主,结合化合物1的NMR数据进行解析.

|
图 3 化合物1和2的1H NMR谱(CDCl3) Figure 3 1H NMR spectra of compound 1 and 2 (CDCl3) |
通过分析化合物2信号峰的化学位移、峰型、对应的积分面积及文献[9-15]报道值,可知δH 7.62(s,1H)是化合物1咪唑环上NCHN(H-9')质子的特征峰[17],随着咪唑环上氮原子上被正丁基取代形成手性N-杂环卡宾前体后,化合物2咪唑环上NCHN(H-9)质子酸性也随之增加,根据电子云密度,化合物2的H-9化学位移向低场移动,推测低场区δH 10.82(s,1H)为H-9特征峰,相对于化合物1向低场移动了1 280 Hz;δH 7.02(s,2H)是化合物1咪唑环上NCHCHN(H-7'和H-8')质子的特征峰,即使生成了咪唑盐,化合物2咪唑环上NCHCHN质子(H-7和H-8)的峰型与化合物1的相同,但是向低场区移动了228 Hz,推测δH 7.59(s,2H)为H-7和H-8的特征峰;δH 6.57(d,J = 9.2 Hz,1H)归属为H-1;δH 4.39(m,2H)归属为H-18;0.98(t,J = 7.4 Hz,3H)归属为H-21.其它质子的信号峰较难区分,需要借助2D NMR谱图才可进一步区分.
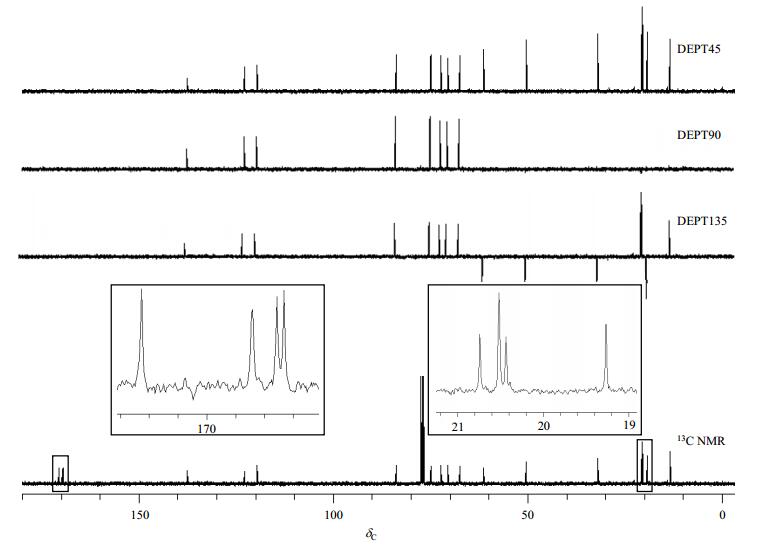
从13C NMR谱与DEPT谱(图 4和图 5),可以确定化合物2中有5个伯碳(δC 13.6、20.4、20.5、20.5、20.7),4个仲碳(δC 19.3、31.8、50.3、61.3)、8个叔碳(δC 67.3、70.4、72.1、74.8、83.7、119.4、122.7、137.4)和4个季碳(δC 169.4、169.5、169.7、170.5).具体的归属需要通过HSQC和HMBC谱来解析.
|
图 4 化合物1和2的13C NMR谱(CDCl3) Figure 4 13C NMR spectra of compound 1 and 2 (CDCl3) |
|
图 5 化合物2的13C NMR和DEPT谱图(CDCl3) Figure 5 13C NMR and DEPT spectra of compound 2 (CDCl3) |
咪唑盐的生成也影响了化合物2中的13C NMR谱(图 4),与化合物1相比,主要表现在化学位移向低场移动,特别是四个与乙酰基相连的伯碳.咪唑盐的生成,改变了咪唑环的电子云密度,使四个乙酰基相连的2个伯碳的化学位移重叠在一起(δC 20.5),表现为3个信号峰:δC 20.4、20.5和20.7.相比之下,未成盐的化合物1中的四个乙酰基伯碳的化学位移却能够明显区分:δC 20.1、20.5、20.6和20.7.
2.3.2 2D NMR谱图分析对于含糖结构片段的化合物,依靠1D NMR谱是很难归属谱线的.从化合物2的COSY谱(图 6),δH 5.28(t, J = 10.0 Hz, 1H)与H-1存在交叉峰,归属为H-2;H-2除与H-1存在交叉峰外,还与δH 5.45(t, J = 9.5 Hz, 1H)存在交叉峰,因此δH 5.45(t, J = 9.5 Hz, 1H)归属为H-3;H-3除与H-2存在交叉峰外,还与δH 5.23(t, J = 8.0 Hz,1H)存在交叉峰,因此δH 5.23(t, J = 8.0 Hz,1H)归属为H-4;H-4除与H-3存在交叉峰外,还与δH 4.29(m, 1H)存在交叉峰,因此δH 4.29(m, 1H)归属为H-5;由于分子内稠环结构的存在,C-5是手性碳原子,导致H-6a与H-6e质子不等价,借助1H-13C HSQC(图 7)和1H-13C HMBC谱(图 8),将δH 4.29(m, 1H)归属为H-6a,δH 4.13(m,1H)归属为H-6e;δH 1.89(m,2H)在COSY谱中与H-18相关,归属为H-19;H-19除与H-18存在交叉峰外,还与δH 1.33(m,2H)相关,因此δH 1.33(m,2H)归属为H-20.通过上述解析,对化合物2的大部分质子化学位移进行了归属.

|
图 6 化合物2的COSY谱(CDCl3) Figure 6 COSY spectra of compound 2 (CDCl3) |

|
图 7 化合物2的1H-13C HSQC谱(CDCl3) Figure 7 1H-13C HSQC spectrum of compound 2 (CDCl3) |

|
图 8 化合物2的1H-13C HMBC谱(CDCl3) Figure 8 1H-13C HMBC spectra of compound 2 (CDCl3) |
在化合物2的HSQC谱中,δC 137.4与H-9相关,归属为C-9;δC 122.7和119.4与δH 7.59(s,2H)(H-7和H-8)相关,归属为C-7和/或C-8;δC 83.7与H-1相关,归属为C-1;δC 72.1与H-3相关,归属为C-3;δC 70.4与H-2相关,归属为C-2;δC 67.3与H-4相关,归属为C-4;δC 74.8与H-5相关,归属为C-5.δC 61.3与δH 4.29(m, 1H)和δH 4.13(m,1H)均有相关,归属为C-6;δC 50.3与H-18相关,归属为C-18;δC 31.8与H-19相关,归属为C-19;δ 19.3与H-20相关,归属为C-20;δC 13.6与H-21相关,归属为C-21.
综上,仍然存在乙酰基上4个季碳(δC 169.4、169.5、169.7和170.5)和4个伯碳(δC 20.4、20.5、20.5和20.7)和2个叔碳(δC 119.4和122.7)仍无法准确归属,需要借助HMBC谱来判断.
在化合物2的1H-13C HMBC谱中,δC 119.4与H-1有交叉峰,归属为C-7;δC 122.7与H-18有交叉峰,归属为C-8;然后归属乙酰基上4个季碳(C-16、C-14、C-12和C-10),δC 170.5与H-6a与H-6e相关,归属为C-16;δC 169.5处信号峰与H-4相关,归属为C-14;δC 169.4处信号峰与H-3相关,归属为C-12;δC 169.7处信号峰与H-2相关,归属为C-10.
在1H-13C HMBC谱中,δH 2.06(s,3H)与C-6、C-16有交叉峰,归属为H-17;δH 2.01(s,3H)与C-4有交叉峰,归属为H-15;δH 1.99(s,3H)与C-2、C-10有交叉峰,归属为H-11;δH 1.96(s,3H)与C-3、C-12有交叉峰,归属为H-13.在1H-13C HSQC谱中,δC 20.4与H-13有交叉峰,归属为C-13;δC 20.5与H-11和H-15均有交叉峰,归属为C-11和C-15;δC 20.7与H-17有交叉峰,归属为C-17.
通过对化合物2的1H NMR、13C NMR、DEPT135、DEPT90、DEPT45、COSY、1H-13C HSQC和1H-13C HMBC谱的解析,同时参考文献归属的特征信号峰,对化合物2的1H NMR和13C NMR信号进行了全部指认归属,结果见表 1.
| 表 1 化合物2的1H和13C NMR归属 Table 1 1H and 13C NMR resonance assignment of compound 2 |
化合物1是化合物2的原料,化合物2分子中同时含有阴、阳两种离子基,在酸性和碱性介质中均稳定.化合物1与化合物2所使用的溶剂和测试条件完全相同.从表 2的数据可以看出,1H NMR化学位移相差较大的是H-1、H-5、H-7、H-8和H-9,差值分别为500 Hz、152 Hz、228 Hz、228 Hz和1 280 Hz;13C NMR化学位移相差较大的是C-7和C-8,差值分别为262 Hz和766 Hz,并且化合物2的咪唑环上质子的化学位移均向低场移动,应该是由于咪唑盐含有阴、阳离子,导致咪唑环上电子云密度较低所致.而糖基的稠环不存在共轭键,咪唑环上电子云的变化对其影响较小,除了与咪唑环相连的H-1的1H NMR化学位移变化较大,其它与化合物1基本相当[20].乙酰基上的氧原子有两对孤对电子,其电子云比成键电子对在空间伸展更大,容易受到咪唑环的影响,故而化合物1和2上乙酰基1H NMR和13C NMR化学位移相差较大,C-10、C-12、C-14和C-16差值分别为81 Hz、71 Hz、20 Hz和40 Hz.化合物1的H-1双峰的J值为6.5 Hz,化合物2的H-1双峰的J值为9.2 Hz,可能是生成咪唑盐后咪唑环电子云密度的改变影响了C-1和C-2二面角的键角导致的[21].
| 表 2 化合物1和2的1H NMR和13C NMR对比 Table 2 Comparison of 1H NMR and 13C NMR data of compound 1 and 2 |
首先对化合物2进行元素分析、IR光谱、HRMS谱图等分析测试,确定其结构组成,进而运用1D和2D NMR技术,特别是1H-13C HMBC谱准确地解析了该化合物氢碳远程相关耦合的异核信息,分析了屏蔽效应的差异,对化合物2的1H和13C NMR信号进行了全归属.
| [1] | KAPDI A R, FAIRLAMB I J. Anti-cancer palladium complexes:a focus on PdX2L2, palladacycles and related complexes[J]. Chem Soc Rev, 2014, 43(13): 4751-4777. DOI: 10.1039/C4CS00063C. |
| [2] | DÍEZ-GONZÁLEZ S, MARION N, NOLAN S P. N-Heterocyclic carbenes in late transition metal catalysis[J]. Chem Rev, 2009, 109(8): 3612-3676. DOI: 10.1021/cr900074m. |
| [3] | HINDI K M, PANZNER M J, TESSIER C A, et al. The medicinal applications of imidazolium carbene-metal complex es[J]. Chem Rev, 2009, 109(8): 3859-3884. DOI: 10.1021/cr800500u. |
| [4] | SHAW C F. Gold-based therapeutic agents[J]. Chem Rev, 1999, 99(9): 2589-2600. DOI: 10.1021/cr980431o. |
| [5] | VELAZQUEZ H D, VERPOORT F. N-heterocyclic carbene transition metal complexes for catalysis in aqueous media[J]. Chem Soc Rev, 2012, 41(21): 7032-7060. DOI: 10.1039/c2cs35102a. |
| [6] | HOPKINSON M N, RICHTER C, SCHEDLER M, et al. An overview of N-heterocyclic carbenes[J]. Nature, 2014, 510(7506): 485-496. DOI: 10.1038/nature13384. |
| [7] | GYURCSIK B, NAGY L. Carbohydrates as ligands:coordination equilibria and structure of the metal complexes[J]. Coord Ch em Rev, 2000, 203(1): 81-149. DOI: 10.1016/S0010-8545(99)00183-6. |
| [8] | ZHAO W, FERRO V, BAKER M V. Carbohydrate-N-heterocyclic carbene metal complexes:synthesis, catalysis and biological studies[J]. Coord Chem Rev, 2017, 339: 1-16. DOI: 10.1016/j.ccr.2017.03.005. |
| [9] | IMANAKA Y, HASHIMOTO H, KINOSHITA I, et al. Incorporation of a sugar unit into a C-C-N pincer Pd complex using click chemistry and Its dynamic behavior in solution and catalytic ability toward the Suzuki-Miyaura coupling in water[J]. Chem Lett, 2014, 43(5): 687-689. DOI: 10.1246/cl.140017. |
| [10] | NISHIOKA T, SHIBATA T, KINOSHITA I. Sugar-incorporated N-heterocyclic carbene complexes[J]. Organometallics, 2007, 26(5): 1126-1128. DOI: 10.1021/om061128d. |
| [11] | HENDERSON A S, BOWER J F, GALAN M C. Carbohydrate-based N-heterocyclic carbenes for enantioselective catalysis[J]. Org Biomol Chem, 2014, 12(45): 9180-9183. DOI: 10.1039/C4OB02056A. |
| [12] | HENDERSON A S, BOWER J F, GALAN M C. Carbohydrates as enantioinduction components in stereoselective catalysis[J]. Org Biomol Chem, 2016, 14(17): 4008-4017. DOI: 10.1039/C6OB00368K. |
| [13] | TEWES F, SCHLECKER A, HARMS K, et al. Carbohydrate-containing N-heterocyclic carbene complexes[J]. J Organomet Chem., 2007, 692(21): 4593-4602. DOI: 10.1016/j.jorganchem.2007.05.007. |
| [14] | SHI J C, LEI N, TONG Q, et al. Synthesis of chiral imidazolinium carbene from a carbohydrate and its Rhodium(Ⅰ) complex[J]. E ur J Inorg Chem, 2007, 2007(15): 2221-2224. DOI: 10.1002/(ISSN)1099-0682. |
| [15] | SHIBATA T, ITO S, DOE M, et al. Dynamic behaviour attributed to chiral carbohydrate substituents of N-heterocyclic carbene ligands in square planar nickel complexes[J]. Dalton Trans, 2011, 40(25): 6778-6784. DOI: 10.1039/c0dt01833c. |
| [16] |
ZHOU Z G, LIU P, TONG Q S, et al. NMR studies on methyl 4, 6-O-benzyl idene-3-deoxy-3-(salicylideneamino)-α-D-altropyranoside[J].
Journal of Fujian Normal University, 2009, 5: 78-80.
周中高, 刘沛, 童庆松, 等. 甲基3-脱氧-3-(2-羟基苄叉氨基)-4, 6-O-苄叉基-α-D-阿卓吡喃糖苷的NMR研究[J]. 福建师范大学学报, 2009, 5: 78-80. |
| [17] |
YANG Z C, ZHOU H H, ZHOU Z Y, et al. Synthesis and characterization of 1-(2, 3, 4, 6-tetra-O-acetyl-β-D-glucopyranosyl)imidazole[J].
Chenmical Intermediate, 2013, 2: 22-26.
杨志才, 周海红, 周珍云, 等. 手性NHC中间体1-(2, 3, 4, 6-四-O-乙酰基-β-D-吡喃葡萄糖基)咪唑的合成及核磁共振研究[J]. 化工中间体, 2013, 2: 22-26. |
| [18] | ZHOU Z G, ZHAO Y, ZHEN H Y, et al. Poly(ethylene glycol)-and glucopyranoside-substituted N-heterocyclic carbene precursors for the synthesis of arylfluorene derivatives using efficient palladium-catalyzed aqueous Suzuki reaction[J]. Appl Organomet Chem, 2016, 30(11): 924-931. DOI: 10.1002/aoc.v30.11. |
| [19] | ZHOU Z G, QIU J B, XIE L F, et al. Synthesis of chiral imidazolium salts from a carbohydrate and their application in Pd-catalyzed Suzuki-Miyaura reaction[J]. Catal Lett, 2014, 144(11): 1911-1918. DOI: 10.1007/s10562-014-1323-4. |
| [20] |
YU D H, KANG W, HAO F, et al. Spectroscopic studies and structural elucidation of cabazitaxel[J].
Chinese J Magn Reson, 2017, 34(2): 191-199.
余大海, 康旺, 郝福, 等. 卡巴他赛结构确证的波谱学研究[J]. 波谱学杂志, 2017, 34(2): 191-199. DOI: 10.11938/cjmr20170208. |
| [21] |
ZHANG E, CUI D Y, SUN W, et al. Structural elucidation of a hydrolysis product from derivatives of allofuranose[J].
Chinese J Magn Reson, 2017, 34(2): 183-190.
张恩, 崔得运, 孙伟, 等. 呋喃阿洛糖衍生物水解产物的结构确定[J]. 波谱学杂志, 2017, 34(2): 183-190. DOI: 10.11938/cjmr20170207. |
 2018, Vol. 35
2018, Vol. 35 
