2. 长春中医药大学附属医院, 吉林 长春 130021
2. The Affiliated Hospital of Changchun University of TMC, Changchun 130021, China
神经退行性疾病是一类由神经系统进行性病变所引起的疾病,包括阿尔茨海默氏病(AD)、帕金森氏病(PD)、亨廷顿氏病(HD)及肌萎缩性侧索硬化症(ALS)缺血性或出血性脑卒中等.由于这类疾病的发生原因复杂,致病机制不很明确,目前尚没有找到有效的治疗药物.FK506结合蛋白(FKBPs)是免疫抑制剂FK506在人体内的作用靶蛋白,家族成员包括FKBP12、FKBP52、FKBP38等[1],其在免疫系统中表达,但生理功能目前并不十分清楚.后续的研究发现FK506结合蛋白在脑组织中的浓度远大于其在免疫组织中的浓度,提示其与神经系统的功能可能存在密切关系[2].1994年,Lyons等人[3]研究发现,免疫抑制剂FK506在体外有显著的促神经生长活性,开创了有机小分子神经生长促进剂研究的先河.其后,大量的高活性化合物不断涌现[4, 5],使FKBPs成为神经退行性疾病防治药物的重要靶标.
本文涉及的(3R)-4-[(4-甲基苯磺酰基)]-1, 4-噻嗪-3-酰基-[(2R)-2-氨基-4-甲基]-戊酸异丙酯(代号:HD5-6,图 1)是一种拥有完全自主知识产权的、高活性FKBPs配体,具有显著的促神经再生作用[6],在多种神经退行性疾病动物模型上表现出了显著的药效[7].在快速老化小鼠SAMP8的定位航行模型中HD5-6给药组的潜伏期较痴呆组明显缩短(p < 0.05),与正常对照组无统计学差异(p > 0.05);在空间探索模型中HD5-6给药组与痴呆组相比,跨平台次数与原平台象限时间比均有统计学差异(p < 0.05),而与正常对照组无统计学差异(p > 0.05),结果表明HD5-6能够显著改善快速老化小鼠SAMP8的学习记忆能力,机制研究的结果表明其能有效改善海马神经元的病理改变,有望用于包括如AD、PD和ALS等与神经退变有关的神经疾病,以及由各种物理损伤(如机械损伤或冲击)或疾病(如糖尿病或自身免疫获得缺陷病)引起的神经病变等相关疾病的临床治疗.目前该化合物作为候选药物分子正在按化药1类的技术规范开展临床前研究.由于HD5-6结构的NMR归属尚未见文献报道,因此本文利用核磁共振(NMR)波谱[8-10](包括1H NMR、13C NMR、DEPT、1D NOESY、1H-1H COSY、1H-13C HSQC和1H-13C HMBC)对该化合物进行了较为全面的结构表征,并对其进行了元素分析,并测定了其质谱(MS)、红外吸收光谱(IR)和紫外吸收光谱(UV),对该化合物的1H和13C NMR信号进行了详细归属,同时讨论了IR特征吸收峰所对应的各官能团的振动形式、UV吸收带位置与该化合物生色团的对应关系,对该化合物的结构及波谱学数据进行了解析,以期对该化合物及衍生物的研究提供更多的波谱信息,为其质量研究提供了较为全面的参考依据.
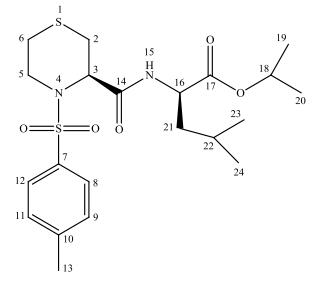
|
图 1 HD5-6的化学结构 Figure 1 Molecular structure of HD5-6 |
UV光谱采用岛津UV2450紫外可见分光光度计(日本岛津制作所)测定.IR光谱采用NICOLET 6700型红外光谱仪(美国Nicolet仪器公司)测定,KBr压片.元素分析采用Elementar Vario ELⅢ元素分析仪(德国元素分析系统公司)测定.高分辨液质联用仪为Agilent 1200液相色谱仪-6230A飞行时间质谱(美国Agilent公司),配备电喷雾离子源(ESI).
1H NMR、13C NMR、1D NOESY、DEPT、1H-1H COSY、1H-13C HSQC和1H-13C HMBC谱均采用JEOL JNM-ECA 400型NMR谱仪(JEOL公司)测定,以氘代二甲基亚砜(DMSO-d6)为溶剂、四甲基硅烷(TMS)为内标,采用5 mm z-轴梯度脉冲多核探头(TH5AT/FG).1H NMR的工作频率为400.13 MHz,90˚脉冲宽度为11.0 μs,实验谱宽为7 348 Hz;13C NMR的工作频率为100.61 MHz,90˚脉冲宽度为8.8 μs,实验谱宽为25 146Hz;DEPT的工作频率及谱宽同13C NMR;1D NOESY谱采用多频率位移激发双梯度自旋回波方法测定,180˚高斯软脉冲,脉冲宽度为40 ms;1H-1H COSY的F2维(1H)和F1维(1H)谱宽均为9 180 Hz,采样数据点阵t2×t1=1 024×512,零填充后傅里叶变换点阵F2×F1=2 048× 1 024;HSQC的F2(1H)和F1(13C)维的谱宽分别为3 206 Hz和15 977 Hz,采样数据点阵t2×t1=1 024×512;HMBC的F2维(1H)和F1维(13C)谱宽分别为3 206 Hz和15 977 Hz,13C-1H远程偶合常数为6 Hz,采样数据点阵t2×t1=1 024×256.
1.1.2 样品与试剂HD5-6样品由军事医学科学院毒物药物研究所肖军海制备并提供.经高效液相色谱(HPLC)面积归一化法检测纯度为99.56%.DMSO-d6购自北京百灵威科技有限公司,其中含有用于定标的TMS(δH 0.00、δC 0.0);其他试剂均为分析纯.
2 结果与讨论 2.1 元素分析样品的元素分析测定值(ω/%,括号内为理论值)如下:C为55.12(55.24);H为7.22(7.08);N为6.28(6.14);O为17.21(17.52);S为14.17(14.02).元素分析实测平均值与理论值误差均小于3‰,由元素分析值可知该样品的元素组成和质量百分比符合HD5-6分子式C21H32N2O5S2.
2.2 MS谱图分析HD5-6质谱(图 2)采集采用ESI离子源,正离子检测的准分子离子峰质荷比(m/z)为457.182 5 [M+H]+和479.164 4 [M+Na]+、负离子检测的准分子离子峰m/z为455.168 0 [M-H]-和491.144 8[M+Cl]-.与HD5-6(分子式为C21H32N2O5S2)精确分子量(456.175 3)一致.
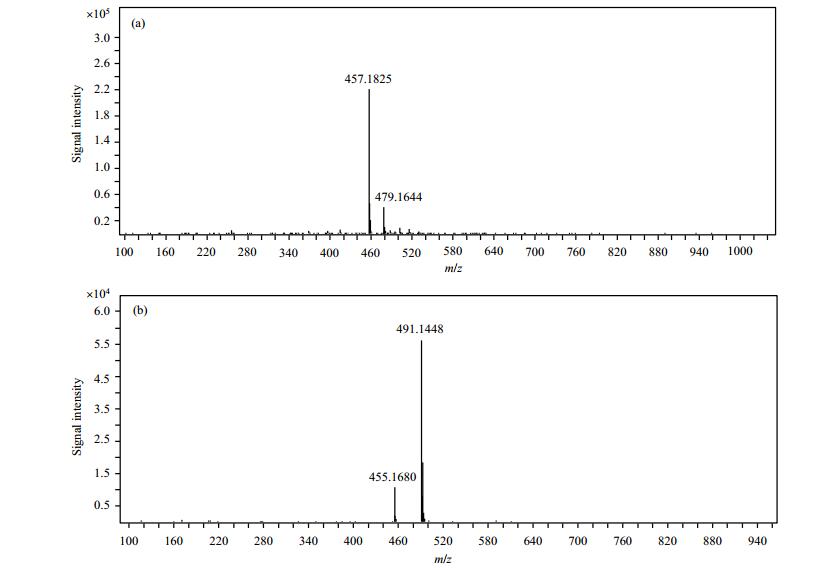
|
图 2 HD5-6质谱. (a)正离子检测模式;(b)负离子检测模式 Figure 2 Mass spectra of HD5-6. (a) Positive ion detection mode; (b) Negative ion detection mode |
HD5-6甲醇溶液的UV光谱中:207.0 nm为环状共轭体系所形成的π→π*跃迁吸收带,属于E2吸收带,表明该化合物含有苯环或杂芳环;230.0 nm为共轭双键π→π*轨道跃迁所产生的吸收带,属于K吸收带,表明该分子可能含有C=C-C=C或C=C-C=O,与HD5-6结构相符.
2.4 IR光谱分析HD5-6的IR吸收光谱在3 411.87、2 980.10、2 955.43、2 935.43、2 910.92、2 867.87、1 731.48、1 678.01、1 596.96、1 509.85、1 470.43、1 377.67、1 365.23、1 342.27、1 272.87、1 250.68、1 162.71、1 091.71~1 215.40、998.86~1 044.74 cm–1处显示有吸收峰.3 411.87 cm–1(νN-H CO-NH)为N-H键的伸缩振动,1 678.01 cm–1(νC=O CO-NH)为C=O键的伸缩振动,表明分子中仲酰胺结构片段的存在;2 980.10、2 955.43、2 935.43、2 910.92、2 867.87 cm–1为甲基、亚甲基的伸缩振动吸收峰,1 377.67、1 365.23 cm–1为C-H弯曲振动,表明分子中含甲基(-CH3)、亚甲基(-CH2-);1 731.48 cm–1(νC=O)为酯键COOR的强伸缩振动吸收峰;1 596.96、1 509.85、1 470.43 cm–1为苯环骨架C=C伸缩振动,表明分子中存在苯环;1 342.27、1 162.71 cm–1为S=O的对称和不对称伸缩振动,表明分子中含有-SO2基团;1 272.87、1 250.68 cm–1为C-O-C的变角振动与酯基C-C的伸缩振动,表明分子中含酯基(C-O-C);1 091.71~1 215.40 cm–1吸收峰为C-N-C伸缩振动;998.86~1 044.74 cm–1为环烷烃中C-C键的伸缩振动,表明分子中含有环烷烃基团.具体的红外吸收光谱数据及归属见表 1.
| 表 1 HD5-6的红外吸收光谱数据及其归属 Table 1 IR data analysis of HD5-6 |
13C NMR谱和DEPT谱(图 3)表明,该分子结构中含5个伯碳,即δC 21.5(包含2个碳原子)、22.0、22.1、23.4;4个仲碳,即δC 26.0、29.3、39.9、43.5;8个叔碳,即δC 24.8、50.9、54.7、68.5、127.6(包含2个碳原子)、130.2(包含2个碳原子);4个季碳,即δC 137.5、143.7、168.4、172.4.
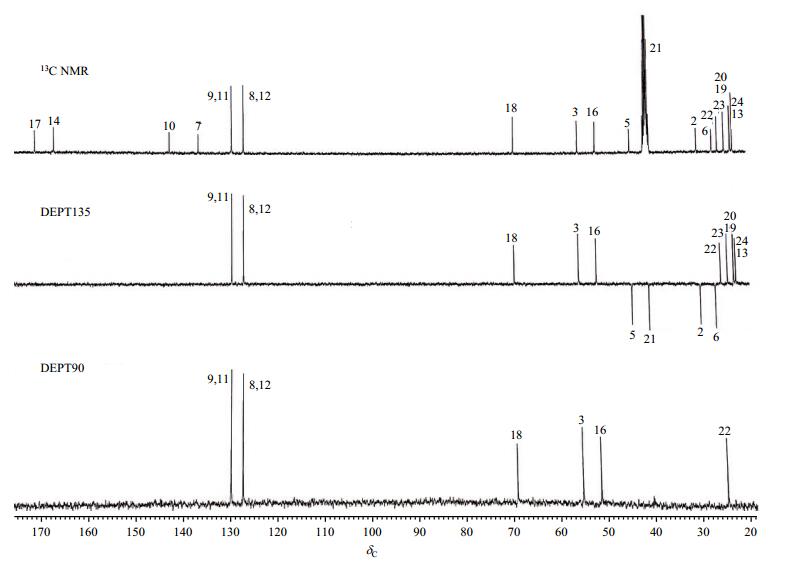
|
图 3 HD5-6的DEPT谱和13C NMR谱 Figure 3 DEPT and 13C NMR spectra of HD5-6 |
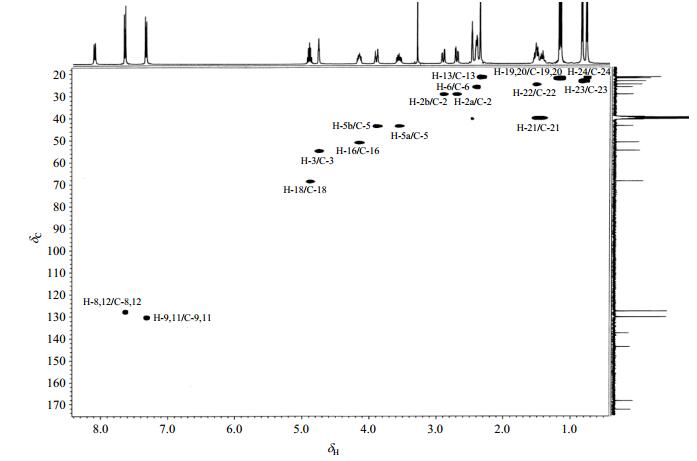
结合1H-1H COSY(图 4)、1H-13C HSQC(图 5)和1H-13C HMBC(图 6)谱图分析,1H NMR谱(图 7)中δH 1.20(3H, d, J=6.5 Hz)和δH 1.21(3H, d, J=6.5 Hz)归属为与次甲基相连的2个甲基质子H-19或H-20,受次甲基质子的偶合影响,均裂分为双重峰.在1H-1H COSY谱中,δH 4.93(1H, m)与H-19、H-20相关,归属为H-18,受邻位H-19、H-20的偶合作用,裂分为多重峰.δC 22.0、22.1在HSQC谱中与H-19、H-20直接相关,HMBC谱显示其与H-18有远程相关,归属为C-19、C-20. dC 68.5在HSQC谱中与H-18相关,HMBC谱显示其与H-19、H-20有远程相关,归属为C-18.
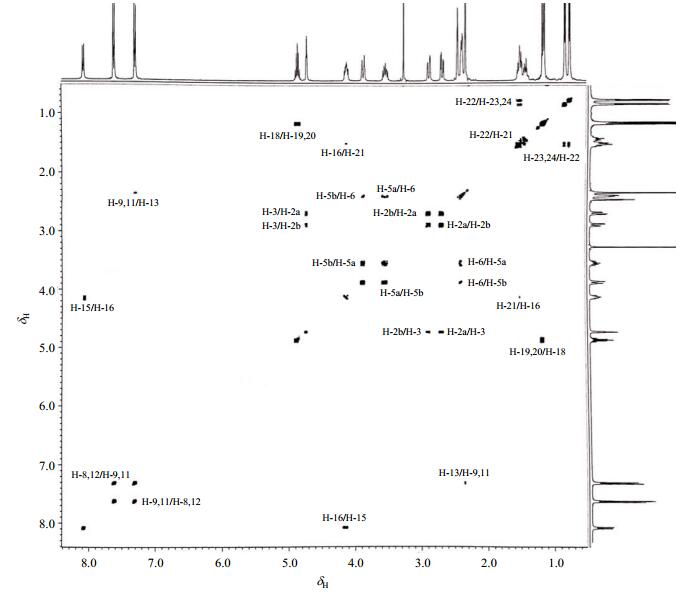
|
图 4 HD5-6的1H-1H COSY谱 Figure 4 1H-1H COSY spectrum of HD5-6 |
|
图 5 HD5-6的1H-13C HSQC谱 Figure 5 1H-13C HSQC spectrum of HD5-6 |

|
图 6 HD5-6的1H-13C HMBC谱. (a)全谱;(b)为(a)中方框所示部分放大图 Figure 6 1H-13C HMBC spectra of HD5-6. (a) Full spectrum; (b) Local amplified spectra in box of (a) |
δH 8.12(1H, d, J=8.0 Hz)进行重水交换后,信号消失,归属为活泼的酰胺质子H-15.在COSY谱中,δH 4.19(1H, m)与H-15相关,归属为H-16;δH 1.46(2H, m)与H-16相关,归属为H-21.δC 50.9在HSQC谱中与H-16相关,HMBC谱显示其与H-21有远程相关,归属为C-16.δH 1.56(1H, m)在COSY谱中与H-21相关,归属为H-22.高场区δH 0.80(3H, d, J=6.3 Hz)和δH 0.87(3H, d, J=6.3 Hz)在COSY谱中与H-22相关,归属为2组甲基质子H-23或H-24,受邻位次甲基质子的偶合影响,均裂分为双重峰.δC 21.5、23.4在HSQC谱中与H-23(或H-24)相关,HMBC谱显示其与H-21、H-22有远程相关,归属为C-23或C-24.δC 24.8在HSQC谱中与H-22相关,HMBC谱显示其与H-16、H-21、H-23(或H-24)远程相关,归属为C-22.δC 39.9在HSQC谱中与H-21相关,HMBC谱显示其与H-16、H-22、H-23(或H-24)远程相关,归属为C-21.δC 172.4在HSQC谱中无相关信号,HMBC谱显示其与H-15、H-16、H-18、H-21有远程相关,归属为C-17.δC 168.4在HSQC谱无相关信号,HMBC谱显示其与H-16有远程相关,归属为C-14.
在1H-1H COSY谱中,δH 7.36(2H, d, J = 8.2 Hz)与δH 7.70(2H, d, J = 8.2 Hz)构成一个质子偶合体系,根据化学位移、峰型、质子个数,归属为苯环上的质子(H-8、H-9、H-11、H-12),其中H-8与H-12是磁等价质子,H-9与H-11是磁等价质子.δH 7.36(2H, d, J = 8.2 Hz)还与δH 2.38(3H)处的单峰弱相关,归属为H-9和H-11,因此δH 2.38归属为H-13,δH7.70归属为H-8、H-12.受H-8、H-12的影响,H-9、H-11均裂分为双重峰;受H-9、H-11的影响,H-8、H-12也裂分为双重峰.δC 127.6在HSQC谱中与H-8(H-12)相关,HMBC谱显示其分别与H-12、H-8有远程相关,由于取代基在苯环上的对称性,两个13C核化学位移相同,归属为C-8和C-12.δC 130.2在HSQC谱中与H-9(H-11)相关,HMBC谱显示其与H-13有远程相关,由于取代苯环对称性,两个13C核化学位移相同,归属为C-9和C-11.δC 21.5在HSQC谱与H-13相关,HMBC谱显示其与H-9、H-10、H-11远程相关,归属为C-13.δC 143.7在HSQC谱中无相关信号,HMBC谱显示其与H-13远程相关,归属为C-10.δC 137.5在HSQC谱无相关信号,HMBC谱显示其与H-9、H-11远程相关,由于受邻位硫原子的影响,13C NMR信号峰较弱,归属为C-7.
在1H-1H COSY谱中,δH 2.73(1H, dd, J2a, 2b = 14.5 Hz, J2a, 3 = 4.0 Hz)、δH 2.93(1H, dd, J2b, 2a = -14.5 Hz, J2b, 3 = 2.3 Hz)、δH 4.79(1H, dd, J3, 2a = -4.0 Hz, J3, 2b = -2.3 Hz)构成了一个质子偶合体系,根据化学位移、峰型、质子个数,归属为噻嗪环上的质子H-2a、H-2b、H-3,其中δH 2.73和δH 2.93在HSQC谱中同时与δC 29.3相关,归属为亚甲基中两个磁不等价的质子H-2a、H-2b,因此δC 29.3归属位C-2,δH 4.79归属为H-3.δC 54.7在HSQC谱与H-3相关,HMBC谱显示其与H-2a有远程相关,归属为C-3.同理,在1H-1H COSY谱中,δH 3.60(1H, m)、δH 3.91(1H, dt)、δH 2.43(2H, br)构成的质子偶合体系,根据化学位移、峰型、质子个数分别归属为H-5a、H-5b、H-6.δC 43.5在HSQC谱显示与H-5a和H-5b相关,HMBC谱显示其与H-3、H-6有远程相关,归属为C-5.δC 26.0在HSQC谱中显示与H-6直接相关,HMBC谱显示其与H-2b、H-5a有远程相关,归属为C-6.
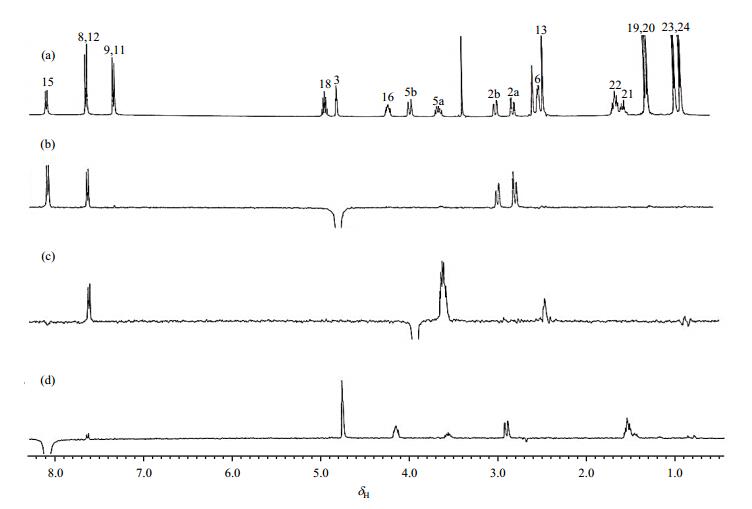
对于HD5-6中被季碳及杂原子分隔的结构体系研究采用HMBC和1D NOESY谱(图 7)结合的方法可以得到满意结果.图 7(b)、(c)的1D NOESY谱显示,选择激发H-3(δH 4.79)信号,产生4个较强的NOE信号,分别出现在H-2a(δH 2.73)、H-2b(δH 2.93)、H-8和H-12(δH 7.70)、H-15(δH 8.12).选择激发H-5b(δH 3.91)信号,产生3个NOE信号,其中H-8和H-12(δH 7.70)信号强度最大,由此可知H-3与H-8、H-5b与H-12之间存在较强的质子间空间效应,且二者在A、B片段(图 8)中相距最近,可确定A、B片段连接方式.图 7(d)的1D NOESY谱显示,选择激发H-15(δH 8.12)信号,产生7个NOE信号,其中H-3(δH 4.79)信号强度最大,由此可知H-15与H-3之间存在较强的质子间空间效应,且二者在A、C片段(图 8)中相距最近,另外HMBC谱也显示其与H-2、H-3、H-16有远程相关,可确定A、C片段连接方式.
|
图 7 HD5-6的NMR谱. (a) 1H NMR谱;(b)~(d) 1D NOESY谱,分别选择激发H-3、H-5b和H-15 Figure 7 NMR spectra of HD5-6. (a) 1H NMR spectrum; (b)~(d) 1D NOESY spectra with selective excitation of the H-3, H-5b, H-15 |

|
图 8 HD5-6的结构片段及NOE相关信号( |
HD5-6的1H NMR、13C NMR归属见表 2、表 3.
| 表 2 HD5-6 1H NMR数据分析(DMSO-d6) Table 2 1H NMR data analysis of HD5-6 (DMSO-d6) |
| 表 3 HD5-6 13C NMR数据分析(DMSO-d6) Table 3 13C NMR data analysis of HD5-6 (DMSO-d6) |
本文通过UV、IR、ESI-MS和NMR谱图(包括1H NMR、13C NMR、DEPT、1D NOESY、1H-1H COSY、1H-13C HSQC和1H-13C HMBC)的测定和解析,对HD5-6的化学结构进行了全面地分析和验证.通过ESI-MS、元素分析测定值确定了HD5-6的分子式;UV光谱显示出该化合物的特征官能团;IR光谱进一步显示出该化合物的各官能团的特征吸收;同时,根据1D NMR和2D NMR数据,对HD5-6的1H NMR和13C NMR信号进行了全归属,综合确证了HD5-6的化学结构.
| [1] | KANG C B, HONG Y, DHE-PAGANON S, et al. FKBP family proteins:immunophilins with versatile biological functions[J]. Neurosignals, 2008, 16(4): 318-325. DOI: 10.1159/000123041. |
| [2] | STEINER J P, DAWSON T M, FOTUHI M, et al. High brain densities of the immunophilin FKBP colocalized with calcineurin[J]. Nature, 1992, 358: 584-587. DOI: 10.1038/358584a0. |
| [3] | LYONS W E, GEORGE E B, DAWSON T M, et al. Immunosuppressant FK506 promotes neurite outgrowth in cultures of PC12 cells and sensory ganglia[J]. Proc Natl Acad Sci USA, 1994, 1(8): 3191-3195. |
| [4] | LIU F, WANG Y Q, MENG L, et al. FK506-binding protein 12 ligands:a patent review[J]. Expert Opin Ther Pat, 2013, 23(11): 1435-1449. DOI: 10.1517/13543776.2013.828695. |
| [5] | FENG X X, POMPLUN S, HAUSCH F. Recent progress in FKBP ligand development[J]. Curr Mol Pharmacol, 2015, 9(1): 27-36. DOI: 10.2174/1874467208666150519113313. |
| [6] | 李松, 肖军海, 韩丹, 等. 噻嗪酰胺衍生物及其在制备神经退行性疾病防治药物的用途: 中国, 102675244 B[P]. 2016-03-30. |
| [7] |
ZHANG Y M, XIAO J H, ZHAO Y, et al. The experimental study of a novel FKBPs ligand (HD5-6) on SAMP8 anti-aging therapy[J].
J Apoplexy and Nervous Diseases, 2014, 31(1): 4-8.
张延明, 肖军海, 赵云, 等. 新型FKBPs配体HD5-6对SAMP8小鼠的抗老化研究[J]. 中风与神经疾病杂志, 2014, 31(1): 4-8. |
| [8] | 宁永成. 有机化合物结构鉴定与有机波谱学[M]. 北京: 科学出版社, 2000. |
| [9] |
JIANG D, MIAO Z C. NMR study on 1, 2-substituted ethylene derivatives[J].
Chinese J Magn Reason, 2013, 30(1): 121-130.
姜丹, 缪振春. 1, 2-二取代苯乙烯衍生物的NMR研究[J]. 波谱学杂志, 2013, 30(1): 121-130. |
| [10] |
JIANG D, XU J. Stereochemistry and spectral assignment of thebaine derivatives:A 1D NOESY NMR study[J].
Chinese J Magn Reason, 2015, 32(1): 95-104.
姜丹, 徐佳. 一维NOE NMR技术用于蒂巴因衍生物的立体结构研究[J]. 波谱学杂志, 2015, 32(1): 95-104. DOI: 10.11938/cjmr20150111. |
 2018, Vol. 35
2018, Vol. 35 
