2. 上海联影医疗科技有限公司, 上海 201800
2. Shanghai United Imaging Healthcare Co., Ltd., Shanghai 201800, China
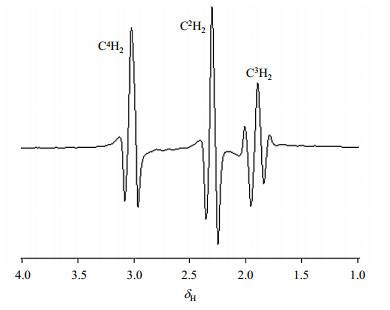
γ-氨基丁酸(γ-aminobutyric acid,GABA)是中枢神经系统的一种重要的抑制性神经递质[1, 2].它参与多种代谢活动,具有很高的生理活性.GABA含量的异常可能会引发癫痫、帕金森、老年痴呆等一系列大脑疾病[3-6].定量检测GABA浓度是阐明与其相关的疾病的病理生理、发病机制,以及评估药物功效的前提.随着磁共振技术的发展,拥有“虚拟活检”之称的磁共振波谱(Magnetic Resonance Spectroscopy,MRS)技术在医学领域的应用日趋广泛,对在体检测GABA含量具有重要意义[7].GABA(NH2-C4H2-C3H2-C2H2-C1OOH)是一个A2M2X2质子自旋系统,属于比较复杂的六旋系统.GABA有三组质子共振峰,分别位于δH 1.9、2.3和3.0处(如图 1所示),与N-乙酰天门冬氨酸(N-Acetyl Aspartate,NAA)、谷氨酸(Glutamate,Glu)、谷氨酰胺(Glutamine,Gln)、肌酸(Creatine,Cr)等代谢物信号有较大的重叠;而且人脑中GABA含量极低(约1~2 mmol/L), 因此,直接检测GABA信号十分困难[8].
|
图 1 GABA的三个共振峰 Figure 1 Three resonance peaks of GABA |
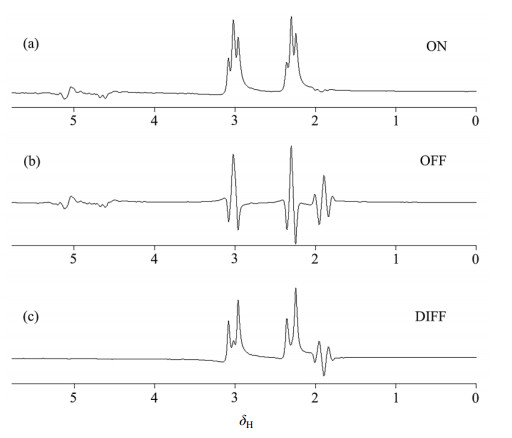
传统的MRS技术不足以直接检测出人脑的GABA含量.近些年来,通过谱编辑的方法对序列进行修改成为研究者常用的一种手段.标量耦合(J耦合)效应使GABA的C3H2(δH 1.9)与C4H2(δH 3.0)之间相互影响.激发δH 1.9处的GABA信号会使得与之耦合的δH 3.0处的GABA信号相位反相,而δH 3.0处的Cr信号却不会受到影响.利用这个原理,对激发(ON)和不激发(OFF)两种状态下的波谱信号做差分(DIFF),即可消除Cr信号影响,并获得加倍的GABA信号(如图 2所示).序列中的谱编辑技术通常采用MEGA(MEscher-GArwood)[9],这是一种最早用于在磁共振脉冲序列里实现溶剂信号抑制的技术.MEGA的原理是在一个具有重聚横向磁化矢量作用的180°脉冲两侧放置两个完全相同的180°软脉冲,利用梯度磁场进行扰相,使得被选择激发的物质信号消失.MEGA的模块化以及易于实施的特性,使其可以被放在任何包含重聚脉冲的序列里使用,在检测GABA的方法设计中得到了广泛应用.在先前的研究中,已有学者基于MEGA原理,结合PRESS序列,对MEGA-PRESS序列的有效性进行了大量验证[10-13].然而,大分子(Macromolecule, MM)位于δH 1.7和δH 3.0处的质子之间也存在J耦合作用.带宽的限制使编辑脉冲不能精确激发特定频率的物质.相近的化学位移和J耦合作用使MM在δH 3.0的信号也同时被编辑[14].因此MEGA-PRESS序列得到的GABA信号往往不够纯净,被一部分MM信号污染(GABA+MM,简称GABA*).Terpstra等人[15]曾指出MM信号占GABA*信号的15%.
|
图 2 编辑GABA信号原理图. (a) ON序列波谱信号;(b) OFF序列波谱信号;(c)差谱信号 Figure 2 Schematic diagram of editing for GABA. (a) Spectrum of ON sequence; (b) Spectrum of OFF sequence; (c) Difference spectrum |
本文利用J耦合差分原理,在联影(United Imaging Healthcare,UIH)的uMR780磁共振系统上实现MEGA-PRESS序列并进行优化,使获得的信号基线更加平稳,并且提高了GABA信号的选择性.
1 实验原理 1.1 设计MEGA-PRESS序列本实验设计的MEGA-PRESS序列时序如图 3所示:基于PRESS序列,在第二个180°硬脉冲前后对称地放置两个180s°软脉冲,配合扰相梯度G2、G3,达到抑制特定频率信号的目的.在ON序列中,打开编辑脉冲,激发δH 1.9;在OFF序列中,关闭编辑脉冲.两种谱线结果做差分得到GABA信号.

|
图 3 MEGA-PRESS序列时序图 Figure 3 Schematic of MEGA-PRESS sequence |
为了保证GABA信号的衍化实现完全的相位重聚,使得差谱信号最强,根据(1)式[1]设置回波时间(Echo Time, TE)为68 ms.
| $ TE = 1/(2^*J) $ | (1) |
其中J是为GABA第3个和第4个碳原子上质子之间的耦合常数,为7.3 Hz.
为了准确激发δH 1.9处的GABA信号,减少激发δH 1.7处的MM信号,180s°编辑脉冲的带宽越小越好.脉冲的带宽与脉冲形状、脉冲时间等因素相关,并且受到时间带宽积的约束.因此在不考虑脉冲形状的情况下,编辑脉冲持续时间应尽可能长.在TE=68 ms的限制下,综合考虑时序图中激发脉冲、扰相梯度等所占用的时间,180s°编辑脉冲的持续时间设置为20 ms.
1.2 设计SLR脉冲MRS激发轮廓可以通过对给定的射频(Radio Frequency,RF)脉冲和磁化强度矢量初始取向解Bloch方程得到.SLR(Shinnar-Le Roux)算法可以对此逆问题进行求解,设计出具有特定激发轮廓的SLR脉冲.和高斯脉冲相比,SLR脉冲具有更好的频率选择性,在相同的脉冲时间内有更窄的带宽和更陡峭的过渡带.因此,在MEGA-PRESS的序列优化中,用SLR脉冲代替高斯脉冲可以更准确地激发δH 1.9处的GABA信号,减少MM信号的污染.
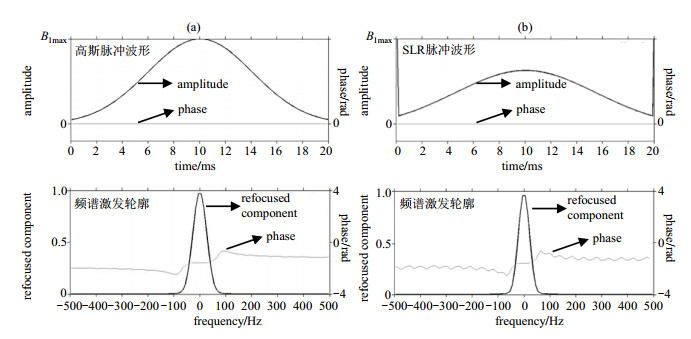
本文基于MATLAB平台,利用软件包matpulse[16]生成优化的SLR脉冲数据.通过编程解Bloch方程仿真其衍化过程,计算出频谱激发轮廓.和高斯脉冲相比,SLR脉冲的性能如下:如图 4(a)和4(b)所示,在20 ms的脉冲持续时间内,高斯脉冲的带宽(Full Width at Half Maximum,FWHM)为62 Hz,SLR脉冲的带宽为50 Hz,且过渡带更陡峭,选择性更好.
|
图 4 高斯脉冲和SLR脉冲性能比较. (a)高斯脉冲;(b) SLR脉冲 Figure 4 Performance comparison of Gaussian pulse and SLR pulse. (a) Gaussian pulse; (b) SLR pulse |
传统的MEGA-PRESS序列已经可以很好地检测出GABA*信号[8],在此基础之上,本研究对MEGA-PRESS序列做了进一步优化.除了利用上文中提到的SLR脉冲代替高斯脉冲以减少MM对GABA信号的污染外,本研究还利用傅里叶变换的平移性质和线性性质,设计出可以同时选择性激发GABA信号和水信号的双频带脉冲.
| $ F(u - {u_0}) < = > f(t)^*{{\rm{e}}^{{\rm{j}}^*2^*{\rm{ \mathsf{ π} }}^*{u_0}t}} $ | (2) |
其中,u代表频率,t代表时间,j代表虚数单位,u0等于两个频带的中心频率之差.
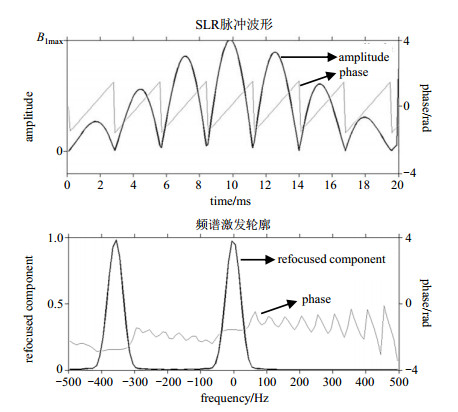
双频带脉冲用于在ON序列里同时激发δH 1.9的GABA信号和δH 4.7的水质子信号,单频带脉冲用于在OFF序列里激发δH 4.7的水质子信号.单频带和双频带脉冲的结合使用,使得MEGA-PRESS序列进一步抑制了水质子信号,减少水信号残余对基线的影响,获得更加平稳的基线.如图 5所示,双频带SLR脉冲以水质子信号为中心,两个频带的中心频率之间相差357.672 Hz,以达到同时激发δH 4.7和δH 1.9的目的.
|
图 5 双频带SLR脉冲 Figure 5 SLR pulse with dual frequency band |
本实验采用纯度为99%的实验级GABA试剂,用蒸馏水配制成浓度为60 mmol/L的GABA水模,并招募健康成年男子作为被试志愿者.为了证实优化后的MEGA-PRESS序列的检测效果优于未优化的MEGA-PRESS序列,本研究利用优化前后的MEGA-PRESS序列分别在GABA水模以及被试志愿者脑部区域对GABA(人脑中为GABA*)信号的检测效果进行对比实验.为了进一步证实SLR脉冲作为编辑脉冲的优势,本研究在优化后的序列中分别采用高斯脉冲和SLR脉冲作为编辑脉冲进行实验.在水模实验中,通过探究两种编辑脉冲在激发δH 1.9处GABA信号时对相邻峰(δH 2.3)信号的影响来证实SLR脉冲相比高斯脉冲具有更窄带宽的优势;在人体实验中,通过定量计算两种编辑脉冲作用下得到的GABA*含量来证实SLR脉冲作为编辑脉冲可以减少MM信号干扰.本研究的实验框架如图 6所示.

|
图 6 实验框架 Figure 6 Experimental framework |
水模及志愿者被试均采用24通道相控阵列头线圈,采用gre_scout序列作为定位像,选择大小为30 mm×30 mm×30 mm的感兴趣区(Region of Interest,ROI).志愿者的ROI设置为枕叶(Occipital,OCC).扫描参数如下:重复时间(Repetition Time, TR)为1 800 ms;TE为68 ms;重复扫描128次.该序列采用8个ON、8个OFF序列交替模式,配合使用8步相位循环,以便更好地消除不需要的信号.优化前后的MEGA-PRESS序列实验参数对比详见表 1.本实验所有数据均在联影uMR780磁共振系统上进行扫描,单次扫描时间需要8 min.
| 表 1 MEGA-PRESS序列实验参数 Table 1 The experimental parameters of MEGA-PRESS sequence |
本文利用MATLAB平台对实验获取的原始数据进行后处理.步骤如下:(1)对不同通道获得的自由感应衰减(Free Induction Decay,FID)信号进行相位校正[17];(2)计算不同通道相位权重并进行通道数据合并[18];(3)利用OFF序列数据计算频率偏移和相位偏移,并对每一对ON、OFF序列数据进行相同参数的校正[19];(4)计算128次OFF序列数据的频偏、相位的标准差,以3σ的标准成对排除异常值;(5)对没有被排除的ON、OFF序列数据分别在时间维度上求平均;(6)对ON、OFF序列数据进行快速傅里叶变换(Fast Fourier Transform,FFT)得到频谱;(7)对ON、OFF序列频谱数据作差分获得GABA信号.
3 结果与讨论 3.1 水模实验在水模实验中,优化前后的MEGA-PRESS序列获得的GABA信号如图 7所示.和未经优化的MEGA-PRESS序列相比,优化的MEGA-PRESS序列获得的GABA信号幅值更大,并且对水质子信号的抑制效果更好,差谱信号在δH 4.7处几乎没有残余水质子信号,基线十分平稳.
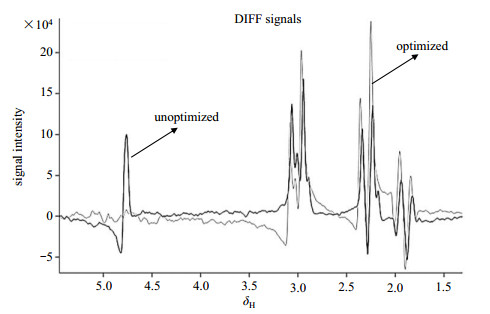
|
图 7 水模实验中,未优化的MEGA-PRESS序列与优化的MEGA-PRESS序列得到的GABA信号对比 Figure 7 The comparison of GABA signals acquired by unoptimized MEGA-PRESS sequence and optimized MEGA-PRESS sequence in the phantom experiment |
高斯脉冲和SLR脉冲分别作为编辑脉冲激发GABA(δH 1.9)信号的实验结果如图 8所示.在MEGA-PRESS序列中,编辑脉冲配合扰相梯度会使被激发的信号消失.因此,我们可以通过观察编辑脉冲对相邻信号的影响来评估两种脉冲的性能;相邻峰信号受到的影响越小,证明编辑脉冲的带宽越窄、过渡带越陡峭.在ON序列获得的信号谱线中,SLR脉冲作为编辑脉冲对δH 2.3处的信号影响更小,证实SLR脉冲具有更窄的带宽和更陡峭的过渡带.因此我们可以推论:在激发δH 1.9处的GABA信号时,利用SLR脉冲作为编辑脉冲,对δH 1.7处的MM信号影响更小,在GABA*定量分析中引入的MM(δH 3.0)信号干扰更少.

|
图 8 水模实验中,分别使用高斯脉冲和SLR脉冲作为编辑脉冲获得的ON序列GABA信号比较 Figure 8 The comparison of GABA signals acquired by ON sequence using Gaussian pulse and SLR pulse as editing pulse, respectively, in the phantom experiment |
在人体实验中,优化前后的MEGA-PRESS序列获得的GABA*信号如图 9所示.二者均在δH 3.0处获得明显的GABA*信号.优化的MEGA-PRESS序列获得的谱线基线平稳,无水信号残余.未经优化的MEGA-PRESS序列获得的谱线在δH 4.7处有明显的水质子信号残余,并且影响到相邻峰的信号(δH 3.7处的峰有明显被抑制的痕迹).由此可以看出:人脑结构比水模复杂,优化后的序列的抑水效果在人体实验中更加显著,弥补了残余水质子信号会影响到相邻信号的不足.
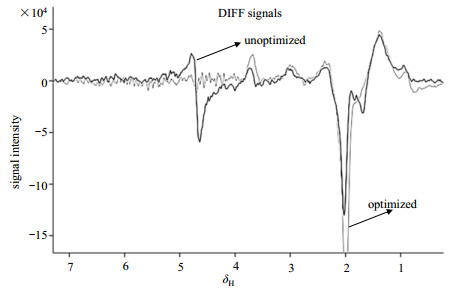
|
图 9 人体实验中,未优化的MEGA-PRESS序列与优化的MEGA-PRESS序列得到的GABA*信号对比 Figure 9 The comparison of GABA* signals acquired by unoptimized MEGA-PRESS sequence and optimized MEGA-PRESS sequence in the volunteer experiment |
定量计算两种编辑脉冲作用下得到的GABA*含量的实验结果如图 10所示.由于磁共振成像(Magnetic Resonance Imaging, MRI)扫描仪不稳定,相同序列重复测量得到的谱线可能会整体偏大或偏小,而代谢物含量之间的比值往往恒定.因此,MRS常常利用某种代谢物与Cr含量的比值进行定量分析.本实验采用GABA*和Cr的比值对GABA*的含量进行分析.图 10(a)为高斯脉冲和SLR脉冲分别作为编辑脉冲得到的差谱信号,我们对GABA*在δH 2.9~3.1范围内进行面积积分.图 10(b)为高斯脉冲和SLR脉冲分别作为编辑脉冲得到的OFF序列波谱信号,我们对Cr在δH 2.8~3.1范围内进行面积积分.最终计算出两种编辑脉冲作用下得到的GABA*与Cr的面积积分比值分别为0.107 4、0.102 6.我们对比值结果进行归一化,如图 10(c)所示.结果表明:SLR脉冲作为编辑脉冲得到的GABA*/Cr比值是高斯脉冲作为编辑脉冲得到的GABA*/Cr比值的95.53%,证实SLR脉冲可以减少4.47%的MM信号污染,提高GABA信号的选择性.
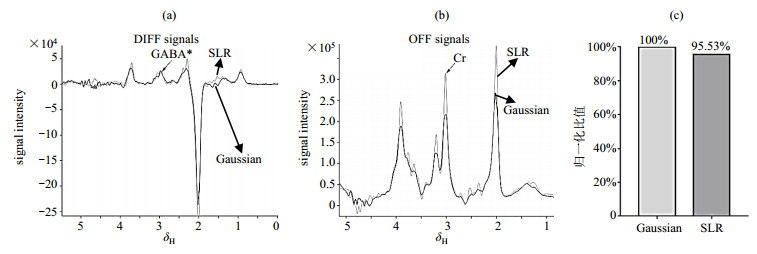
|
图 10 人体实验中,优化的MEGA-PRESS序列分别使用高斯脉冲和SLR脉冲作为编辑脉冲获得的GABA*/Cr结果比较. (a)差谱信号;(b) OFF序列波谱信号;(c) GABA*/Cr归一化结果柱状图 Figure 10 The comparison of GABA*/Cr acquired by optimized MEGA-PRESS sequence using Gaussian pulse and SLR pulse as editing pulse, respectively, in the volunteer experiment. (a) Signal of difference spectrum; (b) Signals of OFF sequence; (c) The histogram of normalized GABA*/Cr |
基于以上实验结果,我们可以证实:1)SLR脉冲相比高斯脉冲具有更窄带宽和更陡峭过渡带的优势;2)优化的MEGA-PRESS序列可以减少MM信号的污染,得到基线平稳的GABA*信号.
本研究采用的方法也具有一定的局限性:优化的MEGA-PRESS序列目前只能提高GABA信号的选择性,减少MM信号的污染却无法将之彻底消除.为了完全消除MM信号的污染,可以通过在ON序列施加选择性激发δH 1.9和4.7的双频带脉冲,在OFF序列施加选择性激发δH 1.5和4.7的双频带脉冲[15],使得ON、OFF序列在抑水的同时对称地影响MM信号(δH 1.7),最后再通过差分消除MM信号.然而,激发δH 1.5时可能会影响到δH 1.9,进而影响到δH 3.0的GABA波形衍化.因此,实现该功能对MEGA模块施加的编辑脉冲的性能要求更加严格.本研究采用的SLR脉冲有希望在不影响GABA信号衍化的前提下完全抑制MM信号,但SLR脉冲的进一步优化以及该方法的有效性仍有待后续实验进一步探究.
4 结论本研究基于MEGA-PRESS序列原理,对MEGA模块中的编辑脉冲进行优化,利用matpulse软件包设计出比高斯脉冲性能更优的SLR脉冲,可以有效减少MM信号对GABA信号的污染.此外,采用单频带和双频带结合的方法,进一步加强对残余水信号的抑制,获得更加平稳的基线以减少对GABA*信号的干扰.最终,在联影的uMR780磁共振系统上实现了在体人脑GABA*含量检测,为进一步的人脑疾病研究提供依据.
| [1] | GRAAF D, ROBIN A. In vivo NMR spectroscopy principles and techniques (2nd ed)[M]. Chichester: John Wiley & Sons, Ltd, 2007. |
| [2] | AGARWAL N, RENSHAW P F. Proton MR spectroscopy-detectable major neurotransmitters of the brain:biology and possible clinical applications[J]. AJNR Am J Neuroradiol, 2012, 33(4): 595-602. DOI: 10.3174/ajnr.A2587. |
| [3] | XIE W J, DONG M, LIU Q, et al. Early predictors and prevention for post-stroke epilepsy:changes in neurotransmitter levels[J]. Transl Neurosci, 2016, 7(1): 1-5. DOI: 10.1515/tnsci-2016-0001. |
| [4] | BLASZCZYK J W. Parkinson's disease and neurodegeneration:GABA-collapse hypothesis[J]. Front Neurosci, 2016, 10: 269. |
| [5] | BAI X, EDDEN R A, GAO F, et al. Decreased gamma-aminobutyric acid levels in the parietal region of patients with Alzheimer's disease[J]. J Magn Reson Imaging, 2015, 41(5): 1326-1331. DOI: 10.1002/jmri.v41.5. |
| [6] | ENNA S J, STERN L Z, WASTEK G J, et al. Cerebrospinal fluid gamma-aminobutyric acid variations in neurological disorders[J]. Arch Neurol, 1977, 34(11): 683-685. DOI: 10.1001/archneur.1977.00500230053008. |
| [7] |
CHEN Y W, SHEN Z W, SU J W, et al. Quantitative measurement of γ-aminobutyric acid concentration in vivo by magnetic resonance spectroscopy:A review[J].
Chinese J Magn Reson, 2006, 23(3): 409-417.
陈耀文, 沈智威, 宿吉伟, 等. MRS定量检测活体γ-氨基丁酸浓度的研究现状[J]. 波谱学杂志, 2006, 23(3): 409-417. |
| [8] |
CHEN L G, LI J Q, WANG Q F. Detection of GABA in human brain on clinical 3 T MRI scanner[J].
Chinese J Magn Reson, 2013, 30(3): 345-353.
陈录广, 李建奇, 王前锋. 人脑GABA测量在临床3 T磁共振成像系统上的实现[J]. 波谱学杂志, 2013, 30(3): 345-353. |
| [9] | MESCHER M, MERKLE H, KIRSCH J, et al. Simultaneous in vivo spectral editing and water suppression[J]. NMR Biomed, 1998, 11(6): 266-272. DOI: 10.1002/(ISSN)1099-1492. |
| [10] | O'GORMAN R L, MICHELS L, EDDEN R A, et al. In vivo detection of GABA and glutamate with MEGA-PRESS:reproducibility and gender effects[J]. J Magn Reson Imaging, 2011, 33(5): 1262-1267. DOI: 10.1002/jmri.22520. |
| [11] | EVANS C J, MCGONIGLE D J, EDDEN R A. Diurnal Stability of γ-aminobutyric acid concentration in visual and sensorimotor Cortex[J]. J Magn Reson Imaging, 2010, 31(1): 204-209. DOI: 10.1002/jmri.21996. |
| [12] | HENRY M E, LAURIAT T L, SHANAHAN M, et al. Accuracy and stability of measuring GABA, glutamate, and glutamine by proton magnetic resonance spectroscopy:A phantom study at 4 Tesla[J]. J Magn Reson Imaging, 2010, 208(2): 210-218. |
| [13] | MULLINS P G, MCGONIGLE D J, O'GORMAN R L, et al. Current practice in the use of MEGA-PRESS spectroscopy for the detection of GABA[J]. Neuroimage, 2014, 86: 43-52. DOI: 10.1016/j.neuroimage.2012.12.004. |
| [14] |
CHEN M N, WANG Q F, LI G Y, et al. Effects of macromolecules on cerebral GABA measurements using magnetic resonance spectroscopy[J].
Chinese J Magn Reson, 2016, 33(4): 618-626.
陈梅泞, 王前锋, 李改英, 等. 人脑GABA磁共振波谱测量中大分子影响的研究[J]. 波谱学杂志, 2016, 33(4): 618-626. |
| [15] | TERPSTRA M, UQURBIL K, GRUETTER R. Direct in vivo measurement of human cerebral GABA concentration using MEGA-editing at 7 Tesla[J]. Magn Reson Med, 2002, 47(5): 1009-1012. DOI: 10.1002/(ISSN)1522-2594. |
| [16] | MATSON G B. An integrated program for amplitude-modulated RF pulse generation and re-mapping with shaped gradients[J]. Magn Reson Imaging, 1994, 12(8): 1205-1225. DOI: 10.1016/0730-725X(94)90086-7. |
| [17] | BROWN M A. Time-domain combination of MR spectroscopy data acquired using phased-array coils[J]. Magn Reson Med, 2004, 52(5): 1207-1213. DOI: 10.1002/(ISSN)1522-2594. |
| [18] | DONG Z, PETERSON B. The rapid and automatic combination of proton MRSI data using multi-channel coils without water suppression[J]. Magn Reson Imaging, 2007, 25(8): 1148-1154. DOI: 10.1016/j.mri.2007.01.005. |
| [19] | EDDEN R A, PUTS N A, HARRIS A D, et al. Gannet:A batch-processing tool for the quantitative analysis of gamma-aminobutyric acid-edited MR spectroscopy spectra[J]. J Magn Reson Imaging, 2014, 40(6): 1445-1452. DOI: 10.1002/jmri.v40.6. |
 2018, Vol. 35
2018, Vol. 35 
