2. 中国科学院大学, 北京 100049
2. University of Chinese Academy of Sciences, Beijing 100049, China
胆碱是一种季铵盐小分子,胆碱及其衍生物广泛存在于人体当中,具有重要的生物功能[1].常见的胆碱衍生物有磷酸胆碱、甘油磷酸胆碱、磷脂酰胆碱、乙酰胆碱等.乙酰胆碱是一种重要的神经递质;磷脂酰胆碱是真核细胞细胞膜的主要成分之一,同时参与极低密度脂蛋白的合成,对于肝脏中甘油等的转化有重要意义[2].真核生物的磷脂酰胆碱由胆碱和甘油脂肪酸通过Kennedy途径合成[3],胆碱是磷脂酰胆碱等胆碱衍生物的合成底物,同时也是人体的必需营养物质.虽然人体可以通过磷脂酰乙醇胺甲基化的方式部分合成,但是仍需从食物中摄取大部分胆碱[4].有研究表明,饮食中胆碱缺乏会导致健康成年人发生不同程度的亚临床器官功能障碍[5].虽然胆碱衍生物在动物肝脏、牛奶等日常饮食中广泛存在,但哺乳期婴儿的食物摄入较为单一,补充饮食中的胆碱类物质对婴儿的正常发育非常重要[2],婴幼儿奶粉中经常有胆碱添加.所以,发展快速准确的胆碱类物质检测方法对于乳制品分析具有重要意义.
核磁共振(NMR)作为一种非侵入性的检测技术,非常适合对食品、血液、组织等复杂混合样品中的代谢物进行快速检测分析.核磁共振氢谱(1H NMR)灵敏度高,是最常见的磁共振检测技术,但由于这些复杂生物样品的1H NMR谱线较宽,且胆碱类物质信号与体内常见的葡萄糖、三甲基胺类等物质的谱峰重叠严重,因此,应用1H NMR对胆碱类物质的定性和定量较为困难.核磁共振磷谱(31P NMR)适用于磷酸化胆碱类物质的检测,已被运用于活体分析.但31P NMR谱的分辨率仍然有限,磷酸化胆碱类物质与磷酸单脂、磷酸二酯信号重叠、无法分辨[6].15N同位素标记后通过NMR技术检测胆碱具有灵敏度高的优点[7],但15N核天然丰度低,对天然产物进行同位素标记技术难度较大,且标记成本较高不利于广泛应用.
14N核的天然丰度高达99.6%,在固体NMR领域应用较多,但液体NMR领域应用较少.因为14N核自旋量子数(I=1),受四极相互作用影响,弛豫快、谱线宽.但是胆碱类物质的氮原子处在非常对称的化学环境下,四极相互作用减弱、弛豫速率变慢、谱线窄化[8].Mao等人[6, 7]通过1H-14N HSQC对牛奶中的胆碱衍生物进行了检测.虽然与氮相连的甲基(NCH3)的1H NMR信号较强,但与氧相连的亚甲基(OCH2)的1H NMR信号有更好的分辨率,因而被用来对肝脏组织中的胆碱衍生物进行定量分析[8].在1H-14N HSQC实验中,极化转移是通过长程J偶合来实现的,由于偶合常数较小,极化转移时间较长.在极化转移期间OCH2和NCH2基团质子的同核偶合以及弛豫效应会导致信号损失严重,影响实验的灵敏度.为了降低由质子同核偶合引起的信号损失,研究人员通过在HSQC序列INEPT极化转移期间加入两对形状脉冲,选择性地将NCH2基团质子的磁化矢量翻转,实现了极化转移期间质子的选择性同核去偶,进而达到了信号增强的目的[7].
由于胆碱及其衍生物分子的纵向弛豫时间较长(T1>1 s),通过常规手段进行二维1H-14N HSQC采样仍然需要较长的实验时间,检测效率较低.Schanda等人[9, 10]发展了基于翻转角优化的带宽选择瞬态异核多量子相干序列(SOFAST-HMQC).SOFAST-HMQC序列由一个角度可变的形状脉冲和一个180°形状脉冲,以及间接维的两个90°硬脉冲构成,脉冲少、操作简单,通过优化激发角度和选择性激发可以使目标磁化更快地恢复到纵向,因而能有效地减少实验的扫描间隔时间,提高实验效率.
本文中我们将SOFAST-HMQC技术应用于胆碱衍生物的选择性检测,通过1H-14N SOFAST-HMQC实验,对乳制品中不同的胆碱衍生物进行了检测分析.结果发现:在相同实验时间内,相比于1H-14N HSQC技术,1H-14N SOFAST-HMQC实现了显著的信号增强.
1 实验部分 1.1 实验试剂为了明确极化转移时间对不同类型实验的影响,我们首先利用人工配制的标准样品对相关实验参数进行了优化和对比分析,进而将其应用于常见的乳制品分析.
人工配制的标准样品由33 mmol/L的胆碱、磷酸胆碱、甘油磷酸胆碱组成,溶剂为10%的D2O和90%的H2O.氯化胆碱分子量为139.62;磷酸胆碱氯化钙盐四水化合物分子量为329.73;甘油磷酰胆碱氯化镉加成物分子量为440.54;均购自西格玛奥德里奇公司.D2O纯度为99.9%,购自Cambridge Isotope Laboratories公司.
乳制品均来自正规超市,分别为:1号样品,国产某品牌纯牛奶;2号样品,进口某品牌全脂牛奶;3号样品,进口某品牌脱脂牛奶;4号样品,进口某品牌婴儿奶粉,称取1 g奶粉溶于5 mL超纯水配制成溶液;5号样品,进口某品牌全脂奶粉,称取1 g奶粉溶于5 mL超纯水配制成溶液;6号样品为进口某品牌全脂奶粉,称取5 g奶粉溶于35 mL超纯水.以上样品溶液均取450 mL至5 mm NMR样品管,并加入50 μL氘代率为99.9%的D2O.
1.2 NMR实验所有实验均在Bruker 600M AVANCE Ⅲ NMR谱仪上完成,配备Bruker反式宽带探头(BBI),对应质子共振频率为600.13 MHz,14N核共振频率为43.35 MHz,实验温度303 K.
标准样品的2D 1H-14N异核相关谱实验参数:F2(1H)维谱宽为6 009.62 Hz,频率偏置为2 824.20 Hz.F1(14N)维谱宽为173.412 Hz,频率偏置为182.08 Hz.空扫次数为16,累加次数为64,采样点数为t2×t1=2 048×12,采样时间为170 ms,极化转移时间优化实验的扫描间隔时间为1 s,扫描间隔时间优化实验的极化转移时间为77 ms,采样期间,间接维去偶脉冲为Waltz16[11].
乳制品样品1D 1H NMR谱采用WATERGATE-W5序列[12],谱宽为12 019.230 Hz,频率偏置为2 826.61 Hz,采样点数为32 k,空扫次数为4,累加次数为8,等待时间为1 s,W5脉冲串时间间隔为179 μs.2D 1H-14N异核相关谱极化转移时间为77 ms,扫描间隔时间为0.3 s,F1(14N)维谱宽为65.029 Hz,其他参数与标准样品相同.
1H-14N HSQC脉冲序列来自Mao等人[7]文献,脉冲序列如图 1(a)所示,选择脉冲形状为SEDUCE[13, 14],脉宽为5 ms,激发中心为2 130.46 Hz,对应于NCH2基团质子的共振频率,以实现极化转移期间选择性质子去偶.相应实验中用于异核相干选择的脉冲梯度形状为SINE,时间为1 ms,强度分别为4×10-3 T/cm和2.97×10-4 T/cm.

|
图 1 (a)1H-14N HSQC与(b)1H-14N SOFAST-HMQC脉冲序列示意图, 脉冲默认相位为x. 1H-14N HSQC序列相位循环为φ1 (x, -x), φ2 (x, x, x, x, -x, -x, -x, -x), φR (x, -x, x, -x, -x, x, -x, x); 1H-14N SOFAST-HMQC序列相位循环为φ1(x, -x), φ2 (x, x, -x, -x), φR (x, -x, -x, x) Figure 1 Pulse sequence of 1H-14N HSQC (a) and 1H-14N SOFAST-HMQC (b), the default phase is x. The phase cycling of 1H-14N HSQC is φ1 (x, -x), φ2 (x, x, x, x, -x, -x, -x, -x), φR (x, -x, x, -x, -x, x, -x, x); the phase cycling of 1H-14N SOFAST-HMQC is φ1 (x, -x), φ2 (x, x, -x, -x), φR (x, -x, -x, x) |
1H-14N SOFAST-HMQC脉冲序列参考Schanda等人[9, 10]文献,脉冲序列如图 1(b)所示,用于选择性激发OCH2基团质子的选择性脉冲形状为PC9[15],翻转角为120°,180°选择性脉冲形状为REBURP[16],激发中心均为2 494.13 Hz,对应于OCH2基团质子的共振频率.120°和180°形状脉冲脉宽分别为30 ms和20 ms,相应实验中脉冲梯度的形状为SMSQ,时间为1 ms,强度分别为5.5×10-4 T/cm和3.5×10-4 T/cm(该脉冲梯度不涉及相干选择).
数据处理:所有NMR谱图通过Bruker Topspin V3.5软件处理,标准样品2D 1H-14N异核相关谱变换点数为2 048和64;牛奶和奶粉样品1D 1H NMR谱变换点数为64 k,2D 1H-14N异核相关谱变换点数为8 192和64.1H-14N二维异核相关谱的相对信号强度由谱中各组分信号最强位置提取的一维谱积分得到,系列实验中积分面积最大的值被定义为1.
数据拟合通过Origin 2015软件进行,极化转移时间优化通过(1)式拟合[6, 7]:
| $ M = {M_{\rm{0}}}^*{\left[ {\sin (2{\rm{ \mathsf{ π} }}{}^{\rm{3}}{J_{{\rm{HN}}}}\mathit{\Delta})^*\exp ( - \frac{\mathit{\Delta} }{{{T_2}}})} \right]^2} $ | (1) |
M为信号强度,M0是质子横向弛豫时间(T2)为无穷大且完全极化转移时的磁化强度,Δ为极化转移时间,3JHN为1H-14N三键偶合常数.
| $ {M_{{\rm{pt}}}} = \frac{{{M_0}^*\sin \beta ^*[1 - \exp ( - \frac{{A + {t_{{\rm{rec}}}}}}{{{T_1}}})]}}{{[1 - \cos \beta ^*\exp ( - \frac{{A + {t_{{\rm{rec}}}}}}{{{T_1}}})]^*n^*{T_{{\rm{scan}}}}}} $ | (2) |
Mpt为单位时间的信号积分强度,M0为热平衡时的磁化强度,T1为纵向弛豫时间,trec为扫描间隔时间,A为采样时间(170 ms).β为翻转角(180°+激发角度),在1H-14N SOFAST-HMQC实验中为60°,1H-14N HSQC实验中为90°.Tscan为序列的总时间(包括扫描间隔时间、极化转移时间、直接维采样时间,间接维平均采样时间),n为累加次数.
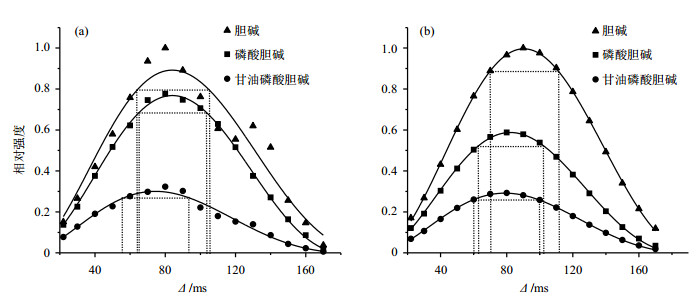
2 结果与讨论 2.1 极化转移时间的选择目标信号OCH2基团质子与14N核之间的3JNH偶合只有2.54~2.76 Hz,与1H-1H同核偶合常数接近,其异核检测极化转移时间通常长达数十毫秒,相关极化转移效率受弛豫和同核偶合影响较大.因此在1H-14N异核相关实验中,极化转移时间的准确设置对信号强度有较大影响[7].为了实现相关物质的高灵敏检测,我们首先对极化转移时间进行了优化对比分析.实验所用样品为人工配制的标准样品.结果如图 2所示,图 2(a)为1H-14N HSQC实验,图 2(b)为1H-14N SOFAST-HMQC实验.纵坐标为各组分在不同极化转移时间的相对信号强度,横坐标为极化转移时间Δ.三角形、方形、圆形分别为胆碱(choline)、磷酸胆碱(phosphocholine)、甘油磷酸胆碱(glycerophosphocholine),实线为根据(1)式拟合的曲线.拟合得到1H-14N SOFAST-HMQC和1H-14N HSQC实验中各组分的最优极化转移时间如表 1所示,不同物质的最佳极化转移时间虽然有所不同,但是在极化转移时间为70~90 ms范围内,所有与信号均可获得较高的强度;而且在此范围内,信号强度差异小且均大于最高强度的90%,如图 2虚线所示.因此,后续1H-14N SOFAST-HMQC和1H-14N HSQC对比实验中,我们选择77 ms作为标准极化转移时间,以保证所有物质都能够高灵敏检测.
|
图 2 极化转移时间优化实验结果. (a) 1H-14N HSQC; (b) 1H-14N SOFAST-HMQC Figure 2 Optimization of transfer delay. (a) 1H-14N HSQC; (b) 1H-14N SOFAST-HMQC |
| 表 1 1H-14N HSQC与1H-14N SOFAST-HMQC实验最优极化转移时间(Δ) Table 1 Optimized transfer delay (Δ) for 1H-14N HSQC and 1H-14N SOFAST-HMQC experiments |
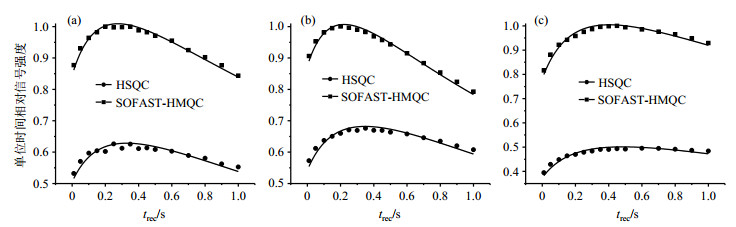
扫描间隔时间占据了实验总时间的较大部分,长的扫描间隔时间有助于信号的完全恢复,但是所需实验时间增加;短的扫描间隔时间能够有效缩短扫描时间,但是信号恢复有限.因此要获得较好的单位时间实验效率,就需要对扫描间隔时间进行对比分析.我们用标准样品在相同条件下对1H-14N SOFAST-HMQC和1H-14N HSQC两种实验的单位时间信号强度随扫描间隔时间的变化进行了分析比较,结果如图 3所示.纵坐标为各组分的单位实验时间相对信号强度,横坐标为不同的扫描间隔时间(trec),圆点和方块分别为1H-14N HSQC和1H-14N SOFAST-HMQC,实线为根据(2)式拟合的曲线.拟合得到的1H-14N SOFAST-HMQC和1H-14N HSQC实验中各组分的最优扫描间隔时间如表 2所示.结果显示:同一种胆碱衍生物,在不同实验中,单位实验时间相对信号强度最高点对应的trec值接近;不同胆碱衍生物的最优扫描间隔时间差别较大,主要原因为不同物质的T1差别较大.在扫描间隔时间在0.20~0.40 s范围内,单位时间的信号强度差异较小且均大于最高强度的94%以上,都可以获得较好的实验效果.在后续的实验中,为实现3种衍生物较为均匀的高效激发,我们选择0.30 s作为实验的标准扫描间隔时间.
|
图 3 扫描间隔时间优化结果. (a)甘油磷酸胆碱; (b)磷酸胆碱; (c)胆碱 Figure 3 Optimization of prescan delay. (a) Glycerophosphocholine; (b) Phosphocholine; (c) Choline |
| 表 2 1H-14N HSQC与1H-14N SOFAST-HMQC实验最优扫描间隔时间(trec) Table 2 Optimized prescan delay (trec) for 1H-14N HSQC and 1H-14N SOFAST-HMQC experiments |
配制的胆碱及其衍生物标准样品的1H-14N SOFAST-HMQC和1H-14N HSQC实验检测结果如图 4所示.图 4(a)和4(b)分别为1H-14N SOFAST-HMQC实验与1H-14N HSQC实验的二维谱投影.在相同实验参数条件下,在扫描间隔时间为0.30 s,极化转移时间为77 ms时,1H-14N SOFAST-HMQC实验的各组分信号强度分别是1H-14N HSQC实验的2.05倍(胆碱)、1.47倍(磷酸胆碱)和1.76倍(甘油磷酸胆碱),说明在较短的扫描间隔时间,1H-14N SOFAST-HMQC有更高的实验效率.

|
图 4 标准样品的(a) 1H-14N SOFAST-HMQC实验与(b) 1H-14N HSQC实验在1H维的投影对比 Figure 4 Proton slices of 1H-14N SOFAST-HMQC (a) and 1H-14N HSQC (b) for standard sample |
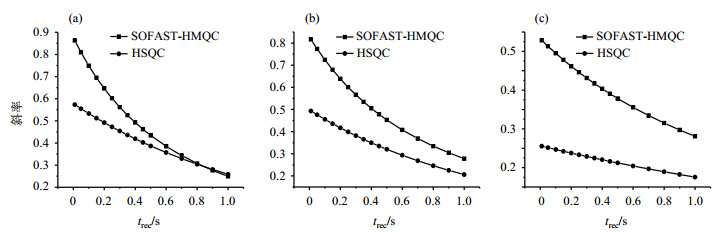
1H-14N SOFAST-HMQC实验可以在较短的扫描间隔时间内实现更强的纵向磁化恢复,因而有更高的实验效率[9, 10].为了进一步明确在不同扫描间隔时两种实验的差异,我们进一步对3种胆碱衍生物在不同扫描间隔时间的相对信号积分强度进行了分析(图 5).图 5(a)、(b)、(c)分别为甘油磷酸胆碱、磷酸胆碱、胆碱,方块和圆点分别为1H-14N SOFAST-HMQC实验和1H-14N HSQC实验,纵坐标为各组分在不同扫描间隔时间的相对信号强度,横坐标为扫描间隔时间trec.从图中可以看出:在0~5 s的大范围扫描间隔时间内,1H-14N SOFAST-HMQC实验的信号强度均高于1H-14N HSQC实验的结果.如图中虚线所示,要获得常见扫描间隔时间1 s条件下1H-14N HSQC实验同等信号强度(实验时间为1 077 s),1H-14N SOFAST-HMQC实验中可采用低于0.5 s的扫描间隔时间(实验时间为674 s).因此通过1H-14N SOFAST-HMQC实验进行检测可以大幅节约实验时间.

|
图 5 标准样品1H-14N HSQC与1H-14N SOFAST-HMQC实验相对信号强度随扫描间隔时间的变化.(a)甘油磷酸胆碱; (b)磷酸胆碱; (c)胆碱 Figure 5 Relative integral intensity varies with prescan delay of 1H-14N HSQC and 1H-14N SOFAST-HMQC for standard sample. (a) Glycerophosphocholine; (b) Phosphocholine; (c) Choline |
信号强度与扫描间隔时间的关系可以通过(3)式表示[17]:
| $ M = \frac{{{M_0}^*\sin \beta ^*[1 - \exp ( - \frac{{A + {t_{{\rm{rec}}}}}}{{{T_1}}})]}}{{1 - \cos \beta ^*\exp ( - \frac{{A + {t_{{\rm{rec}}}}}}{{{T_1}}})}} $ | (3) |
M为信号强度,M0为热平衡时的磁化强度,T1为纵向弛豫时间,trec为扫描间隔时间,A为采样时间,β为翻转角(180°+激发角度),在1H-14N SOFAST-HMQC实验中为60°,1H-14N HSQC实验中为90°.通过(3)式对实验数据进行拟合得到的T1如表 3所示.
| 表 3 1H-14N SOFAST-HMQC与1H-14N HSQC实验的拟合T1 Table 3 Fitting results of T1 from1H-14N HSQC and 1H-14N SOFAST-HMQC experiments |
为进一步确认1H-14N SOFAST-HMQC实验与1H-14NHSQC实验的纵向弛豫恢复速率,对信号强度与扫描间隔时间的函数进行求导可得到公式(4):
| $ \frac{{{\rm{d}}M}}{{{\rm{d}}{t_{{\rm{rec}}}}}} = \frac{{{M_0}^*\sin \beta ^*(1 - \cos \beta )^*[1 - \exp ( - \frac{{A + {t_{{\rm{rec}}}}}}{{{T_1}}})]}}{{{{[1 - \cos \beta ^*\exp ( - \frac{{A + {t_{{\rm{rec}}}}}}{{{T_1}}})]}^2}}} $ | (4) |
将前文拟合结果带入(4)式,模拟结果如图 6所示.从图中可以看出在扫描间隔时间小于0.8 s的情况下,1H-14N SOFAST-HMQC实验纵向磁化矢量恢复速率均高于1H-14N HSQC实验,因此在较短的扫描间隔时间下,1H-14N SOFAST-HMQC脉冲序列有更高的实验效率.
|
图 6 磁化强度随扫描间隔时间变化的导函数模拟曲线.(a)甘油磷酸胆碱; (b)磷酸胆碱; (c)胆碱 Figure 6 Magnetization intensity varies with prescan delay. (a) Glycerophosphocholine; (b) Phosphocholine; (c) Choline |
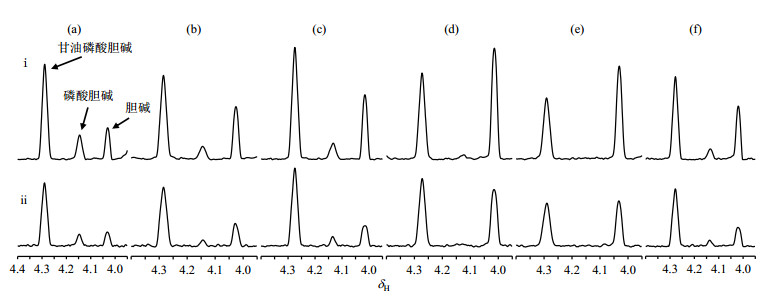
1H-14N异核相关实验具有选择性高的特点,适合于检测复杂生物体系中的胆碱衍生物.我们选取来源不同的6个牛奶和奶粉溶液,对1H-14N SOFAST-HMQC和1H-14N HSQC实验的检测效果进行了进一步对比分析.图 7为牛奶和奶粉溶液样品的2D 1H-14N SOFAST-HMQC谱及其对应的1D 1H NMR谱,14N维化学位移通过液氨进行了定标,图 7(a)~(f)分别为1~6号样品.从图中可以看出在1D 1H NMR谱中,胆碱及其衍生物的信号被背景宽的信号所掩蔽,难以完全分辨.而在相应1H-14N SOFAST-HMQC二维谱中,胆碱及其衍生物得到了选择性检测,且具有很高的分辨率,不同种类的胆碱衍生物可以被完全识别区分,信号归属如图 7(a)所示.

|
图 7 牛奶和奶粉溶液样品2D 1H-14N SOFAST-HMQC谱及其对应的1D 1H NMR谱. (a)~(f)分别为1~6号样品.信号归属如图(a)中所示 Figure 7 2D 1H-14N SOFAST-HMQC and 1D 1H NMR spectra of the dairy products. (a)~(f) represent sample 1~6, respectively. Signal assignment is shown in Fig. (a) |
图 8为在相同实验参数下1H-14N SOFAST-HMQC实验与1H-14N HSQC实验的投影,(ⅰ)为1H-14N SOFAST-HMQC实验、(ⅱ)为1H-14N HSQC实验,(a)~(f)分别为1~6号样品.我们根据标准样品中胆碱衍生物的化学位移对奶粉样品中的信号进行了归属,从右到左依次为胆碱(δH 4.02)、磷酸胆碱(δH 4.13)、甘油磷酸胆碱(δH 4.27).1H-14N SOFAST-HMQC实验中胆碱及其衍生物的信号强度分别为1H-14N HSQC实验的1.32~3.00倍,详细结果如表 4所示.结果表明在复杂混合体系中,1H-14N SOFAST-HMQC依然能够有效提高相应实验的效率.从谱中还可以发现,奶粉溶液样品(d)、(e)、(f)与牛奶样品(a)、(b)、(c)相比磷酸胆碱相对含量较低,而胆碱含量比例却有所升高,可能由于奶粉中有胆碱作为添加剂;部分脱脂牛奶样品(c)的胆碱衍生物含量总体略高于全脂牛奶样品(b).
|
图 8 牛奶和奶粉溶液样品(ⅰ) 1H-14N SOFAST-HMQC与(ⅱ) 1H-14N HSQC实验信号积分对比.(a)~(f)分别为1~6号样品,信号归属如图(a)所示 Figure 8 Integral intensity comparison of 1H-14N SOFAST-HMQC (ⅰ) and 1H-14N HSQC (ⅱ) of the dairy products. (a)~(f) represent sample 1~6, respectively. Signal assignment is shown in Fig. (a) |
| 表 4 1H-14N SOFAST-HMQC与1H-14N HSQC实验相比信号强度倍数 Table 4 Signal intensity multiple of 1H-14N SOFAST-HMQC as compared to 1H-14N HSQC experiment |
本文中我们通过引入1H-14N SOFAST-HMQC实验来提高乳制品中的胆碱衍生物的检测效率.结果发现,无论是对于配制的标准样品还是不同类型的乳制品,在相同实验条件下,1H-14N SOFAST-HMQC实验相比于1H-14N HSQC实验可实现约1.5~2.0倍的信号增强.通过实验数据与理论模拟分析,确认效率提高主要是由于1H-14N SOFAST-HMQC的表观纵向弛豫恢复速率更高,在扫描间隔时间较短的条件下实现更快速地胆碱衍生物的检测.我们的应用分析还发现奶粉溶液样品与牛奶样品相比磷酸胆碱的相对含量明显较低,而胆碱的相对含量较高,可能是由于奶粉中有胆碱作为添加剂所引起.
| [1] | BLUSZTAJN J K. Choline, a vital amine[J]. Science, 1998, 281(5378): 794-795. DOI: 10.1126/science.281.5378.794. |
| [2] | ILCOL Y O, OZBEK R, HAMURTEKIN E, et al. Choline status in newborns, infants, children, breast-feeding women, breast-fed infants and human breast milk[J]. J Nutr Biochem, 2005, 16(8): 489-499. DOI: 10.1016/j.jnutbio.2005.01.011. |
| [3] | ARTEGOITIA V M, MIDDLETON J L, HARTE F M, et al. Choline and choline metabolite patterns and associations in blood and milk during lactation in dairy cows[J]. PloS one, 2014, 9(8): 103412. DOI: 10.1371/journal.pone.0103412. |
| [4] | FISCHER L M, DACOSTA K A, KWOCK L, et al. Sex and menopausal status influence human dietary requirements for the nutrient choline[J]. Am J Clin Nutr, 2007, 85(5): 1275-1285. DOI: 10.1093/ajcn/85.5.1275. |
| [5] | GLUNDE K, BHUJWALLA Z M, RONEN S M. Choline metabolism in malignant transformation[J]. Nat Rev Cancer, 2011, 11(12): 835-848. DOI: 10.1038/nrc3162. |
| [6] | MAO J Z, JIANG L, JIANG B, et al. A selective NMR method for detecting choline containing compounds in liver tissue:The 1H-14N HSQC experiment[J]. J Am Chem Soc, 2010, 132(49): 17349-17351. DOI: 10.1021/ja107745g. |
| [7] | MAO X A, LI N, MAO J Z, et al. Fast detection of choline-containing metabolites in liver using 2D 1H-14N three-bond correlation (HN3BC) spectroscopy[J]. J Magn Reson, 2012, 214(1): 352-359. |
| [8] | MAO J Z, JIANG L, JIANG B, et al. 1H-14N HSQC detection of choline-containing compounds in solutions[J]. J Magn Reson, 2010, 206(1): 157-160. DOI: 10.1016/j.jmr.2010.06.003. |
| [9] | SCHANDA P, BRUTSCHER B. Very fast two-dimensional NMR spectroscopy for real-time investigation of dynamic events in proteins on the time scale of second[J]. J Am Chem Soc, 2005, 127(22): 8014-8015. DOI: 10.1021/ja051306e. |
| [10] | SCHANDA P, KUPCE E, BRUTSCHER B. SOFAST-HMQC experiments for recording two-dimensional heteronuclear correlation spectra of proteins within a few seconds[J]. J Biomol NMR, 2005, 33(4): 199-211. DOI: 10.1007/s10858-005-4425-x. |
| [11] | SHAKA A J, KEELER J, FREEMAN R. Evaluation of a new broadband decoupling sequence:WALTZ-16[J]. J Magn Reson, 1983, 53(2): 313-340. |
| [12] | LIU M L, MAO X A, YE C H, et al. Improved WATERGATE pulse sequences for solvent suppression in NMR spectroscopy[J]. J Magn Reson, 1998, 132(1): 125-129. DOI: 10.1006/jmre.1998.1405. |
| [13] | EMSLEY L, BODENHAUSEN G. Optimization of shaped selective pulses for NMR using a quaternion description of their overall propagators[J]. J Magn Reson, 1992, 97(1): 135-148. |
| [14] | MCCOY M A, MUELLER L. Selective shaped pulse decoupling in NMR:homonuclear[carbon-13] carbonyl decoupling[J]. J Am Chem Soc, 1992, 114(6): 2108-2112. DOI: 10.1021/ja00032a026. |
| [15] | GEEN H, FREEMAN R. Band-selective radiofrequency pulses[J]. J Magn Reson, 1991, 93(1): 93-141. |
| [16] | KUPCE E, FREEMAN R. Wideband excitation with polychromatic pulses[J]. J Magn Reson, 1994, 108(2): 268-273. DOI: 10.1006/jmra.1994.1123. |
| [17] | ERNST R R, BODENHAUSEN G, VERKOEYEN A著, 毛希安译. 一维和二维核磁共振原理[M]. 北京: 科学出版社, 1997. |
 2018, Vol. 35
2018, Vol. 35 
