药品的安全性、药物的效能及不良反应等与药物及药物杂质的结构都密不可分.药物及药物杂质结构的确定对其合成机理、合成工艺、规避副反应、药性、副作用等一系列相关研究的重要性不言自明[1].核磁共振(NMR)技术在有机化合物结构分析鉴定中具有不可替代的重要位置,化学位移、峰型、峰面积、偶合常数、氢-氢(1H-1H)和碳-氢(1H-13C)二维相关谱可提供药物及药物杂质构象等有效信息,对于关联、理解、解释药物及药物杂质的药物活性及副作用大有帮助[2, 3].药物分子通常化学结构较为复杂,化学位移较为相近,同时构象也会对化学位移产生不同程度的影响.因而,要做到对药物化合物1H和13C NMR数据的详尽归属,不仅需要1D NMR谱图,也需要2D NMR数据[4-7].
二氢苯并呋喃的衍生物和5-H4受体拮抗剂——普卡必利(prucalopride),又名4-氨基-5-氯-2, 3-二氢-N-[1-(3-甲氧基丙基)-4-哌啶基]-7-苯并呋喃甲酰胺[8, 9],能够显著改善肠道运转.普卡必利作为治疗慢性便秘药物,于2009年在欧盟获批上市[10, 11].目前,关于普卡必利的合成及药理研究报道[12-17]较多;多数文献只将其1H和13C NMR数据进行罗列,或者对其特征信号峰进行标注[18-22],并没有对其1H和13C NMR信号进行详尽归属.本文首先以4-氨基-5-氯-2, 3-二氢苯并呋喃-7-羧酸和1-(3-甲氧基丙基)-4-哌啶胺为原料,通过酰胺缩合反应合成了普卡必利;然后应用超高效液相色谱-串联质谱(UPLC-MS/MS)和液相色谱-高分辨质谱(LC-HRMS)对其元素组成进行了确认;继而利用液体1D和2D NMR谱(包括1H NMR、13C NMR、DEPT135、DEPT90、1H-1H COSY、1H-13C HSQC和1H-13C HMBC),对普卡必利的1H和13C NMR信号进行了详尽的归属,确定了其结构.
1 实验部分 1.1 仪器与试剂UPLC-MS/MS测试是在QTRAP 5500型串联四极杆质谱系统上完成的. LC-HRMS在H-Class/Xevo G2-S QTof型超高效液相色谱/四极杆飞行时间串联质谱仪上进行测试. 1H NMR、13C NMR、DEPT、1H-1H COSY、1H-13C HSQC和1H-13C HMBC谱图均在Bruker Avance Ⅲ-400型超导NMR谱仪测定,使用PABBO-5 mm多核宽带探头.
普卡必利经改进文献[20]和[22]方法合成,4-氨基-5-氯-2, 3-二氢苯并呋喃-7-羧酸、1-(3-甲氧基丙基)-4-哌啶胺和N, N'-羰基二咪唑及四氢呋喃等试剂均购于Sigma-Aldrich公司.直径5 mm的NMR样品管(ST-500,NORELL)、CDCl3(99.8%氘代)、D2O(99.8%氘代)和DMSO-d6(99.8%氘代)均购于青岛腾龙微波科技有限公司.
1.2 实验条件NMR测试温度为(293.0±0.1)℃,分别使用CDCl3、D2O和DMSO-d6为溶剂,以四甲基硅烷(TMS)为内标. 1H NMR和13C NMR的工作频率分别为400.13和100.76 MHz. 1H NMR的谱宽为9.18 kHz,采样点数为32 768,90˚脉冲宽度为11 μs,弛豫延迟为1.2 s;13C NMR的谱宽为25 kHz,采样点数为16 384,90˚脉冲宽度为8.8 μs,弛豫延迟为1.2 s. DEPT135、DEPT90采用仪器自带的标准脉冲序列,谱宽为16 129.0 Hz,采样累加次数为256. 1H-1H COSY、1H-13C HSQC及1H-13C HMBC谱的采集均采用标准脉冲程序,采用反向检测探头. 1H-1H COSY的F2(1H)和F1(1H)维的谱宽均为6 009.61 Hz,采样数据点阵t2×t1=2 048×256,每个t1增量累加2次,弛豫延迟为1.0 s;HSQC的F2(1H)和F1(13C)维的谱宽分别为6 398.86 Hz和22 136.58 Hz,采样数据点阵t2×t1=2 048×256,d2=1/(2JCH)=3.45 ms(JCH为一键碳-氢偶合常数),每个t1增量累加2次,弛豫延迟为1.2 s;HMBC的F2(1H)和F1(13C)维的谱宽分别为6 393.86 Hz和22 138.80 Hz,采样数据点阵t2×t1=4 096×256,d6=1/(2nJCH)=62.5 ms(nJCH为远程碳-氢偶合常数),每个t1增量累加12次,弛豫延迟为1.2 s.
2 结果与讨论 2.1 普卡必利的合成[20, 22]改进参考文献方法,室温下,氮气保护,向250 mL三口烧瓶中加入4-氨基-5-氯-2, 3-二氢苯并呋喃-7-羧酸(2.0 g,9.36 mmol),经过三次抽真空和置换氮气,再注入30 mL现蒸的干燥四氢呋喃(THF),搅拌0.5 h,加入N, N'-羰基二咪唑(2.0 g,12.17 mmol),继续搅拌反应0.5 h.滴加1-(3-甲氧基丙基)-4-哌啶胺(2.08 g,12.16 mmol)的THF溶液(20 mL),用50 ℃水浴加热反应5.0 h.真空蒸去有机溶剂,加入50 mL蒸馏水,室温下搅拌1.0 h,过滤,滤饼用蒸馏水洗(3×20 mL),真空干燥至恒重,得2.9 g白色固体普卡必利,产率为82%,熔点(mp.)为90~92 ℃.
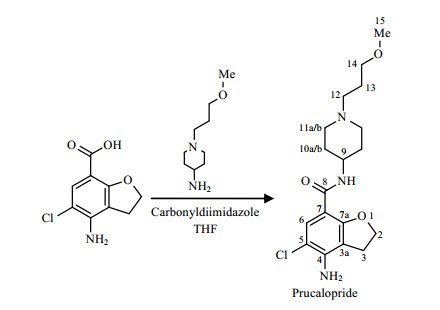
2.2 普卡必利的质谱分析在正离子检测模式下,经UPLC分离和电喷雾离子源电离后的普卡必利MS/MS质谱图显示检测得到质荷比(m/z)为367.99的离子峰[图 2(a)],推测其为[M+H]+;同时得到m/z=195.89的主要碎片峰,根据普卡必利化合物结构中存在酰胺键,相对其它化学键,酰胺键作用力比较弱,在高温和水存在时均容易断裂,推测其为4-氨基-5-氯-2, 3-二氢苯并呋喃-7-羰基正离子.普卡必利的HRMS谱图[图 2(b)]显示在正离子检测模式下得到m/z=368.173 8的离子峰,推测其为[M+H]+,与普卡必利(分子式为C18H26ClN3O3)的理论分子量367.874 0一致.
|
图 1 普卡必利的化学合成 Figure 1 Synthesis of prucalopride |
|
图 2 普卡必利的(a)超高效液相色谱-串联质谱和(b)液相色谱-高分辨质谱 Figure 2 UPLC-MS/MS (a) and LC-HRMS (b) spectra of prucalopride |
化合物普卡必利结构中存在两种活泼氢,为了判断酰胺NH和芳环上NH2两种活泼氢的信号峰.首先以CDCl3和DMSO-d6为溶剂分别进行1H NMR测试(图 3),同时对DMSO-d6为溶剂的1H NMR进行重水交换实验.当以CDCl3为溶剂时,通过分析信号峰的化学位移、峰型及其对应的积分面积,推测δH 7.29(1H, s)和δH 4.28(2H, s)分别为酰胺NH和芳环上的NH2.在DMSO-d6为溶剂的1H NMR谱图中,推测δH 5.88(2H, s)和δH 7.30(1H, d, J=8.0 Hz)分别对应芳环上NH2和酰胺NH;当向DMSO-d6为溶剂样品中加入D2O后,δH 5.88(2H, s)处NH2的信号基本消失,同时酰胺NH的化学位移往低场移动,出现在δH 7.39(1H, d, J=8.0 Hz).上述结果也说明在不同氘代溶剂中,活泼氢的化学位移具有不确定性(图 3),在接下来文中所述的化学位移均以CDCl3为溶剂测试所得,包括所有二维谱.

|
图 3 普卡必利在CDCl3、DMSO-d6和DMSO-d6+D2O中的1H NMR谱 Figure 3 1H NMR spectra of prucalopride in CDCl3, DMSO-d6 and DMSO-d6+D2O |
根据化学位移、积分面积和谱峰裂分情况,δH 3.33(3H, s)归属为H-15;H-9与酰胺氮原子相连,受到去屏蔽效应的作用,其化学位移向低场移动,δH 3.99(1H, m)归属为H-9;由于2, 3-二氢苯并呋喃环的存在,呋喃环上OCH2(H-2)化学位移应向低场移动,即δH 4.76(2H, t, J=8.8 Hz)归属为H-2,与文献[13, 18, 22]相符;由于氯原子的吸电子效应,苯环H-6的化学位移值向低场移动,δH 7.84(1H, s)归属为苯环H-6.
由普卡必利13C NMR和DEPT谱(图 4),可确定它含1个伯碳(δC 58.6)、7个仲碳(δC 27.1、27.3、33.2、52.4、55.5、71.2、72.8)、2个叔碳(δC 46.2、130.0)和6个季碳(δC 107.5、110.8、112.0、142.8、157.2、163.1).结构复杂时需借助HSQC和HMBC谱进行归属[23],在此亦然.
|
图 4 普卡必利的13C NMR和DEPT谱(CDCl3) Figure 4 13C NMR and DEPT spectra of prucalopride (CDCl3) |
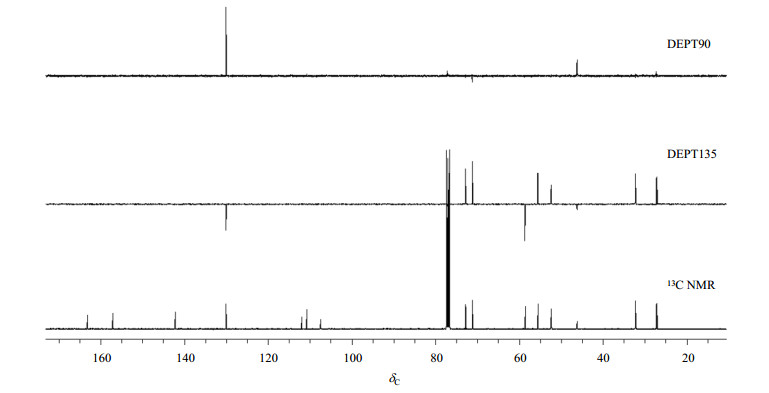
所有2D NMR谱均以CDCl3为溶剂测试所得.从普卡必利的1H-1H COSY谱(图 5)得知,δH 3.05(2H, t, J=8.8 Hz)与H-2存在交叉峰,归属为H-3.由于分子内刚性哌啶环结构的存在,导致H-10a与H-10b、H-11a与H-11b质子不等价,δH 1.57(2H, m)和δH 1.99(2H, m)与H-9在COSY谱中存在交叉峰,归属为H-10a和H-10b. δH 2.16(2H, t, J=11.2 Hz)和δH 2.83(2H, d, J=10.8 Hz)与H-10存在交叉峰,归属为H-11a和H-11b.通过上述解析,对普卡必利质子的化学位移进行了部分归属,尚余H-12、H-13和H-14未归属,要借助HMBC谱.
|
图 5 普卡必利的1H-1H COSY NMR谱(CDCl3) Figure 5 1H-1H COSY NMR spectrum of prucalopride (CDCl3) |
由普卡必利的HSQC谱(图 6)可以看到δC 72.8与H-2相关,归属为C-2;δC 27.1与H-3相关,归属为C-3;δC 130.0与H-6相关,归属为C-6;δC 46.2与H-9相关,归属为C-9;δC 33.2与H-10a、H-10b均有相关,归属为C-10;δC 52.4与H-11a、H-11b均有相关,归属为C-11;δC 58.6与H-15相关,归属为C-15.余下3个仲碳(δC 27.3、55.5、71.2)和6个季碳(δC 107.5、110.8、112.0、142.8、157.2、163.1)未归属,还需要借助于HMBC谱.
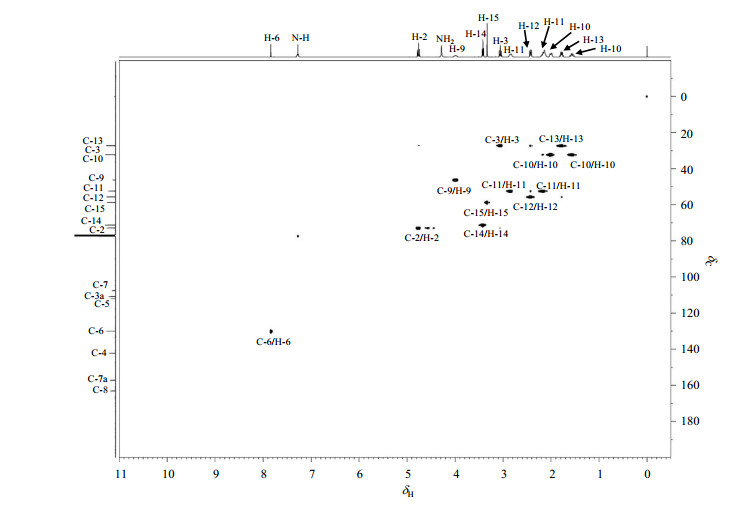
|
图 6 普卡必利的1H-13C HSQC谱(CDCl3) Figure 6 1H-13C HSQC spectrum of prucalopride (CDCl3) |
普卡必利的1H-13C HMBC谱(图 7)中,δC 110.8与H-2、H-3和NH2均有交叉峰,归属为C-3a;δC 142.8与H-6和H-3均有交叉峰,归属为C-4;δC 112.0与H-6和NH2均有交叉峰,归属为C-5,δC 107.5处信号峰与H-6相关,归属为C-7;δC 157.2处信号峰与H-2,H-3和H-6相关,归属为C-7a;而C-8是羰基碳,是体系中所有化学位移最低场的,因此δC 163.1归属为C-8.
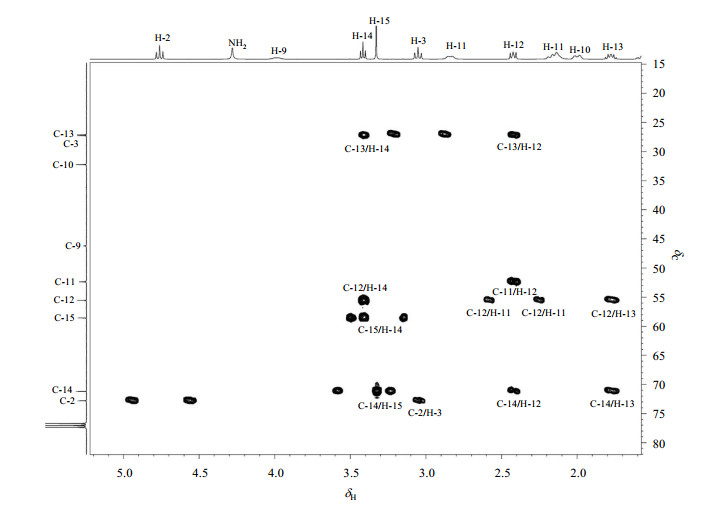
|
图 7 普卡必利的1H-13C HMBC局部放大谱(CDCl3) Figure 7 Partial enlarged 1H-13C HMBC spectrum of prucalopride (CDCl3) |
HMBC谱上C-15仅与δH 3.42(2H, t, J=6.4 Hz)存在交叉峰,因此将δH 3.42(2H, t, J=6.4 Hz)归属为H-14,HSQC谱上δC 71.2与H-14相关,归属为C-14;C-14与H-12和H-13均存在交叉峰,C-12直接与氮原子相连,受到去屏蔽效应的作用,与C-13相比化学位移处于低场,同时,C-12与H-11、H-13和H-14均存在交叉峰,因此将δH 2.42(2H, t, J=7.2 Hz)归属为H-12,δH 1.78(2H, m)归属为H-13.从HSQC谱上可以看出,δC 27.3与H-13相关,归属为C-13;δC 55.5与H-12相关,归属为C-12;再看COSY谱,H-13与H-12和H-14均存在交叉峰,H-14与H-13存在交叉峰,H-12与H-13存在交叉峰,进一步验证了上述归属的正确性.
通过对普卡必利的1H NMR、13C NMR、DEPT135、DEPT90、1H-1H COSY、1H-13C HSQC和1H-13C HMBC谱的分析,并且结合文献[13, 18, 22],对普卡必利的已见报道但未进行分析归属的1H NMR和13C NMR信号进行了全部指认归属,结果见表 1.
| 表 1 普卡必利的1H NMR和13C NMR归属(CDCl3) Table 1 The 1H NMR and 13C NMR assignment of prucalopride (CDCl3) |
首先改进文献方法合成了普卡必利,然后综合运用UPLC-MS/MS和LC-HRMS对普卡必利进行了元素组成分析,进而运用液体1D和2D NMR技术,特别是1H-13C HMBC谱有效的呈现了碳-氢远程偶合的信息,揭示了不同的屏蔽效应,对普卡必利的1H和13C NMR信号进行了分析和准确的归属,确定了其结构.本工作对苯并呋喃衍生物及相关下游药物合成工艺的进一步优化,以及相关衍生药物的研究具有参考价值.
| [1] | ROY A J. Pharmaceutical impurities-A mini-review[J]. AAPs PharmSciTech, 2002, 3(2): 1-8. DOI: 10.1208/pt030206. |
| [2] | LIU DAVID Q, SUN M J, KORD A S. Recent advances in trace analysis of pharmaceutical genotoxic impurities[J]. J Pharm Biomed, 2010, 51(5): 999-1014. DOI: 10.1016/j.jpba.2009.11.009. |
| [3] | SNODIN DAVID J, MCCROSSEN S D. Guidelines and pharmacopoeial standards for pharmaceutical impurities:overview and critical assessment[J]. Regul Toxicol Pharmacol, 2012, 63(2): 298-312. DOI: 10.1016/j.yrtph.2012.03.016. |
| [4] | 裘祖文, 裴奉奎. 核磁共振波谱[M]. 北京: 科学出版社, 1989. |
| [5] | BREITMAIER E. Structure elucidation by NMR in organic chemistry. A practical guide[M]. New York: Wiley Online Library, 2002. |
| [6] |
ZHANG E, CUI D Y, SUN W, et al. Structural elucidation of a hydrolysis product from derivatives of allofuranose[J].
Chinese J Magn Reson, 2017, 34(2): 183-190.
张恩, 崔得运, 孙伟, 等. 呋喃阿洛糖衍生物水解产物的结构确定[J]. 波谱学杂志, 2017, 34(2): 183-190. DOI: 10.11938/cjmr20170207. |
| [7] |
SUN W, SHE M Y, ZONG C L, et al. An NMR study on diacetonefructose[J].
Chinese J Magn Reson, 2017, 34(3): 329-337.
孙伟, 厍梦尧, 宗春蕾, 等. 果糖二丙酮的结构全归属[J]. 波谱学杂志, 2017, 34(3): 329-337. DOI: 10.11938/cjmr20162526. |
| [8] | BOURAS E P, CAMILLERI M, BURTON D D, et al. Selective stimulation of colonic transit by the benzofuran 5HT4 agonist, prucalopride, in healthy humans[J]. Gut, 1999, 44(5): 682-686. DOI: 10.1136/gut.44.5.682. |
| [9] | EMMANUEL A V, KAMM M A, ROY A J, et al. Effect of a novel prokinetic drug, R093877, on gastrointestinal transit in healthy volunteers[J]. Gut, 1998, 42(4): 511-516. DOI: 10.1136/gut.42.4.511. |
| [10] | TACK J. Prucalopride:A new drug for the treatment of chronic constipation[J]. Expert Rev Gastroent, 2009, 3(4): 337-343. DOI: 10.1586/egh.09.38. |
| [11] | PONTI F D, TONINI M. Irritable bowel syndrome:New agents targeting serotonin receptor subtypes[J]. Drugs, 2001, 61(3): 317-32. DOI: 10.2165/00003495-200161030-00001. |
| [12] | EMMANUEL A V, ROY A J, NICHOLLS T J, et al. Prucalopride, a systemic enterokinetic, for the treatment of constipation[J]. Aliment Pharm Therap, 2002, 16(7): 1347-1356. DOI: 10.1046/j.1365-2036.2002.01272.x. |
| [13] | KROBERT K A, BRATTELID T, LEVY F O, et al. Prucalopride is a partial agonist through human and porcine atrial 5-HT4 receptors:Comparison with recombinant human 5-HT4 splice variants[J]. N-S Arch Pharmacol, 2005, 371(6): 473-479. DOI: 10.1007/s00210-005-1068-0. |
| [14] | CAMILLERI M, BEYENS G, KERSTENS R, et al. Safety assessment of prucalopride in elderly patients with constipation:A double-blind, placebo-controlled study[J]. Neurogastroent Motil, 2009, 21(12): 1256-e117. DOI: 10.1111/nmo.2009.21.issue-12. |
| [15] | WONG B S, MANABE N, CAMILLERI M. Role of prucalopride, a serotonin (5-HT4) receptor agonist, for the treatment of chronic constipation[J]. Clin Exp Gastroenterol, 2010, 3: 49-56. |
| [16] | QUIGLEY E M M. Prucalopride:Safety, efficacy and potential applications[J]. Therap Adv Gastroenterol, 2012, 5(1): 23-30. DOI: 10.1177/1756283X11423706. |
| [17] | SMART C J, RAMESH A N. The successful treatment of acute refractory pseudo-obstruction with prucalopride[J]. Colorectal Disease, 2012, 14(8): e508. DOI: 10.1111/codi.2012.14.issue-8. |
| [18] | WILLEMSENS B, COPMANS A, BEERENS D, et al. Dihydro-7-benzofurancarboxylic acid:An intermediate in the synthesis of the enterokinetic agent R108512[J]. Acs Symposium, 2003, 870: 125-139. DOI: 10.1021/symposium. |
| [19] | SCHUURKES J A J, LAERHOVEN VAN J. Prucalopride-n-oxide: US, 501346[P]. 2003-01-13 |
| [20] |
LIU Y, XIA C, LIU Y. Synthesis of prucalopride[J].
Pharm Clin Res, 2011, 19(4): 306-307.
刘宇, 夏超, 刘媛. 普卡必利的合成[J]. 药学与临床研究, 2011, 19(4): 306-307. |
| [21] |
YUAN Y Z, TANG J D, CEN J D. Synthesis of prucalopride monosuccinat[J].
Chin J Pharm, 2012, 43(1): 5-8.
原友志, 唐家邓, 岑均达. 琥珀酸普卡必利的合成[J]. 中国医药工业杂志, 2012, 43(1): 5-8. |
| [22] | FRAMPTON J E. Prucalopride[J]. Drugs, 2009, 69(17): 2463-2476. DOI: 10.2165/11204000-000000000-00000. |
| [23] |
YU D H, KANG W, HAO F, et al. Spectroscopic studies and structural elucidation of cabazitaxel[J].
Chinese J Magn Reson, 2017, 34(2): 191-199.
余大海, 康旺, 郝福, 等. 卡巴他赛结构确证的波谱学研究[J]. 波谱学杂志, 2017, 34(2): 191-199. DOI: 10.11938/cjmr20170208. |
 2018, Vol. 35
2018, Vol. 35 
