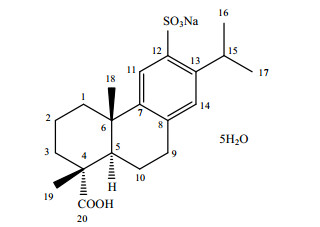
依卡倍特钠(ecabet sodium)最早是由日本田边制药株式会社研发上市的胃粘膜保护剂[1].它与胃黏膜病变部位的血浆蛋白结合,覆盖在胃黏膜上形成膜屏障,通过抑制胃蛋白酶活性、增加胃部内源性前列腺素等机制起到保护胃黏膜的作用. 1999年在中国获得进口许可,用于治疗胃粘膜损伤(糜烂、出血、红肿、水肿),以及急性胃炎和慢性胃炎的急性发作期.依卡倍特钠具有三个手性中心,化学式为C20H27NaO5S·5H2O,化学名为(+)-(1R, 4aS, 10aR)-1, 2, 3, 4a, 9, 10, 10a-八氢-1, 4a-二甲基-7-(1-甲基乙基)-6-磺酸-1-菲羧酸-6-钠盐五水合物,其结构式如图 1所示.
|
图 1 依卡倍特钠的化学结构 Figure 1 The structure of ecabet sodium |
目前关于依卡倍特钠的合成、药理及临床研究方面的文献报道[2-14]较多,而对其核磁共振(NMR)波谱的1H NMR和13C NMR信号进行全归属的文献仅有祝贺等[15]在《精细化工中间体》发表的《依卡倍特钠的核磁共振数据解析》,而祝贺等将部分1H NMR和13C NMR的信号归属错误.本文测定了依卡倍特钠的紫外吸收光谱(UV)、红外吸收光谱(IR)、高分辨质谱(HR-MS)、NMR谱图(包括1H NMR、13C NMR、DEPT、1H-1H COSY、1H-13C HSQC和1H-13C HMBC谱),参考相关书籍[16, 17],对其所有的1H NMR和13C NMR信号进行了归属,讨论了红外特征吸收峰所对应的官能团的振动形式,从而提供了较完备的依卡倍特钠的波谱和结构信息,为其后续研究提供参考依据.
1 实验部分 1.1 样品与试剂实验中的依卡倍特钠原料由亚邦医药研究院制备并提供.具体以脱氢松香酸为起始原料,通过磺化、成盐以及精制等步骤得到依卡倍特钠.样品经高效液相色谱(HPLC)测试纯度为99.95 %,符合结构鉴定所需的纯度.热重分析,在30.0~300.0 ℃失去约18.23 %的重量,与5个结晶水在分子中所占的比例(18.29 %)相吻合.
氘代试剂DMSO-d6(氘代率为99.8%),含0.03% v/v四甲基硅烷(TMS),购自北京百灵威科技有限公司.其余试剂(分析纯)均为上海国药集团化学试剂有限公司.
1.2 仪器UV光谱用岛津UV1601(日本岛津)测定;IR光谱用NICOLET Impact 410型红外光谱仪(美国Nicolet公司)测定,KBr压片;质谱图用Agilent 1260-6230 TOF LC-MS质谱仪(美国Agilent公司)测定,配备电喷雾离子源(ESI);NMR谱图采用Bruker Avance 500型NMR谱仪(瑞士Bruker公司)测定.
1.3 NMR实验室温下样品溶于DMSO-d6中,1D和2D NMR实验均在配备反向检测探头的Bruker 500型NMR谱仪上完成,采用直径为5 mm的NMR样品管.1H NMR的观测频率为500.13 MHz,90˚脉冲宽度为9.8 μs;13C NMR的观测频率为125.77 MHz,90˚脉冲宽度为8.0 μs;1H-1H COSY的F2维(1H)和F1维(1H)谱宽均为8 325 Hz,采样数据点阵t2×t1 =1 024×512;HSQC的F2维(1H)和F1维(13C)谱宽分为8 325Hz和19 268 Hz,采样数据点阵t2×t1 =1 024×512,HMBC的F2维(1H)和F1维(13C)谱宽分别为6 009.6 Hz和30 303.0 Hz,采样数据点阵t2×t1 =1 024×256. DEPT的采样参数与13C NMR实验相同.
2 结果与讨论 2.1 UV光谱分析分别以0.1 mol/L盐酸溶液、0.1 mol/L氢氧化钠溶液和甲醇为溶剂测定依卡倍特钠的UV光谱.依卡倍特钠在0.1 mol/L盐酸溶液中有3个主要的紫外吸收峰:205.0 nm为R带吸收,是由n→π*跃迁产生,说明分子中存在羧酸结构;222.0 nm为E2带吸收,270.0 nm为B带吸收,说明分子中存在芳香环结构.依卡倍特钠在0.1 mol/L氢氧化钠溶液中由于分子中的羧酸进一步成钠盐,吸收峰呈现红移.依卡倍特钠在甲醇溶剂中的UV光谱与0.1 mol/L盐酸溶液中的基本一致.以上紫外吸收图谱结果表明样品结构中可能存在羧酸和芳香环结构.
2.2 IR光谱分析IR光谱中,3 513 cm-1(νO-H)为典型的羧酸官能团吸收峰. 1 649 cm-1(νC=O)表明分子中存在羰基结构.3 011 cm-1(νC-H ArH)处较弱的特征吸收峰,表明分子中存在芳环,可能是苯环或芳杂环;1 475 cm-1、1 553 cm-1、1 632 cm-1(νC=C Ph)是典型的苯环碳骨架振动吸收峰;841 cm-1(δC-H Ph)进一步表明四取代苯环的存在;2 952 cm-1(νC-H CH3)、2 871 cm-1(νC-H CH2)、1 485 cm–1(δC-H CH2)、1 460 cm-1(δC-H CH2)、1 440 cm-1(δC-H CH3)、1 385 cm-1(δC-H CH3)表明分子中存在甲基和亚甲基.具体的IR谱峰数据及归属见表 1.
| 表 1 依卡倍特钠的IR光谱数据及归属 Table 1 IR data and assignment of ecabet sodium |
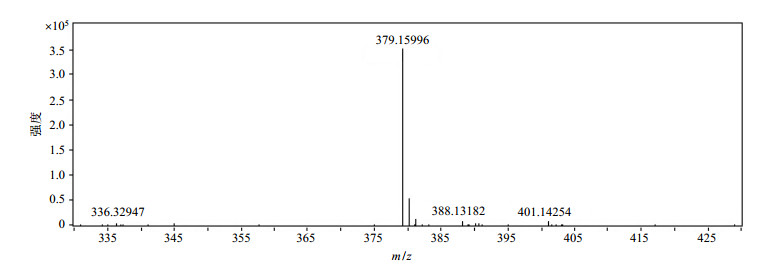
依卡倍特钠ESI-MS谱图见图 2所示.在负离子检测模式下,得到质荷比(m/z)为379.159 96的离子峰[M-Na-5H2O]-,与依卡倍特钠(分子式为C20H27NaO5S·5H2O,精确分子量为492.555 77)一致.
|
图 2 依卡倍特钠的质谱图 Figure 2 MS spectrum of ecabet sodium |
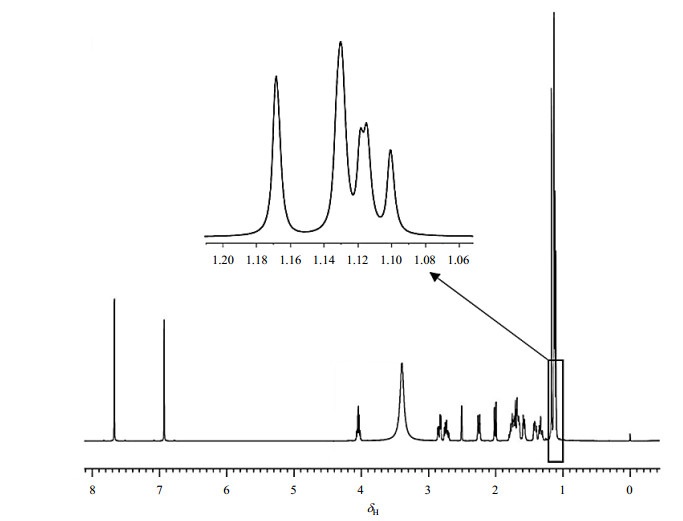
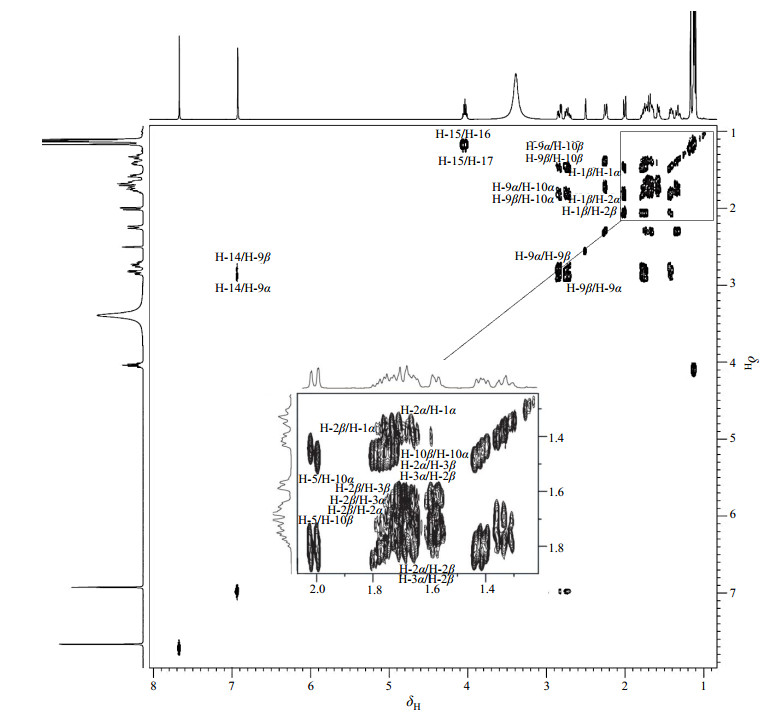
结合2D NMR分析以及文献[18],1H NMR谱(图 3)中给出14组质子信号,在低场δH 9~13(1H, brs)出现的宽峰因加入重水交换后消失,为活泼氢.根据质子化学位移规律,δH 7.67(1H, s)和δH 6.93(1H, s)为芳香环质子信号峰,受邻位磺酸钠基团范德华效应和去屏蔽效应的影响,偏向低场的δH 7.67归属为H-11,而δH 6.93归属为H-14.在1H-1H COSY谱(图 4)中,δH 2.86(1H, dd, J=6.6/17.2 Hz)和δH 2.76(1H, m)与H-14相关,结合HSQC谱(图 5),推测其应为同碳上的两个磁不等价的质子,被归属为H-9α或H-9β.在1H-1H COSY谱中,δH 1.80(1H, m)和δH 1.43(1H, m)与H-9α和H-9β相关,结合HSQC谱,推测其亦为同碳上的两个磁不等价的质子,被归属为H-10α或H-10β,由于受到5位手性碳原子的影响产生较大的同碳偶合,同时受9位质子的偶合作用,均裂分为多重峰.在1H-1H COSY谱中,δH 2.02(1H, m)和H-10α和H-10β相关,被归属为H-5,由于受10位质子的偶合作用,裂分为多重峰.在1H-1H COSY谱中,δH 2.26(1H, d, J=12.9 Hz)、δH 1.80(1H, m)、δH 1.72(2H, m)、δH 1.59(1H, m)和δH 1.35(1H, m)构成了一个质子偶合体系,结合HSQC谱,δH 2.26和δH 1.35为同碳上的两个质子,δH 1.80和δH 1.72为同碳上的两个质子,δH 1.72和δH 1.59为同碳上的两个质子,受分子刚性影响,质子不等价,归属为H-1~3.其中δH 1.80和δH 1.72同时与δH 2.26、δH 1.35、δH 1.72和δH 1.59相关,被归属为H-2α或H-2β,由于受到邻位即1位和3位质子的偶合作用,裂分为多重峰. δH 2.26和δH 1.35、δH 1.72和δH 1.59被归属为H-1α和H-1β或H-3α和H-3β.高场区δH 1.12(6H, m)、δH 1.13(3H, s)和δH 1.17(3H, s)被归属为四组甲基质子,其中δH 1.12归属为H-16或H-17.在1H-1H COSY谱中,δH 4.07(1H, m)与δH 1.12相关,被归属为H-15,由于受到邻近位即16位和17位质子的偶合作用,裂分多重峰.由于受到邻近位羧酸基团范德华力的弱去屏蔽效应影响,偏向低场的δH 1.17归属为H-19,δH 1.13归属为H-18.
|
图 3 依卡倍特钠的1H NMR谱图 Figure 3 1H NMR spectrum of ecabet sodium |
|
图 4 依卡倍特钠的1H-1H COSY谱图 Figure 4 1H-1H COSY spectrum of ecabet sodium |
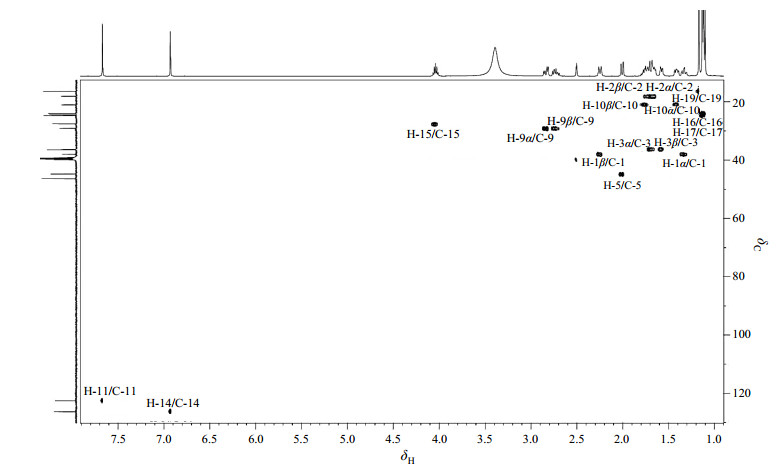
|
图 5 依卡倍特钠的1H-13C HSQC谱图 Figure 5 1H-13C HSQC spectrum of ecabet sodium |
13C NMR和DEPT图谱(图 6)表明,该分子结构中含4个伯碳(δC 16.4、δC 24.0、δC 24.2和δC 24.7),5个仲碳(δC 18.1、δC 21.0、δC 29.1、δC 36.3和δC 37.9),4个叔碳(δC 27.6、δC 44.8、δC122.5和δC 126.2),7个季碳(δC 36.4、δC 46.4、δC 135.1、δC 142.9、δC 143.3、δC 145.3和δC 179.4).

|
图 6 依卡倍特钠的DEPT谱和13C NMR谱图 Figure 6 DEPT spectra and 13C NMR spectrum of ecabet sodium |
δC 16.4在HSQC谱中与H-19直接相关,HMBC谱(图 7)显示其与δH 1.59、δH 1.72和H-5远程相关,被归属为C-19,因此δH 1.59和δH 1.72归属为H-3α或H-3β,δH 1.35和δH 2.26被归属为H-1α或H-1β. δC 18.1在HSQC谱中与H-2α和H-2β直接相关,在HMBC谱与H-1α、H-1β、H-3α和H-3β远程相关,被归属为C-2. δC 21.0在HSQC谱中与H-10α和H-10β直接相关,在HMBC谱显示其与H-5、H-9α和H-9β远程相关,被归属为C-10. δC 24.0和δC 24.2与H-16或H-17直接相关,HMBC谱显示其与H-15和H-16或H-17远程相关,被归属为C-16或C-17. δC 24.7在HSQC谱中与H-18直接相关,HMBC谱显示其与H-1α、H-1β、H-5和H-11远程相关,被归属为C-18. δC 27.6在HSQC谱中与H-15直接相关,HMBC谱显示其与H-11、H-14、H-16和H-17远程相关,被归属为C-15. δC 29.1在HSQC谱中与H-9α和H-9β直接相关,HMBC谱显示其与H-5、H-10α、H-10β和H-14远程相关,被归属为C-9. δC 36.3在HSQC谱中与H-3α和H-3β直接相关,HMBC谱显示其与H-1α、H-1β、H-2α、H-2β、H-5和H-19远程相关,被归属为C-3. δC 36.4在HSQC谱中无相关信号,HMBC谱显示其与H-1α、H-1β、H-2α、H-2β、H-5、H-10α、H-10β、H-11和H-18远程相关,被归属为C-6. δC 37.9在HSQC谱中与H-1α和H-1β直接相关,HMBC谱显示其与H-5和H-18远程相关,被归属为C-1. δC 44.8在HSQC谱中与H-5直接相关,HMBC谱显示其与H-1α或H-1β、H-3α或H-3β、H-9α、H-9β、H-10α或H-10β、H-18和H-19远程相关,被归属为C-5. δC 46.6在HSQC谱中无相关信号,HMBC谱显示其与H-3α、H-3β、H-5和H-19远程相关,被归属为C-4. δC 122.5在HSQC谱中与H-11直接相关,HMBC谱显示其与H-14远程相关,被归属为C-11. δC 126.2在HSQC谱中与H-14直接相关,HMBC谱显示其与H-9α、H-9β、H-11和H-15远程相关,被归属为C-14. δC 135.1在HSQC谱中无相关信号,HMBC谱显示其与H-9α、H-9β、H-10α或H-10β和H-11远程相关,被归属为C-8. δC 142.9在HSQC谱中无相关信号,HMBC谱显示其与H-14远程相关,被归属为C-12. δC 143.3在HSQC谱中无相关信号,HMBC谱显示其与H-11、H-15、H-16和H-17远程相关,被归属为C-13. δC 145.3在HSQC谱中无相关信号,HMBC谱显示其与H-5、H-9α、H-9β、H-14和H-18远程相关,被归属为C-7. δC 179.4为羰基碳,HMBC谱显示其与H-5和H-19远程相关,被归属为C-20.

|
图 7 依卡倍特钠的1H-13C HMBC谱图. (a)全谱;(b)~(e)为(a)中方框所示部分放大图 Figure 7 1H-13C HMBC spectra of ecabet sodium. (a) Full spectrum; (b)~(e) Local amplified spectra in box of (a) |
具体的1H和13C NMR数据及归属见表 2.已发表的依卡倍特钠结构鉴定的文献[15]中,H-1α、H-1β、H-2α、H-2β、H-3α、H-3β、H-18和H-19归属有误,C-1、C-2、C-3、C-7、C-8、C-12、C-18和C-19归属有误.
| 表 2 依卡倍特钠1H和13C NMR数据分析(DMSO-d6) Table 2 1H and 13C NMR data analysis of ecabet sodium (DMSO-d6) |
本文通过UV、IR、ESI-MS、1H NMR、13C NMR、DEPT、1H-1H COSY、1H-13C HSQC和1H-13C HMBC谱图的测定与解析,对依卡倍特钠的结构进行了全面的分析与验证,通过热重分析确定了结晶水的个数,通过HR-MS确认了其精确分子量,结合UV和IR光谱给出各基团的特征吸收,1H NMR、13C NMR、DEPT、1H-1H COSY、1H-13C HSQC和1H-13C HMBC谱的测定和解析确证了化合物的1H和13C NMR归属,从而确证了依卡倍特钠的结构.
| [1] | ITO Y, FUKUSHIMA T, SUGAWARA Y, et al. Metabolic fate of a new anti-ulcer drug (+)-(1R, 4a S, 10a R)-1, 2, 3, 4, 4a, 9, 10[J]. J Pharmacobiodyn, 1991, 14(9): 547-554. DOI: 10.1248/bpb1978.14.547. |
| [2] | ONODA Y, MAGARIBUCHI T, TAMAKI H. Effects of the new anti-ulcer agent 12-sulfodehydroabietic acid monosodium salt on duodenal alkaline secretion in rats[J]. Arzneimittel-Forschung, 1990, 40(5): 576-578. |
| [3] | ONODA Y, MAGARIBUCHI T, TAMAKI H. Effects of 12-sulfodehydroabietic acid monosodium salt (TA-2711), a new anti-ulcer agent, on gastric secretion and experimental ulcers in rats[J]. Jpn J Pharamacol, 1989, 51(1): 65-73. DOI: 10.1254/jjp.51.65. |
| [4] | ONODA Y, TAKIDO M, MAGARIBUCHI T, et al. Effects of 12-sulfodehydroabietic acid monosodium salt (TA-2711), a new anti-ulcer agent, on gastric mucosal lesions induced by necrotizing agents and gastric mucosal defensive factors in rats[J]. Jpn J Pharamacol, 2006, 52(4): 631-638. |
| [5] | SHIBATA K, ITO Y, HONGO A, et al. Bacterial activity of a new antiulcer agent, ecabet sodium, against helicobacter pylori under acidic conditions[J]. Antimicrob Agents Chemother, 1995, 39(6): 1295-1299. DOI: 10.1128/AAC.39.6.1295. |
| [6] | ITO Y, SHIBATA K, HONGO A, et al. Ecabet sodium, a locally acting antiulcer drug, inhibits urease activity of helicobacter pylori[J]. Eur J Pharm, 1998, 345(2): 193-198. DOI: 10.1016/S0014-2999(97)01622-1. |
| [7] | ITO Y, NAKAMURA S, ONODA Y, et al. Effects of the new anti-ulcer drug ecabet sodium (TA-2711) on pepsin activity. Ⅰ. Inactivation of enzyme protein[J]. Jpn J Pharmacol, 1993, 62(2): 169-174. DOI: 10.1254/jjp.62.169. |
| [8] | PEARSON J P, ROBERTS N B. Mucosal protective effects of ecabet sodium:pepsin inhibition and interaction with mucus[J]. Clin Sci, 2001, 100(4): 411-417. DOI: 10.1042/cs1000411. |
| [9] | SHIMOYAMA T, FUKUDA S, LIU Q, et al. Ecabet sodium inhibits the ability of helicobacter pylori to induce neutrophil production of reactive oxygen species and interleukin-8[J]. J Gastroenterol, 2001, 36(3): 153-157. DOI: 10.1007/s005350170122. |
| [10] | ICHIKAWA T, ISHIHARA K, HAYASHIDA H, et al. Effects of ecabet sodium, a novel gastroprotective agent, on mucin metabolism in rat gastric mucosa[J]. Dig Dis Sci, 2000, 45(3): 606-613. DOI: 10.1023/A:1005469913079. |
| [11] |
YU H, HAN R G. Analysis the effect of ecabet sodium therapy in gastric ulcers relevant to helicobacter pylori[J].
China Modern Medicine, 2009, 16(22): 19-21.
于辉, 韩汝贵. 依卡倍特钠治疗幽门螺杆菌相关性胃溃疡的疗效分析[J]. 中国当代医药, 2009, 16(22): 19-21. DOI: 10.3969/j.issn.1674-4721.2009.22.011. |
| [12] |
WANG H J, YU Z L, LIN S R, et al. A randomized, double blind, multi-centers and comparative control clinical trial of ecabet sodium for gastric ulcer and gastritis[J].
Chinese Journal of New Drugs, 2005, 14(8): 1045-1048.
王惠吉, 于中麟, 林三仁, 等. 依卡倍特钠治疗胃溃疡及胃炎的疗效和安全性[J]. 中国新药杂志, 2005, 14(8): 1045-1048. |
| [13] | HIROSHI W, SHIN-ICHI K, MASATOSHI K, et al. Antiulcer activity of dehydroabietic acid derivatives[J]. Chem Pharm Bull, 1985, 33(4): 1472-1487. DOI: 10.1248/cpb.33.1472. |
| [14] | HASSELSTROM T, MCPHERSON J. Reactions involved in the sulfonation of heat treated abietic acid[J]. J Am Chem Soc, 1938, 60(10): 2340-2341. DOI: 10.1021/ja01277a019. |
| [15] |
ZHU H, YUAN Y Q, SUN Q L, et al. Assignment of chemical shift of ecabet sodium[J].
Fine Chemical Intermediates, 2008, 38(5): 65-67.
祝贺, 袁延强, 孙庆雷, 等. 依卡倍特钠的核磁共振数据解析[J]. 精细化工中间体, 2008, 38(5): 65-67. |
| [16] | 宁永成. 有机化合物结构鉴定与有机波谱学[M]. 北京: 科学出版社, 2000. |
| [17] | 赵天增. 核磁共振图谱[M]. 北京: 北京大学出版社, 1982. |
| [18] | TERIS A, VAN BEEK, FRANK W, et al. Fungal biotransformation products of dehydroabietic acid[J]. J Nat Prod, 2007, 70(2): 154-159. DOI: 10.1021/np060325e. |
 2018, Vol. 35
2018, Vol. 35 
