2. 辽宁省中药单体原料及制剂工程技术研究中心, 辽宁 大连 116000
2. Liaoning API and Formulation of Traditional Chinese Medicine Monomer Engineering Technology Research Center, Dalian 116000, China
连翘脂素(phillygenin),又称连翘苷元,主要存在于木犀科(Oleaceae)连翘属(Forsythia)的植物连翘[Forsythia suspensa (Thunb.) Vahl]中,为含双骈四氢呋喃环的木脂素类化合物,具有清除自由基、抗炎、抗肿瘤、抗氧化等药理活性.例如连翘脂素可强力清除二苯代苦味酰基自由基(DPPH)[1];抑制低密度脂蛋白和高密度脂蛋白的氧化作用[2, 3];抑制脂多糖诱导小鼠单核巨噬细胞白血病细胞(RAW 264.7)产生一氧化氮[4];抑制环腺苷磷酸二酯酶的活性[5];减轻亚硝酸盐诱导的猪肾近曲小管上皮细胞(LLC-PK1)损伤,预防过氧亚硝酸盐阴离子引发的相关疾病[6];保护由四氯化碳诱导的大鼠急性肝损伤[7];治疗牛血清蛋白诱导的大鼠免疫性肝纤维化[8];对人肝癌细胞(SMMC-7721)和小鼠黑色素肉瘤细胞B16均有体外抑制活性[9, 10].
非甾体抗炎药(NSAID)布洛芬(ibuprofen)通过抑制环氧合酶-2(COX-2)进而抑制前列腺素的合成,缓解炎症反应和疼痛;通过作用于下视丘体温调节中枢引起外周血管扩张,皮肤血流增加出汗,起到解热作用.由于布洛芬还会抑制环氧合酶-1(COX-1),长期服用会产生恶心、呕吐、胃溃疡、胃出血、肾损伤等不良反应.因此将布洛芬制成前药不但会增加布洛芬的治疗指数,也会提高患者顺应性.
本文以连翘脂素和布洛芬为原料,通过Schotten-Baumann酯化反应合成了布洛芬酯类前药——连翘脂素-布洛芬酯(图 1).有文献[11, 12]显示布洛芬酯类前药在体内分解为原药后,既降低了布洛芬的副作用,又起到协同治疗作用.通过SciFinder数据库检索,未发现其结构,由此判定为新的未报道的化合物.

|
图 1 连翘脂素-布洛芬酯的结构 Figure 1 The structure of ibuprofen-phillygenin ester |
本文测定了连翘脂素-布洛芬酯的紫外吸收光谱(UV)、红外吸收光谱(IR)、基质辅助激光解吸/电离飞行时间质谱(MALDI-TOF-MS),以及多种1D和2D核磁共振(NMR)波谱(包括1H NMR、13C NMR、DEPT135、DEPT90、1H-1H COSY、1H-1H NOESY、1H-13C HSQC和1H-13C HMBC),对其进行了结构确证,并对其1H和13C NMR数据进行了全归属.
1 实验部分 1.1 仪器与试剂IR光谱用PE Spectrum-100傅里叶变换红外光谱仪(PerkinElmer Inc.,美国)测定,KBr压片;UV光谱用PE.Lambda35紫外分光光度计(PerkinElmer Inc.,美国)测定;高分辨质谱用IonSpec 7.0 T傅里叶变换离子回旋共振质谱仪(FT-ICR-MS,Varian, Inc.,美国)测定;NMR实验在Bruker Avance Ⅲ HD 600型超导NMR谱仪(Bruker,瑞士)上测定,配备5 mm z梯度三共振反式低温探头.
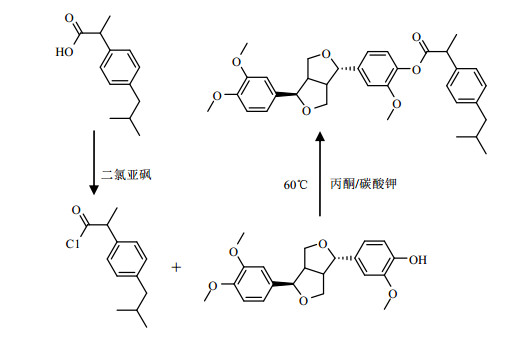
1.2 样品合成 1.2.1 布洛芬酰氯的合成称取布洛芬(2.06 g,0.01 mol)置于三口瓶内,溶于40 mL二氯甲烷;向三口瓶内加入酰基化试剂氯化亚砜(11.9 g,0.1 mol),室温(20 ℃)下反应15 h;减压蒸发去除二氯甲烷,即得到布洛芬酰氯.
1.2.2 连翘脂素-布洛芬酯的合成称取连翘脂素(3.72 g,0.01 mol)于装有200 mL丙酮溶剂的三口瓶中,加入碳酸钾(1.5 g,0.01 mol),然后向三口瓶中滴加制备的布洛芬酰氯(2.24 g,0.01 mol);在搅拌状态下加热至60 ℃,并在60 ℃温度下进行酯化反应15 h;将酯化反应后的反应混合物降温至室温(20~25 ℃),过滤,去除固体残渣,滤液进行减压回收丙酮溶剂;将回收溶剂后得到的固体溶于二氯甲烷,用水洗涤溶液至中性;用无水硫酸钠进行干燥,减压蒸发去除二氯甲烷溶剂,得到白色固体.所得固体采用石油醚进行重结晶处理,即得连翘脂素-布洛芬酯纯品5.49 g,产率为98%,熔点为110 ℃.利用高效液相色谱(HPLC)测试样品纯度为99.78%,符合结构鉴定所需纯度.合成路线见图 2.
|
图 2 连翘脂素-布洛芬酯的合成路线 Figure 2 The synthesis of ibuprofen-phillygenin ester |
样品溶于CDCl3,以四甲基硅烷(TMS)为内标,实验温度为297.9 K.1H和13C NMR的工作频率分别为600.13 MHz和150.92 MHz,谱宽分别为12 335.5 Hz和36 057.7 Hz.DEPT的工作频率为150.92 MHz,谱宽为36 057.7 Hz.2D NMR谱包括1H-1H COSY、1H-1H NOESY、1H-13C HSQC和1H-13C HMBC谱,均采用标准脉冲程序.1H-1H COSY的F2维(1H)和F1维(1H)谱宽均为8 012.8 Hz,采样数据点阵t2×t1=1 024×512;1H-1H NOESY的F2维(1H)和F1维(1H)谱宽均为8 012.8 Hz,采样数据点阵t2×t1=1 024×512;HSQC谱的F2维(1H)和F1维(13C)谱宽分别为8 012.8 Hz和24 998.9 Hz,采样数据点阵t2×t1=1 024×512;HMBC谱的F2维(1H)和F1维(13C)谱宽分别为8 012.8 Hz和24 998.9 Hz,采样数据点阵t2×t1=1 024×512.
2 结果与讨论 2.1 UV光谱分析UV光谱中,203 nm为π→π*反键轨道跃迁特征吸收峰,属于E2吸收带;275 nm为n→π*反键轨道跃迁特征吸收峰,属于R吸收带,符合连翘脂素-布洛芬酯分子结构的特征.
2.2 IR光谱分析IR光谱中,2 867.21 cm-1(-CH2-)表明分子中存在芳环;2 953.73 cm-1(Ar-OCH3)表明分子中含有甲氧基苯结构片段;1 760.11 cm-1(C=O)表明分子中存在羰基;1 606.25 cm-1、1 591.38 cm-1、1 514.46 cm-1(Ar-CH)为苯环骨架振动吸收峰;1 270.57 cm-1、1 042.86 cm-1(Ar-O-C)表明分子中含有为芳基烷基醚,符合连翘脂素-布洛芬酯分子结构的特征.
2.3 高分辨MS谱图分析高分辨MS谱图(图 3)采用MALDI-TOF-MS数据:测得的加钠离子峰[M+Na]+质荷比(m/z)为583.265 40,与理论值(583.266 63)一致,误差为1.23‰.

|
图 3 连翘脂素-布洛芬酯的基质辅助激光解吸/电离飞行时间质谱图 Figure 3 MALDI-TOF-MS spectrum of ibuprofen-phillygenin ester |
由13C NMR和DEPT谱图(图 4)表明,该分子结构中含有6个伯碳——δC 18.8、22.5(2C)、56.0、55.9、55.8;3个仲碳——δC 69.8、71.1和45.1;16个叔碳——δC 129.3(2C)、127.5(2C)、122.6、118.1、117.8、111.1、110.0、109.0、87.3、82.0、54.7、50.1、45.0和30.3;9个季碳——δC 172.9、151.4、148.9、148.1、140.6、140.2、139.5、137.4、131.0.

|
图 4 连翘脂素-布洛芬酯的DEPT和13C NMR谱图. (a)高场区域;(b)低场区域 Figure 4 DEPT and 13C NMR spectra of ibuprofen-phillygenin ester at (a) high field and (b) low field regions |
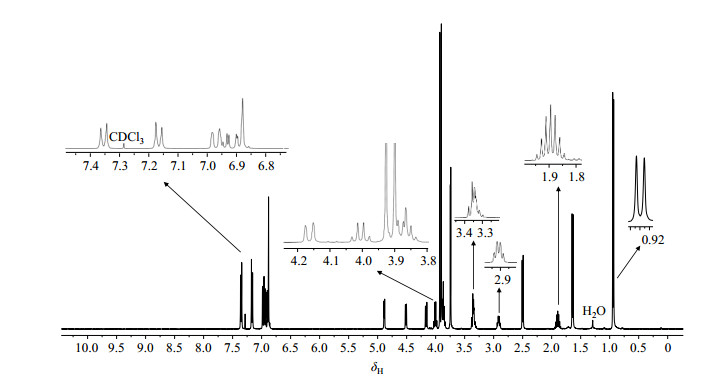
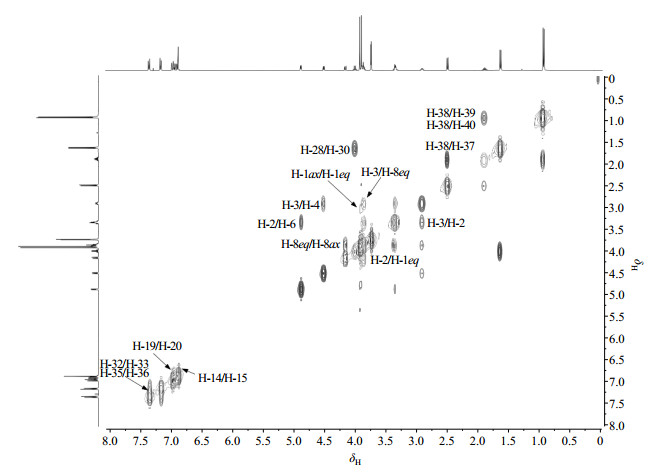
连翘脂素布洛芬酯的1H NMR谱中共显示40组质子信号(见图 5),参照Pelter等[13, 14]归属的epi-isomers型木脂素1H NMR信号,δH 4.47(1H, d, J=6 Hz)被归属为H-4.δH 4.86(1H, d, J=4.2 Hz)被归属为H-6.根据COSY谱(见图 6)相关可知,δH 2.88~2.89(1H,m)与H-4相关,被归属为H-3. δH 4.14(1H, d, J=9.6 Hz)在COSY谱中与H-3相关,可能为H-2或H-8ax,因为H-2不可能是双峰,所以被归属为H-8ax.根据NOESY谱(见图 7)相关可知,δH 3.86~3.88(2H, m)与H-6有两个空间相关峰,且在COSY谱中与H-8ax有相关峰,被归属为H-1eq和H-8eq.在COSY谱中,δH 3.32~3.35(2H, m)既与H-3和H-6有相关;又与δH 3.86~3.88(2H, m)有两个相关峰,因此其中一个质子被归属为H-2,另一个质子被归属为H-1ax.
|
图 5 连翘脂素-布洛芬酯的1H NMR谱图 Figure 5 1H NMR spectra of ibuprofen-phillygenin ester |
|
图 6 连翘脂素-布洛芬酯的1H-1H COSY谱图 Figure 6 1H-1H COSY spectrum of ibuprofen-phillygenin ester |
|
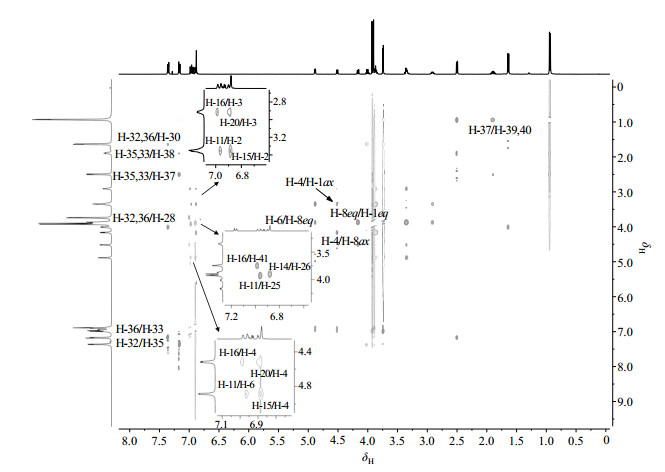
图 7 连翘脂素-布洛芬酯的1H-1H NOESY谱图 Figure 7 1H-1H NOESY spectra of ibuprofen-phillygenin ester |
δC 87.4在HSQC谱(图 8)中与H-4相关,HMBC谱(图 9)显示其与H-1和H-8有远程相关,归属为C-4. δC 82.0在HSQC谱中与H-6相关,归属为C-6. δC 71.1在HSQC谱中与H-8相关,归属为C-8. δC 69.8在HSQC谱中与H-1ax和H-1eq相关,HMBC谱显示其与H-6有远程相关,归属为C-1. δC 54.7在HSQC谱中与H-3相关,HMBC谱显示其与H-1有远程相关,归属为C-3.δC 50.1与H-2相关,HMBC谱显示其与H-3、H-4和H-6有远程相关,归属为C-2.
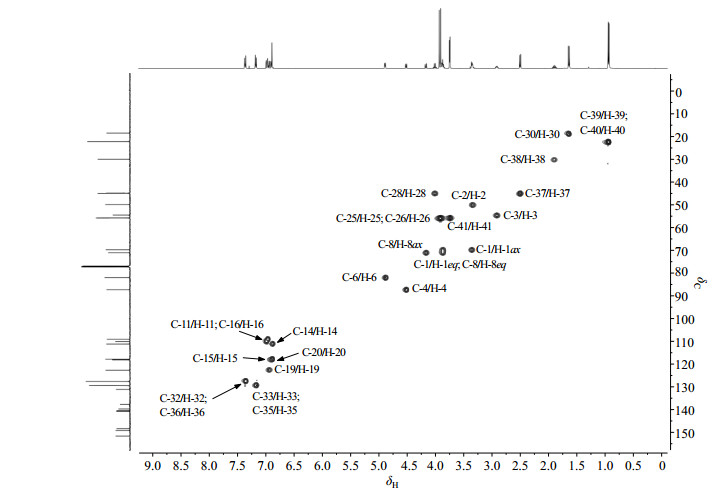
|
图 8 连翘脂素-布洛芬酯的HSQC谱图 Figure 8 HSQC spectrum of ibuprofen-phillygenin ester |
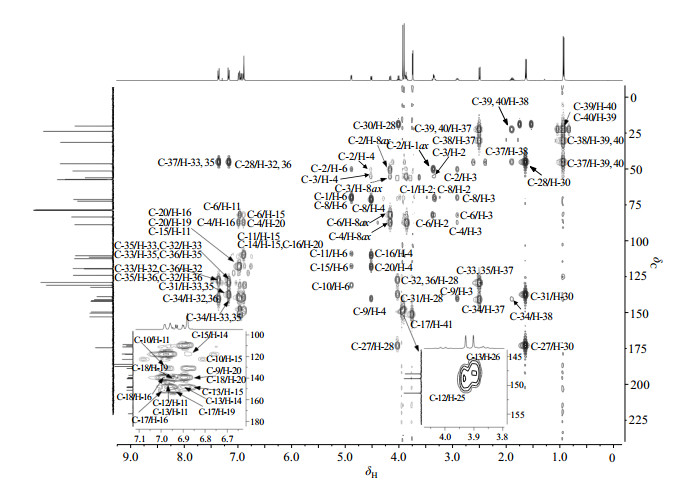
|
图 9 连翘脂素-布洛芬酯的HMBC谱图 Figure 9 HMBC spectra of ibuprofen-phillygenin ester |
结合文献[15, 16],δC 172.9为羰基碳,归属为C-27.由于羰基氧γ位的甲基碳化学位移会向高场移动,δC 18.8归属为C-30.δH 1.62(3H, d, J=6.6 Hz)在HSQC谱中与C-30相关,被归属为H-30.δH 3.98(1H, q, J=7.2 Hz)在COSY谱中与H-30相关,被归属为H-28.δC 45.0在HSQC谱中与H-28相关,归属为C-28. δH 7.33(2H, d, J=8.0 Hz)和δH 7.14(2H, d, J=8.0 Hz)构成AA'BB'体系,为对位二取代苯上的质子,应为H-32、H-33、H-35和H-36,由于羧基的吸电子效应降低苯环电子密度,δH 7.33(2H, d, J=8.0 Hz)理论上更靠近低场,暂时被归属为苯环上磁等价质子H-32和H-36.δC 127.5在HSQC谱中与δH 7.33相关,在HMBC谱中与H-28有远程相关,被归属为C-32和C-36,这进一步证明了δH 7.33 (2H, d, J=8.0 Hz)为H-32和H-36.因此,δH 7.14(2H, d, J=8.0 Hz)被归属为H-33和H-35.δC 129.3在HSQC谱中与H-33和H-35相关,被归属为C-33和C-35.δC 137.4在HSQC谱中无相关峰,在HMBC谱中显示其与H-28、H-30、H-33和H-35有远程相关,归属为C-31.δC 140.6在HSQC谱中无相关峰,在HMBC谱中显示其与H-32和H-36有远程相关,归属为C-34.仲碳δC 45.1在HMBC谱中显示其与H-33和H-35有远程相关,归属为C-37.高场区δH 2.48(2H, d, J=6.6 Hz)受邻位质子耦合影响,均裂为双峰,在HSQC中与C-37相关,因此归属为H-37.
δH 1.87(1H,dp, J=13.5/6.8 Hz)在COSY谱中与H-37相关,因此被归属为H-38. δC 30.3在HSQC谱中与H-38相关,归属为C-38. δH 0.92(6H, d, J=6.4 Hz)归属为两组甲基质子H-39和H-40,为磁等价质子. δC 22.5与H-39和H-40直接相关,在HMBC谱中显示其与H-37有远程相关,被归属为C-39、C-40.
低场区谱峰重叠,但是仍能看出δH 6.98(1H, br. s)、δH 6.93(1H, dd, J=2.4/8.0 Hz)、δH 6.96(1H, br. s)、δH 6.89(1H, dd, J=1.6/7.2 Hz),δH 6.84(2H, br. m)构成两组部分重合的ABX偶合体系,为连翘脂素核上的芳香氢,由于羧基的吸电子效应,H-16、H-19和H-20在理论上更靠近低场,因此δH 6.98(1H, br. s)归属为H-16,δH 6.93(1H, dd, J=2.4/8.0 Hz)归属为H-19,δH 6.96(1H, br. s)归属为H-11,δH 6.89(1H, dd, J=1.6/7.2 Hz)归属为H-14,δH 6.84(2H, br. m)则归属为为H-15和H-20.
参考千叶真理子等[17-22]对连翘脂素类化合物芳香区碳原子信号的归属,并结合2D NMR谱图,对部分碳原子归属分析如下:δC 122.6在HSQC谱中与H-19相关,归属为C-19;δC 111.1在HSQC谱中与H-14有相关,又在HMBC谱中与H-15远程相关,归属为C-14,δC 139.5在HSQC谱中无相关峰,HMBC谱显示其与H-4、H-3和H-16有远程相关,可以归属为C-9;δC 131.0在HSQC谱中无相关峰,HMBC谱显示其与H-11和H-15有远程相关,可以归属为C-10;δC 118.1在HMBC谱中与H-4和H-16有远程相关,归属为C-20;δC 110.0在HMBC谱中与H-4和H-20远程相关,归属为C-16;季碳δC 140.2在HMBC谱中与H-16和H-19有远程相关,可以归属为C-18;δC 151.4在HMBC谱中与H-16、H-19和H-20远程相关,归属为C-17;叔碳δC 117.8在HMBC谱中与H-14远程相关,归属为C-15;H-6在HMBC谱中除与C-15相关外,还与δC 109.0远程相关,则δC109.0归属为C-11;季碳δC 148.1在HMBC谱中与H-14和H-15远程相关,归属为C-13;剩余季碳δC 148.9则归属为C-12.
δH 3.72(3H, s)、δH 3.90(3H, s)和δH 3.93(3H, s)为连翘脂素核的三组甲基峰质子,在NOESY谱中,H-16与δH 3.72(3H, s)有空间相关,H-11与δH 3.93(3H, s)有空间相关,H-14与δH 3.90(3H, s)有空间相关,因此归属δH 3.72(3H, s)为H-41,δH 3.93(3H, s)为H-25,δH 3.90(3H, s)为H-26,在HSQC谱中δC 55.8与H-41相关,归属为C-41,而C-25和C-26则不能确切区分.
具体的1H和13C NMR归属见表 1.
| 表 1 连翘脂素-布洛芬酯的NMR数据分析(CDCl3, 600 MHz) Table 1 The NMR data analysis of ibuprofen-phillygenin ester (CDCl3, 600 MHz) |
本文以连翘脂素、布洛芬为原料,通过Schotten-Baumann酯化反应合成了连翘脂素-布洛芬酯.运用UV、IR、MALDI-TOF-MS及NMR(包括1H NMR、13C NMR、DEPT、1H-1H COSY、1H-1H NOESY、1H-13C HSQC和1H-13C HMBC)等一系列技术,对连翘脂素-布洛芬酯的结构进行了解析,并对其1H和13C NMR信号进行了归属.
| [1] | HUNG C Y, TSAI Y C, Li K Y. Phenolic antioxidants isolated from the flowers of osmanthus fragrans[J]. Molecules, 2012, 17(9): 10724-10737. |
| [2] | CHEN C C, CHEN H Y, SHIAO M S, et al. Inhibition of low density lipoprotein oxidation by tetrahydrofurofuran Llignans from forsythia suspensa and magnolia coco[J]. Planta Med, 1999, 65(8): 709-711. DOI: 10.1055/s-1999-14093. |
| [3] | CHANG M J, HUNG T M, MIN B S, et al. Lignans from the fruits of forsythia suspensa (Thunb.) vahl protect high-density lipoprotein during oxidative stress[J]. Biosci Biotechnol Biochem, 2008, 72(10): 2750-2755. DOI: 10.1271/bbb.80392. |
| [4] | LEE D G, LEE S M, BANG M H, et al. Lignans from the flowers of osmanthus fragrans var. aurantiacus and their inhibition effect on NO production[J]. Arch Pharm Res, 2011, 34(12): 2029-2035. DOI: 10.1007/s12272-011-1204-y. |
| [5] | NIKAIDO T, OHMOTO T, KINOSHITA T, et al. Inhibition of cyclic AMP phosphodiesterase by lignans[J]. Chem Pharm Bull, 1981, 29(12): 3586-3592. DOI: 10.1248/cpb.29.3586. |
| [6] | PIAO X L, CHO E J, JANG M H, et al. Cytoprotective effect of lignans from forsythia suspensa against peroxynitrite-induced LLC-PK1 cell damage[J]. Phytother Res, 2009, 23(7): 938-942. DOI: 10.1002/ptr.v23:7. |
| [7] |
FENG Q, XIA W K, WANG X Z, et al. Protective effects of phillygenin against CCl4 induced hepatic injury in rat[J].
Chin Pharmacol Bull, 2015, 31(3): 426-430.
冯芹, 夏文凯, 王现珍, 等. 连翘苷元对四氯化碳大鼠急性肝损伤的保护作用[J]. 中国药理学通报, 2015, 31(3): 426-430. |
| [8] |
WANG E L, YAO J C, LIU Z. Effect of forsythiaside on immunological hepatic fibrosis of rats[J].
Drug Eva Res, 2015, 38(2): 161-164.
王恩利, 姚景春, 刘铮. 连翘苷元对大鼠免疫性肝纤维化的影响[J]. 药物评价研究, 2015, 38(2): 161-164. |
| [9] | SU B N, ZHU Q X, GAO K, et al. Lignan and phenylpropanoid glycosides from Lancea tibetica and their antitumor activity[J]. Planta Med, 1999, 65(6): 558-561. DOI: 10.1055/s-1999-14026. |
| [10] |
ZHAO C Y, QIU R, ZHENG R L. In vitro antitumor activities of furan lignans[J].
J Lanzhou Univ:Nat Sci Ed, 2000, 36(4): 66-68.
赵晨阳, 邱嵘, 郑荣梁. 呋喃骈呋喃木脂素的体外抗肿瘤活性)[J]. 兰州大学学报:自然科学版, 2000, 36(4): 66-68. |
| [11] |
ZHAO X L, CHEN D W, LI K X, et al. Synthesis of ibuprofen eugenol ester prodrug and its hydrolysis kinetics[J].
J Shenyang Pharm Univ, 2006, 23(2): 70-73.
赵秀丽, 陈大为, 李可欣, 等. 布洛芬丁香酯前体药物的合成及其水解动力学[J]. 沈阳药科大学学报, 2006, 23(2): 70-73. |
| [12] |
ZHAO X L, CHEN D W, HU H Y, et al. Study on pharmacokinetics of oral ibuprofen eugenol ester microemulsion in rats[J].
Chin Pharm J, 2008, 43(7): 532-535.
赵秀丽, 陈大为, 胡海洋, 等. 口服布洛芬丁香酯微乳在大鼠体内药动学研究[J]. 中国药学杂志, 2008, 43(7): 532-535. |
| [13] | PELTER A, WARD R S, RAO E V, et al. Revised structures for pluviatilol, methyl pluviatilol and xanthoxylol:General methods for the assignment of stereochemistry to 2, 6-diaryl-3, 7-dioxabicyclo[3.3.0] octane lignans[J]. Tetrahedron, 1976, 32(22): 2783-2788. DOI: 10.1016/0040-4020(76)80123-8. |
| [14] | MIYAZAWA M, KASAHARA H, KAMEOKA H. Phenolic lignans from flower buds of magnolia fargesii[J]. Phytochem, 1992, 31(10): 3666-3668. DOI: 10.1016/0031-9422(92)83756-O. |
| [15] |
WANG E J, CHEN G Y, PENG M S. NMR studies of chiral discrimination of ibuprofen enantiomers in β-cyclodextrin inclusion complexes[J].
Chinese J Magn Reson, 2009, 26(2): 216-222.
王恩举, 陈光英, 彭明生. NMR研究β-环糊精对布洛芬的手性识别[J]. 波谱学杂志, 2009, 26(2): 216-222. |
| [16] |
MA M S, LEI X X. Chiral recognition of ibuprofen enatiomers by a chiral thiourea in the presence of DMAP using NMR[J].
Chinese J Magn Reson, 2014, 31(4): 564-571.
马敏山, 雷新响. 手性硫脲在DMAP条件下对布洛芬类药物的NMR手性识别[J]. 波谱学杂志, 2014, 31(4): 564-571. DOI: 10.11938/cjmr20140410. |
| [17] | NISHIBE S, CHIBA M, HISADA S. Studies on the chinese crude drug "forsythiae fructus." Ⅰ. On the constituents of forsythiae fructus on the market[J]. Yakugaku Zasshi, 1977, 97(10): 1134-1137. DOI: 10.1248/yakushi1947.97.10_1134. |
| [18] |
FAN H Y, FU L. Synthesis and structure characterization of phillyrin[J].
Liaoning Chem Indus, 2014, 43(3): 241-243.
樊宏宇, 富力. 连翘苷的合成与结构表征[J]. 辽宁化工, 2014, 43(3): 241-243. |
| [19] | NISHIBE S, TSUKAMOTO T, HISADA S. Effects of O-methylation and O-glucosylation on carbon-13 nuclear magnetic resonance chemical shifts of matairesinol, (+)-pinoresinol and (+)-epipinoresinol[J]. Chem Pharm Bull, 1984, 32(11): 4653-4657. DOI: 10.1248/cpb.32.4653. |
| [20] | 陈德昌. 碳谱及其在中草药化学中的应用[M]. 北京: 人民卫生出版社, 1991: p390-391. |
| [21] | RAHMAN M M A, DEWICK P M, JACKSON D E. Lignans of forsythia intermedia[J]. Phytochem, 1990, 29(6): 1971-1980. DOI: 10.1016/0031-9422(90)85050-P. |
| [22] | CHIBA M, HISADA S, NISHIBE S. The position of glucose linkage in phillyrin[J]. Chem Pharm Bull(Tokyo), 1981, 25(12): 3435-3436. |
 2018, Vol. 35
2018, Vol. 35 
