2. 中国科学院大学, 北京 100049
2. University of Chinese Academy of Sciences, Beijing 100049, China
阿霉素(doxorubicin, DOX)与紫杉醇(paclitaxel, TAX)作为两种广谱高效的抗肿瘤药物已经被广泛地运用到临床的肿瘤治疗中[1].DOX是蒽环类抗生素家族的成员,它们的主要抗癌机理是通过将自身杂乱地嵌入DNA内以抑制生物大分子的合成,从而导致转录信息及表观遗传信息的改变,随后引起细胞凋亡[2].TAX与微管中的β-微管蛋白结合,并冻结微管聚合物,以阻止有丝分裂过程中纺锤体的组装和染色体的分离,从而将快速增殖的肿瘤细胞的分裂阻断在G2/M期[3, 4].由于TAX在产生了蒽环类药物耐药性的乳腺癌治疗中表现出良好的活性,DOX和TAX的联合使用已经成为了治疗转移性乳腺癌的普遍策略.临床上使用先静脉滴注50~60 mg/m2 DOX,随后滴注150~200 mg/m2 TAX的治疗方案被证明对晚期乳腺癌患者有较好的治疗效果[5],这一治疗方案因此得到普遍的推广.尽管如此,DOX和TAX在临床上的应用还是由于它们的心脏毒性、骨髓抑制、中性粒细胞减少、脱发和肌肉疼痛等副作用而受到了一定的限制[6],发展新型给药方式以降低毒副作用成为研究者关注的重点之一.
随着纳米科技在生命科学领域的应用和发展,通过纳米载体的药物传送体系(drug delivery systems)获得了广泛的关注.各种研究表明通过纳米载体的药物传送方式可以更有效的抑制动物模型的肿瘤生长,同时降低药物的毒副作用.作为药物载体的纳米颗粒有脂质体、微球、聚合物胶束以及基于金、银、硅各种无机纳米颗粒等[7].其中单甲基聚乙二醇-羟基乙酸共聚物[methoxy poly(ethylene glycol)-poly(lactide-co-glycolide),mPEG-PLGA]因为其良好的生物相容性和两亲性受到了研究者较大的关注和认可[8, 9].mPEG-PLGA纳米共聚物可以同时包埋亲水性和亲脂性的抗肿瘤药物,它的表面也可以通过化学修饰的方式载带与肿瘤细胞过表达的抗体对应的配体以达到靶向消除肿瘤细胞的目的[10].由于mPEG-PLGA纳米颗粒具有高通透性、滞留效应(enhanced permeability and retention effect, EPR effect)和可控缓释的药物释放特点,相比传统给药方式,载带DOX和TAX的mPEG-PLGA对于B16-F10肿瘤在C57BL小鼠肺部的转移上有更强的抑制效果,相关血生化的检测结果也显示其具有更小的器官毒性[10].
在前期的细胞实验和肿瘤模型实验中,关于纳米颗粒载体的这一新型药物传送体系和传统给药方式的研究仅仅集中在对宏观的细胞生存率、肿瘤抑制大小的表征以及血生化病理检测上[10, 11],并没有对它们给机体在分子水平和代谢水平上带来的影响差异进行过系统的比较和研究.代谢组学作为系统生物学的分支,能够定量描述机体对各种病理学刺激或者其它一些外源因素(如药物等)的代谢应答,已经被广泛应用到疾病诊断、病理学、药理学和毒理学等生命科学领域[12-14].基于核磁共振(nuclear magnetic resonance, NMR)技术的代谢组学方法可以无偏向性地检测大量代谢物,涵盖糖代谢、氨基酸代谢、胆碱代谢、核苷酸代谢等多种代谢途径[15-18],能为本研究提供重要的代谢物轮廓信息,是代谢组非靶向研究的重要工具.考虑DOX和TAX的治疗对象以乳腺癌患者为主,脾脏作为参与肿瘤免疫反应的重要器官,考察其代谢组的变化可以直接反映机体在药物影响下免疫系统的调节情况.因此本研究采用经典的4T1小鼠原发性乳腺癌细胞原位移植的动物模型,以基于NMR的代谢组学为平台,通过比较荷瘤小鼠及其在DOX和TAX以传统给药和基于mPEG-PLGA纳米载体给药方式时脾脏代谢组与健康对照组小鼠脾脏代谢表型的差异,对不同给药方式影响乳腺癌特定器官的代谢组进行研究.本研究同时为该乳腺癌小鼠模型的脾脏这一重要免疫器官的代谢表型信息提供了基础研究数据.
1 实验部分 1.1 药品与化学试剂盐酸阿霉素与TAX购于百灵威科技有限公司,mPEG-PLGA包埋DOX与TAX的纳米聚合物(NP-DT)由国家纳米科学中心提供.甲醇、K2HPO4·3H2O、NaH2PO4·2H2O(分析纯)购于上海国药集团化学试剂有限公司,2, 2, 3, 3-氘代三甲基硅烷丙酸钠(TSP)购于美国剑桥同位素实验室.
1.2 动物实验及样品收集4T1小鼠乳腺癌细胞系购于中国科学院上海细胞库,培养细胞使用的90% DMEM(dulbecco’s modified eagle medium)培养基和10%胎牛血清购于美国英杰公司,细胞生长于37 ℃、含5% CO2的培养箱中.
48只6周龄大小的雌性无特定病原(specific pathogen free, SPF)级BALB/c小鼠购于北京维通利华实验动物技术有限公司,小鼠饲养于中国科学院武汉物理与数学研究所SPF级动物房.适应两周后,小鼠被随机分为4组,对其中3组小鼠的第4对乳腺脂肪垫移植5×105个悬浮于200 μL磷酸盐缓冲液(phosphate buffer solution, PBS)的4T1细胞,另外1组健康对照组小鼠注射的200 μL PBS缓冲溶液.3组荷瘤小鼠的平均肿瘤大小达到150 mm3后,对这3组小鼠分别尾静脉注射生理盐水(用量为与给药组对应的溶剂体积)、8.62 μmol/kg.bw DOX和4.61 μmol/kg.bw TAX(D/T)或包埋等量药物的纳米药物(NP-DT),健康对照组同样通过尾静脉注射等体积生理盐水,每间隔3天给药1次.完成3次给药后,于首次给药后的第14天处死小鼠,取小鼠脾脏称重后进行液氮速冻并保存于-80 ℃冰箱中.
1.3 尿酸检测血清样本在处死小鼠前通过摘眼球采血获得.尿酸(uric acid,UA)的临床血生化检测由武汉大学人民医院检验科采用HITACHI 7080全自动生化分析仪完成.
1.4 代谢物提取取50 mg脾脏样品加入600 μL提取液(V甲醇:V水=2:1)涡旋混匀后,使用组织破碎仪(德国凯杰)在20 Hz频率下匀浆90 s,匀浆破碎的样品经过冰浴超声3次后离心(12 000 g,4 ℃)10 min收集上清.离心后的沉淀加入600 μL提取液重复上述操作,共提取3次.3次提取得到的上清混合后使用真空旋转蒸发仪(德国赛默飞世尔)去除甲醇后,使用冷冻干燥机获得提取物冻干粉.将提取物冻干粉溶于600 μL磷酸盐缓冲溶液(0.1 mol/L,pH 7.4,VK2HPO4:VNaH2PO4 = 4:1,含0.01% TSP和75% D2O),离心(12 000 g,4 ℃)10 min后取550 μL上清至直径为5 mm的NMR样品管待测.
1.5 NMR实验在配备5 mm TCI超低温探头的德国Bruker Avance Ⅲ 600型NMR谱仪上,采用标准noseygppr1d脉冲序列采集小鼠脾脏提取物的1H NMR全谱,采样温度为298 K,谱宽设定为12 000 Hz,采样点数为64 k,累加扫描64次,循环等待时间和混合时间分别为2 s和100 ms.
为了对脾脏中的代谢物进行归属,在该NMR谱仪上采集了一系列的二维图谱,包括1H-1H COSY、1H-1H TOCSY、1H-13C HSQC、1H-13C HMBC和J-Res,实验温度为298 K.其中COSY和TOCSY的F2维(1H)和F1维(1H)谱宽设定为6 313.13 Hz,采样点数t2×t1 = 2 048×128,每个t1增量累加64次.HSQC F2维(1H)和F1维(13C)谱宽分别为6 313.13 Hz和26 410.10 Hz,HMBC F2维(1H)和F1维(13C)谱宽分别为6 313.13 Hz和33 201.93 Hz,采样点数均为t2×t1 = 2 048×120,每个t1增量累加扫描320次.J-Res的F2维(1H)谱宽设定为6 313.13 Hz,采样点数为t2×t1 = 2 048×48,每个t1增量累加扫描64次.
1.6 NMR谱图处理及多变量统计分析NMR图谱处理在Topspin V3.1(Bruker,德国)软件上进行,傅里叶变换后的谱图在进行了相位和基线校正,以及TSP定标后使用AMIX软件(Bruker,德国)进行分段积分,积分间隔选取1.2 Hz,积分区段为δ 0.5~9.5,同时删去受水峰和甲醇峰影响较大的δ 4.7~5.2和δ 3.35~3.37区段.分段积分后的值对各脾脏样本湿重进行归一化.
归一化后的数据矩阵使用SIMCA-P+ V12.0(Umetrics,瑞典)进行多变量统计学分析.主成分分析(principal component analysis,PCA)采用中心化(mean-center,ctr)对数据进行标准化处理后进行建模.正交偏最小二乘法判别分析(orthogonal partial least squares-discriminant analysis, OPLS-DA)采用Pareto(Par)进行数据标准化处理,再分别对健康小鼠脾脏与不同处理的荷瘤小鼠(荷瘤+生理盐水组、荷瘤+D/T组和荷瘤+NP-DT组)的脾脏进行两两比较的建模,通过R2X、Q2和CV-ANOVA的p值对模型的有效性进行评判.将模型信息回溯转换获取在相互比较的两组间显著变化的代谢物(协相关系数|r|>0.553).采用Chenomx profiler(Chenomx,加拿大)软件进行积分和定量(参考内标TSP),随后通过SPSS V20.0(IBM,美国)进行独立样本t-test(95%置信度),以对在相互比较的两组间代谢物浓度变化作进一步统计学分析.
2 结果与讨论 2.1 脾脏重量脾脏是机体最大的免疫器官和免疫中心,脾脏肿大在荷瘤机体中普遍存在[19, 20].本研究中的健康对照组小鼠脾脏重量为(76.2±22.7)mg,而3组荷瘤小鼠脾脏重量则分别高达(225.0±44.7)mg(荷瘤+生理盐水组)、(235.7±48.5)mg(荷瘤+D/T组)和(246.2±30.8)mg(荷瘤+NP-DT组).3组荷瘤小鼠与健康对照组的脾脏重量进行对比时,t-test的p值均小于0.001;而荷瘤+D/T或荷瘤+NP-DT处理相比生理盐水处理的荷瘤小鼠,脾脏重量没有统计学差异(图 1).
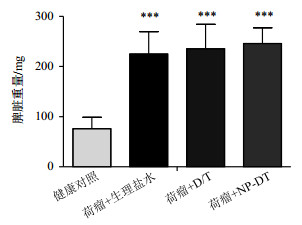
|
图 1 各组小鼠脾脏湿重的t-test分析(n=12).3组荷瘤小鼠与健康对照组的脾脏重量进行对比时,t-test的p值均小于0.001(***);而荷瘤+D/T或荷瘤+NP-DT处理相比生理盐水处理的荷瘤小鼠,脾脏重量没有统计学差异 Figure 1 t-test for spleen weight of healthy control, tumor bearing mice treated with saline, D/T or NP-DT (n = 12). Difference is statistically significant by two-tailed t-test (***p < 0.001) when comparing 3 tumor-bearing groups with healthy controls, while there no significant difference exists between tumor groups treated with D/T or NP-DT and saline |
健康小鼠和荷瘤小鼠脾脏提取物的1H NMR均值谱如图 2所示.代谢物的归属通过二维谱图和相关文献[21-23],结合公共数据库BMRB(biological magnetic resonance bank)和HMDB(human metabolome database)进行确认.归属出的45种代谢物(表 1)涵盖了涉及糖代谢、氨基酸代谢、核苷酸代谢、胆碱代谢等多条代谢通路.
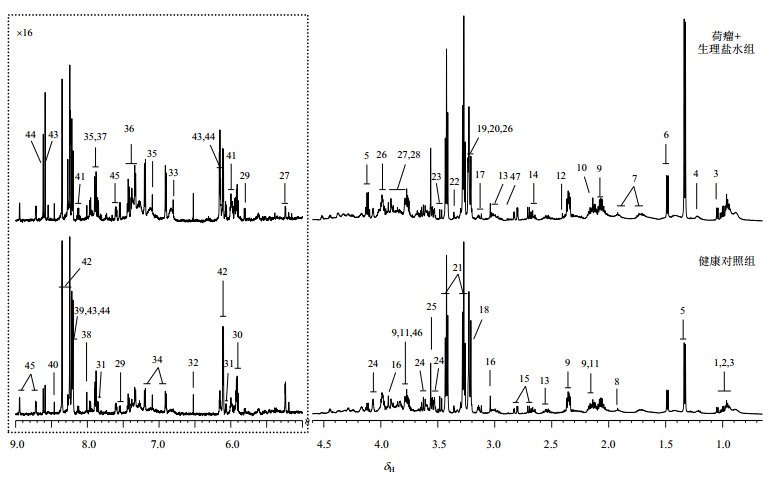
|
图 2 小鼠脾脏提取物的1H NMR谱图(上图为荷瘤+生理盐水组小鼠脾脏提取物均值谱,下图为健康对照组小鼠脾脏提取物均值谱).虚线框部分纵向放大16倍 Figure 2 1H NMR spectra of mouse spleen extracts (the above presents the average spectrum of spleen extract from tumor-bearing mice treated with saline; the below is the average spectrum of spleen extracts from healthy mice). The spectra in the dashed box are longitudinally expanded for 16 times |
| 表 1 小鼠脾脏水相提取物1H和13C NMR归属 Table 1 1H and 13C NMR assignments for metabolites in spleen hydrophilic extracts of mice |
4组48个脾脏的水相提取物数据矩阵在降维后的分布如图 3的PCA得分图所示,各组之间有明显的分离趋势.通过OPLS-DA对健康组小鼠和3组不同处理的荷瘤组小鼠分别建模,以提取组间具有显著差异的代谢物信息.3组OPLS-DA模型均表现有较好的可解释性、可预测性和有效性(表 2).对模型相关信息进行回溯转换得到的显著变化代谢物进行积分拟合和定量后,各组显著变化的代谢物如图 4所示.结果显示4T1细胞的植入,显著地对小鼠脾脏细胞的糖代谢、氨基酸代谢、核苷酸代谢、胆碱代谢以及涉及肠道菌群共代谢等各种代谢途径产生了较大扰动.DOX和TAX传统给药和通过纳米载体包埋给药两种不同方式并没有显著逆转由4T1生长引起的小鼠脾脏代谢组变化趋势,但是传统的D/T药物处理使得荷瘤小鼠脾脏中的上调的TMAO恢复到了健康对照组水平,NP-DT对脾脏代谢组的影响则表现为对葡萄糖和延胡索酸变化水平的调节.

|
图 3 小鼠脾脏代谢物主成分分析三维得分分布图 Figure 3 Three-dimensional PCA scores plot from the spleen metabonome of healthy control, tumor bearing mice treated with saline, D/T or NP-DT |
| 表 2 小鼠脾脏代谢组OPLS-DA模型质量参数表 Table 2 OPLS-DA model parameters of spleen extracts generated from comparing healthy control with tumor bearing mice treated with saline, D/T and DT-NP |
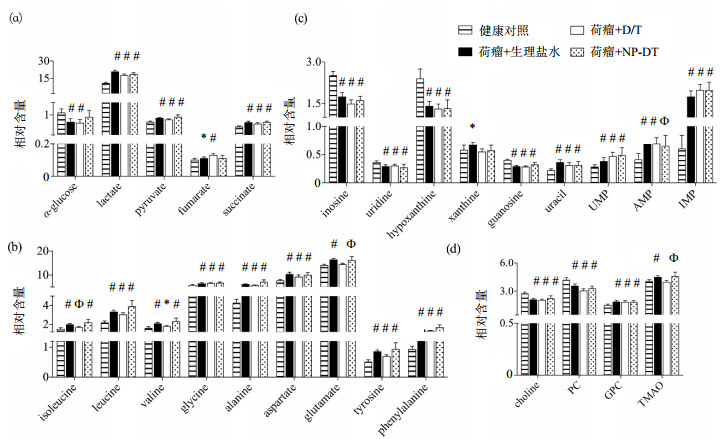
|
图 4 脾脏中荷瘤小鼠各处理组与健康对照组比较时,显著变化的代谢物 Figure 4 Significantly changed metabolites in spleen of tumor mice treated with saline, D/T and NP-DT groups compared to the healthy mice (n=12). Data are presented as the mean ± standard deviation. *p < 0.05, Φ p < 0.01, #p < 0.001, by two-tailed t-test |
4T1乳腺癌细胞系的引入对小鼠脾脏的形态、重量和代谢表型均产生了剧烈的影响.这些影响在DOX和TAX的两种不同给药形式的干预下,没有形态和重量等宏观上的改变(图 1),但是它们在代谢表型上表现出来的差异值得进一步比较和研究.
2.4.1 糖代谢及TCA循环4T1细胞的引入使得小鼠脾脏的葡萄糖浓度出现了显著下调,以及丙酮酸、乳酸、延胡索酸和琥珀酸浓度的上升,这些活跃的能量供应可以最大限度的满足肿瘤生长的需求[24-26].不同于抗肿瘤药物对肿瘤细胞和其它脏器中活跃的瓦伯格效应(Warburg effect)的抑制[27],DOX和TAX联合使用的两种不同给药方式对于乳酸升高均没有表现出显著的抑制效果,但是通过纳米包埋的NP-DT处理改变了荷瘤小鼠生理盐水处理组和传统给药方式处理组中葡萄糖和延胡索酸浓度的变化趋势,提示这一给药方式可以在一定程度上减少对肿瘤生长的能量供应.
2.4.2 氨基酸代谢生理盐水处理及两种不同给药方式处理的荷瘤小鼠脾脏中的氨基酸水平(alanine、aspartate、glutamate、glycine、valine、isoleucine、leucine、tyrosine、phenylalanine)相较于健康小鼠均出现了显著的上升.脾脏中氨基酸显著上调的同时还伴随着次黄嘌呤核苷的显著下调.次黄嘌呤核苷是转运RNA的重要组成成分,在基因翻译的摆动配对中起到关键作用[28, 29].一系列氨基酸的上调提示了脾脏中可能存在着氨基酸转运过程的扰动,它们的变化可能是为了满足肿瘤生长所需的大量能量供应,或者是为了满足免疫活跃的肿大脾脏自身的物质需求.虽然通过D/T给药处理后,谷氨酸的浓度恢复到了健康对照组水平,同时异亮氨酸和缬氨酸的浓度也表现出下调的趋势,但两种给药方式均未能显著改变肿瘤生长过程脾脏这一脏器中氨基酸的上升趋势.说明不同药物干预对脾脏向肿瘤组织提供能量或者调控自身免疫的影响不大.
2.4.3 核苷酸代谢在受感染而引起脾脏肿大的动物模型中,二磷酸腺苷(ADP)、AMP、尿嘧啶的上调伴随次黄嘌呤和胞嘧啶核苷的下调已见报道[30].本研究也发现AMP、UMP、IMP、尿嘧啶的上调伴随次黄嘌呤、次黄嘌呤核苷、尿嘧啶核苷和鸟嘌呤核苷的下调,这一变化提示了核苷酸合成代谢的活跃.AMP和UMP等都是RNA的重要结构组成,充足的核苷酸供应和RNA的合成可以保证处于免疫活跃状态下并伴随着重量不断增长的脾脏中各种抗体、免疫因子等基础蛋白的合成.从该研究结果来看,不同给药方式干预对该变化未产生影响.
在D/T及NP-DT的不同给药方式作用下,这两组荷瘤小鼠脾脏的黄嘌呤浓度均恢复到正常小鼠水平.虽然荷瘤小鼠脾脏中的黄嘌呤水平显著升高,但在脾脏和血样中并没有观察到尿酸水平的异常变化,而受两种不同给药方式处理的小鼠血液中,尿酸水平(表 3)均显著上升,这一变化可能与D/T及NP-DT对黄嘌呤氧化酶活跃程度的影响有关.
| 表 3 4组小鼠血液中的尿酸浓度 Table 3 Uric acid contents in serum from mice of 4 groups (n = 12) |
4T1的生长导致小鼠脾脏中胆碱代谢相关的物质发生了显著的变化.胆碱代谢又称肯尼迪循环(Kennedy cycle),对细胞膜的生物合成与降解有非常重要的意义[31, 32].胆碱可以通过胆碱激酶转化为磷酸胆碱,再进一步生成磷脂酰胆碱(卵磷脂)参与细胞膜的组成.卵磷脂的分解也可以通过生成甘油磷酸胆碱得到胆碱来进一步循环生成磷酸胆碱或者卵磷脂.胆碱和磷酸胆碱的显著下调同时甘油磷酸胆碱的显著上调提示了细胞膜生物合成的需求升高,这一需求可能是为了满足脾脏自身或者4T1肿瘤的生长.不同给药方式干预均对4T1生长产生的胆碱代谢物变化没有产生影响.
我们在结果中发现4T1荷瘤小鼠脾脏中出现了显著的TMAO浓度升高(图 4).TMAO是哺乳动物的胆碱和肉碱通过肠道微生物产生后经过肝肠循环被肝脏所吸收的代谢物.较高的TMAO浓度会减少肠道、肝脏和血管壁中的胆固醇的清除而使胆固醇沉积[33, 34].脾脏中TMAO的变化提示了肿瘤的生长可能同样影响了肠道微生物的功能以及荷瘤小鼠的胆固醇代谢.在D/T的药物干预下,TMAO的浓度恢复到了健康小鼠水平,体现了D/T在改善荷瘤机体肠道微生物功能等方面的药效.而NP-DT在机体中的平稳缓释相对于D/T的直接作用在脾脏胆碱相关代谢的恢复上并没有表现出太大优势.
3 结论本文通过基于NMR的代谢组学方法研究了4T1荷瘤乳腺癌小鼠与正常小鼠脾脏代谢组表型的差异,发现了荷瘤小鼠除了出现明显的脾脏肿大外,为了供应肿瘤的生长以及满足自身的免疫调节,其脾脏的糖类、氨基酸、有机酸、核酸和胆碱等一系列代谢物均发生了显著性变化.两种不同给药方式对荷瘤小鼠脾脏代谢组的影响也表现出了明显的差异性,传统给药模式对TMAO相关的肠道微生物代谢紊乱有较好效果,而通过纳米载体的给药方式更有利于缓和荷瘤小鼠葡萄糖和延胡索酸等糖代谢相关的能量供应.但是DOX和TAX无论是以传统方式还是新型纳米载体传递系统进行给药,对荷瘤小鼠脾脏其它显著受扰动代谢物的恢复作用却不大.这可能与4T1细胞的侵袭性较强,脾脏本身对外来4T1细胞生长的免疫应答程度较大,代谢组扰动剧烈,同时药物治疗的次数较少有关.后期可以考虑增加给药剂量和给药次数以区分和放大不同给药方式对脾脏代谢组的影响差异,也可以对其它重要靶器官如肝脏、肾脏和心脏等的代谢表型变化予以关注.以上研究为更全面认识荷瘤小鼠脾脏这一重要免疫器官的代谢表型变化和不同给药方式对脾脏代谢组的影响提供了基础数据.
| [1] | GEHL J, BOESGAARD M, PAASKE T, et al. Combined doxorubicin and paclitaxel in advanced breast cancer:effective and cardiotoxic[J]. Ann Oncol, 1996, 7(7): 687-693. DOI: 10.1093/oxfordjournals.annonc.a010717. |
| [2] | TACAR O, SRIAMORNSAK P, DASS C R. Doxorubicin:an update on anticancer molecular action, toxicity and novel drug delivery systems[J]. J Pharm Pharmacol, 2013, 65(2): 157-170. DOI: 10.1111/j.2042-7158.2012.01567.x. |
| [3] | SCHALHORN B. Paclitaxel (taxol)——a cytostatic drug with a new kind of mechanism of action[J]. Med Kiln Suppl, 1993, 2: 4-6. |
| [4] | WANG T H, WANG H S, SOONG Y K. Paclitaxel-induced cell death:where the cell cycle and apoptosis come together[J]. Cancer, 2000, 88(11): 2619-2628. DOI: 10.1002/(ISSN)1097-0142. |
| [5] | HENDERSON I, BERRY D A, DEMETRI G D, et al. Improved outcomes from adding sequential paclitaxel but not from escalating doxorubicin dose in an adjuvant chemotherapy regimen for patients with node-positive primary breast cancer[J]. J Clin Oncol, 2003, 21(6): 976-983. DOI: 10.1200/JCO.2003.02.063. |
| [6] | GIORDANO S H, LIN Y L, KUO Y F, et al. Decline in the use of anthracyclines for breast cancer[J]. J Clin Oncol, 2012, 30(18): 2232-2239. DOI: 10.1200/JCO.2011.40.1273. |
| [7] | TORCHILIN V P. Multifunctional nanocarriers[J]. Adv Drug Deliver Rev, 2006, 58(14): 1532-1555. DOI: 10.1016/j.addr.2006.09.009. |
| [8] | DIAO Y Y, HAN M, DING P T, et al. DOX-loaded PEG-PLGA and Pluronic copolymer composite micelles enhances cytotoxicity and the intracellular accumulation of drug in DOX-resistant tumor cells[J]. Pharmazie, 2010, 65(5): 356-358. |
| [9] | GUO J W, GAO X L, SU L, et al. Aptamer-functionalized PEG-PLGA nanoparticles for enhanced anti-glioma drug delivery[J]. Biomaterials, 2011, 32(31): 8010-8020. DOI: 10.1016/j.biomaterials.2011.07.004. |
| [10] | WANG H, WU Y, ZHAO R F, et al. Engineering the assemblies of biomaterial nanocarriers for delivery of multiple theranostic agents with enhanced antitumor efficacy[J]. Adv Mater, 2013, 25(11): 1616-1622. DOI: 10.1002/adma.201204750. |
| [11] | WANG H, ZHAO Y, WU Y, et al. Enhanced anti-tumor efficacy by co-delivery of doxorubicin and paclitaxel with amphiphilic methoxy PEG-PLGA copolymer nanoparticles[J]. Biomaterials, 2011, 32(32): 8281-8290. DOI: 10.1016/j.biomaterials.2011.07.032. |
| [12] | NICHOLSON J K, LINDON J C, HOLMES E. 'Metabonomics':understanding the metabolic responses of living systems to pathophysiological stimuli via multivariate statistical analysis of biological NMR spectroscopic data[J]. Xenobiotica, 1999, 29(11): 1181-1189. DOI: 10.1080/004982599238047. |
| [13] | TANG H R, WANG Y L. Metabonomics:a revolution in progress[J]. Prog Biochem Biophys, 2006, 33(5): 401-417. |
| [14] | KADDURAH-DAOUK R, KRISTAL B S, WEINSHILBOUM R M. Metabolomics:a global biochemical approach to drug response and disease[J]. Annu Rev Pharmacol Toxicol, 2008, 48: 653-683. DOI: 10.1146/annurev.pharmtox.48.113006.094715. |
| [15] | BATHEN T F, SITTER B, SJOBAKK T E, et al. Magnetic resonance metabolomics of intact tissue:a biotechnological tool in cancer diagnostics and treatment evaluation[J]. Cancer Res, 2010, 70(17): 6692-6696. DOI: 10.1158/0008-5472.CAN-10-0437. |
| [16] | ZHANG L M, WANG L M, HU Y L, et al. Selective metabolic effects of gold nanorods on normal and cancer cells and their application in anticancer drug screening[J]. Biomaterials, 2013, 34(29): 7117-7126. DOI: 10.1016/j.biomaterials.2013.05.043. |
| [17] |
SONG Y P, LI N, XUE H S, et al. Metabonomics analysis of brown adipose and white adipose tissues[J].
Chinese J Magn Reson, 2016, 33(2): 208-223.
宋懿朋, 李宁, 薛海斯, 等. 棕色脂肪组织和白色脂肪组织的代谢组学研究[J]. 波谱学杂志, 2016, 33(2): 208-223. DOI: 10.11938/cjmr20160204. |
| [18] |
CHEN L, SONG K, WANG Y L. Effects of attenuated salmonella typhimurium infection on fecal metabonome in mice[J].
Chinese J Magn Reson, 2014, 31(3): 349-363.
陈璐, 宋侃, 王玉兰. 感染减毒鼠伤寒沙门氏菌对小鼠粪样代谢组的影响[J]. 波谱学杂志, 2014, 31(3): 349-363. |
| [19] | FLORESCU I, FEKETE T, TICLETE I. Splenomegaly in pancreatic cancer[J]. Med Interna (Bucur), 1968, 20(7): 833-837. |
| [20] | PAOLINI R, TOFFOLI S, POLETTI A, et al. Splenomegaly as the first manifestation of thyroid cancer metastases[J]. Tumori, 1997, 83(4): 779-782. |
| [21] | JIANG L M, HUANG J, WANG Y L, et al. Metabonomic analysis reveals the CCl4-induced systems alterations for multiple rat organs[J]. J Proteome Res, 2012, 11(7): 3848-3859. DOI: 10.1021/pr3003529. |
| [22] | AN Y P, XU W X, LI H D, et al. High-fat diet induces dynamic metabolic alterations in multiple biological matrices of rats[J]. J Proteome Res, 2013, 12(8): 3755-3768. DOI: 10.1021/pr400398b. |
| [23] | SONG Y P, ZHAO R F, HU Y L, et al. Assessment of the biological effects of a multifunctional nano-drug-carrier and its encapsulated drugs[J]. J Proteome Res, 2015, 14(12): 5193-5201. DOI: 10.1021/acs.jproteome.5b00513. |
| [24] | GATENBY R A, GILLIES R J. Why do cancers have high aerobic glycolysis?[J]. Nat Rev Cancer, 2004, 4(11): 891-899. DOI: 10.1038/nrc1478. |
| [25] | GIAMPAZOLIAS E, TAIT S W. Mitochondria and the hallmarks of cancer[J]. FEBS J, 2016, 283(5): 803-814. DOI: 10.1111/febs.13603. |
| [26] | HANAHAN D, WEINBERG R A. The hallmarks of cancer[J]. Cell, 2000, 100(1): 57-70. DOI: 10.1016/S0092-8674(00)81683-9. |
| [27] | LAMEGO I, DUARTE I F, MARQUES M P, et al. Metabolic markers of MG-63 osteosarcoma cell line response to doxorubicin and methotrexate treatment:comparison to cisplatin[J]. J Proteome Res, 2014, 13(12): 6033-6045. DOI: 10.1021/pr500907d. |
| [28] | CRICK F H. Codon-anticodon pairing:the wobble hypothesis[J]. J Mol Biol, 1966, 19(2): 548-555. DOI: 10.1016/S0022-2836(66)80022-0. |
| [29] | VARANI G, MCCLAIN W H. The G x U wobble base pair. A fundamental building block of RNA structure crucial to RNA function in diverse biological systems[J]. EMBO reports, 2000, 1(1): 18-23. DOI: 10.1093/embo-reports/kvd001. |
| [30] | ZHU X Y, LEI H H, WU J F, et al. Systemic responses of BALB/c mice to Salmonella typhimurium infection[J]. J Proteome Res, 2014, 13(10): 4436-4445. DOI: 10.1021/pr500770x. |
| [31] | FAGONE P, JACKOWSKI S. Phosphatidylcholine and the CDP-choline cycle[J]. Biochim Biophys Acta, 2013, 1831(3): 523-532. DOI: 10.1016/j.bbalip.2012.09.009. |
| [32] | ABOAGYE E O, BHUJWALLA Z M. Malignant transformation alters membrane choline phospholipid metabolism of human mammary epithelial cells[J]. Cancer Res, 1999, 59(1): 80-84. |
| [33] | WANG Z, ROBERTS A B, BUFFA J A, et al. Non-lethal inhibition of gut microbial trimethylamine production for the treatment of atherosclerosis[J]. Cell, 2015, 163(7): 1585-1595. DOI: 10.1016/j.cell.2015.11.055. |
| [34] | WARRIER M, SHIH D M, BURROWS A C, et al. The TMAO-generating enzyme flavin monooxygenase 3 is a central regulator of cholesterol balance[J]. Cell Rep, 2015, 10(3): 326-338. DOI: 10.1016/j.celrep.2014.12.036. |
 2018, Vol. 35
2018, Vol. 35 
