2. 中国科学院生物磁共振分析重点实验室, 波谱与原子分子物理国家重点实验室, 武汉磁共振中心(中国科学院, 武汉物理与数学研究所), 湖北 武汉 430071
2. CAS Key Laboratory of Biomedical Magnetic Resonance Analysis, State Key Laboratory of Magnetic Resonance and Atomic and Molecular Physics, National Center for Magnetic Resonance in Wuhan(Wuhan Institute of Physics and Mathematics, Chinese Academy of Sciences), Wuhan 430071, China
自20世纪40年代问世以来,已有5次诺贝尔奖被授予在核磁共振(nuclear magnetic resonance,NMR)领域做出杰出贡献的科学家们.NMR是自旋量子数不为0(I≠0)的原子核在特定磁场中自旋能级发生塞曼分裂,在特定频率的脉冲(射频)作用下发生能级跃迁的现象.
NMR波谱利用NMR现象从原子水平上探测物质的微观结构,因具备操作简便、检测快速、高通量、重复性好等特点,在生物医学领域迅速得到广泛应用,包括基础科学研究、临床疾病诊断和预后.根据所测原子核的不同,可将NMR波谱分为基于1H、13C、14N、15N、19F、31P、23Na核的NMR波谱等.基于不同原子核的NMR波谱具有不同的优势;在生物医学领域,也具有不同的应用范围.例如研究大脑区域性葡萄糖代谢速率可采用基于13C核的NMR波谱技术[1],结合同位素标记技术和特殊的去耦技术,可靶向检测大脑内特定物质的代谢.例如将13C标记的葡萄糖或醋酸钠等通过外周血管注入大鼠体内,通过POCE(proton observed carbon edit)技术[2]或13C NMR[3]技术可实时检测大鼠脑内(活体或离体)谷氨酸(glutamate,Glu)、γ-氨基丁酸(gamma-amino butyric acid,GABA)和谷氨酰胺(glutamine,Gln)等物质的代谢水平和代谢速率,继而获得特定时刻脑内特定神经元及胶质细胞的活动状态.基于14N核和15N核的NMR波谱的联合在蛋白质代谢研究中具有独特优势.基于31P核的NMR波谱技术在研究大脑能量代谢领域运用广泛[4].而基于23Na核和39K核的NMR波谱技术可用于研究钠离子和钾离子的动态变化[5].而作为生命体含量最为丰富的氢原子,基于1H核的NMR波谱在代谢组学、代谢动力学等研究领域应用最为广泛[3-6].尽管NMR波谱灵敏度较低,但若结合动态核激化(dynamic nuclear polarization,DNP)等技术,其灵敏度可显著提高:一般而言,基于1H核的NMR 实验的灵敏度可提高数倍,基于13C核的NMR实验的灵敏度提高可至数百倍[7].
根据检测对象和使用仪器的不同,NMR波谱技术又可分为活体谱(in vivo magnetic resonance spectroscopy,in vivo MRS)和离体谱两大类.其中,活体谱的采集对象为存在生命体征的人体或动物,而离体谱为人体或动物组织的提取物、体液等样品的谱图.
在生物医学研究领域应用最为广泛的基于1H核的NMR波谱按习惯也可以分为活体磁共振氢谱(proton magnetic resonance spectroscopy,1H MRS)和离体核磁共振氢谱(proton nuclear magnetic resonance,1H NMR).本文将对这两种技术进行概述,并讨论它们应用于脑科学领域时的差异.
1 采样设备和参数的不同就采集谱图使用的设备而言,1H MRS多采用磁共振成像(magnetic resonance imaging,MRI)扫描仪完成,而1H NMR则多采用NMR谱仪,两种仪器对于场强分别习惯以特斯拉(T)和兆赫兹(MHz)描述.
1H NMR和1H MRS技术虽都属于NMR波谱,但二者的采样对象却有显著区别.1H NMR一般采集的是整个样品的谱图;而1H MRS既可以采集组织整体的谱图,更可以采集空间定域谱,即空间中部分组织的谱图.这是因为1H MRS方法通过在主磁场(B0)或射频场(B1)方向叠加一个梯度场,可以实现空间定位.其中可实现成功定位的技术包括深度分辨表面波谱技术(depth-resolved surface spectroscopy,DRESS)、活体内图像选择波谱技术(bpxzz-37-2-232-selected in vivo spectroscopy,ISIS)、激励回波采样模式(stimulated echo acquisition mode,STEAM)和点分辨自旋回波波谱定位技术(point-resolved echo spin spectroscopy,PRESS)等等.其中,PRESS技术已广泛应用于1H MRS,它包含90˚-180˚-180˚脉冲,每个射频脉冲都是层选脉冲,且梯度场作用在3个互相垂直方向,可以得到定位区域内完整的信号.因此,1H MRS技术的待测样品多为活体组织.在实际检测中,为更好地观测到组织内或样品中的待测物质,两种技术都需要对样品或组织中水信号进行压制.1H MRS多采用成熟的预饱和压水技术,而1H NMR可采用的压水技术则较多,例如预饱和压水、WATERGATE及ES(excitation sculpting)技术等等.
与1H MRS相比,1H NMR技术可获得多种多维谱图信息,从而对待测样品中的未知组分进行代谢物归属,如:氢-氢相关谱(1H-1H correlation spectroscopy,COSY)、J-分解谱(J-resolved spectroscopy,J-Res)、氢-氢全相关谱(1H-1H total correlation spectroscopy,TOCSY)、氢-碳异核单量子相关谱(1H-13C heteronuclear single quantum correlation,HSQC)和氢-碳异核多键相关谱(1H-13C heteronuclear multiple bond correlation,HMBC)等.
2 检测灵敏度不同大鼠脑组织1H MRS和1H NMR的谱图主要包含如下代谢物的信息:乳酸(lactate,Lac)、N-乙酰天门冬氨酸(N-acetyl aspartate,NAA)、胆碱(choline,Cho)、谷氨酸和谷氨酰胺复合物(Glu+ Gln,Glx)、GABA、肌酸(creatine,Cr)、肌醇(myo-inositol,Ins),丙氨酸(alanine,Ala)、Glu、Gln、天门冬氨酸(aspartate,Asp)、牛磺酸(taurine,Tau)、甘氨酸(glycine,Gly)、丙酮(acetone,Ace)、脂质和葡萄糖等代谢物信息[8, 9].基于1H NMR的部分代谢组分在青年大鼠(1-2月龄)大脑皮层中的浓度[10]见表 1所示.
| 表 1 基于1H NMR的青年大鼠大脑皮层小分子代谢物浓度范围[10] Table 1 Concentration ranges of small molecule metabolites in cerebral cortex ofyoung rats based on 1H NMR[10] |
在检测这些组分时,这两种技术的检测灵敏度和谱图信噪比具有一定差异.1H MRS技术通过特定的序列可以对某个感兴趣区域(region of interest,ROI)的代谢物信息进行实时捕获,实现较准确的空间定位.但受限于检测方法,1H MRS无法对不规则状脑区,例如整个海马脑区进行精准定位扫描.而且1H MRS谱图易受到生物大分子、脂质和水分子的影响,因此谱峰分辨率较低,一般用于检测组织内浓度较高的物质,如Cr和NAA等等.而1H NMR技术可以对整个组织进行代谢组分分析[11, 12];也可以将组织进行匀浆,进行代谢物全组分提取和富集,进而进行准确的定性和定量分析[6, 13].经过大分子沉淀和多次离心后,样品均匀度好、谱峰分辨率较高、可检测到的代谢物种类较多,同时对待测物质的浓度要求相对较低,一般达到微摩尔(μmol)级即可被检测出.因此,在相同磁场强度的检测条件下,1H NMR的磁场均匀性、检测灵敏度和信噪比远高于1H MRS(图 1).
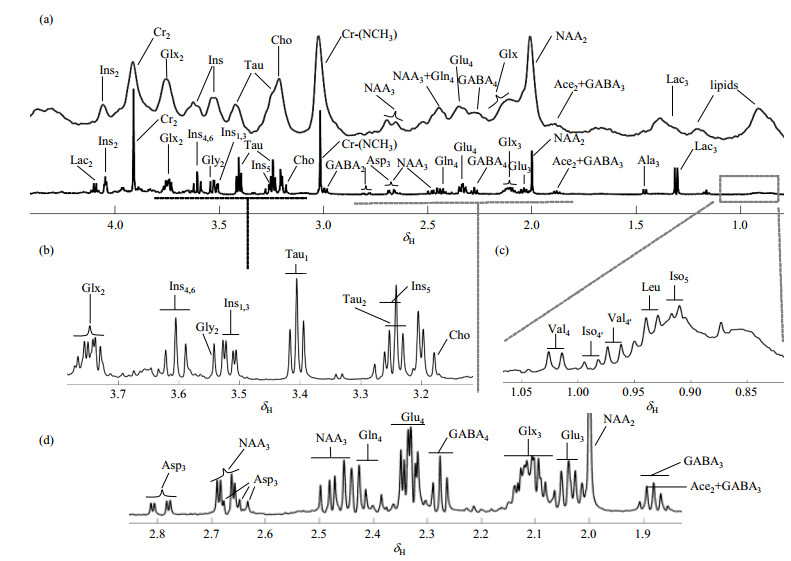
|
图 1 小鼠大脑皮层的1H MRS(7.0 T)与1H NMR(600 MHz)谱图示例.(a)上方为1H MRS谱图,下方为1H NMR谱图;(b)~(d)分别是(a)图中1H NMR谱图的放大谱图. Lac,乳酸;Ins,肌醇;Cr,肌酸;Glx,谷氨酸和谷氨酰胺复合物;Gly,甘氨酸;Tau,牛磺酸;Cho,胆碱;GABA,γ-氨基丁酸;Asp,天门冬氨酸;NAA,N-乙酰天门冬氨酸;Glu,谷氨酸;Gln,谷氨酰胺;Ace,丙酮;Ala,丙氨酸;Val,缬氨酸;Iso,异亮氨酸;Leu,亮氨酸 Fig. 1 The 1H MRS (7.0 T) and 1H NMR (600 MHz) spectra of mouse cortex. (a) 1H MRS spectrum (up) and 1H NMR spectrum (bottom); (b)~(d) represent the amplify spectra of 1H NMR spectrum in Fig. (a). Lac, lactate; Ins, myo-inositol; Cr, creatine; Glx, glutamate+glutamine; Gly, glycine; Tau, taurine; Cho, choline; GABA, gamma-amino butyric acid, Asp, aspartate; NAA, N-acetyl aspartate; Glu, glutamate; Gln, glutamine; Ace, acetone; Ala, alanine; Val, valine; Iso, isoleucine; Leu, leucine |
在脑科学基础研究领域,1H MRS技术的检测对象主要包括啮齿类动物(大鼠和小鼠)、树鼩、犬、猫及猴,其检测前最主要的准备工作是对待测动物进行麻醉和固定.待检动物被麻醉后,利用特定的装置将其固定与动物床,通过MRI扫描仪对大脑的不同层面(水平面、冠状面和矢状面)进行结构成像,以便调整动物的位置,使待测脑区处于最有利于接收线圈获取信号的位置.动物固定完成后,即可进行1H MRS数据采集.就适用的动物实验而言,因1H MRS技术在检测前后勿须处死动物,因此其可对同一只动物进行不同时间和空间的纵向比较.例如研究小鼠不同脑区的代谢物水平变化与年龄的关系[14];比较同一动物接受特定干预前后的不同脑区代谢物变化;揭示与不同疾病或药物代谢相关的机制[15, 16]等.另一方面,因为是活体检测,在检测过程中机体内的代谢仍在进行,因此1H MRS技术检测的是被测个体在一定时间窗口内代谢物的平均水平.此外,被测动物在进行1H MRS检测时,需预先麻醉或通过特定装置强制固定在动物床上,此过程不仅需要一定的时间准备,并且很可能需要使用麻醉药物,因此不太适用于针对麻醉药物或急性实验的研究,例如与麻醉密切相关的术后认知功能障碍动物模型的相关研究.
1H NMR技术应用于脑科学研究时,一般是针对于脑组织样品进行研究,包括组织、体液、排泄物等.脑科学研究中,组织样品主要包括脑组织和脊髓.因为检测的是离体组织样品,其与1H MRS最大的区别是,1H NMR不能对同只动物进行不同时间点的纵向比较.生理状态下,大脑处于富氧环境,动物一旦死亡,富含氧的血液循环即停止,组织有氧代谢为主的状态很快转为无氧代谢为主,即乳酸浓度瞬间升高[17],从而影响到下游代谢产物GABA或者其他的代谢产物.因此,该技术最重要的检测前准备是组织固定.通过组织固定将机体代谢瞬时终止,方可准确地反应动物实时的代谢情况.组织固定预处理主要有三种方法,快速断头后冷冻、冷冻固定后断头[17]和微波固定后断头[18].快速断头后冷冻方法的优点是方便快捷,缺点是脑部的代谢和生化反应一直在进行,直至样品冷冻后.而伴随着脑部研究的精细化,当前的研究往往需要将脑组织进行更为精细的分区(甚至到核团水平),这意味着分离组织可能需要消耗更多的时间,因此该处理方法正逐渐被淘汰.冷冻固定后断头取材可显著减少代谢物在动物机体死亡后的变化(postmortem change)[17].但使用液氮速冻后,脑或脊髓组织的质地异常坚硬,很难对组织进行精细分区,该法当前主要应用于皮层区域的研究.另外,该方法并不能对蛋白进行彻底的变性,因此在操作过程中必须在低温条件下进行,持续利用液氮或干冰降温.微波热固定组织技术是利用微波将脑组织迅速加热,导致脑内生化反应所必需的酶发生不可逆的失活变性,将代谢反应瞬时停止,以减少代谢物的死亡后变化[18].微波作用于脑组织表面时,能够同时穿透到脑的深部,达到短时间内使组织深部和表面同时被固定的效果[18].研究表明,经微波固定的组织内代谢组分在12 h内变化不明显[19],这为脑组织的精细分离提供了充裕的时间.该方法一般先将动物麻醉,然后将动物置入特殊的微波加热装置;待微波固定完成后,将动物取出,快速冷冻降温、断头,然后对脑组织进行精细分区.微波技术自1971年问世以来,受到了广泛的关注和应用.目前啮齿类动物的微波固定装置愈发先进,功率可稳定达到数千瓦、微波时间可缩短至1 s左右[18-22].但该设备价格昂贵,并非所有实验室均可承受.近年来,有研究者发现利用家用微波炉同样可以对组织进行微波固定,但由于功率原因和加热面积不够集中,因此加热时间略长于专用微波装置[6].相较于冷冻固定法,微波固定法能够很好的保护脑组织原始解剖结构,这对于脑组织分区至关重要[23].基于以上优势,微波热固定方法已成为离体1H NMR检测时,组织样品预处理最常用的固定方法.
4 数据处理方法的不同1H MRS定量分析代谢物浓度时,主要是分析所检测区域内代谢物的总和.1H MRS的检测区域多为规则的正方体或长方体.与1H NMR相比,它更加受制于生物组织的复杂性、生物体大分子的干扰、观测区域磁场的不均匀性、实验仪器的限制,以及代谢组分之间质子信号的相互干扰以及自旋耦合等一系列因素的影响,其直接定量或者相对定量均相对更加繁琐.在定量分析前,需要对数据进行更加严格的频率、相位和基线校正,以及去噪处理等预处理.基于代谢物谱峰的高度或峰面积与其实际浓度呈正比这一关系,可采用峰高或峰面积对其进行定量分析.也可将谱图中某一浓度相对恒定的物质(如Cr[12]或者Ins[24])作为内标,计算其它代谢组分的相对含量.此外,1H MRS还可借助外标准液结合STEAM和PRESS序列来进行定量[25].基于1H MRS技术的不断发展,一系列活体波谱的拟合算法和数据处理软件应运而生,使1H MRS的定量分析更加方便,如LC Model、JMRIU、TARQUIN等[13, 26, 27].
1H NMR技术进行定量研究时,除可将某一浓度相对恒定的物质作为内标,进而计算出其它代谢组分的相对含量外[28, 29],还可实现待测组分的绝对定量.如将已知浓度的外标准品和待测样品同时加入NMR样品管进行检测,结合二者的峰面积、组织重量以及目标化合物的结构等信息获得代谢物的绝对含量.常用的外标准品包括位于dH 8.46的甲酸钠(sodium formate)和dH 0.00的三甲基硅基丙酸盐(sodium-3-trimethylsilylpropionae,TSP).选取外标准品时,一般需满足以下要求:首先外标准品必须可溶于待测溶液;其次是高度化学惰性(即外标准品不与待测样品的代谢物发生反应);外标准品应当只有一个简单或易于识别的吸收峰(即在谱图中不与其它代谢物存在谱峰重叠);此外,理想的外标准品还应当具有沸点低、易回收的性质.例如TSP一般不用于血液1H NMR波谱分析,因其能与血液中大分子蛋白发生反应[30],尤其是白蛋白[31].因此,多选用甲酸钠作为内标定量分析血液中代谢组分.1H NMR虽可定量计算NMR样管中所测物质的绝对浓度,但由于在样品提取时,难以使目标物质的提取率达到100%,因此,在进行1H NMR分析时,需增加样本数量,以消除动物个体和提取率的差异.
在离体1H NMR数据处理过程中,数据归一化(normalization)是必不可少的一环.归一化的主要目的是消除样品间不均一性(浓度或含量的不同),常用的归一化方法有不归一化[32]、质量归一化[6]、面积归一化[32]和熵归一化[33].其中不归一化是指直接将代谢物的谱峰面积积分并作为变量进行统计分析,该方法可用与成分相对稳定的样品,如血浆样品.质量归一化是将代谢物的谱峰面积积分后除以样品的质量再进行定量分析,该归一化多用于可以精确称重的组织样品,如脑和脊髓等组织样品[6, 20].面积归一化是将样本中的所有谱峰看做一个整体,先求出所有谱峰的总面积,然后将每一个峰的面积除以总面积.面积归一化得到的数据反映的是代谢物的比例,当外界因素对样品中所有物质的影响是同等程度,该归一化可有效消除稀释或提取效率等因素的影响;相反,当外界因素对样品中某变量影响巨大时(如糖尿病患者和对照组的血液或尿液中葡萄糖信号对整个样品总面积的影响),该法则不能如实还原出真实的变化[34].熵归一化一般是在面积归一化的基础上,根据一组样品(多为对照组)的谱峰分布情况,找出一个合适的谱作为参考谱,进而得出熵值分布图,并以此来还原样品的真实浓度.
5 在脑科学研究领域的具体应用的不同目前,MRS在基础实验和临床试验中均有广泛的应用,最常用的是基于1H、31P和13C核的MRS.1H MRS可用于检测几种重要的神经递质(图 1);而13C MRS通过检测葡萄糖类物质的代谢流,可在常态或病理状态下无损研究生命体组织机能;31P MRS可提供有关机体能量代谢物质和细胞内pH值等重要信息.当前,1H MRS可用于确诊疾病的发病状态以及后期治疗效果的评估等领域,已被用于多种疾病的相关研究当中,例如肝脏、心肌、骨骼肌、代谢性疾病、(颞叶)癫痫、脑出血、脑缺氧、脑损伤及精神性疾病等等.1H MRS技术在脑科学研究领域的应用前景非常广泛.Morley等[35]利用1H MRS技术对酒精依赖的成年志愿者进行检测,发现其大脑顶叶的GABA浓度与酒精性肝病的严重程度呈负相关联系.Ford等[36]采集了健康志愿者服用高剂量的B族维生素6个月前后的1H MRS谱图,发现服用B族维生素6月后,志愿者血液中的VB6含量和脑部后扣带回的NAA、Cr和Cho呈现明显的正相关,而血液中的VB12只与Cr呈正相关.Cheong等[37]利用1H MRS检测了不同阶段的肌萎缩性脊髓侧索硬化症患者和匹配的健康志愿者的大脑的细胞构筑变化,结果表明在入组后12个月的观察期内,上肢运动功能明显恶化患者的运动皮层的NAA/Ins比值显著下降,延髓功能评分下降患者脑桥的Glu+Gln含量显著增加.最近,一项多中心的临床研究发现,接受过低温治疗的新生儿脑病患者,在其出生后早期(4~14天)进行丘脑1H MRS检测,对其两年后的神经发育情况具有很好的预测作用,具体为丘脑NAA的浓度与患儿的神经发育呈现负相关联系[38].在临床诊断方面,1H MRS在临床脑瘤[39-41]、脑损伤[42]和阿尔兹海默[43]等的诊疗工作中,相比于传统的MRI,其具有更高的灵敏度和特异性(1H MRS的78% vs MRI的66%),因此经常被作为辅助诊断和疾病分级的工具[42].一般情况下,在疾病的发展过程中,代谢物质的改变先于组织病理形态的改变,1H MRS技术对这些代谢物质的改变的识别性较高,故可提供组织化学特性方面的信息,进而达到早期检测脑瘤等恶性脑疾病的目的,同时对其后期诊疗效果评估亦具有重要意义.例如,1H MRS对于脑瘤的诊断和准确定级具有重要的诊疗意义[39-41],临床医生可根据不同的诊断结果和脑瘤进程实施不同的治疗方案.
相比于1H MRS的广泛引用,1H NMR在脑科学研究领域则主要集中在基础科学研究.如Swann等[44]利用1H NMR对生长在不同饲养环境(无菌、清洁、SPF级)下的小鼠的额叶和海马组织进行代谢物检测,结果发现三种饲养环境下的小鼠在上述脑区的代谢物含量具有差异性.本文作者[6]对疼痛和瘙痒模型小鼠进行脊髓代谢物的检测,发现二者的脊髓代谢物表型明显不同.Mcguire等[45]对慢性脑损伤大鼠进行1H NMR检测,发现相比于对照组,脑损伤后代谢的异常主要集中与额叶和脑干区域.相比于1H MRS,1H NMR的优势是能够对体液的代谢物进行检测,如油脂对尿液代谢的影响[46]、急性异烟肼中毒的血液代谢变化[47]等等.另外,由于1H MRS谱图的分辨率较低、谱峰重叠严重,研究者经常采用1H NMR技术验证1H MRS的研究结果[48].
6 展望作为一种可对组织或样品实现无损检测的技术,NMR波谱自问世后,一直作为生物体内代谢物定性和定量检测的重要技术之一.在疾病的发展过程中,组织内代谢物质的改变往往早于病理组织形态的改变.近年来,随着技术的不断进步,NMR波谱技术作为目前唯一能够无损检测活体组织内化学特性的技术已逐渐进入临床应用阶段.与其它技术相比,NMR波谱技术可基本实现肿瘤等疾病的诊断和定级,进而实现对恶性疾病的早发现、早治疗,尽可能降低患者的病痛以及医疗成本.另外,脑认知能力和各类神经精神疾病与神经元的活动息息相关,功能磁共振信号可以通过脑血流的改变对大脑功能进行预测,但无法区分大脑内兴奋性或者抑制性神经元的活性.为适应此需求,研究人员近年来发明了功能磁共振波谱(1H fMRS)技术[49],通过研究任务相关Glu、GABA等相关代谢组分的变化,直接测量脑内相关的神经元活动,且对血管的变化不太敏感,进而探索大脑的调节与变化机制.随着技术的不断发展,NMR波谱技术必然能够在基础神经科学和精神神经疾病研究中发挥越来越大的作用.
| [1] | ZHOU Q, ZHENG H, CHEN J X, et al. Metabolic fate of glucose in the brain of APP/PS1 transgenic mice at 10 months of age:a 13C NMR metabolomic study[J]. Metab Brain Dis, 2018, 33(5): 1661-1668. DOI: 10.1007/s11011-018-0274-7. |
| [2] | SERRES S, BEZANCON E, FRANCONI J M, et al. Brain pyruvate recycling and peripheral metabolism:an NMR analysis ex vivo of acetate and glucose metabolism in the rat[J]. J Neurochem, 2007, 101(5): 1428-1440. DOI: 10.1111/j.1471-4159.2006.04442.x. |
| [3] | WANG J, DU H Y, JIANG L H, et al. Oxidation of ethanol in the rat brain and effects associated with chronic ethanol exposure[J]. Proc Natl Acad Sci U S A, 2013, 110(35): 14444-14449. DOI: 10.1073/pnas.1306011110. |
| [4] | RACKAYOVA V, BRAISSANT O, MCLIN V A, et al. H-1 and P-31 magnetic resonance spectroscopy in a rat model of chronic hepatic encephalopathy:in vivo longitudinal measurements of brain energy metabolism[J]. Metab Brain Dis, 2016, 31(6): 1303-1314. DOI: 10.1007/s11011-015-9715-8. |
| [5] | KOPP C, LINZ P, DAHLMANN A, et al. 23Na magnetic resonance imaging-determined tissue sodium in healthy subjects and hypertensive patients[J]. Hypertension, 2013, 61(3): 635-640. DOI: 10.1161/HYPERTENSIONAHA.111.00566. |
| [6] | LIU T T, HE Z G, TIAN X B, et al. Specific patterns of spinal metabolites underlying alpha-Me-5-HT-evoked pruritus compared with histamine and capsaicin assessed by proton nuclear magnetic resonance spectroscopy[J]. Biochim Biophys Acta Mol Basis Dis, 2017, 1863(6): 1222-1230. DOI: 10.1016/j.bbadis.2017.03.011. |
| [7] |
HE Y G, FENG J W, ZHANG Z, et al. Development of pulsed dynamic nuclear polarization for enhancing NMR and MRI[J].
Chinese J Magn Reson, 2015, 32(2): 393-398.
贺玉贵, 冯继文, 张志, 等. 脉冲动态核极化增强的NMR和MRI系统研究[J]. 波谱学杂志, 2015, 32(2): 393-398. |
| [8] | GOVINDARAJU V, YOUNG K, MAUDSLEY A A. Proton NMR chemical shifts and coupling constants for brain metabolites[J]. NMR Biomed, 2000, 13(3): 129-153. DOI: 10.1002/1099-1492(200005)13:3<129::AID-NBM619>3.0.CO;2-V. |
| [9] | MANDAL P K. In vivo proton magnetic resonance spectroscopic signal processing for the absolute quantitation of brain metabolites[J]. Eur J Radiol, 2012, 81(4): e653-e664. DOI: 10.1016/j.ejrad.2011.03.076. |
| [10] | PATEL A B, DE GRAAF R A, ROTHMAN D L, et al. Effects of gamma-Aminobutyric acid transporter 1 inhibition by tiagabine on brain glutamate and gamma-Aminobutyric acid metabolism in the anesthetized rat in vivo[J]. J Neurosci Res, 2015, 93(7): 1101-1108. DOI: 10.1002/jnr.23548. |
| [11] | TATE A R, FOXALL P J D, HOLMES E, et al. Distinction between normal and renal cell carcinoma kidney cortical biopsy samples using pattern recognition of H-1 magic angle spinning (MAS) NMR spectra[J]. NMR Biomed, 2000, 13(2): 64-71. DOI: 10.1002/(SICI)1099-1492(200004)13:2<64::AID-NBM612>3.0.CO;2-X. |
| [12] | MROUE K H, XU J D, ZHU P Z, et al. Selective detection and complete identification of triglycerides in cortical bone by high-resolution H-1 MAS NMR spectroscopy[J]. Phys Chem Chem Phys, 2016, 18(28): 18687-18691. DOI: 10.1039/C6CP03506J. |
| [13] | NARESSI A, COUTURIER C, DEVOS J M, et al. Java-based graphical user interface for the MRUI quantitation package[J]. MAGMA, 2001, 12(2/3): 141-152. |
| [14] | DUARTE J M, DO K Q, GRUETTER R. Longitudinal neurochemical modifications in the aging mouse brain measured in vivo by 1H magnetic resonance spectroscopy[J]. Neurobiol Aging, 2014, 35(7): 1660-1668. DOI: 10.1016/j.neurobiolaging.2014.01.135. |
| [15] | WANG W T, LEE P, HUI D, et al. Effects of ethanol exposure on the neurochemical profile of a transgenic mouse model with enhanced glutamate release using in vivo 1H MRS[J]. Neurochem Res, 2018. DOI: 10.1007/s11064-018-2658-9. |
| [16] | LEI H X, DIRREN E, POITRY-YAMATE C, et al. Evolution of the neurochemical profiles in the G93A-SOD1 mouse model of amyotrophic lateral sclerosis[J]. J Cereb Blood Flow Metab, 2019, 39(7): 1283-1298. DOI: 10.1177/0271678X18756499. |
| [17] | SHANK R P, APRISON M H. Post mortem changes in the content and specific radioactivity of several amino acids in four areas of the rat brain[J]. J Neurobiol, 1971, 2(2): 145-151. DOI: 10.1002/neu.480020207. |
| [18] | SCHMIDT D E, SPETH R C, WELSCH F, et al. The use of microwave radiation in the determination of acetylcholine in the rat brain[J]. Brain Res, 1972, 38(2): 377-389. |
| [19] | DE GRAAF R A, CHOWDHURY G M I, BROWN P B, et al. In situ 3D magnetic resonance metabolic imaging of microwave-irradiated rodent brain:a new tool for metabolomics research[J]. J Neurochem, 2009, 109(2): 494-501. DOI: 10.1111/j.1471-4159.2009.05967.x. |
| [20] | WASEK B, ARNING E, BOTTIGLIERI T. The use of microwave irradiation for quantitative analysis of neurotransmitters in the mouse brain[J]. J Neurosci Meth, 2018, 307: 188-193. DOI: 10.1016/j.jneumeth.2018.05.016. |
| [21] | PAASONEN J, STENROOS P, SALO R A, et al. Functional connectivity under six anesthesia protocols and the awake condition in rat brain[J]. NeuroImage, 2018, 172: 9-20. DOI: 10.1016/j.neuroimage.2018.01.014. |
| [22] | SCHMIDT M J, SCHMIDT D E, ROBISON G A. Cyclic adenosine monophosphate in brain areas-microwave irradiation as a means of tissue fixation[J]. Science, 1971, 173(4002): 1142-1143. DOI: 10.1126/science.173.4002.1142. |
| [23] | MARUYAMA Y, NAKAMURA R, KOBAYASHI K. Effect of microwave irradiation on brain tissue structure and catecholamine distribution[J]. Psychopharmacology (Berl), 1980, 67(2): 119-123. DOI: 10.1007/BF00431965. |
| [24] | WIDERSTROM-NOGA E, PATTANY P M, CRUZ-ALMEIDA Y, et al. Metabolite concentrations in the anterior cingulate cortex predict high neuropathic pain impact after spinal cord injury[J]. Pain, 2013, 154(2): 204-212. DOI: 10.1016/j.pain.2012.07.022. |
| [25] | TOGNARELLI J M, DAWOOD M, SHARIFF M I F, et al. Magnetic resonance spectroscopy:principles and techniques:lessons for clinicians[J]. J Clin Exp Hepatol, 2015, 5(4): 320-328. DOI: 10.1016/j.jceh.2015.10.006. |
| [26] | ROVENCHER S W. Estimation of metabolite concentrations from localized in-vivo proton NMR-spectra[J]. Magn Reson Med, 1993, 30(6): 672-679. DOI: 10.1002/mrm.1910300604. |
| [27] | GRAVERON-DEMILLY D. Quantification in magnetic resonance spectroscopy based on semi-parametric approaches[J]. MAGMA, 2014, 27(2): 113-130. DOI: 10.1007/s10334-013-0393-4. |
| [28] | CHANG L H, PEREIRA B M, WEINSTEIN P R, et al. Comparison of lactate concentration determinations in ischemic and hypoxic rat brains by in vivo and in vitro 1H NMR spectroscopy[J]. Magn Reson Med, 1987, 4(6): 575-581. DOI: 10.1002/mrm.1910040608. |
| [29] | DOERT A, PILATUS U, ZANELLA F, et al. H-1-and C-13-NMR spectroscopy of Thy-1-APP(SL) mice brain extracts indicates metabolic changes in Alzheimer's disease[J]. J Neural Transm, 2015, 122(4): 541-550. DOI: 10.1007/s00702-015-1387-3. |
| [30] | DE GRAAF R A, BEHAR K L. Quantitative 1H NMR spectroscopy of blood plasma metabolites[J]. Anal Chem, 2003, 75(9): 2100-2104. DOI: 10.1021/ac020782+. |
| [31] | KRIAT M, CONFORTGOUNY S, VIONDURY J, et al. Quantitation of metabolites in human blood-serum by proton magnetic-resonance spectroscopy-a comparative-study of the use of formate and tsp as concentration standards[J]. NMR Biomed, 1992, 5(4): 179-184. DOI: 10.1002/nbm.1940050404. |
| [32] | DAI H, XIAO C N, LIU H L, et al. Combined NMR and LC-DAD-MS analysis reveals comprehensive metabonomic variations for three phenotypic cultivars of Salvia Miltiorrhiza Bunge[J]. J Proteome Res, 2010, 9(3): 1565-1578. DOI: 10.1021/pr901045c. |
| [33] | ZHANG J T, ZHANG Y, DU Y Y, et al. Dynamic metabonomic responses of tobacco (Nicotiana tabacum) plants to salt stress[J]. J Proteome Res, 2011, 10(4): 1904-1914. DOI: 10.1021/pr101140n. |
| [34] | DIETERLE F, ROSS A, SCHLOTTERBECK G, et al. Probabilistic quotient normalization as robust method to account for dilution of complex biological mixtures. Application in H-1 NMR metabonomics[J]. Anal Chem, 2006, 78(13): 4281-4290. DOI: 10.1021/ac051632c. |
| [35] | MORLEY K C, LAGOPOULOS J, LOGGE W, et al. Brain GABA levels are reduced in alcoholic liver disease:A proton magnetic resonance spectroscopy study[J]. Addict Biol, 2018. DOI: 10.1111/adb.12702. |
| [36] | FORD T C, DOWNEY L A, SIMPSON T, et al. The effect of a high-dose vitamin B multivitamin supplement on the relationship between brain metabolism and blood biomarkers of oxidative stress:A randomized control trial[J]. Nutrients, 2018, 10: 1860. DOI: 10.3390/nu10121860. |
| [37] | CHEONG I, DEELCHAND D K, EBERLY L E, et al. Neurochemical correlates of functional decline in amyotrophic lateral sclerosis[J]. J Neurol Neurosurg Psychiatry, 2018. DOI: 10.1136/jnnp-2018-318795. |
| [38] | LALLY P J, MONTALDO P, OLIVEIRA V, et al. Magnetic resonance spectroscopy assessment of brain injury after moderate hypothermia in neonatal encephalopathy:a prospective multicentre cohort study[J]. Lancet Neurol, 2019, 18(1): 35-45. |
| [39] | GRUBER S, STADLBAUER A, MLYNARIK V, et al. Proton magnetic resonance spectroscopic imaging in brain tumor diagnosis[J]. Neurosurg Clin N Am, 2005, 16(1): 101-114. DOI: 10.1016/j.nec.2004.07.004. |
| [40] | CASTILLO M, KWOCK L. Proton MR spectroscopy of common brain tumors[J]. Neuroimaging Clin N Am, 1998, 8(4): 733-752. |
| [41] | AL-OKAILI R N, KREJZA J, WANG S M, et al. Advanced MR imaging techniques in the diagnosis of intraaxial brain tumors in adults[J]. Radiographics, 2006, 26(S1): S173-S189. |
| [42] | MARINO S, CIURLEO R, BRAMANTI P, et al. 1H MR spectroscopy in traumatic brain injury[J]. Neurocrit Care, 2011, 14(1): 127-133. DOI: 10.1007/s12028-010-9406-6. |
| [43] | SOHER B J, DORAISWAMY P M, CHARLES H C. A review of 1H MR spectroscopy findings in alzheimer's disease[J]. Neuroimaging Clin N Am, 2005, 15(4): 847-852. DOI: 10.1016/j.nic.2005.09.013. |
| [44] | SWANN J R, GARCIA-PEREZ I, BRANISTE V, et al. Application of 1H NMR spectroscopy to the metabolic phenotyping of rodent brain extracts:A metabonomic study of gut microbial influence on host brain metabolism[J]. J Pharmaceut Biomed, 2017, 143: 141-146. DOI: 10.1016/j.jpba.2017.05.040. |
| [45] | MCGUIRE J L, DEPASQUALE E A K, WATANABE M, et al. Chronic dysregulation of cortical and subcortical metabolism after experimental traumatic brain injury[J]. Mol Neurobiol, 2019, 56: 2908-2921. DOI: 10.1007/s12035-018-1276-5. |
| [46] | TAN C X, CHONG G H, HAMZAH H, et al. Effect of virgin avocado oil on diet-induced hypercholesterolemia in rats via (1) H NMR-based metabolomics approach[J]. Phytother Res, 2018, 32(11): 2264-2274. DOI: 10.1002/ptr.6164. |
| [47] | RUAN L Y, FAN J T, HONG W, et al. Isoniazid-induced hepatotoxicity and neurotoxicity in rats investigated by (1)H NMR based metabolomics approach[J]. Toxicol Lett, 2018, 295: 256-269. DOI: 10.1016/j.toxlet.2018.05.032. |
| [48] | JIANG L H, HERZOG R I, MASON G F, et al. Recurrent antecedent hypoglycemia alters neuronal oxidative metabolism in vivo[J]. Diabetes, 2009, 58(6): 1266-1274. DOI: 10.2337/db08-1664. |
| [49] | STANLEY J A, RAZ N. Functional magnetic resonance spectroscopy:the "new" MRS for cognitive neuroscience and psychiatry research[J]. Front Psychiatry, 2018, 9: 76. |
 2020, Vol. 37
2020, Vol. 37 
