2. 中国科学技术大学, 安徽合肥 230026
2. University of Science and Technology of China, Hefei 230026, China
磁共振成像(MRI)是现代医学诊断中最有力的检测手段之一,主要以生物体内水质子在外磁场影响下产生的磁化信号为基础,利用磁场梯度来解析生物体内三维结构信息.温度作为一种衡量物体内分子热运动剧烈程度的物理量能够影响磁共振信号的强度与频率,因此可通过MRI技术检测物体的温度.MRI温度检测技术具有无电离辐射、高空间分辨[1, 2]、能够为检测区域同时提供结构信息和温度信息以构成直观温度分布图的优势,广泛应用于医学诊断以及治疗过程中.例如,检测局部温度的异常可为肿瘤以及炎症等疾病的诊断提供参考依据;热疗过程中实时精确地监测目标区域温度能有效控制加热幅度,从而避免对正常机体组织造成过热损伤[3-8].
MRI检测温度的主要方法是通过测量自由水质子的温敏性磁共振参数,如纵向弛豫时间(T1)、自扩散系数(D)、质子共振频率位移(PRF)等[9-13].但是,自由水质子的磁共振参数对温度的敏感度低,这导致MRI测量温度的精确度较低,同时,由于检测过程中运动产生的伪影以及磁场的不均一性均会增大检测误差,使得该方法在检测微小温度变化时受到限制[14, 15].与温敏性MRI造影剂结合的水质子的磁共振参数对温度变化的响应更加敏感,因此利用温敏性MRI造影剂可显著提高检测温度的灵敏度.此外,温敏性MRI造影剂具有可测量温度绝对值、不受运动影响等优点,使其在利用MRI精确检测温度方面发挥重要作用.
迄今,研究人员已开发了多种不同材料的温敏性MRI造影剂,包括脂质体造影剂、顺磁性化学交换饱和转移(PARACEST)造影剂、自旋交叉材料、微凝胶造影剂以及组合材料造影剂.本文主要介绍这几类温敏性MRI造影剂的原理、研究进展及应用前景.
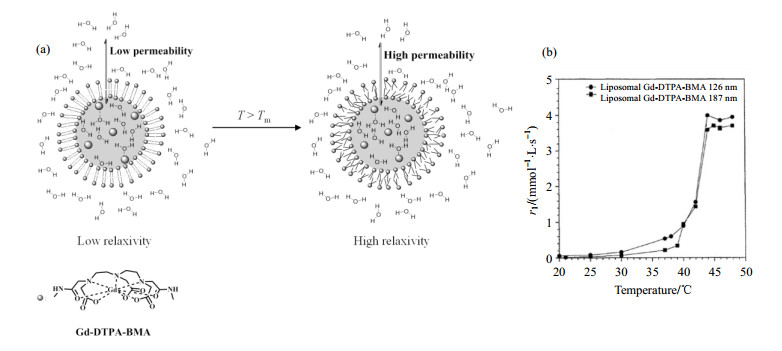
1 温敏性MRI造影剂的原理和研究进展 1.1 脂质体造影剂脂质体是由两性分子(如磷脂)在水中形成具有双分子层的封闭囊泡.在脂质体相转变温度(Tm)附近,其磷脂双分子层对水分子的通透性呈几何级增长[16-19].Fossheim等[20, 21]首先制备了二棕榈酰磷脂酰胆碱(DPPC)/二棕榈酰磷脂酰甘油(DPPG)脂质薄膜,随后将其浸入浓度为250 mmol/L的钆-2-(双(2-(羧甲基-(甲基氨基甲酰甲基)氨基)乙基)氨基)乙酸(Gd-DTPA-BMA)溶液中,水化后获得包裹Gd-DTPA-BMA平均尺寸分别为126 nm和187 nm的脂质体造影剂.本文根据文献描述绘制该造影剂对温度响应机理图.图 1(a)显示温度低于脂质体相转变温度时,与Gd-DTPA-BMA结合的水质子与外界水质子交换速率较慢,造影剂的弛豫率较低.如37 ℃时,126 nm和187 nm的脂质体造影剂的纵向弛豫率(r1)仅为0.53 mmol-1·L·s-1和0.21 mmol-1·L·s-1 [图 1(b)];而当温度超过该脂质体相转变温度(Tm = 42.4~42.6 ℃)时,脂质体膜内磷脂双分子层由规则固相排列转变为不规则的液晶相,导致脂质体膜通透性增加,与Gd-DTPA-BMA结合的水质子与外界水质子的交换速率加快,造影剂的弛豫率急速升高,如当温度升至44 ℃时,126 nm和187 nm的脂质体造影剂的r1分别提高为37 ℃时的7倍和17倍.
|
图 1 (a) 包裹有Gd-DTPA-BMA的脂质体造影剂对温度的响应机制;(b)包裹有Gd-DTPA-BMA的脂质体造影剂造影剂纵向弛豫率(r1)随温度变化曲线[20] Figure 1 (a) The mechanism of temperature response of liposomal Gd-DTPA-BMA contrast agent; (b) Temperature dependence of the relaxivity of liposomal Gd-DTPA-BMA contrast agent[20] |
在温敏性脂质体中引入二棕榈酰磷脂酰二甘油(DPPG2)可使脂质体在处于生理温度(37 ℃)附近的血红蛋白溶液中高度稳定,增强其体内循环时间.Hossann等[18]将6种已应用于临床的顺磁性钆造影剂分别包裹于DPPG2修饰的脂质体胶囊内部,制备尺寸小于150 nm的脂质体造影剂,并研究了这6种脂质体造影剂对温度的敏感性.实验结果表明包裹有Gd-DTPA-BMA和钆-10-(2-羟基丙基)-1, 4, 7, 10-四氮杂环十二烷-1, 4, 7-三乙酸(Gd-HP-DO3A)的2种脂质体造影剂对温度变化最为敏感.在DPPG2脂质体的相转变温度(42.2~43.1 ℃)附近,Gd-DTPA-BMA的r1由1.2 mmol-1·L·s-1增强至4.5 mmol-1·L·s-1,提高了2.8倍,Gd-HP-DO3A的r1由0.6 mmol-1·L·s-1增强至4.2 mmol-1·L·s-1,提高了6.0倍.包裹有Gd-DTPA-BMA的温敏性脂质体能在4 ℃保存10周并且不会暴露其内部造影剂,可作为一种潜在的辅助热疗的MRI测温材料.
随温度升高脂质体膜的通透性增强,但当温度进一步升高后,脂质体膜破裂并释放其内部的造影分子,这种效应同样会导致弛豫率的增强[22-24].Kim等[16]利用短链类弹性蛋白多肽、1, 2-二硬酯酰-sn-甘油-3-磷酰乙醇胺-N-[甲氧基-(聚乙二醇)2000](DSPE-PEG2000)和胆固醇修饰1, 2-二硬脂酰-sn-甘油-3-磷酰胆碱(DPPC/DSPC),并将钆贝葡胺(Gd-BOPTA)与阿霉素(DOX)一同包裹于脂质体胶囊内,制备了平均尺寸为123 nm的温敏性脂质体造影剂Gd-DOX-STL,该脂质体在生理温度(37 ℃)下高度稳定,42 ℃时能快速释放其内部的药物及造影剂.借助小鼠肿瘤模型监测药物释放,将Gd-DOX-STL通过静脉注射到小鼠体内,观察到其在肿瘤部位聚集,对肿瘤部位加热至42~43 ℃并维持30 min,相对于未加热部位,被加热的肿瘤部位DOX的含量由245.8升至374.5(任意单位),弛豫速率变化值同步由0.033 s-1提高至0.133 s-1,说明Gd-DOX-STL可作为一种潜在的肿瘤诊疗试剂.
脂质体MRI造影剂对温度敏感度高,可用于热疗过程中测量温度绝对值,由于检测到的温度绝对值依赖于脂质体的相转变温度,而与顺磁性造影剂本身无关,因此可通过调节温敏性脂质体的组成定制相转变温度来满足对温度的不同需求.这种测量温度的方法对运动不敏感,并且不会产生背景信号.但是借助该造影剂只能检测到一个温度点,而不是一个范围内所有温度;而且当温度超过相转变温度时,T1加权成像信号强度不会再发生变化,并且温度升高会导致造影剂从脂质体内部泄露,具有潜在的生物安全隐患,因此应用于临床的药剂量、毒性等因素还需要进一步评估[25].
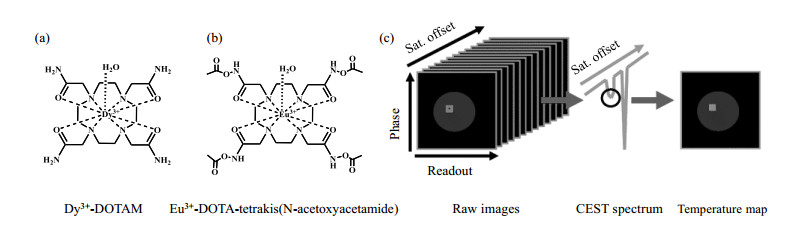
1.2 顺磁性化学交换饱和转移(PARACEST)造影剂化学位移是与温度相关的磁共振参数,利用质子共振频率位移方法测量温度就是基于自由水质子的化学位移与温度之间的关系.与顺磁性镧系金属直接结合的活泼质子的化学位移对温度具有更高的敏感度,其随温度的变化率远大于自由水质子的化学位移随温度的变化率.但是通常用于检测的顺磁镧系金属溶液的浓度较低,导致活泼质子的信号难于检测.借助化学交换饱和转移(CEST)技术[26],在活泼质子共振频率附近的范围施加一系列选择频率的预饱和脉冲,通过观察CEST谱图上自由水质子的信号强度变化就能找到对应的活泼质子的化学位移,由于自由水的浓度约为55 mol/L,其产生的信号有效放大了低浓度PARACEST造影剂的活泼质子信号[4, 27-29].Sherry等[28]制备了基于顺磁性金属镝(Dy)和铕(Eu)螯合物的PARACEST造影剂:镝-1, 4, 7, 10-四氮杂环十二烷四乙酰胺(Dy3+-DOTAM)和铕-1, 4, 7, 10-四氮杂环十二烷四乙酰氧基乙酰胺[Eu3+-DOTA-tetrakis (N-acetoxyacetamide)],其结构如图 2(a)和2(b)所示.在不同温度下,对两种造影剂的水溶液施加2 s频率范围分别为δ-1 500~500和δ-50~100的预饱和脉冲, 通过自由水质子峰强度降低时所施加的脉冲频率确定造影剂的活泼质子化学位移,并建立温度与化学位移之间关系,如图 2(c)所示.实验结果表明两种造影剂活泼质子的化学位移随温度线性变化,变化率分别为δH 0.40/℃和δH 6.90/℃,相比于PRF法(δH 0.01/℃),灵敏度分别提高了40倍和690倍.
|
图 2 (a) 镝-1, 4, 7, 10-四氮杂环十二烷四乙酰胺(Dy3+-DOTAM)结构;(b)铕-1, 4, 7, 10-四氮杂环十二烷四乙酰氧基乙酰胺Eu3+-DOTA-tetrakis (N-acetoxyacetamide)结构;(c)基于PARACEST的MRI测温法生成温度图的基本步骤[28] Figure 2 (a) Stracture of Dy3+-DOTAM; (b) Strcture of Eu3+-DOTA-tetrakis(N-acetoxyacetamide); (c) Basic procedure for generating a temperature map based on PARACEST MRI thermometry[28] |
PARACEST造影剂也被应用于活体温度的检测.Mcvicar等[30]将多肽修饰到DOTA杂环上,通过配位反应制备了铥-1, 4, 7, 10-四氮杂环十二烷四乙酰胺-甘氨酸-赖氨酸(Tm3+-DOTAM-Gly-Lys).利用该造影剂在体外实验中检测温度的精确度达到0.3 ℃,将该造影剂溶于磷酸缓冲液后直接注射入小鼠后肢,并施加5 s频率范围为δ-1 000~1 000的预饱和脉冲,使用快速自旋回波脉冲序列得到小鼠后肢肌肉组织温度分布图,检测温度的精确度达到0.5 ℃.由于Tm3+-DOTAM-Gly-Lys中氨基质子的CEST谱图线宽对pH值高度敏感,因此该造影剂还可同时用于检测活体组织中的pH值.
与温敏性PARACEST造影剂结合的活泼质子化学位移对温度敏感,因此可利用PARACEST造影剂检测微小的温度变化;而且利用CEST效应,难于检测的低浓度活泼质子信号可放大为高浓度的自由水质子信号,因此可减少造影剂的使用浓度以减小活体应用时镧系金属的毒性.结合镧系金属造影剂的化学位移对温度的高敏感度以及CEST效应的信号放大作用,基于PARACEST造影剂的MRI测温技术在今后有望成为利用MRI检测活体温度的关键技术.但是CEST实验需要在一定频率范围施加一系列预饱和脉冲以确定活泼质子的化学位移,因此成像时间较长;而且造影剂的毒性及其在组织内部的分布等因素对活体温度检测的影响还有待于进一步探究[28].
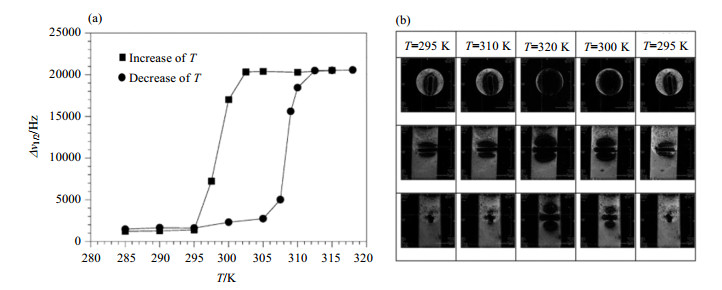
1.3 自旋交叉材料造影剂自旋交叉材料是由具有3dn(4≤n≤7)电子排布的过渡金属离子及其配体组成的一类特殊化合物.在其转变温度(Tc)附近,过渡金属离子的自旋态(S)及磁性会发生可逆转变.Muller等[31]制备了以1, 2, 4-三氮唑(Htrz)为配体的自旋交叉配合物[Fe(Htrz)3](ClO4)2,在Tc附近,Fe(Ⅱ)由S=0的反磁性状态转变为S=2的顺磁性状态,引起强烈的磁场不均一性,通过横向弛豫作用使NMR和MRI的信号发生改变.如图 3(a)和图 3(b)所示:在Tc附近,含有[Fe(Htrz)3](ClO4)2水溶液的NMR谱半高宽(Δv1/2)发生突变,并在MRI谱图中观察到“均一的磁场破坏”现象.由于滞回现象存在,升温过程中的转变温度(Tc↑)和降温过程中的转变温度(Tc↓)会有差别,由此根据不同控温过程可检测到两个温度绝对值.
|
图 3 (a) 火胶棉包裹的[Fe(Htrz)3](ClO4)2水溶液的NMR谱的半高宽(Δv1/2)随温度变化曲线;(b)不同温度下测得火胶棉包裹的[Fe(Htrz)3](ClO4)2的顶部、中部和底部的磁共振图像[31] Figure 3 (a) Temperature dependence of line widths at half-height of the NMR spectrum of water for [Fe(Htrz)3](ClO4)2 particles coated with collodion; (b) Top, middle, and coronal bottom MR images for five different temperatures with coated [Fe(Htrz)3](ClO4)2 particles[31] |
基于自旋交叉材料的温敏性MRI造影剂在Tc附近能对温度快速响应,但是[Fe(Htrz)3](ClO4)2晶体结构对水敏感,该造影剂应用于水溶液时需用疏水性的材料,如火胶棉将其包裹.
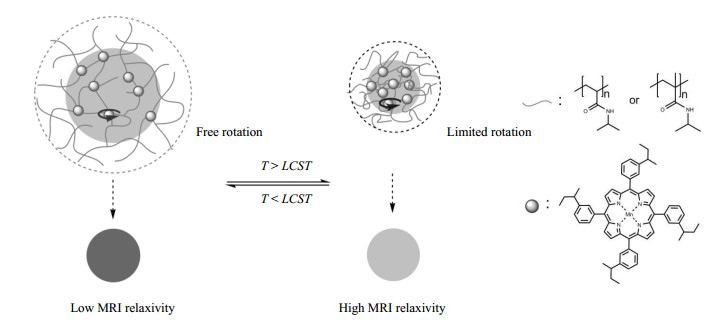
1.4 微凝胶造影剂类似脂质体,以聚-N-异丙基丙烯酰胺(PNIPAM)为代表的微凝胶是另一类具有温敏性的高分子材料,在水溶液中具有最低临界溶解温度(LCST).在LCST附近,微凝胶会通过迅速收缩或溶胀来响应温度变化,并且这种转变是可逆的[32-35].我们研究团队曾报道了利用温敏性微凝胶造影剂检测温度的研究[36],通过自由基乳液聚合反应制备了以锰卟啉为T1造影分子分别与PNIPAM和聚-N-异丙基甲基丙烯酰胺(PNIPMAM)单体共聚的温敏性微凝胶.负载锰卟啉的尺寸为530 nm(25 ℃)的PNIPAM微凝胶在其LCST(33 ℃)附近,体积迅速收缩,导致其内部锰卟啉的运动受到限制,转动时间增加,r1明显升高(图 4).动态光散射实验结果表明在29~35 ℃温度范围,微凝胶的直径由530 nm降至365 nm,降低了31%;同时T1实验结果表明在29~33 ℃温度区间造影剂的r1由8.5 mmol-1·L·s-1升至12.2 mmol-1·L·s-1,上升了44%,随温度的变化率为1.0 mmol-1·L·s-1/℃,对应检测温度的精确度达到0.15~0.30 ℃.
|
图 4 LCST附近微凝胶体积变化导致造影剂弛豫率发生显著改变的机理[36] Figure 4 The mechanism of longitudinal relaxivity of MRI contrast agent strongly modulated by microgel volume change around the LCST[36] |
温敏性微凝胶也被应用于超小超顺磁性氧化铁纳米粒子(USPIOs)体系[15, 37],Hannecart等[15]借助3-(乙氧基硅基)琥珀酸酐(TEPSA)对USPIOs进行修饰,使其表面带有羧基基团,随后通过酰胺化反应将温敏性聚合物聚醚胺M-2005嫁接到USPIOs表面,制备以温敏性水凝胶为外壳、氧化铁为内核的尺寸为52 nm(15 ℃)的核壳结构纳米粒子.随温度逐渐升高至超过聚醚胺M-2005的最低临界溶解温度(LCST=22 ℃)时,纳米粒子外层由亲水性变为疏水性,阻止了水分子与氧化铁表面接触,降低USPIOs质子自旋与核磁矩的相互作用,低场MRI检测到USPIOs的r1和r2均下降.r1和r2随温度变化的曲线拐点(25 ℃)均接近LCST.
利用温敏性微凝胶造影剂可检测微凝胶LCST附近微小的温度变化,该方法还具有操作简易、技术可移植等优势.例如,应用我们制备的PNIPAM微凝胶造影剂,使用常规的可变反转角MRI序列,可在15 s扫描时间内获得精确度达到0.15 ℃的温度绝对值.此外,微凝胶造影剂的温度响应范围可通过改变微凝胶中亲水性与疏水性官能团的比例进行调节,使其在生理温度下能够工作.因此,微凝胶造影剂在活体温度检测中具有潜在的应用前景.但是,微凝胶造影剂在盐浓度高的溶液中以及血红蛋白存在时会发生聚集,今后可采用具有最低临界溶解温度的生物高分子材料制备MRI造影剂并实现其在活体中的应用.
1.5 组合材料造影剂近年来研究人员也尝试将几种温敏性材料结合,制备组合材料造影剂.固态脂质纳米粒子和水凝胶纳米粒子分别具有各自的温度阈值,这两种温敏性材料组合将产生具有两个温度响应区间的造影剂.Shuhendler等[38]将固态脂质纳米粒子和微凝胶组合制备了温敏性造影剂,首先制备包含钆造影分子的超小水凝胶纳米粒子——聚-N-异丙基丙烯酰胺-丙烯酰胺(PNIPAM-AM),再将其包裹入更大的,由十四烷酸酯、二十烷酸甲酯或二十烷酸乙酯组成的温敏性固态脂质纳米粒子中,得到尺寸为104~112 nm的水凝胶-脂质复合纳米粒子(HLN).温度较低时,负载钆的水凝胶纳米粒子会保持在固态脂质内部,T1加权成像信号强度低;当温度达到固态脂质纳米粒子的相转变温度时,脂质溶解,水凝胶纳米粒子处于溶胀状态,T1加权成像信号迅速增强;温度超过水凝胶的LCST后,水凝胶纳米粒子结构坍塌,限制Gd3+和自由水分子的相互作用,T1加权成像信号再次减弱,由此利用Gd-HLN体系通过控制温度就能实现T1加权成像信号的“关-开-关”.该造影剂的两个温度阈值可通过改变固态脂质纳米粒子的组成以及NIPAM/AM的比例来调节,因此可定制温度阈值满足不同的需求.但是Gd-HLN体系的毒性及其在活体温度检测中的应用价值还有待探究.
过渡金属离子自旋态变化会引起大幅度的化学位移变化,应用CEST技术,可通过自由水质子信号确定与不同自旋态金属离子结合的活泼氢的化学位移.Jeon等[39]制备了两种基于六配位Fe(Ⅱ)自旋交叉材料造影剂——[Fe(3-bpp)2]2+(3-bpp=2, 6-di(pyrazol-3-yl)pyridine)和[(Me2NPY5Me2)Fe(H2O)]2+(Me2NPY5Me2=4-dimethylamino-2, 6-bis(1, 1-bis(2-pyridyl)ethyl)pyridine),这2种造影剂的自旋交叉现象发生在一定温度区间.在低温时具有更高比例的低自旋态S=0的Fe2+;当温度升高,高自旋态S=2的Fe2+的比例逐渐增加,对应的化学位移随温度线性增加.两种自旋交叉材料产生的化学位移随温度变化率分别为δH0.23/℃和δH1.02/℃,对应检测温度的灵敏度分别为质子共振频率位移法的23倍和102倍.应用这种自旋交叉材料CEST造影剂,借助9.4 T MRI扫描仪,在选定的温度下获得一系列CEST图像,经数据拟合后得到对应的温度分布图,基于这种方法测得的温度与热电偶测得的温度高度吻合.但是当氧化性物质存在时,造影剂易被氧化,因此需要对该造影剂进行改进以增加其稳定性.
Zhu等[40]将PARACEST造影剂Eu-DOTA修饰到短链聚-N-异丙基丙烯酰胺-甲基丙烯酸甲酯(PNIPAAM-MMA)高分子上,随后将其与长链PNIPAAM-MMA混合,采用自组装的方法得到平均尺寸为99.6 nm(37 ℃)的温敏性聚合物胶束CEST造影剂Eu-(PNIPAAM-MMA-DO3AmCE),如图 5所示,通过混合不同比例的长短链聚合物将其LCST控制在37 ℃,在37 ℃附近胶束外层的PNIPAAM高分子长链由亲水性变为疏水性,并相互交联向胶束的核层靠拢,使得埋藏于胶束内部的短链上的PARACEST造影剂充分与自由水质子接触,导致顺磁性金属的结合水质子与自由水质子交换速率增强,CEST信号明显增强.
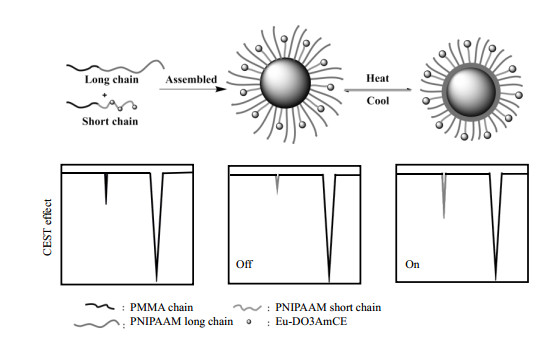
|
图 5 聚合物胶束的CEST信号对温度响应原理图[40] Figure 5 A schematic diagram of the CEST MRI signal of micelles changes in response to the temperature changes[40] |
近年来,一系列温敏性MRI造影剂,如脂质体造影剂、PARACEST造影剂、自旋交叉材料、微凝胶造影剂已被开发.相比于不使用温敏性造影剂时直接测量磁共振温敏性参数的方法,温敏性MRI造影剂对温度变化具有高度敏感、能精准定位病灶区域,通过对造影剂材料的修饰可使其满足不同实际需求.脂质体造影剂和PARACEST造影剂已应用于活体实验:脂质体造影剂能在小鼠肿瘤部位聚集,可作为一种潜在的肿瘤诊疗试剂;PARACEST造影剂可用于小鼠正常组织的温度检测,精确度达到0.5 ℃.此外,组合材料造影剂也被应用于温度检测,相比于单一材料,组合材料在应用于特定的检测需求时更具优势.相信随着造影剂设计的创新、新型温敏性生物相容性材料的开发,以及快速图像采集方法的逐步应用,基于温敏性MRI造影剂的测温法将迎来更广阔的发展空间.
| [1] |
YANG B L. Future of ultra high field MRI in basic research and clinical applications[J].
Chinese J Magn Reson, 2015, 32(4): 707-714.
杨保联. 超高场磁共振人体成像应用研究和医学前景[J]. 波谱学杂志, 2015, 32(4): 707-714. DOI: 10.11938/cjmr20150416. |
| [2] |
ZHANG H Y, LI C L, YING X F, et al. A Gadolinium based T1 MRI probe for detection of lung cancer stem cells[J].
Chinese J Magn Reson, 2016, 33(4): 623-674.
张宏岩, 李春林, 英晓芳, 等. 靶向肺癌干细胞的多肽Gd基T1型MRI探针的研究[J]. 波谱学杂志, 2016, 33(4): 623-674. |
| [3] | THORARINSDOTTIR A E, GAUDETTE A I, HARRIS T D. Spin-crossover and high-spin iron(Ⅱ) complexes as chemical shift 19F magnetic resonance thermometers[J]. Chem Sci, 2017, 8(3): 2448-2456. DOI: 10.1039/C6SC04287B. |
| [4] | FERNANDO W S, MARTINS A F, ZHAO P, et al. Breaking the barrier to slow water exchange rates for optimal magnetic resonance detection of paraCEST agents[J]. Inorg Chem, 2016, 55(6): 3007-3014. DOI: 10.1021/acs.inorgchem.5b02850. |
| [5] | DECKERS R, SPRINKHUIZEN S M, CRIELAARD B J, et al. Absolute MR thermometry using nanocarriers[J]. Contrast Media Mol, 2014, 9(4): 283-290. DOI: 10.1002/cmmi.1572. |
| [6] | QUESSON B, LAURENT C, MACLAIR G, et al. Real-time volumetric MRI thermometry of focused ultrasound ablation in vivo:A feasibility study in pig liver and kidney[J]. NMR Biomed, 2011, 24(2): 145-153. DOI: 10.1002/nbm.v24.2. |
| [7] |
YU K C, LV Z Y, YAO Y, et al. Recent progress in development of bio-active MRI contrast agents[J].
Chinese J Magn Reson, 2010, 27(3): 355-368.
俞开潮, 吕志勇, 姚遥, 等. 生物激活磁共振成像造影剂的研究进展[J]. 波谱学杂志, 2010, 27(3): 355-368. |
| [8] |
YU K C, WANG G P, DING S W, et al. Recent Progeresses in the development of contrate agents used in megnetic resonance imaging[J].
Chinese J Magn Reson, 2004, 21(4): 506-525.
俞开潮, 王国平, 丁尚武, 等. 用于磁共振成像对比增强的造影剂研发进展[J]. 波谱学杂志, 2004, 21(4): 506-525. |
| [9] |
GAO T X, LV Z, DING H Y, et al. Research progress of magnetic resonance imaging thermometry[J].
Chinese Journal of Medical Imaging, 2014, 7: 547-533.
高天新, 吕宙, 丁海艳, 等. 磁共振温度成像技术研究进展[J]. 中国医学影像学杂志, 2014, 7: 547-533. DOI: 10.3969/j.issn.1005-5185.2014.07.017. |
| [10] | RIEKE V, PAULY K B. MR thermometry[J]. J Magn Reson Imaging, 2008, 27(2): 376-390. DOI: 10.1002/(ISSN)1522-2586. |
| [11] | SETTECASE F, SUSSMAN M S, ROBERTS T P L. A new temperature-sensitive contrast mechanism for MRI:Curie temperature transition-based imaging[J]. Contrast Media Mol, 2007, 2(1): 50-54. DOI: 10.1002/(ISSN)1555-4317. |
| [12] | QUESSON B, DE ZWART J A, MOONEN C T W. Magnetic resonance temperature imaging for guidance of thermotherapy[J]. J Magn Reson Imaging, 2000, 12(4): 525-533. DOI: 10.1002/(ISSN)1522-2586. |
| [13] | BORMAN P T S, BOS C, DE BOORDER T, et al. Towards real-time thermometry using simultaneous multislice MRI[J]. Phys Med Biol, 2016, 61(17): 461-477. DOI: 10.1088/0031-9155/61/17/N461. |
| [14] | HANKIEWICZ J H, CELINSKI Z, STUPIC K F, et al. Ferromagnetic particles as magnetic resonance imaging temperature sensors[J]. Nat Commun, 2016, 7: 1-8. |
| [15] | HANNECART A, STANICKI D, VANDER ELST L, et al. Nano-thermometers with thermo-sensitive polymer grafted USPIOs behaving as positive contrast agents in low-field MRI[J]. Nanoscale, 2015, 7(8): 3754-3767. DOI: 10.1039/C4NR07064J. |
| [16] | KIM H R, YOU D G, PARK S J, et al. MRI monitoring of tumor-selective anticancer drug delivery with stable thermosensitive liposomes triggered by high-intensity focused ultrasound[J]. Mol Pharm, 2016, 13(5): 1528-1539. DOI: 10.1021/acs.molpharmaceut.6b00013. |
| [17] | DICHEVA B M, KONING G A. Targeted thermosensitive liposomes:an attractive novel approach for increased drug delivery to solid tumors[J]. Expert Opin Drug Del, 2014, 11(1): 83-100. DOI: 10.1517/17425247.2014.866650. |
| [18] | HOSSANN M, WANG T, SYUNYAEVA Z, et al. Non-ionic Gd-based MRI contrast agents are optimal for encapsulation into phosphatidyldiglycerol-based thermosensitive liposomes[J]. J Control Release, 2013, 166(1): 22-29. DOI: 10.1016/j.jconrel.2012.12.003. |
| [19] | TASHJIAN J A, DEWHIRST M W, NEEDHAM D, et al. Rationale for and measurement of liposomal drug delivery with hyperthermia using non-invasive imaging techniques[C]//Symposium of the European-Society-for-Hyperthermic-Oncology, Prague, CZECH REPUBLIC. European Soc Hypertherm Oncol, 2008, 24(1):79-90. |
| [20] | FOSSHEIM S L, IL'YASOV K A, HENNIG J, et al. Thermosensitive paramagnetic liposomes for temperature control during MR imaging-guided hyperthermia:In vitro feasibility studies[J]. Acad Radiol, 2000, 7(12): 1107-1115. DOI: 10.1016/S1076-6332(00)80064-1. |
| [21] | FOSSHEIM S L, FAHLVIK A K, KLAVENESS J, et al. Paramagnetic liposomes as MRI contrast agents:Influence of liposomal physicochemical properties on the in vitro relaxivity[J]. Magn Reson Imaging, 1999, 17(1): 83-89. DOI: 10.1016/S0730-725X(98)00141-6. |
| [22] | DAVIES G L, KRAMBERGER I, DAVIS J J. Environmentally responsive MRI contrast agents[J]. Chem Commun, 2013, 49(84): 9704-9721. DOI: 10.1039/c3cc44268c. |
| [23] | TAGAMI T, FOLTZ W D, ERNSTING M J, et al. MRI monitoring of intratumoral drug delivery and prediction of the therapeutic effect with a multifunctional thermosensitive liposome[J]. Biomaterials, 2011, 32(27): 6570-6578. DOI: 10.1016/j.biomaterials.2011.05.029. |
| [24] | DE SMET M, HEIJMAN E, LANGEREIS S, et al. Magnetic resonance imaging of high intensity focused ultrasound mediated drug delivery from temperature-sensitive liposomes:An in vivo proof-of-concept study[J]. J Control Release, 2011, 150(1): 102-110. DOI: 10.1016/j.jconrel.2010.10.036. |
| [25] | LINDNER L H, REINL H M, SCHLEMMER M, et al. Paramagnetic thermosensitive liposomes for MR-thermometry[J]. Int J Hyperthermia, 2005, 21(6): 575-588. DOI: 10.1080/02656730500158410. |
| [26] | HEFFERN M C, MATOSZIUK L M, MEADE T J. Lanthanide probes for bioresponsive imaging[J]. Chem Rev, 2014, 114(8): 4496-4539. DOI: 10.1021/cr400477t. |
| [27] | HINGORANI D V, BERNSTEIN A S, PAGEL M D. A review of responsive MRI contrast agents:2005-2014[J]. Contrast Media Mol, 2015, 10(4): 245-265. DOI: 10.1002/cmmi.v10.4. |
| [28] | ZHANG S R, MALLOY C R, SHERRY A D. MRI thermometry based on PARACEST agents[J]. J Am Chem Soc, 2005, 127(50): 17572-17573. DOI: 10.1021/ja053799t. |
| [29] | LI A X, WOJCIECHOWSKI F, SUCHY M, et al. A sensitive PARACEST contrast agent for temperature MRI:Eu3+-DOTAM-Glycine (Gly)-Phenylalanine (Phe)[J]. Magn Reson Med, 2008, 59(2): 374-381. DOI: 10.1002/(ISSN)1522-2594. |
| [30] | MCVICAR N, LI A X, SUCHY M, et al. Simultaneous in vivo pH and temperature mapping using a PARACEST-MRI contrast agent[J]. Magn Reson Med, 2013, 70(4): 1016-1025. DOI: 10.1002/mrm.24539. |
| [31] | MULLER R N, VANDER ELST L, LAURENT S. Spin transition molecular materials:Intelligent contrast agents for magnetic resonance imaging[J]. J Am Chem Soc, 2003, 125(27): 8405-8407. DOI: 10.1021/ja0349599. |
| [32] | SIGOLAEVA L V, GLADYR S Y, GELISSEN A P H, et al. Dual-stimuli-sensitive microgels as a tool for stimulated spongelike adsorption of biomaterials for biosensor applications[J]. Biomacromolecules, 2014, 15(10): 3735-3745. DOI: 10.1021/bm5010349. |
| [33] | SHIRAKURA T, KELSON T J, RAY A, et al. Hydrogel nanoparticles with thermally controlled drug release[J]. ACS Macro Lett, 2014, 3(7): 602-606. DOI: 10.1021/mz500231e. |
| [34] | LI P H, XU R Z, WANG W H, et al. Thermosensitive poly(N-isopropylacrylamide-co-glycidyl methacrylate) microgels for controlled drug release[J]. Colloid Surfaces B, 2013, 101: 251-255. DOI: 10.1016/j.colsurfb.2012.07.009. |
| [35] | LYON L A, MENG Z, SINGH N, et al. Thermoresponsive microgel-based materials[J]. Chem Soc Rev, 2009, 38(4): 865-874. DOI: 10.1039/b715522k. |
| [36] | ZHENG X W, QIAN J C, TANG F, et al. Microgel-based thermosensitive MRI contrast agent[J]. ACS Macro Lett, 2015, 4(4): 431-435. DOI: 10.1021/acsmacrolett.5b00058. |
| [37] | BALASUBRAMANIAM S, POTHAYEE N, LIN Y, et al. Poly(N-isopropylacrylamide)-coated superparamagnetic iron oxide nanoparticles:relaxometric and fluorescence behavior correlate to temperature-dependent aggregation[J]. Chem Mater, 2011, 23(14): 3348-3356. DOI: 10.1021/cm2009048. |
| [38] | SHUHENDLER A J, STARUCH R, OAKDEN W, et al. Thermally-triggered "off-on-off" response of gadolinium-hydrogel-lipid hybrid nanoparticles defines a customizable temperature window for non-invasive magnetic resonance imaging thermometry[J]. J Control Release, 2012, 157(3): 478-484. DOI: 10.1016/j.jconrel.2011.09.061. |
| [39] | JEON I R, PARK J G, HANEY C R, et al. Spin crossover iron(Ⅱ) complexes as PARACEST MRI thermometers[J]. Chem Sci, 2014, 5(6): 2461-2465. DOI: 10.1039/C4SC00396A. |
| [40] | ZHU X L, CHEN S Z, LUO Q, et al. Body temperature sensitive micelles for MRI enhancement[J]. Chem Commun, 2015, 51(44): 9085-9088. DOI: 10.1039/C5CC02587G. |
 2017, Vol. 34
2017, Vol. 34 
