2. 波谱与原子分子物理国家重点实验室, 武汉磁共振中心(中国科学院 武汉物理与数学研究所), 湖北 武汉 430071
2. State Key Laboratory of Magnetic Resonance and Atomic and Molecular Physics, National Center for Magnetic Resonance in Wuhan(Wuhan Institute of Physics and Mathematics, Chinese Academy of Sciences), Wuhan 430071, China
二氢黄酮是自然界中普遍存在的一类黄酮类化合物,广泛分布于谷类、水果及各类植物中,具有抗氧化、抗菌、抗癌、抗炎及对保护心血管系统等多种生物活性[1, 2],被认为是食物和植物药中重要营养补充剂.二氢黄酮是黄酮类化合物大家族中的亚类,其基本碳骨架为C6(A环)-C3(C环)-C6(B环),其中C环的C-2与C-3为单键,C-2为手性碳原子,这是其区别于黄酮类其它亚类化合物的重要结构特征.
二氢黄酮类化合物因C环C-2为手性碳原子而有R与S构型之分,手性分离与分析主要采用毛细管电泳和手性色谱柱分离等技术,结合圆二色光谱(CD)技术进行构型确认[3-7].目前,核磁共振(NMR)波谱技术是鉴定黄酮类化合物结构的重要方法之一[8-11].R与S构型二氢黄酮在1H NMR谱中无明显差别,但其糖苷化后的产物——R与S构型二氢黄酮糖苷成为非对映异构体,在1H NMR谱中可观察到它们之间的差别[3].20世纪70年代,Gaffield等[12]采用NMR与CD法对葡萄中苦味成分进行了研究,发现未成熟葡萄中S构型柚皮素7-O-新陈皮糖苷(Naringenin 7-O-neohesperidoside, Naringin)含量较高,而成熟葡萄中R构型柚皮素7-O-新陈皮糖苷含量较高,该文通过NMR和CD技术得到不同成熟度R与S构型含量比例,给出了柚皮素7-O-新陈皮糖苷中H-3ax与H-3eq的化学位移差异,但未提供其余质子化学位移差异信息.Pan等[3]在鹿仙草(Balanophora involucrata)中分离得到R与S构型圣草酚7-O-葡萄糖苷,结果显示两者C环与葡萄糖残基端基质子在1H NMR谱中存在明显差别.Maltese等[13]对葡萄皮提取物进行了1D和2D NMR分析,指认R与S构型柚皮苷、陈皮苷、新陈皮苷3个二氢黄酮糖苷,列出部分质子的化学位移,NMR数据提示上述三者的R与S构型化合物的质子在1H NMR谱中有明显化学位移差异. Funari等[14]从巴西植物Lippia salviaefolia乙醇提取物中分离得到R与S构型的3', 4', 5, 6-四羟基二氢黄酮7-O-葡萄糖苷和3', 4', 5, 8-四羟基二氢黄酮7-O-葡萄糖苷,采用CD技术确认立体构型,结果表明,上述两类二氢黄酮糖苷的R与S构型化合物在NMR谱中有一些差别.
为详细描述二氢黄酮葡萄糖苷非对映异构体在NMR谱中的差别,本文首先对R与S构型柚皮素7-O-葡萄糖苷混合物氘代二甲亚砜(DMSO-d6)溶液进行了1H NMR、13C NMR、1H-1H COSY、1H-13C HSQC和1H-13C HMBC谱图分析,对其1H和13C NMR谱峰进行了归属;然后采用手性色谱柱对R与S型柚皮素7-O-葡萄糖苷(图 1)进行分离,并结合CD光谱确认其立体构型;最后,为避免葡萄糖残基质子对二氢黄酮苷元质子化学位移的影响,采集了R与S构型柚皮素7-O-葡萄糖苷及其混合物氘代乙腈(CD3CN)溶液的NMR谱,详细指出R与S构型柚皮素7-O-葡萄糖苷在1H NMR谱上的特征差别谱峰.
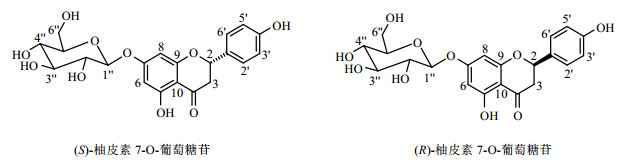
|
图 1 R与S构型柚皮素7-O-葡萄糖苷化学结构 Figure 1 Chemical structure of R and S naringenin 7-O-glycoside |
柚皮素7-O-葡萄糖苷的R与S构型混合物由湖北中医药大学药学院许汉林教授提供,样品采用植物化学分离方法从植物药皂荚中分离得到.柚皮素7-O-葡萄糖苷R与S构型异构体为本实验室采用TCI® Chiral MB-S手性色谱柱[梯希爱(上海)化成工业发展有限公司]分离制备.
1.2 CD光谱测定CD光谱在ChirascanTM圆二色光谱仪(Applied Photophysics,英国)上采集.R与S构型柚皮素7-O-葡萄糖苷溶于乙腈溶剂(HPLC级,购自Tedia公司)中进行测定(浓度根据光谱强度进行调整),在室温条件下记录180~500 nm波长范围的光谱数据.
1.3 NMR实验柚皮素7-O-葡萄糖苷R与S构型混合物溶于DMSO-d6(99.9 %氘代,购自Sigma Aldrich公司),以DMSO-d6残余峰为内标进行定标(δH2.50、δC39.5).手性分离后的R与S构型柚皮素7-O-葡萄糖苷样品溶于CD3CN(99.8 %氘代,购自Sigma Aldrich公司)采集1H NMR谱,以CD3CN残余峰定标(δH1.94).
NMR实验在配备5 mm 1H-13C-15N三共振超低温探头的Bruker Avance Ⅲ 600型NMR谱仪上进行,采样温度为298 K.1H和13C NMR的工作频率分别为600.13 MHz和150.91 MHz.1H NMR谱宽为12 000 Hz,13C NMR谱宽为36 057 Hz.在采集2D NMR谱时,为保证F1维有较高分辨率,且不采集到过多的噪音,根据二氢黄酮类化合物1H和13C常见化学位移区间,对实验参数中谱宽和采样点进行了适当调整.其中1H-1H COSY谱采集采用标准脉冲序列COSYGPMFQF,F1与F2维谱宽均设置为3 000 Hz,采样点数为2 048×128.1H-13C HSQC谱采集采用标准脉冲序列HSQCETGPSISP2.2,F1维谱宽设置为16 602 Hz,F2维谱宽设置为6 009 Hz,采样点数为2 048 × 256. 1H-13C HMBC谱采集采用标准脉冲序列HMBCGPNDQF,F1维谱宽均设置为25 657 Hz,F2维谱宽均设置为8 013 Hz,采样点数为2 048 × 300.
2 结果与讨论 2.1 1H NMR谱分析在R与S构型柚皮素7-O-葡萄糖苷混合物DMSO-d6溶液的1H NMR谱中(图 2和图 3),各谱峰整体分辨良好,杂信号较少,根据谱峰特征易判断样品中含有两个二氢黄酮糖苷类化合物[15-17]:低场δH 12.0附近区域的尖锐单峰是二氢黄酮类化合物OH-5质子与4-位羰基形成分子内氢键的特征信号,在低场δH 12.02与12.01处(图 3),各有1个尖锐单峰,提示样品中含有两个二氢黄酮类化合物;结合1H-1H COSY谱(S1)可知,位于δH5.47(dd, J = 12.9/ 2.9 Hz)、δH3.30(dd, J = 17.0/12.9 Hz)与δH2.73(dd, J = 17.0/2.9 Hz)附近的3个质子来自于1个偶合系统,为二氢黄酮类化合物C环中3个质子的ABX偶合特征信号,根据化学位移归属为H-2、H-3ax与H-3eq,在1H NMR谱中(图 3)中,可观察到两套H-2与H-3eq的质子信号,再次提示样品中含有两个二氢黄酮类化合物;δH6.12~6.14区域为二氢黄酮类化合物A环中H-6与H-8特征化学位移区间,从两质子的重叠峰形(图 3)来推测,样品中含两组H-6与H-8间位质子;δH4.93附近的双峰为葡萄糖端基质子H-1″的特征信号,在1H NMR谱(图 3)中观察到δH4.92(d, J = 7.7 Hz)和4.94(d, J = 7.7 Hz)两个葡萄糖端基质子信号的双峰,推测样品中含有两个二氢黄酮葡萄糖苷.二氢黄酮类化合物中C环上C-2为手性碳原子,存在R与S两种构型,因此推测此样品可能为R与S二氢黄酮葡萄糖苷的混合物.
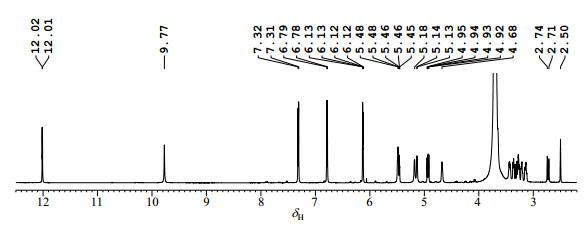
|
图 2 R与S构型柚皮素7-O-葡萄糖苷混合物1H NMR图谱(DMSO-d6) Figure 2 The 1H NMR spectrum of the mixture of R and S naringenin 7-O-glycoside (DMSO-d6) |
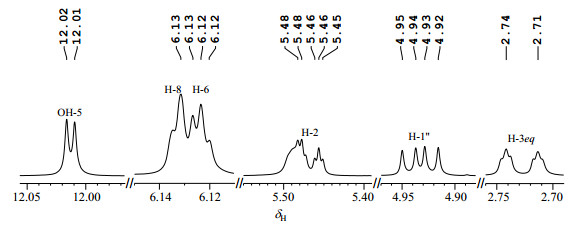
|
图 3 R与S构型柚皮素7-O-葡萄糖苷混合物1H NMR谱中6对差异质子谱峰(DMSO-d6) Figure 3 Six varing pairs of proton in 1H NMR spectrum of the mixture of R and S naringenin 7-O-glycoside (DMSO-d6) |
在该混合物DMSO-d6溶液的1H NMR谱(图 2)中,除观察到上述信号外,还观察到1套对位取代苯环的特征信号:δH6.79(d,J= 8.5 Hz)和δH7.31(d,J= 8.5 Hz),为一对偶合质子,根据化学位移、偶合常数与峰形,判断它们是来自于二氢黄酮类化合物中B环中H-2'/6'和H-3'/5'.在δH3.80~3.00区间,出现一些偶合裂分复杂且相互重叠的信号,为葡萄糖残基上脂肪质子的信号.在含水量较少的DMSO-d6溶液中,葡萄糖残基上醇羟基质子也会出峰,在δH4.50~5.60区间,可观察到4个羟基质子的裂分信号.此外,在δH9.77处有一较宽单峰,推测为二氢黄酮B环上对位酚羟基质子OH-4'.
2.2 13C NMR谱分析在上述混合物的1H NMR谱中,可观察到R与S立体构型产生的质子化学位移的差别.对13C NMR谱(图 4)进行分析,结合1H-13C HSQC(S3)与1H-13C HMBC(S4),可判断R与S立体构型产生8个碳原子的化学位移差别,对应于13C NMR谱(图 5)的7对碳峰,分别为C-3、C-5、C-7、C-9、C-1'、C-2'与C-6'、C-1″,其中C-2'与C-6'具有相同化学位移.
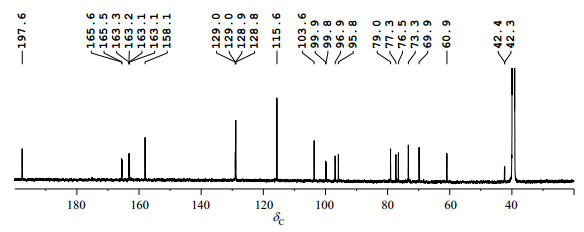
|
图 4 R与S构型柚皮素7-O-葡萄糖苷混合物13C NMR图谱(DMSO-d6) Figure 4 13C NMR spectrum of the mixture of R and S naringenin 7-O-glycoside (DMSO-d6) |
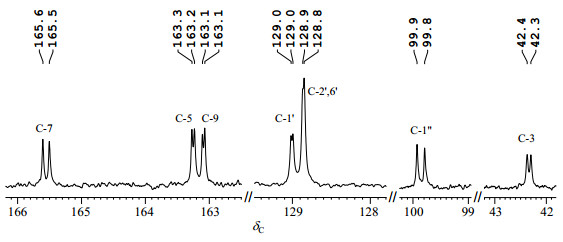
|
图 5 R与S构型柚皮素7-O-葡萄糖苷混合物13C NMR图谱中7对差异碳峰(DMSO-d6) Figure 5 Seven varing pairs of carbon in 13C NMR spectrum of the mixture of R and S naringenin 7-O-glycoside (DMSO-d6) |
在1H NMR谱中,R与S构型混合物中H-6与H-8质子拥挤在δH6.12~6.14之间,难以直接区分.这一区间是R与S构型柚皮素7-O-葡萄糖苷在1H NMR中差别的特征区域,因此必须对其进行确切指认.在1H NMR谱中,H-6与H-8化学位移相近,且在1H-13C HMBC谱(图 6)中与多个远程碳原子有偶合关系,难以直接对其进行指认.

|
图 6 R与S构型柚皮素7-O-葡萄糖苷混合物的局部1H-13C HMBC图(DMSO-d6) Figure 6 Partial enlarged 1H-13C HMBC spectrum of the mixture of R and S naringenin 7-O-glycoside (DMSO-d6) |
δH12.01/12.02为二氢黄酮类化合物在DMSO-d6溶液中OH-5与C环中C-4位羰基形成分子内氢键的特征信号[15-17],此质子除与δC 103.7(C-10)在1H-13C HMBC谱中有远程偶合外,还与δC96.9有多键偶合.从化合物结构上分析,δH12.01/12.02与C-6发生三键偶合几率大于与C-8发生五键偶合几率,因此δC96.9被归属为C-6.根据1H-13C HSQC谱确认δH6.13为H-6.因此δH6.14归属为H-8,在1H-13C HSQC谱中与H-8有单键偶合的δC95.8归属为C-8.
柚皮素7-O葡萄糖苷NMR数据已有文献报道[17],但数据不够详尽.因此,结合后文构型分析,对DMSO-d6溶液中柚皮素7-O葡萄糖苷的1H与13C NMR谱峰归属见表 1.
| 表 1 R与S构型柚皮素7-O-葡萄糖苷的1H和13C NMR分析(600 MHz, DMSO-d6) Table 1 1H and 13C NMR data analysis for R and S naringenin 7-O-glycoside(600 MHz, DMSO-d6) |
为确证以上化合物的归属,通过手性色谱柱分离得到两种构型纯品,并利用CD光谱对两种纯品进行构型确证(图 7).根据两种纯品在290 nm(π→π*)和332 nm(n→π*)吸收特征峰,判断这两种纯品分别为R与S构型柚皮素7-O-葡萄糖[7].两种构型在圆二色光谱中表现出相反的Cotton效应,证实R与S柚皮素7-O-葡萄糖在1H NMR谱中会表现出微弱差异.

|
图 7 R与S构型柚皮素7-O-葡萄糖苷圆二色光谱 Figure 7 The CD spectra of R and S naringenin 7-O-glycoside |
柚皮素7-O-葡萄糖苷在DMSO-d6溶液中葡萄糖残基质子与H-3ax质子信号重叠,为更好的比较R与S构型柚皮素7-O-葡萄糖苷在1H NMR谱的差别,换用了可以排除上述重叠干扰的CD3CN溶剂,分别采集了R与S构型柚皮素7-O-葡萄糖苷纯品及其混合物的1H NMR谱图(图 8).
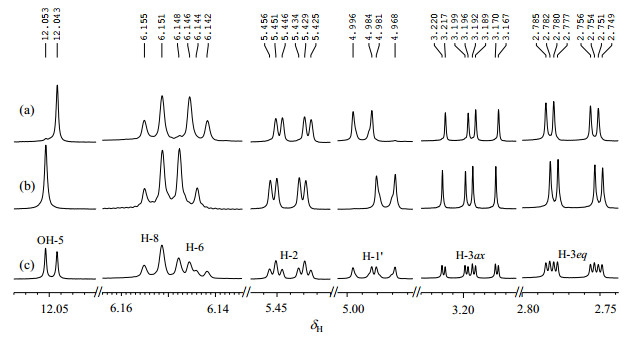
|
图 8 R与S构型柚皮素7-O-葡萄糖苷及其混合物中差异质子的1H NMR谱.(a) R构型;(b) S构型;(c) R与S构型混合物(CD3CN) Figure 8 1H NMR spectrum of differential protons in pure R and S naringenin 7-O-glycoside and their mixture. (a) R configuration; (b) S configuration; (c) R and S mixture (CD3CN) |
在R与S构型混合物CD3CN溶液的1H NMR谱[图 8(c)]中,柚皮素7-O-葡萄糖苷中6个质子,即A环OH-5、H-6,C环H-2、H-3ax与H-3eq,葡萄糖残基端基质子H-1″等质子表现为两套信号. R构型[图 8(a)]、S构型[图 8(b)]谱中相应的质子化学位移与混合物样品[图 8(c)]中的谱峰化学位移进行了对应.R与S构型中质子化学位移差值(ΔS-R)为OH-5(5.8 Hz)、H-2(2.5 Hz)、H-3ax(1.7 Hz)、H-6(1.3 Hz)、H-3eq(-1.7 Hz)、H-1″(-9.3 Hz),推测柚皮素7位羟基糖苷化之后,影响了A环H-6电子云分布,并影响了C环手性碳原子的成对电子伸展方向,影响了H-2、H-3ax与H-3eq电子云分布.此外,引入的葡萄糖残基端基质子因为苷元柚皮素R与S构型的差别,也导致了端基质子电子云密度的差别,从而产生化学位移的差别.其中葡萄糖端基质子H-1″化学位移偏移最大.具体的R与S构型柚皮素7-O-葡萄糖苷CD3CN溶液中各质子的化学位移差别见表 2.
| 表 2 R与S构型柚皮素7-O-葡萄糖苷的1H NMR数据(600 MHz, CD3CN) Table 2 1H NMR data of R and S naringenin 7-O-glycoside (600 MHz, CD3CN) |
R与S构型二氢黄酮糖苷为非对映异构体,已有文献[12-14]报道了它们在NMR谱上的差别.文献中化学位移精确到δ0.01,对应于600 MHz液体高分辨NMR谱仪中的6 Hz.而现代NMR谱仪氢核分辨率达到1 Hz以下,能很容易观察到1H NMR谱图中δ0.01以下的差别.因此,文献报道R与S构型二氢黄酮糖苷的数据一定程度上掩盖了它们之间的真实差别.
3 结论为便于利用1H NMR谱图判断二氢黄酮糖苷的R与S构型非对映异构体,本文首先在植物药皂荚提取物中分离得到一种二氢黄酮苷——柚皮素7-O-葡萄糖苷R与S构型混合物,分析其DMSO-d6溶液的一系列1D和2D NMR谱,对其1H和13C NMR谱峰进行了归属;然后,采用手性色谱柱对该混合物进行分离,结合CD光谱确定构型;最后,为鉴别R与S构型柚皮素7-O-葡萄糖苷在1H NMR谱中特征差别谱峰,避免葡萄糖残基质子对二氢黄酮苷元质子化学位移的影响,采集了R与S构型柚皮素7-O-葡萄糖苷及其混合物CD3CN溶液的NMR谱,结果显示葡萄糖残基端基质子化学位移差别最为明显,为9.4 Hz;5-位酚羟基质子化学位移差别为5.8 Hz,C环上3个质子化学位移差也较明显.此结果表明,1H NMR谱可以用以区分二氢黄酮糖苷类非对映异构体.但是在借助1H NMR谱对这类成分进行指认时,务必对糖残基端基、5位酚羟基及C环质子峰形加以注意,以判别是否有R与S构型同时存在的可能.
| [1] | YAO L H, JIANG Y M, SHI J, et al. Flavonoids in food and their health benefits[J]. Plant Food Hum Nutr, 2004, 59(3): 113-122. DOI: 10.1007/s11130-004-0049-7. |
| [2] | ANDERSON O M, MARKHAM K R. Flavanoids:chemistry, biochemistry and applications[M]. Florida: CRC Press, 2006. |
| [3] | CIRILLI R, FERRETTI R, DE SANTIS E, et al. High-performance liquid chromatography separation of enantiomers of flavanone and 2'-hydroxychalcone under reversed-phase conditions[J]. J Chromatogr A, 2008, 1190(1, 2): 95-101. |
| [4] | PAN J Y, ZHANG S, YAN L S, et al. Separation of flavanone enantiomers and flavanone glucoside diastereomers from Balanophora involucrata Hook. f. by capillary electrophoresis and reversed-phase high-performance liquid chromatography on a C-18 column[J]. J Chromatogr A, 2008, 1185(1): 117-129. DOI: 10.1016/j.chroma.2008.01.049. |
| [5] | ZUKOWSKI A J. Determination of diastereomerization barrier of some flavanones by high-performance liquid chromatography methods[J]. J Chromatogr A, 2006, 1134(1, 2): 95-100. |
| [6] | CACCAMESE S, CARUSO C, PARRINELLO N. High-performance liquid chromatographic separation and chiroptical properties of the enantiomers of naringenin and other flavanones[J]. J Chromatogr A, 2005, 1076(1, 2): 155-162. |
| [7] | SLADE D, FERREIRA D, MARAIS P. Circular dichroism, a powerful tool for the assessment of absolute configuration of flavonoids[J]. Phytochemistry, 2005, 66(18): 2177-2215. DOI: 10.1016/j.phytochem.2005.02.002. |
| [8] |
XU M F, SHEN L Q, WANG K W. NMR characterization of two flavonyl glycosides isolated from Daphniphyllum angusticolium Hutch[J].
Chinese J Magn Reson, 2010, 27(2): 259-265.
许明峰, 沈莲清, 王奎武. 虎皮楠中2个黄酮苷的波谱学研究[J]. 波谱学杂志, 2010, 27(2): 259-265. |
| [9] |
PENG S, HAN L F, LIU E W, et al. NMR characterization of two flavonyl glycosides isolated from Drynaria fortunei[J].
Chinese J Magn Reson, 2010, 27(2): 141-147.
彭双, 韩立峰, 刘二伟, 等. 骨髓碎补中2个黄酮苷类化合物的NMR研究[J]. 波谱学杂志, 2010, 27(2): 141-147. |
| [10] |
SONG N, WANG R R, LI Z L, et al. Structure determination of flavonoid glycoside extracted from Capsella bursa-pastoris(L.) medic. by NMR spectroscopy[J].
Chinese J Magn Reson, 2009, 26(1): 89-92.
宋宁, 王荣荣, 李占林, 等. 2D NMR对荠菜中的一个黄酮苷进行结构解析[J]. 波谱学杂志, 2009, 26(1): 89-92. |
| [11] |
HU Y Y, XIAO Y, ZHAO N, et al. Calculation of 13C chemical shifts of dihydroflavone using a model based on atomic electronegativity interaction vector[J].
Chinese J Magn Reson, 2005, 22(4): 383-389.
胡银玉, 肖燕, 赵娜, 等. 二氢黄酮类化合物的核磁共振碳谱模拟研究[J]. 波谱学杂志, 2005, 22(4): 383-389. |
| [12] | WILLIAM G, ROBERT L, BRUNO G, et al. C-2 stereochemistry of naringin and its relation to taste and biosynthesis in maturing grapefruit[J]. Bioorg Chem, 1975, 4(3): 259-269. DOI: 10.1016/0045-2068(75)90036-X. |
| [13] | FEDERICA M, CORNELIS E, FRANK K, et al. Identification of natural epimeric flavanone glycosides by NMR spectroscopy[J]. Food Chem, 2009, 116(2): 575-579. DOI: 10.1016/j.foodchem.2009.03.023. |
| [14] | CRISTIANO F, THAIS P, DANIEL R, et al. Interconverting flavanone glucosides and other phenolic compounds in Lippia salviaefolia Cham ethanol extracts[J]. Phytochemistry, 2011, 72(16): 2052-2061. DOI: 10.1016/j.phytochem.2011.07.004. |
| [15] |
WANG L, YU M M, CHI Y Q, et al. Chemical constituents of Euphorbia dracunculoides[J].
China J Chin Mat Med, 2014, 39(20): 3969-3973.
王莉, 喻明明, 迟宇前, 等. 蒿状大戟化学成分研究[J]. 中国中药杂志, 2014, 39(20): 3969-3973. |
| [16] | EHAB R, MOHAMMED H, HAZEM A, et al. Flavanone glycosides from Gleditsia caspia[J]. J Nat Prods, 2010, 3: 35-46. |
| [17] | HIROBUMI Y, HIROKI K, YASUHARU S., et al. Metabolism of administered (2 RS)-naringenin in flavonoid producing cultured cells of Sophora flavescens[J]. Plant Biotech, 2004, 21(5): 355-359. DOI: 10.5511/plantbiotechnology.21.355. |
 2017, Vol. 34
2017, Vol. 34 
