2. 西北大学 地质学系, 大陆动力学国家重点实验室, 陕西 西安 710029
2. State Key Laboratory of Continental Dynamics, Department of Geology, Northwest University, Xi'an 710029, China
糖类物质几乎参与所有的生命活动,在细胞的发育、分化和老化发生发展过程中起识别、传输、催化和调控等作用.糖类物质具有多种生物活性,含糖类结构的药物在抗癫痫、抗肿瘤、抗炎、抗病毒、降血糖、抗衰老、抗凝血和免疫促进等方面发挥着极其重要的作用. 2, 3:4, 5-双-O-(1-甲基亚乙基)-β-D-吡喃果糖(又称果糖二丙酮)作为一种重要的药物合成中间体,能够通过选择性开环及各种官能团转化制备许多关键的手性中间体和手型药物,同时它也是诸多具有重要生理功能的药物和天然产物的母体部分[1-4].果糖二丙酮具有多个手性原子,其立体构型直接关系着药物的药性和生理活性,因此对果糖二丙酮的空间构型确定工作具有十分重要的意义.本文利用核磁共振(NMR)技术对果糖二丙酮的结构(图 1)进行了表征,应用1H NMR、13C NMR、DEPT135、1H-13C HMBC、1H-13C HSQC、1H-1H COSY、NOESY对其质子的空间位置进行了指认归属,并对文献[5]中未见报道的13C NMR数据进行了补充.同时,结合密度泛函理论(DFT)对结构进行了计算模拟,佐证了该空间构型的合理性.
|
图 1 果糖二丙酮的化学结构 Figure 1 Molecular structure of diacetonefructose |
1H NMR、13C NMR、DEPT135、1H-1H COSY、NOESY、1H-13C HSQC、1H-13C HMBC实验均在Bruker Avance Ⅲ-400型超导NMR谱仪完成,使用PABBO-5 mm多核宽带探头.果糖二丙酮(纯度 > 99%)购自阿拉丁试剂公司;直径为5 mm的NMR样品管(ST-500,NORELL)、溶剂D2O(99.8%氘代,CIL)、内标物3-(三甲基硅基)-1-丙磺酸钠(DSS)购自腾龙微波科技有限公司.
1.2 实验条件测试温度为(293.0 ± 0.1)K.样品溶于D2O,以DSS为内标. 1H NMR和13C NMR的工作频率分别为400.13 MHz和100.61 MHz,谱宽分别为8 012.8 Hz和24 038.5 Hz. DEPT135采用仪器自带标准脉冲序列deptsp135,谱宽为16 129.0 Hz.二维谱包括二维梯度场1H-1H COSY、NOESY、1H-13C HSQC和1H-13C HMBC谱,均采用标准脉冲程序采集. 1H-1H COSY和NOESY的F2维(1H)和F1维(1H)的谱宽均为2 525.3 Hz,采样数据点阵t2×t1 = 1 024×128,NOESY混合时间0.5 s;1H-13C HSQC和1H-13C HMBC的F2(1H)和F1(13C)维谱宽分别为2 525.3 Hz和14 492.8 Hz,采样数据点阵t2×t1= 1 024 ×128.
理论计算采用量子化学密度泛函理论[6]的B3LYP[7]方法,在6-31+G**[8]基组水平上,对果糖二丙酮分子进行全参数优化,得到其结构与能量,全部计算工作使用Gaussian09[9]程序完成.
2 结果与讨论 2.1 NMR谱图分析 2.1.1 1D NMR谱图分析化合物果糖二丙酮分子式为C12H20O6,相对分子量为260.28.
从化合物果糖二丙酮的1H NMR谱(图 2)中,通过化学位移、峰型与积分面积规律,及文献[5]比对,推测δH4.75(dd,J = 8.0,2.4 Hz,1H)为H-3、δH4.44(d, J = 8.0 Hz, 1H)为H-2、δH4.40(d, J = 2.4 Hz, 1H)为H-4、δH3.96(dd, J = 13.2, 1.2 Hz, 1H)为H-1a、δH3.75(d, J = 13.2 Hz, 1H)为H-1b、δH3.66(d, J = 12.0 Hz, 1H)为H-7b、δH3.60(d, J = 12.0 Hz, 1H)为H-7a、δH1.56(s, 3H)、δH1.47(s, 3H)、δH1.42(s, 3H)和δH1.39(s, 3H)为4个甲基的化学位移,由于4个甲基的化学环境相似,从1H NMR谱中推断其准确位置较为困难,需要借助于其它实验进行指认.

|
图 2 果糖二丙酮的1H NMR谱图(293 K) Figure 2 1H NMR spectrum of diacetonefructose (293 K) |
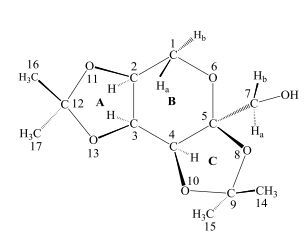
通过13C NMR谱与DEPT135谱(图 3),可以确定化合物有3个叔碳(δC72.0、72.7、73.1)、2个仲碳(δC63.2、66.2)、3个季碳(δC105.8、112.2、112.2)和4个伯碳(δC25.5、27.2、27.3、28.1).具体的归属需通过HSQC和HMBC谱确定.
|
图 3 果糖二丙酮的13C NMR和DEPT135谱图(293 K) Figure 3 13C NMR and DEPT135 spectra of diacetonefructose (293 K) |
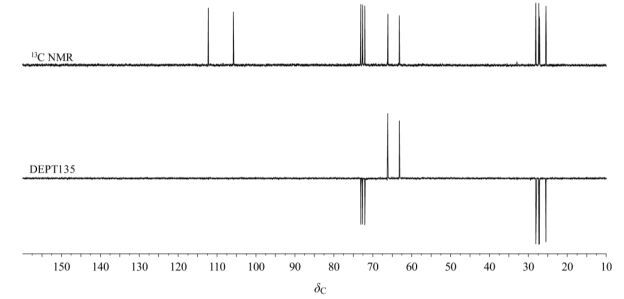
从1H-1H COSY谱中(见图 4),可以看到H-3与H-2、H-4均有交叉峰;没有看到H-2与H-1a、H-1b的交叉峰,这可能是因为H-2与H-1a、H-1b的二面角接近90˚,导致观察不到它们之间的耦合关系.受邻位手性碳原子的影响,H-1a与H-1b、H-7b与H-7a产生同核相关.甲基质子δH1.56与δH1.42,δH 1.47与δH 1.39有弱的远程耦合交叉峰产生,其交叉峰说明了4个甲基中有2个属于A环,另外2个属于C环.

|
图 4 果糖二丙酮的1H-1H COSY NMR谱(293 K) Figure 4 1H-1H COSY NMR spectrum of diacetonefructose (293 K) |
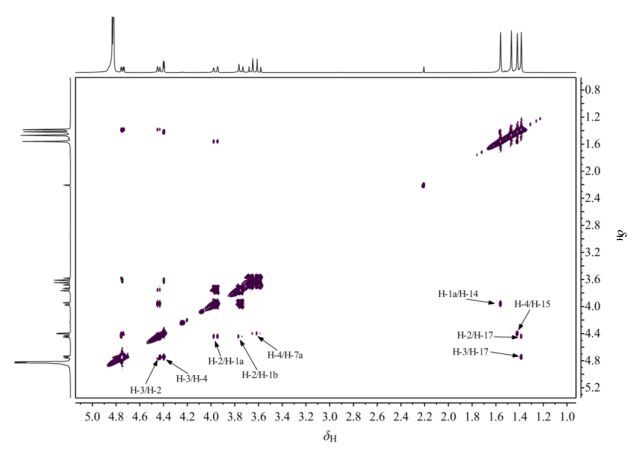
在NOESY谱(图 5)中,B环区域可以看到H-2与H-1a、H-1b均有相关,H-2、H-3与最高场甲基均有相关峰,可知该甲基处于A环的屏蔽区域,结合1H NMR谱以及H-2与H-3的耦合常数(3J = 8.0 Hz),说明H-2与H-3处于直立键的位置,最高场甲基与H-2和H-3处于A环的同一侧,设定最高场甲基为H-17,结合1H-1H COSY谱图,可以得知δH1.47是H-16;1H NMR谱中,H-3与H-4的耦合常数(3J)为2.4 Hz,说明H-4处于平伏键的位置,C环区域可以看到H-4与H-15有相关峰,可以确定它们在C环的同侧,位于较高场的甲基设定为H-15,处于C环的屏蔽区域,结合1H-1H COSY谱图,可以得知δH1.56是H-14,H-4与H-7a有交叉峰,可知H-4与H-7a在C环同侧;在B环中,H-1a与H-14有相关,可知它们在B环同侧,且位于去屏蔽区,出峰位置位于低场.
|
图 5 果糖二丙酮的NOESY NMR谱(293 K) Figure 5 NOESY NMR spectrum of diacetonefructose (293 K) |
通过上述分析,对果糖二丙酮质子的化学位移进行了归属,并确定了4个甲基的空间位置.由于使用的溶剂为D2O,存在活泼氢交换现象,故对于-OH上的活泼质子没有进行归属.同时,确定2、3、4位的3个手性原子都是S构型,果糖二丙酮的空间构型应如图 6所示.

|
图 6 果糖二丙酮的空间结构(293 K) Figure 6 The molecular geometry of diacetonefructose (293 K) |
果糖二丙酮的HSQC谱图如图 7所示,由图可以看到δC63.2与H-1a、H-1b均有相关,归属为C-1;δC66.2与H-7a、H-7b均相关,归属为C-7;δC72.0、72.7、73.1分别与H-3、H-4、H-2相关,分别归属为C-3、C-4、C-2.但对于δC105.8、112.2、112.3这三个季碳的归属,还需要借助于HMBC谱图.

|
图 7 果糖二丙酮的1H-13C HSQC NMR谱图(293 K) Figure 7 1H-13C HSQC NMR spectrum of diacetonefructose (293 K) |
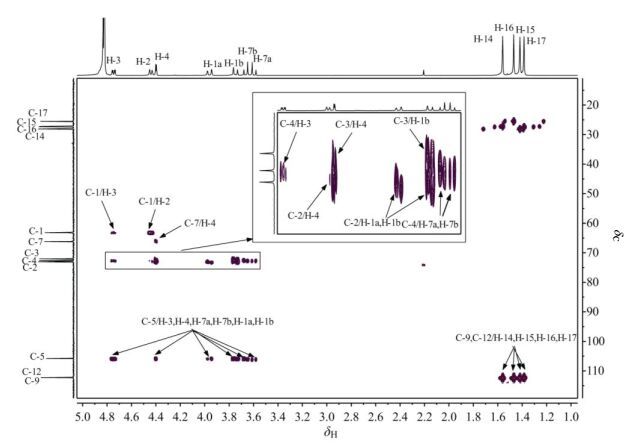
在果糖二丙酮的HMBC谱(图 8)中,δC105.8与H-3、H-4、H-1a、H-1b、H-7b和H-7a均有交叉峰,归属为C-5;δC112.2与H-17、H-15、H-16有交叉峰,归属为C-9;δC 112.3和H-14有交叉峰,归属为C-12;C-2与H-4、H-1a和H-1b有交叉峰;C-4与H-7a、H-7b和H-3均有交叉峰;C-3与H-1b和H-4均有交叉峰;C-7只与H-4有交叉峰;C-1与H-3和H-2有交叉峰.通过对HMBC谱图的分析,对三个季碳原子C-5、C-9和C-12的化学位移进行了归属,同时对前面基于HSQC谱图的分析结果进行了验证.
|
图 8 果糖二丙酮的1H-13C HMBC谱(293 K) Figure 8 1H-13C HMBC spectrum of diacetonefructose (293 K) |
通过对果糖二丙酮的1H NMR、13C NMR、DEPT135、1H-1H COSY、NOESY、1H-13C HSQC和1H-13C HMBC谱图的分析,并结合文献[10-17],对果糖二丙酮的已有报道的1H NMR信号[5]和未见报道的13C NMR信号进行了全部指认,结果见表 1.
| 表 1 化合物果糖二丙酮的1H和13C NMR归属 Table 1 1H and 13C NMR assignments of diacetonefructose |
对果糖二丙酮的理论计算模拟使用Gaussian09程序,采用密度泛函理论B3LYP方法.在6-31+G**基组水平上,使用极化连续介质模型(PCM)对果糖二丙酮的分子结构进行了优化,振动频率分析发现优化结构无虚频,表明该优化结构为势能面上的极小点,为稳定构型,优化后的几何构型及其所有键长键角如图 9所示.
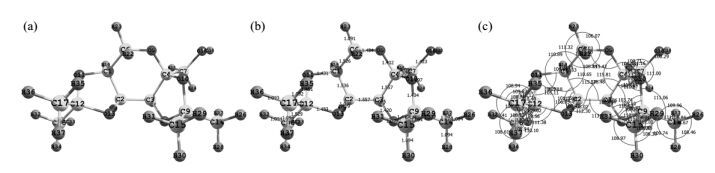
|
图 9 果糖二丙酮的(a)优化结构、(b)所有键长(0.1 nm)及(c)键角 Figure 9 The optimize structure (a), all bond length (b) and bond angle (c) of diacetonefructose |
对优化后的果糖二丙酮的结构进行了前线轨道理论分析,所得结果如图 10所示,由图 10中可以看出,果糖二丙酮的最高占据轨道(HOMO)几乎分布于整个分子体系,而最低未占轨道(LUMO)则仅仅分布于羟基位置,HOMO与LUMO之间能量差为7.15 eV,表明该分子不易发生化学反应、性质稳定.此外,还对果糖二丙酮结构的自然键轨道理论(NBO)进行了分析,其电荷分布及数值如图 10(c)所示.
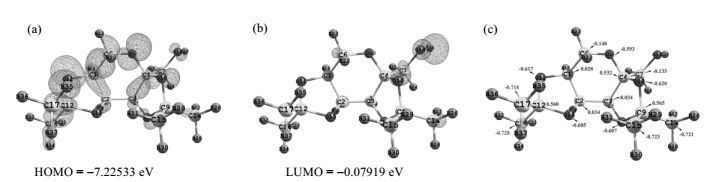
|
图 10 果糖二丙酮的(a)最高占据轨道、(b)最低未占轨道及(c)电荷分布 Figure 10 HOMO (a), LUMO (b) and charge distribution (c) of diacetonefructose |
通过综合运用1D和2D NMR技术,分析和归属了果糖二丙酮的所有1H和13C NMR信号.运用NOESY实验对果糖二丙酮空间结构进行了确定;利用1H-13C HMBC实验,根据不同的空间取向和屏蔽效应,对4个化学环境相似的甲基进行了准确的归属.此外,利用Gaussian09程序,采用密度泛函理论对果糖二丙酮的结构进行了计算模拟,并佐证了基于NMR谱图确定的果糖二丙酮构型的合理性和稳定性.
| [1] | SAYYEDEH S P, SAYYED M H, MEHDI S. Fructose-catalyzed synthesis of tetrahydrobenzo[J]. Chinese J Catal, 2015, 36(5): 757-763. DOI: 10.1016/S1872-2067(14)60302-8. |
| [2] | MARIA R B, LAURA D L, STEFANIA F, et al. Carbonic anhydrase inhibitors:Design, synthesis and structural characterization of new heteroaryl-N-carbonylbenzenesulfonamides targeting druggable human carbonic anhydrase isoforms[J]. Eur J Med Chem, 2015, 102(18): 223-232. |
| [3] | ROSARIA G, STEFANIA F, STEFANO A, et al. Synthesis and evaluation of pharmacological profile of 1-aryl-6, 7-dimethoxy-3, 4-dihydroisoquinoline-2(1H)-sulfonamides[J]. Bioorg Med Chem, 2009, 17(10): 3659-3664. DOI: 10.1016/j.bmc.2009.03.066. |
| [4] |
CHEN X L. Topiramate tablets, phenobarbital, valproate treatment of pediatric epilepsy comparison[J].
Chinese J Clin Ration Drug Use, 2015, 8(3C): 67-68.
陈秀莲. 苯巴比妥、托吡酯片、丙戊酸钠治疗小儿癫痫的疗效比较[J]. 临床合理用药, 2015, 8(3C): 67-68. |
| [5] | SADAYUKI A, TAKEHIKO W, YOSHIHISA I. Microenvironmental polarity control of electron-transfer photochirogenesis. enantiodifferentiating polar addition of 1, 1-diphenyl-1-alkenes photosensitized by saccharide naphthalenecarboxylates[J]. J Am Chem Soc, 2003, 125(10): 3008-3027. DOI: 10.1021/ja028680o. |
| [6] | PARR R G, YANG W. Density functional theory of atoms and molecules[M]. New York: Oxford University Press, 1989. |
| [7] | BECKE A D. Density-functional thermochemistry. Ⅲ. The role of exact exchange[J]. J Chem Phys, 1993, 98(7): 5648-5652. DOI: 10.1063/1.464913. |
| [8] | DITCHFIELD R, HEHRE W J, POPLE J A. Self-consistent molecular-orbital methods. Ⅸ. An extended gaussian-type basis for molecular-orbital studies of organic molecules[J]. J Chem Phys, 1971, 54(2): 724-728. DOI: 10.1063/1.1674902. |
| [9] | FRISCH M J, TRUCKS G W, SCHLEGEL H B, et al. Gaussian 09[M]. Wallingford: Gaussian, Inc., 2009. |
| [10] |
SUN W, WEI Y F, BAI Y J, et al. An NMR study of α-mangostin[J].
Chinese J Magn Reson, 2008, 25(2): 257-264.
孙伟, 魏永锋, 白银娟, 等. α-山竹黄酮的NMR研究[J]. 波谱学杂志, 2008, 25(2): 257-264. |
| [11] | SAMUEL O N, WU W N, BRUCE E M. Synthesis of hydroxylated derivatives of topiramate, a novel antiepileptic drug based on d-fructose:Investigation of oxidative metabolites[J]. Carbohyd Res, 1997, 304(1): 29-38. DOI: 10.1016/S0008-6215(97)00214-0. |
| [12] | JOCHEN K, THOMAS Z. Synthesis of spirofused carbohydrate-oxazoline based palladium(Ⅱ) complexes[J]. Carbohyd Res, 2015, 411(26): 56-63. |
| [13] |
XU C L, ZHENG Y N. Studies on the structural identification of new flavonolglycoside of salix raddeana laksc[J].
Chinese J Ana l Chem, 2005, 33(9): 1311-1314.
许传莲, 郑毅男. 大黄柳叶中新黄酮苷的结构鉴定[J]. 分析化学, 2005, 33(9): 1311-1314. |
| [14] |
XU H, LI Y L, TIAN H C, et al. Preparation and chemical structure identification of methylated metabolites of salvianolic acid A[J].
Chinese J Anal Chem, 2014, 42(1): 65-70.
许卉, 李艳丽, 田红翠, 等. 丹酚酸A甲基结合代谢物的制备与结构鉴定[J]. 分析化学, 2014, 42(1): 65-70. |
| [15] |
CHAI J, WANG X, LI H M, et al. A Two-dimensional NMR study on steroid glycosides extracted from trillium tschonoskii[J].
Chinese J Magn Reson, 2015, 32(1): 105-115.
柴江, 王欣, 李慧敏, 等. 延龄草中2个甾体皂苷的2D NMR研究[J]. 波谱学杂志, 2015, 32(1): 105-115. DOI: 10.11938/cjmr20150112. |
| [16] |
YUAN K, JIA A, LV J L, et al. Structural identification of new C-glycosylflavones from mimosa pudica[J].
Chinese J Anal Chem, 2007, 35(5): 739-742.
袁珂, 贾安, 吕洁丽, 等. 含羞草中新黄酮碳苷的结构鉴定[J]. 分析化学, 2007, 35(5): 739-742. |
| [17] |
REN F Z, CHEN S H, ZHANG X X, et al. Structure analysis of an oligosaccharide isolated from bixo orel lana by NMR spectroscopy[J].
Chinese J Magn Reson, 2011, 28(1): 160-167.
任风芝, 陈书红, 张雪霞, 等. 胭脂树低聚糖的结构分析[J]. 波谱学杂志, 2011, 28(1): 160-167. |
 2017, Vol. 34
2017, Vol. 34 
