2. 厦门大学 电子科学系, 福建省等离子体与磁共振研究重点实验室, 福建 厦门 361005
2. Department of Electronic Science, Xiamen University, Fujian Provincial Key Laboratory of Plasma and Magnetic Resonance, Xiamen 361005, China
在特定的化学环境下,因化学交换导致不同的质子(-NH、-OH等)会从一种物质的饱和状态向另一种物质转移,即称化学交换饱和转移(Chemical Exchange Saturation Transfer, CEST)效应.
CEST成像作为一种新的磁共振成像(Magnetic Resonance Imaging, MRI)技术是在磁化传递(Magnetization Transfer, MT)及化学交换理论基础上发展起来的,其原理是利用特定的偏共振饱和脉冲,对外源性或内源性特定物质的质子进行充分的预饱和,进而与自由水中的质子进行化学交换,从而影响自由水中质子的信号强度.这样可通过检测水质子信号的变化,来间接反映这种物质的相关信息及化学交换的组织环境.由于CEST成像使用水信号间接检测特定代谢物信息,因此低浓度代谢物的信号得到明显的放大,可以探测的代谢物浓度可达到微摩尔(μmol),甚至纳摩尔(nmol)级别.这种以细胞内物质为内源性对比剂,进行组织的酸碱度成像及其各种代谢物成像的技术,具有广泛的应用前景[1-4].
众所周知,蛋白质是生命的物质基础,占体重的比例达16%~20%,它与各种形式的生命活动密切相关,是机体细胞的重要组成部分.蛋白质由肽键将氨基酸连接而成,而酰胺质子正是肽键的组成部分之一,其分布范围非常广泛.酰胺质子转移(Amide Proton Transfer, APT)成像[3-5]是一种基于CEST成像,能无创性地检测内源性的、位于细胞质内的游离蛋白质及多肽分子的新影像技术.APT成像产生CEST的物质为细胞内蛋白质和/或多肽的酰胺质子.酰胺质子的化学位移为δH(8.3±0.5),即位于水峰左边3.5 ppm的位置[6].釆用CEST技术,用饱和脉冲激发可交换的酰胺质子,这样被饱和的酰胺质子会与未饱和的水中质子进行化学交换,从而使水中质子的信号强度发生变化.由于酰胺质子的共振频率在偏离水质子3.5 ppm处,因此利用APT成像进行在体检测时,会受到水的直接饱和效应(water saturation)和传统的MT效应的影响.当我们采用磁化传递率(Magnetization Transfer Ratio, MTR)来定量评价时,
| $MTR = 1 - {S_{sat}}/{S_0}$ | (1) |
Ssat为相应饱和频率的信号值;S0为饱和频率为0的信号值.必须分离出APT的效果:
| $\begin{array}{*{20}{l}} {MT{R_{asym}}(3.5{\rm{ppm}}) = {S_{sat}}( - 3.5{\rm{ppm}})/{S_0} - {S_{sat}}( + 3.5{\rm{ppm}})/{S_0}}\\ { \approx MT{{R'}_{asym}}(3.5{\rm{ppm}}) + APTR} \end{array}$ | (2) |
上式中
| $APTR = \frac{{{K_{SW}}[{\rm{amide}}{\mkern 1mu} {\rm{proton}}]}}{{[{\rm{water}}{\mkern 1mu} {\rm{proton}}]{R_{1{\rm{w}}}}}}(1 - {{\rm{e}}^{ - {R_{1{\rm{w}}}}{t_{{\rm{sat}}}}}})$ | (3) |
其中KSW为氨基类化合物的化学交换率;[water proton]为水质子浓度,与含水量有关;[amide proton]为CEST氨基质子浓度;tsat为饱和脉冲饱和时间;R1w为纵向弛豫率.对于水溶液里的质子交换,有KSW∝10pH-pKw,(3) 式说明了氨基类化合物的化学交换率与溶液酸碱度之间的关系.
疾病早期代谢物的变化和细胞内外酸碱度的变化越来越受到人们的重视,因为代谢和pH值平衡是维持机体内环境稳态的重要组成部分之一.正常情况下,机体各组织代谢和pH值处于一种动态平衡过程,只在很小的范围内波动;在病理条件下,尤其是脑肿瘤的代谢和pH值可能存在异常变动.因此可用代谢物和pH反映组织的生理、病理变化.目前尚无一种成熟的方法,可实现无创地检测活体代谢物和pH值,而CEST成像可以实现这一目的,用于疾病,特别是脑部疾病的早期诊断和评估,对于肿瘤的预后及治疗有重要意义.虽然CEST技术可从传统的解剖成像扩展到活体生化代谢和pH值成像,开创了MRI分子影像新领域,为临床疾病诊断治疗甚至预防提供了一种全新的检查手段.然而,在临床应用研究中,CEST成像仍存在一些重要的影响因素有待阐明,本文就这个问题进行初步探讨.
1 材料与方法 1.1 实验材料采用试管模型和临床病例,分别从成像组织、设备、技术及其他因素4个方面收集数据分析.
试管模型:在同一大量杯,分别采用50 mL试管制作含有30%谷氨酸(Glu)、碘剂(I320)、纯水(H2O)和肌酸(Cr)的模型,采用30%琼脂糖固定.
临床案例:收集从2013年10月至2014年10月进行CEST图像采集的临床病例45例,其中志愿者8例,患者37例;男25例,女20例.年龄在35~73岁之间,平均年龄为52.6岁.患者中脑梗塞患者12例,脑肿瘤患者25例.在检查前所有受检者均了解检查内容,并签署了知情同意书.
1.2 方法采用GE Signa HDe 1.5 T MRI扫描仪分别进行试管模型和临床病例的数据采集,其中试管模型进行CEST成像和Z谱成像,临床案例进行CEST成像和常规MRI检查.
CEST成像:采用pulsed RF irradiation的GRE序列,其饱和脉冲占空比为50%.脉冲个数和相位编码数一致,单个饱和脉冲的饱和时间为8 ms,总的饱和时间=8 ms×饱和脉冲个数×2.脉冲间隔时间(TR)为60 ms,回波时间(TE)时间默认为最小值.视野(FOV)= 20×20 cm2,翻转角(flip angle)为35˚,矩阵=128×128,MT翻转角=105˚,opfat=1,激励次数为8次.分别采集opmt=1、MT频率=-224 Hz,opmt=1、MT频率=224 Hz,及opmt=0三组图像,并通过该三组图像进行后处理得出APT图.opfat是脂肪抑制的开关命令符,1为开、0为关;opmt是MT饱和脉冲的开关命令符,1为开、0为关.在对比成像效果时,分别采用不同采集矩阵(128×128和256×256)、不同激励次数(2次和8次)、不同翻转角(15˚ ~ 65˚,间隔10˚)、不同MT翻转角(35˚ ~ 105˚,间隔10˚)进行对比分析.
Z谱:opmt=1,MT频率为-354~ 354 Hz、间隔10 Hz,分别采集不同激励次数(2次和8次)、不同翻转角(35˚ ~ 115˚,间隔10˚)的Z谱分析.
1.3 数据处理及分析所得数据采用MATLAB平台上自主编译的后处理软件进行CEST-APT成像和CEST-Z谱重建等进行后处理,分别对原始图、APT图、Z谱进行信号值和谱线分析.数据分析采用SPSS 13.0进行统计学分析.
2 结果与讨论 2.1 成像组织组织中的不同代谢物的含量决定了CEST成像时APT信号对比情况,包括游离蛋白及多肽的含量、组织的水含量、pH值、温度、水的纵向弛豫时间(T1)等都会影响APT信号,其中最主要的是蛋白及多肽含量[3].本实验中的CEST模型和临床案例,都证明了这一点.
模型Z谱在磁化传递频率区间范围为-294~ -194 Hz时可显示30% Glu、I320、H2O、Cr的信号差异,与H2O差异最大处为-244~ -214 Hz.原始图像信号30% I320明显高于Glu、H2O、Cr,Cr略低于Glu,APT图Cr略低于Glu,如图 1所示.根据文献所述,1.5 T拉莫尔频率为63.75 MHz,APT为δH3.5,频率范围为(224±5)Hz;Cr一般为δH3.05,频率范围为(194.4±5)Hz;谷氨酸类为δH2.1~2.4和δH3.65~3.8,频率范围为133.8~153.0 Hz和232.7~242.2 Hz.
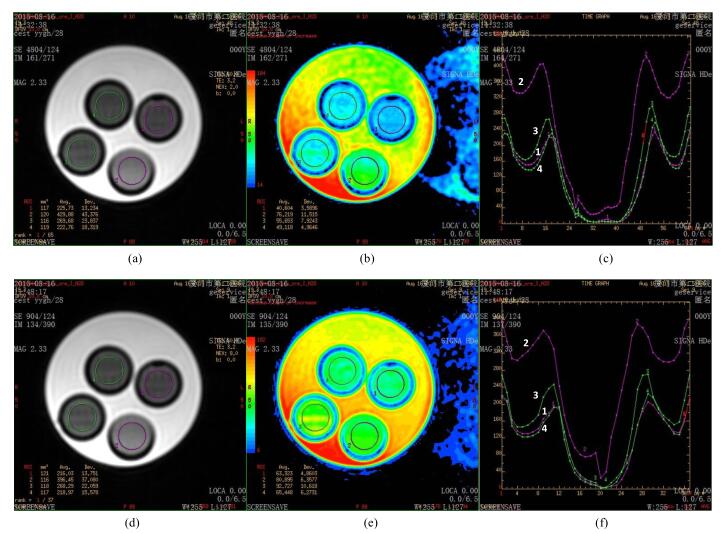
|
图 1 (a)饱和频率为-354 Hz的原始图(激励次数为2);(b)最大斜率图(激励次数为2);(c) Z谱图(激励次数为2);(d)饱和频率为-354 Hz的原始图(激励次数为8);(e)最大斜率图(激励次数为8);(f) Z谱图(激励次数为8).编号1~4分别代表 30%谷氨酸(Glu)、碘剂(I320)、纯水(H2O)和肌酸(Cr)四种代谢物 Figure 1 (a) Original map with the saturation frequency of -354 Hz (NEX=2); (b) Maximum slope map (NEX=2); (c) Z spectra (NEX=2); (d) Original map with the saturation frequency of -354 Hz (NEX=8); (e) Maximum slope map (NEX=8); (f) Z spectra (NEX=8). No. 1~4 represent 30% Glu, I320, H2O and Cr, respectively |
因氨基质子浓度的增多,25例脑肿瘤液体衰减反转恢复序列成像(Fluid Attenuated Inversion Recovery,FLAIR)呈高信号,弥散加权成像(Diffusion Weighted Imaging,DWI)呈高信号、灌注加权成像(Perfusion Weighted Imaging,PWI)呈低灌注,CEST原始图像可区分病变区域;APT图呈高信号(如图 2所示),可区分肿瘤实变区、坏死区及瘤周水肿区.对于小点状的转移灶,原始图像上可以区分信号的差异.
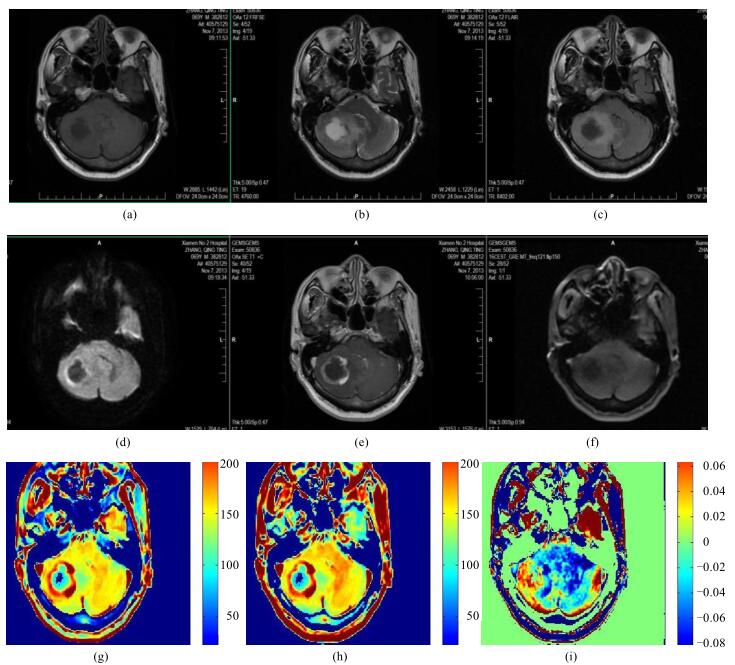
|
图 2 脑肿瘤患者脑部磁共振图像. (a) T1加权图;(b) T2加权图;(c) T2 FLAIR图;(d) DWI图;(e)增强T1加权图;(f)饱和频率为-224 Hz的原始图;(g)饱和频率为-224 Hz的伪彩图;(h)饱和频率为224 Hz的伪彩图;(i) APT图 Figure 2 Brain MR images of the patients with brain tumor. (a) T1 weighted image; (b) T2weighted image; (c) T2 FLAIR image; (d) DWI image; (e) Enhance T1 weighted image; (f) Original map with the saturation frequency of -224 Hz; (g) Pcolor map with the saturation frequency of -224 Hz; (h) Pcolor map with the saturation frequency of 224 Hz; (i) APT image |
因缺血导致pH的变化,12例脑梗塞缺血区FLAIR呈高信号、DWI呈高信号、PWI呈低灌注,CEST原始图像可区分病变区域;APT图呈低信号(如图 3所示),可区分实际病变区及水肿区.
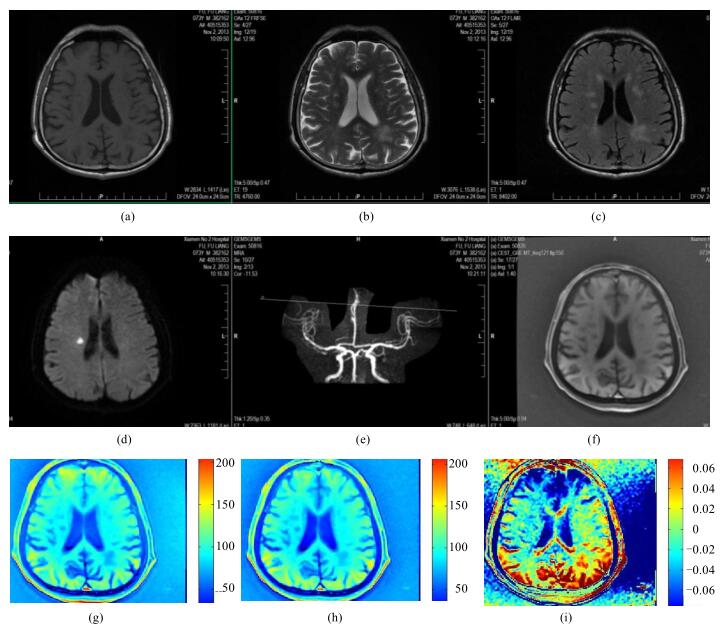
|
图 3 脑梗塞患者脑部磁共振图像. (a) T1加权图;(b) T2加权图;(c) T2 FLAIR图;(d) DWI图;(e)增强T1加权图;(f)饱和频率为-224 Hz的原始图;(g)饱和频率为-224 Hz的伪彩图;(h)饱和频率为224 Hz的伪彩图;(i) APT图 Figure 3 Brain MR images of the patients with brain infarction. (a) T1 weighted image; (b) T2weighted image; (c) T2 FLAIR image; (d) DWI image; (e) Enhance T1 weighted image; (f) Original map with the saturation frequency of -224 Hz; (g) Pcolor map with the saturation frequency of -224 Hz; (h) Pcolor map with the saturation frequency of 224 Hz; (i) APT image |
当然,本实验入选样本数据量不算多,可能存在一定的偏差,需要更大量的样本.
2.2 成像设备实验结果显示,1.5 T MRI扫描仪实现CEST效应的有效饱和频率范围较小,信噪比相对低.
因为实现APT成像需要两个基本条件[3, 7],即Δw≥K和R1≤K,其中Δw为酰胺质子与自由水质子的化学位移差,K为化学交换速率,R1为水质子的纵向弛豫速率.酰胺质子的共振峰位于δH8.3处,相对于水峰而言,Δw为δ 3.5,则3.0 T场强下,Δw为448 Hz,且K值范围为10~300 Hz,故在3.0 T MRI扫描仪上进行APT成像是符合条件的,且可以进行定量分析组织的pH值.这也是目前CEST成像的研究及应用主要在3.0 T及以上场强的MRI扫描仪的原因.本实验是在1.5 T MRI扫描仪上进行的,Δw = 224 Hz,只有部分满足Δw≥K这个条件,故在饱和的过程中将直接影响到水峰,相对信号差异不是太明显,致使APT成像时CEST效应低,且信噪比相对较低,如图 1所示.
另外,磁场的稳定性及均匀度也会影响CEST成像效果[8].本实验过程中,进行了可重复性的分析.重复采集,即同一模型或同一受检者,在同一定位的情况下,间隔数分钟以后重新采集一次.发现该成像技术可重复性与磁场稳定性及均匀度有关,即在保证磁场的稳定性及均匀度的情况下,可进行比较准确的CEST成像,否则,将得到重复性较差的数据,进而影响图像质量.所以,在每次进行CEST成像时,需进行磁场稳定性及均匀度的质量控制检查并校正.
2.3 成像技术在1.5 T场强的磁场下,CEST图像信噪比相对较低,而要得到可靠的结果需要有更高的信噪比,因此不能完全移植3.0 T场强下的成像参数,必须进行优化改善.本实验组通过修改矩阵大小、激励次数、翻转角、MT翻转角等序列参数进行方案优化.结果显示:1.5 T场强下,在其他参数不变的情况下,降低矩阵可以一定程度提高信噪比;增加激励次数可提高信噪比,但是激励次数增加会导致采样时间增加,这时APT图及Z谱影响不大,但受检者就可能因为采样时间长而无法耐受;增大采集翻转角可以增加原始图像信噪比;MT翻转角为105˚时CEST效果最好.本文模型未制作不同pH值的状态,据文献[8, 9],pH值越大,信号下降越明显.本实验中出现的信号偏差很大程度上可能是因为pH值的影响.当然,还可以通过编译序列包,改变预饱和时间来进一步优化序列,该部分工作正在进行中.
对于Z谱,不同MT翻转角虽原始图信号不同,但不影响Z谱谱线的对比.激励次数为8次、MT翻转角为105˚时,信号较好,但采集时间较长;而激励次数为2次、MT翻转角为105˚时,所得数据符合组织Z谱情况.
所有的CEST数据均采用pulsed RF irradiation的GRE序列,其饱和脉冲占空比(即饱和脉冲与间隔时间之比)为50%.脉冲个数和相位编码数一致,单个饱和脉冲的饱和时间为8 ms,总的饱和时间=8 ms×饱和脉冲个数×2.即矩阵越大,饱和时间越长,采集时间也越长.且文献报道[7-9]TR为60 ms,足够组织纵向恢复至原始状态.故我们认为,优化后CEST序列参数可设置为:TR=60 ms,TE默认为最小值,翻转角=35˚,FOV=20×20 cm2,矩阵=128×128,MT翻转角=105˚,opfat=1, 激励次数为8次.分别采集opmt=1、MT频率为-224 Hz,opmt=1、MT频率为224 Hz,及opmt=0三组图像,并通过该三组图像并得出APT图.Z谱采集时,opmt=1、MT频率为-354 ~ 354 Hz,间隔10 Hz,激励次数为2次.
2.4 其他因素虽说采集时间对序列本身没有影响,但受检者配合情况、环境室温等因素,都会影响CEST成像效果.本实验中,出现12例首次扫描失败.其中7例为无法耐受长时间卧位,5例为检查间温度太高.
3 结论1.5 T场强下,CEST技术受到成像组织、设备、技术等因素的影响,待优化的参数较多.在保证磁场稳定性及均匀度的情况下,CEST序列参数为:TR=60 ms,TE默认为最小值,翻转角=35˚,FOV=20×20 cm2,矩阵=128×128,MT翻转角=105˚,opfat=1,激励次数为8次.分别采集opmt=1、MT频率为-224和224 Hz,及opmt=0三组图像.Z谱采集时采用opmt=1,MT频率为-354~354 Hz、间隔10 Hz,激励次数为2次,就可以得到满意的CEST原始图、APT图、Z谱,可以区分代谢物及其浓度,并可准确无创伤性地检测脑肿瘤及脑梗塞等疾病微环境早期代谢变化.
| [1] | WARD K M, ALETRAS A H, BALABAN R S. A new class of contrast agents for MRI based on proton chemical exchange dependent saturation transfer (CEST)[J]. J Magn Reson, 2000, 143(1): 79-87. DOI: 10.1006/jmre.1999.1956. |
| [2] | HUA J, JONES C K, BLAKELEY J, et al. Quantitative description of the asymmetry in magnetization transfer effects around the water resonance in the human brain[J]. Magn Reson Med, 2007, 58(4): 786-793. DOI: 10.1002/(ISSN)1522-2594. |
| [3] |
YANG Y G, SHEN Z W, WU R H, et al. Research of chemical exchange saturation transfer in brain[J].
Chin J Magn Reson Imaging, 2016, 7(4): 81-84.
杨永贵, 沈智威, 吴仁华, 等. 脑部化学交换饱和转移成像研究[J]. 磁共振成像, 2016, 7(4): 81-84. |
| [4] | VAN ZIJL P C M, YADAV N N. Chemical exchange saturation transfer (CEST):What is in a name and what isn't?[J]. Magn Reson Med, 2011, 65(4): 927-948. DOI: 10.1002/mrm.22761. |
| [5] | WANG S, JARSO S, VAN ZIJL P C, et al. Role of amide proton transfer (APT)-MRI of endogenous proteins and peptides in brain tumor imaging[M]. New York: Springer, 2014: 171-181. |
| [6] | MORI S, ELEFF S M, PILATUS U, et al. Proton NMR spectroscopy of solvent-saturable resonances:A new approach to study pH effects in Situ[J]. Magn Reson Med, 1998, 40(1): 36-42. DOI: 10.1002/(ISSN)1522-2594. |
| [7] | SUN P Z, WANG E, CHEUNG J S, et al. Simulation and optimization of pulsed radio frequency (RF) irradiation scheme for chemical exchange saturation transfer(CEST) MRI-demonstration of pH-weighted pulsed-amide proton CEST MRI in an animal model of acute cerebral ischemia[J]. Magn Reson Med, 2011, 66(4): 1042-1048. DOI: 10.1002/mrm.22894. |
| [8] | SUN P Z, ZHOU J, HUANG J, et al. Simplified quantitative description of amide proton transfer (APT) imaging during acute ischemia[J]. Magn Reson Med, 2007, 57(2): 405-410. DOI: 10.1002/(ISSN)1522-2594. |
| [9] | SUN P Z, ZHOU J, SUN W, et al. Detection of the ischemic penumbra using pH-weighted MRI[J]. J Cereb Blood Flow Metab, 2007, 27(6): 1129-1136. DOI: 10.1038/sj.jcbfm.9600424. |
 2017, Vol. 34
2017, Vol. 34 
