2. 河北省中药注射剂工程技术研究中心, 河北 石家庄 051430
2. Hebei Traditional Chinese Medicine Injection Engineering Technology Research Center, Shijiazhuang 051430, China
卡巴他赛(结构见图 1)是赛诺菲-安万特公司开发的新型紫杉类药物,2010年经美国食品药品监督管理局(FDA)优先审批程序批准上市,用于联合泼尼松治疗既往接受过含多西他赛方案治疗的转移性激素难治性前列腺癌[1].卡巴他赛为现今第一个且唯一一个能够为患者提供生存受益的二线化疗药物,其作用机理为通过与微管蛋白结合促进微管双聚体装配成微管,同时通过防止去多聚化过程抑制微管分解而使微管稳定,从而影响有丝分裂及分裂间期细胞功能.临床试验结果显示,它的抗癌效果良好,且不良反应可耐受,应用前景十分广阔[2].
|
图 1 卡巴他赛的结构 Figure 1 The structure of cabazitaxel |
经过文献检索发现, 文献[3–9]报道的主要关注点是关于卡巴他赛的合成方法, 而波谱数据方面的报道有所欠缺.其中,文献[3, 4]中仅报道了其核磁共振氢谱(1H NMR)数据;文献[5]报道了二甲氧基多西他赛丙酮化物的1H NMR谱数据;文献[6, 7]只公开了卡巴他赛电喷雾质谱(ESI-MS)的离子峰, 没有进行详细的碎片裂解分析.本文结合文献[10, 11]方法, 利用红外吸收光谱、紫外吸收光谱、NMR波谱(包括1H NMR、13C NMR、DEPT-135、COSY、HSQC和HMBC)、质谱等谱学方法和差示扫描量热分析、X-射线粉末衍射及元素分析等技术对卡巴他赛的结构及波谱学数据进行了解析, 以期对卡巴他赛及同类物的研究提供更多的波谱信息, 为卡巴他赛的质量研究提供较为全面的参考依据.
1 实验部分 1.1 样品与试剂卡巴他赛样品为自制合成, 经高效液相色谱(HPLC)面积归一化法检测纯度为99.81%.差示扫描量热分析显示204.8~213.7 ℃样品失重49.03%, 为样品分解失重, 说明样品中不含游离水和结晶水, 也不含大量的残留溶剂;X-射线粉末衍射显示样品不含有可辨认的衍射峰形, 为无定形粉末;元素分析显示样品含C:64.43%, H:6.95%, N:1.39%, 符合卡巴他赛分子式C45H57NO14.
其它所用试剂均为分析纯.
1.2 仪器红外吸收光谱用NICOLET-5700傅里叶变换红外光谱仪(Thermo Fisher Scientific Inc.,美国)测定,KBr压片;紫外吸收光谱用TU-1901紫外分光光度计(北京普析通用仪器有限公司)测定;NMR谱图采用Bruker ARX400型NMR谱仪(Bruker,瑞士)测定;质谱图用QSTAR Elite LC/MS/MS System质谱仪(AB Sciex Pte. Ltd., 美国)测定,配备电喷雾离子源(ESI).
1.3 NMR实验样品溶于CDCl3, 1D和2D NMR实验均在配备BBFO探头的Bruker 400型NMR谱仪上完成, 采用直径为5 mm的NMR样品管. 1H和13C NMR的共振频率分别为400.17 MHz和100.62 MHz. 1H NMR 90˚脉冲宽度10.8 µs, 弛豫延迟为1.2 s. 13C NMR 90˚脉冲宽度为8.8 µs, 采样点数为32 k, 弛豫延迟为1.2 s, 采用质子宽带去偶法测定.1H-1H COSY、1H-13C HSQC、1H-13C HMBC和DEPT-135实验采用Bruker公司标准脉冲程序,1H-1H COSY的F2维(1H)和F1维(1H)谱宽均为5 330 Hz, 累加次数为16,采样数据点阵t2×t1= 1 024×512;HSQC和HMBC实验中F1维(13C)谱宽为24 038 Hz, F2维(1H)谱宽为5 330 Hz,采样数据点阵t2×t1 = 1 024×512.DEPT-135的采样参数与13C NMR实验相同.NMR谱图均以四甲基硅烷(TMS)定标(δH0.00,δC 0.0).
2 结果与讨论 2.1 红外吸收光谱分析卡巴他赛的红外吸收光谱中,3 439.9 cm–1为O-H的伸缩振动,表明分子中含游离羟基(-OH);3 064.4 cm–1为苯环上=C-H伸缩振动,1 602.5、1 585.1、1 495.6、1 452.7 cm–1为苯环骨架C=C伸缩振动, 746.9、709.0 cm–1为单取代苯环C-H弯曲振动, 表明分子中含有苯环结构;2 980.0、2940.6、2 897.7、2 822.6 cm–1为甲基、亚甲基、甲氧基C-H的伸缩振动吸收峰, 1 392.2、1 368.2 cm–1为甲基C-H弯曲振动, 表明分子中含甲基(-CH3)、亚甲基(-CH2)和甲氧基(-OCH3);1 723.6 cm–1为C=O的伸缩振动吸收峰, 表明分子中含羰基(C=O);1 269.8、1 246.2 cm–1为C-C-C的变角振动与酯基C-C的伸缩振动, 表明分子中含酯基(C-O-C);1 170.1、1 026.5 cm–1为环醚中C-O-C的伸缩振动, 表明分子中含有环醚键.具体的红外吸收光谱数据及归属见表 1.
| 表 1 卡巴他赛的红外吸收光谱分析 Table 1 Infrared data analysis of cabazitaxel |
卡巴他赛精制品在甲醇溶液中的紫外吸收光谱中, 206.5 nm为π→π*反键轨道跃迁特征吸收峰, 属于E2吸收带;230.0 nm为π→π*反键轨道跃迁的结果, 属于K吸收带, 证明该分子可能含有两个或两个以上共轭双键体系, 与卡巴他赛分子结构相符.
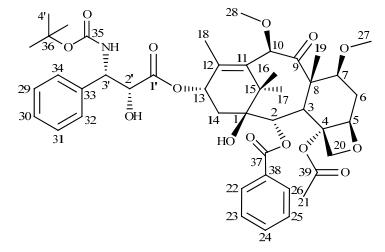
2.3 NMR谱图分析 2.3.1 1H NMR和1H-1H COSY谱图分析卡巴他赛化合物1H NMR谱中共显示57组质子信号,结合1H-1H COSY谱(图 2)和文献[4]对比,可知高场δH 1.20(6H, s, H-16, 17)、1.35(9H, s, H-4')、1.70(3H, s, H-19)、1.87(3H, s, H-18)、2.35(3H, s, H-21)、3.29(3H, s, H-27)和3.44(3H, s, H-28)为甲基质子信号.其中,H-27、28由于受氧原子的吸电子作用影响,其化学位移相对处于较低场. δH 2.26(2H, d, J = 8.8 Hz,H-14)、δH 1.75(2H, m, H-6a, OH-1)、δH 2.65(1H, m, H-6b)、δH 4.15(1H, d, H-20a)、δH 4.27(1H, d, H-20b)为亚甲基质子信号.其中,δH 1.75(1H, m, H-6a)和2.65(1H, m, H-6b)为一组同碳质子信号,δH 4.15(1H, d, J = 8.4 Hz, H-20a)和4.27(1H, d, J = 8.4 Hz, H-20b)也是一组同碳质子信号,1H-1H COSY谱显示它们相互关联;δH 3.79(1H, d, J = 6.8 Hz, H-3)、3.83(1H, dd, J = 6.4/10.4 Hz, H-7)、4.62(1H, s, H-2')、4.79(1H, s, H-10)、4.95(1H, d, J = 8.4 Hz, H-5)、5.25(1H, d, J = 7.2 Hz, H-3')、5.61(1H, d, J = 7.6 Hz, H-2)和6.18(1H, t, J = 8.6 Hz, H-13)为次甲基质子信号.其中H-3'受氨基吸电子和苯环的去屏蔽效应响应影响,其化学位移处于低场;H-13受氧原子和C-12位烯烃双键的吸电子作用,化学位移也处于低场. dH 3.46和δH 5.46分别为C-2'位上羟基质子和C-3'位上酰胺质子信号;δH 7.29、7.38、7.46、7.58、8.07为两个苯环上H-22~26和H-29~34的10个质子信号,所有1H NMR数据与文献[4]报道一致,符合卡巴他赛结构,具体的1H NMR和1H-1H COSY数据及归属见表 2.
|
图 2 卡巴他赛的1H-1H COSY谱 Figure 2 1H-lH COSY spectrum of cabazitaxel |
| 表 2 卡巴他赛的1H和13C NMR数据(CDCl3,400 MHz) Table 2 1H and 13C NMR data of cabazitaxel (CDCl3, 400 MHz) |
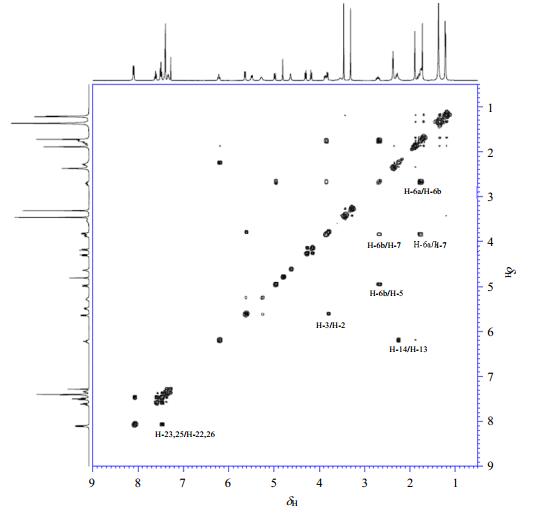
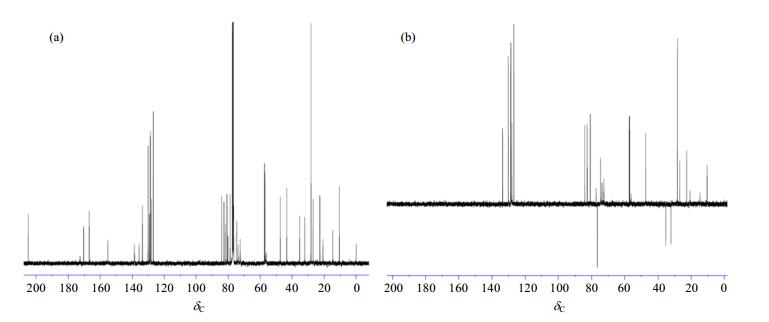
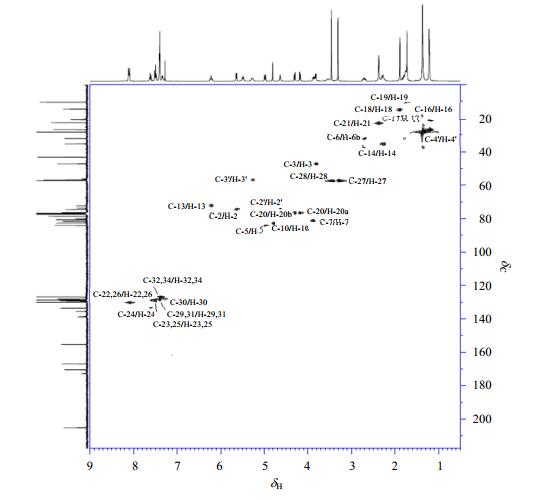
卡巴他赛的13C NMR谱中[图 3(a)]共计给出38个信号峰, 与目标分子相比, 少了7个碳原子信号, 说明分子中化学环境相同的碳原子化学位移存在重叠.DEPT-135谱中[图 3(b)]显示3个仲碳原子, 22个伯碳或者叔碳原子, 而14个季碳没有出峰, 这与卡巴他赛的结构一致.具体地,δC 10.3(C-19)、14.6(C-18)、20.7(C-16)、22.6(C-21)、26.8(C-17)、28.2(C-4')、57.0(C-27)、57.3(C-28)为伯碳,在HSQC谱(图 4)中分别与δH 1.70、1.87、1.20、2.35、1.20、1.35、3.29、3.44相关;δC 32.1(C-6)、35.2(C-14)、76.5(C-20)为仲碳原子,在HSQC谱中分别与δH1.75/2.65、δH2.26和δH 4.15/4.27相关;δC 47.4(C-3)、56.2(C-3')、72.5(C-13)、73.7(C-2')、74.5(C-2)、80.7(C-7)、82.6(C-10)、84.1(C-5)为脂肪链叔碳,在HSQC谱中分别与δH 3.79、5.25、6.18、4.62、5.61、3.83、4.79、4.95相关;δC 126.8(C-32, 34)、128.0(C-30)、128.6(C-23, 25)、128.8(C-29, 31)、130.1(C-22, 26)、133.6(C-24)为两个苯环上的10个叔碳,在HSQC谱中与δH 7.38、7.29、7.46、7.38、8.07、7.58相关;δC 43.3(C-15)、56.9(C-8)、78.7(C-1)、80.2(C-36)、81.7(C-4)、129.2(C-38)、135.6(C-12)、138.7(C-11,33)、155.3(C-35)、166.9(C-37)、170.4(C-39)、172.6(C-1')、204.9(C-9)均为季碳原子,HSQC谱中和其他质子也没有显示相关峰,而在HMBC谱中(图 5)他们分别和各自相邻近的质子显示出偶合信号,具体地C-15与H-10、16、17有远程偶合,C-8与H-2、3、6b、7、10有远程偶合,C-1与H-2、14有远程偶合,C-36与H-4'有远程偶合,C-4与H-3、5、20有远程偶合,C-38与H-22、23、24、25、26有远程偶合,C-12和H-10、18有远程偶合,δC 138.7(C-33)与H-32、34具有远程偶合,δC 138.7(C-11)与H-10、16、17有远程偶合,C-37与H-2、22、23、25、26有远程偶合,C-39与H-21有远程偶合,C-1'与H-13有远程耦合,C-9与H-10、19有远程偶合. C-4'三个碳原子所处化学环境相同,显示为1个信号峰;C-11和C-33所处的化学环境类似,显示为1个信号峰;两个苯环上C-22/26、C-23/25、C-29/31和C-32/34由于化学环境相同,显示4组重叠碳原子信号峰.具体的13C NMR、HSQC和HMBC数据及归属见表 2.
|
图 3 卡巴他赛的(a) 13C NMR和(b) DEPT-135谱图 Figure 3 (a) 13C NMR and (b) DEPT-135 spectra of cabazitaxel |
|
图 4 卡巴他赛的1H-13C HSQC谱图 Figure 4 1H-13C HSQC spectrum of cabazitaxel |

|
图 5 卡巴他赛的1H-13C HMBC谱图 Figure 5 1H-13C HMBC spectrum of cabazitaxel |
卡巴他赛样品采用ESI-MS检测,可观察到质荷比(m/z)为836.4 [M+H]+的准分子离子峰和858.4 [M+Na]+的加钠离子峰;另外还观察到m/z为818.4和730.3、555.3、541.2等碎片离子峰;该检测结果与卡巴他赛的分子量(M = 835.93)一致,根据化合物的结构,对主要碎片进行解析,可能的裂解途径见图 6所示.

|
图 6 卡巴他赛可能的质谱裂解方式 Figure 6 Possible mass fragmentation mechanism of cabazitaxel |
本文通过差示扫描量热分析、X-射线粉末分析和元素分析确定该化合物为无定型化合物,另外, 报道了卡巴他赛的红外吸收光谱和紫外吸收光谱特征, 讨论了质谱主要碎片离子的可能裂解方式, 对化合物的1H和13C NMR信号进行了全归属.利用上述谱学技术确证了卡巴他赛的结构.
| [1] | FDA. Label approved on 6/17/2010 for JEVTANA, NDA no.201023[EB/OL].[2012-03-27]. http://www.Accessdatafda.gov/drugsatfda_docs/label/2010/201023lbl.pdf.2010. |
| [2] |
WANG Z H, ZHONG X L. Pharmacology and clinical evaluation of antiprostate cancer cabazitaxel[J].
Chinese New Drugs J, 2011, 20(9): 764-765.
王志宏, 钟旭丽. 抗前列腺癌新药卡巴他赛的药理与临床评价[J]. 中国新药杂志, 2011, 20(9): 764-765. |
| [3] | BOUCHARD H, BOURAZT J D, COMMERCON. A methods of treating cell lines expressing multidrug resistance Pglycoprotein:US, 6372780[P]. 2002-04-06. |
| [4] | BOUCHARD H, BOURZAT J D, COMMER. CEDILLA. ON A. Taxoids, their preparation and pharmaceutical compositions containing them:US, 5847170[P]. 1998-12-08. |
| [5] | E迪迪埃M-A·佩林. 二甲氧基多西他赛丙酮化物及其制备方法: 中国, 200480026128[P]. 2004-09-16. |
| [6] | 张伟中, 张爱平, 王权勇, 等. 一种卡巴他赛的制备方法: 中国, 201110293499. 6[P]. 2012-01-11. |
| [7] |
WANG L B, CHEN M, LIU X Y, et al. Synthesis of novel anticancer drug cabazitaxel[J].
Chinese J Med Chem, 2014, 24(3): 205-208.
王力彬, 陈明, 刘雪英, 等. 新型紫杉烷类抗肿瘤药物卡巴他赛的合成研究[J]. 中国药物化学杂志, 2014, 24(3): 205-208. |
| [8] |
ZHANG G N, FANG W S. A new synthesis route of cabazitaxel[J].
Chinese Pharm J, 2012, 21(5): 472-476.
张国宁, 方唯硕. 一种合成卡巴他赛的新方法[J]. 中国药学杂志, 2012, 21(5): 472-476. |
| [9] |
LI J, YAO Q X, WANG X J, et al. Syntehsis of antitumor agent cabazitaxel[J].
Chem & Bioeng, 2013, 30(10): 51-53.
李靖, 姚全兴, 王信见, 等. 抗肿瘤药卡巴他赛的合成[J]. 化学与生物工程, 2013, 30(10): 51-53. DOI: 10.3969/j.issn.1672-5425.2013.10.013. |
| [10] |
SUN X W, LI Z G, NI G C, et al. Spectral studies and structural elucidation of cidation of aspoxicillin[J].
Chinese J Magn Reson, 2012, 29(4): 582-589.
孙学伟, 李志刚, 倪广才, 等. 阿扑西林结构确证的谱学研究[J]. 波谱学杂志, 2012, 29(4): 582-589. |
| [11] |
WU C L, LI J M, WEI H J, et al. Spectral analysis and structural elucidation of atorvastatin lactone[J].
Chinese J Magn Reson, 2014, 31(2): 268-277.
吴春丽, 李杰明, 魏会杰, 等. 阿托伐他汀内酯的波谱学数据与结构确证[J]. 波谱学杂志, 2014, 31(2): 268-277. |
 2017, Vol. 34
2017, Vol. 34 
