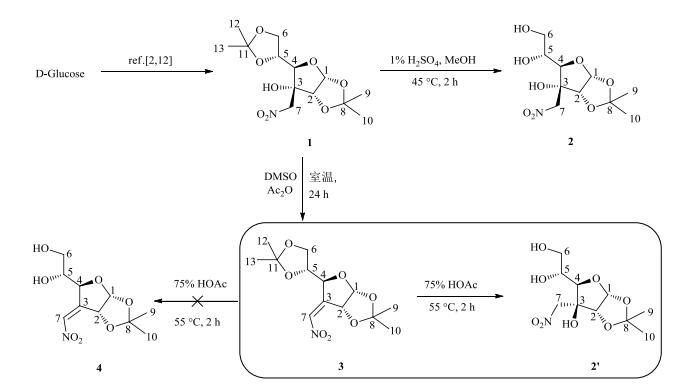
氮杂糖(亚氨基糖)不仅具有潜在的糖苷酶和糖基转移酶抑制活性,而且在抗病毒、抗菌、抗癌、治疗糖尿病等方面都具有重要的应用[1–3].1, 2;5, 6-双-O-异丙叉基-3-C-硝甲基-α-D-呋喃阿洛糖(化合物1)是合成氮杂糖类化合物的重要中间体,有关于它的合成及结构确证已有文献报道[4].通过Henry反应引入硝基是合成氮杂糖类化合物的重要途径之一,例如通过硝基甲烷途径来合成支链硝基和氨基糖[5, 6].我们在实验室合成氮杂糖的过程中发现,化合物1在酸性条件下选择性脱除5, 6-异丙叉基得到1, 2-O-异丙叉基-3-C-硝甲基-α-D-呋喃阿洛糖(化合物2),核磁共振(NMR)数据与文献报道[7]相符.若化合物1先经过Moffatt脱水反应[8]生成C-3硝基烯产物1, 2;5, 6-双-O-异丙叉基-3-脱氧-亚甲基硝基-α-D-呋喃木糖(化合物3)[9]后,我们推测化合物3在酸性条件下会选择性脱除5, 6-异丙叉基得到1, 2-O-异丙叉基-3-脱氧-亚甲基硝基-α-D-呋喃木糖(化合物4).但出乎意料的是,化合物3脱除5, 6-异丙叉基后并没有得到预期的水解产物4,而是得到了1, 2-O-异丙叉基-3-C-硝甲基-α-D-呋喃葡萄糖(化合物2′)[10](如图 1所示).本文推测化合物3在脱保护过程中协同发生氧杂-Michael加成反应得到C-3位构型反转的水解产物2′,并且羟基离子是从硝基烯烃的面上进攻,在这类分子中立体化学是通过1, 2位的丙叉基保护控制产物的构型[11].化合物2′的NMR数据目前还没有文献报道.本文利用NMR谱图,包括1H NMR、13C NMR、DEPT-135、1H-1H COSY、gHSQC和gHMBC谱图,对其1H和13C NMR信号进行了归属,确定了其分子结构.
|
图 1 化合物2和2′的制备 Figure 1 Synthesis of the compounds 2 and 2′ |
NMR波谱仪:Bruker 400;高分辨质谱仪:Waters-Micromass公司Q-ToF型质谱仪.醋酸酐、醋酸,分析纯,购自西陇化工股份有限公司;硫酸、甲醇,分析纯,购自烟台市双双化工有限公司;氘代二甲基亚砜(DMSO-d6)购自北京百灵威科技有限公司;重水(D2O)和氘代氯仿(CDCl3)购自青岛腾龙微波科技有限公司,CDCl3中含有用于定标(δH0.00,δC 0.0)的四甲基硅烷(TMS).
1.2 样品合成化合物1按照文献[2, 12]报道的方法,以工业葡萄糖为原料先后经过双保护和氧化两步反应来制备.化合物1在硫酸/甲醇(硫酸体积分数为1%)体系、45 ℃条件下反应2 h,选择性脱除5, 6-异丙叉基得到C-3构型保持的化合物2,产物结构经过NMR谱图确证[7].化合物1以DMSO为溶剂,醋酸酐条件下,室温反应24 h,则发生Moffatt脱水反应生成硝基烯化合物3;然后在75%醋酸、55 ℃加热条件下选择性脱除5, 6-异丙叉基同时发生氧杂-Michael加成得到化合物2′.化合物3和2′经色谱柱分离得到.
1.3 NMR实验将化合物溶于氘代试剂中进行NMR测试,1H NMR的观测频率为400.13 MHz,90˚脉冲宽度是13.6 μs;13C NMR的观测频率是100.62 MHz,90˚脉冲宽度是6.5 μs;DEPT谱宽为24 038 Hz,累加次数为256.1H-1H COSY的F2维(1H)和F1维(1H)谱宽均是3 600 Hz,累加次数为16,采样数据点阵t2×t1= 1 024×512;HSQC实验中F2维(1H)谱宽为5 330 Hz,F1维(13C)谱宽为16 667 Hz,采样数据点阵t2×t1= 1 024×512;HMBC实验中F2维(1H)谱宽为5 330 Hz,F1维(13C)谱宽为22 347 Hz,累加次数为16,d2= 1/(2 JCH)= 3.45 ms(JCH为单键碳氢偶合常数),采样数据点阵t2×t1= 1 024×256.
2 结果与讨论 2.1 化合物2的结构鉴定化合物2为淡黄色片状固体,NMR数据与文献[7]报道基本相符.1H NMR(400 MHz,D2O):δH 5.91(d,J = 3.8 Hz,1H,H-1)、5.00(d, J = 12.8 Hz,1H,H-7a)、4.93(d,J = 3.8 Hz,1H,H-2)、4.75(d,J = 12.8 Hz,1H,H-7b)、3.96(d,J = 7.9 Hz,1H,H-4)、3.64~3.76(m,2H,H-6)、3.51~3.61(m,1H,H-5)、1.52(s,3H,H-10)、1.33(s,3H,H-9);13C NMR(D2O):δC113.6(C-8)、103.0(C-1),79.7(C-3)、78.9(C-2)、78.6(C-4)、76.8(C-7)、69.2(C-6)、63.2(C-5)、25.3(C-10)、25.2(C-9).化合物2的加钠离子峰[M+Na]+的质荷比(m/z)实验测得值为302.085 5,与理论值302.085 2一致.
2.2 化合物3的结构鉴定经色柱谱纯化(石油醚:乙酸乙酯=15:1)后的化合物3为无色油状液体.NMR数据与文献[9]报道基本相符.1H NMR(400 MHz,CDCl3):δH 7.43~7.53(m,1H,H-7)、5.91(d,J = 4.2 Hz,1H,H-1)、5.81(d,J = 4.2 Hz,1H,H-2)、4.76~4.78(m,1H,H-4)、4.10~4.20(m,1H,H-6a)、3.97~4.10(m,2H,H-5,H-6b)、1.50(s,3H,H-13)、1.46(s,3H,H-12)、1.43(s,3H,H-10)、1.37(s,3H,H-9);13C NMR(CDCl3):δC 149.3(C-3)、135.8(C-7)、113.5(C-1)、110.6(C-11)、105.0(C-8)、79.1(C-2)、78.4(C-4)、76.2(C-5)、67.4(C-6)、27.3(C-13)、27.2(C-12)、26.8(C-10)、25.2(C-9).化合物3的加钠离子峰[M+Na]+的实验测得m/z值为324.105 6,与理论值324.105 9一致.
2.3 化合物2′的结构鉴定经色柱谱分离纯化(石油醚:乙酸乙酯= 4:1)得到的化合物2′为无色油状液体,对其NMR数据进行归属如下所述:
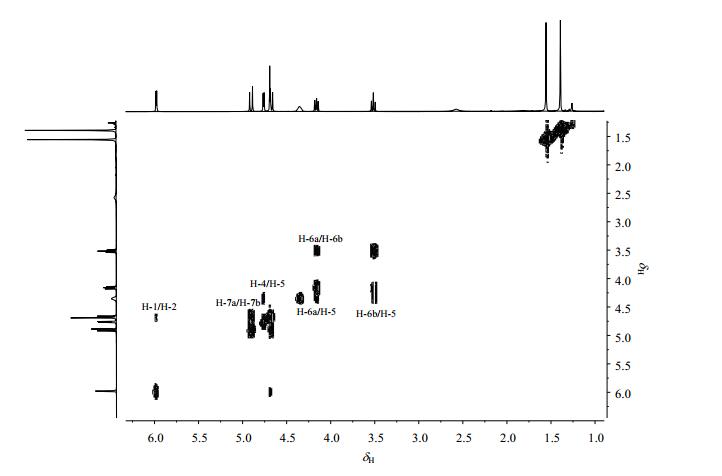
在1H NMR(CDCl3)图谱中,根据化学位移和J偶合常数的规律[13, 14],高场区δH 1.39(s,3H)、δH 1.55(s,3H)归属为异丙基中两个-CH3的质子信号,即H-9和H-10;低场区δH 5.97(d,J = 3.2 Hz,1H)与δH 4.68(d,J = 3.2 Hz,1H)均为双峰,且在1H-1H COSY谱(图 2)中相关,归属为糖环上质子H-1和H-2.δH 4.16(dd,J = 8.8 Hz,7.2 Hz,1H)和δH 3.51(t,J = 8.8 Hz,1H)亦在1H-1H COSY谱中相关,归属为为-CH2不等价的两个质子H-6a和H-6b.δH 4.90(d,J = 12.8 Hz,1H)和δH 4.67(d,J = 12.8 Hz,1H)亦在1H-1H COSY谱中相关,归属为另一个-CH2上两个不等价的质子H-7a和H-7b.从1H-1H COSY谱中可以看出,H-6a和H-6b还与δH 4.34~4.37(m,1H)相关,所以δH 4.34~4.37被归属为H-5,H-5还与δH 4.76(d,J = 4.4 Hz,1H)相关联,所以δH 4.76被归属为H-4.
|
图 2 化合物2′的1H-1H COSY谱 Figure 2 1H-1H COSY spectrum of the compound 2′ |
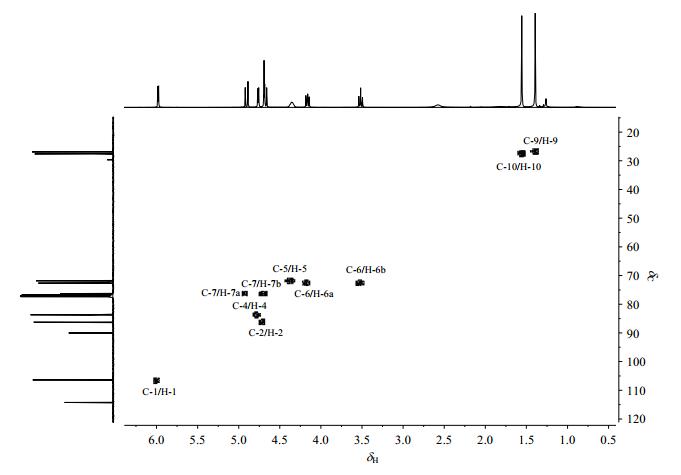
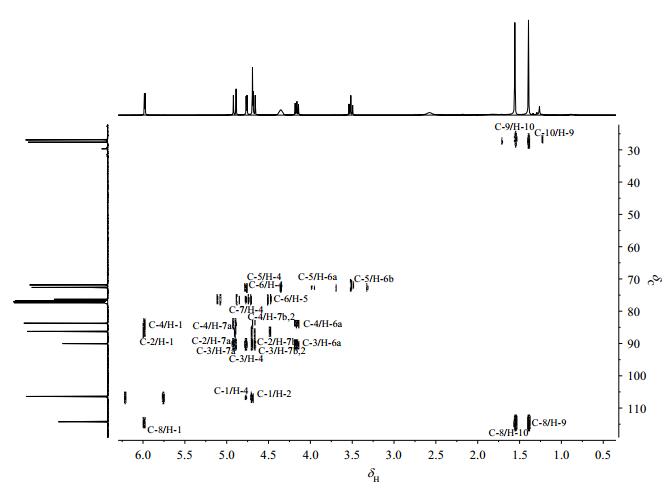
从13C NMR和DEPT-135的叠加图(图 3)发现,δC 114.3、δC 90.0为季碳;δC 72.6、δC 76.3为仲碳.从gHSQC谱(图 4)中可以看出,δC 106.4、δC 86.3分别与H-1和H-2相关,被归属为C-1和C-2.δC72.6与H-6a和H-6b相关,被归属为C-6;δC 76.3与H-7a和H-7b相关,被归属为C-7;δC 71.8、δC 83.6分别与H-5和H-4相关,被归属为C-5和C-4.δC 26.9和δC 27.6分别与H-9和H-10相关,被归属为C-9和C-10.从gHMBC图谱(图 5)上看,δC114.3分别与H-1、H-9和H-10相关,被归属为C-8;δC90.0与H-1、H-7a、H-2、H-7b和H-4相关,被归属为C-3.化合物2′的具体NMR归属见表 1.化合物2′的[M+Na-H2O]+的实验测得m/z值为284.074 3,与理论值284.074 6一致.

|
图 3 化合物2′的13C NMR和DEPT-135谱 Figure 3 13C NMR and DEPT-135 spectra of the compound 2′ |
|
图 4 化合物2′的HSQC谱 Figure 4 HSQC spectrum of the compound 2′ |
|
图 5 化合物2′的HMBC谱 Figure 5 HMBC spectrum of the compound 2′ |
| 表 1 化合物2′的1H和13C NMR数据(CDCl3, 400 MHz) Table 1 1H and 13C NMR data analysis of the compound 2′ (CDCl3, 400 MHz) |
化合物2和化合物2′为非对映异构体,从表 2的数据可以看出,1H NMR化学位移相差较大的是H-4、H-5和H-6,差值分别为320 Hz、318 Hz和184 Hz;13C NMR化学位移相差较大的是C-2、C-3和C-5,差值分别为744 Hz、1 036 Hz和865 Hz,并且都是化合物2的1H和13C NMR信号更靠近高场,可能是由于化合物2的1, 2位丙叉保护和3位的亚甲基硝基位于四氢呋喃环的异侧,导致环上碳氢原子核周围电子云密度较高所致.化合物2的H-4双峰的J值为7.9 Hz,化合物2′的H-4双峰J值为4.4 Hz,可能是C-3的立体异构影响了C-4和C-5二面角的键角大小,从而导致H-4的J值差异较大.
| 表 2 化合物2′(CDCl3, 400 MHz)和化合物2(D2O, 400 MHz)的NMR数据比较 Table 2 Comparison of NMR data for the compound 2′ (CDCl3, 400 MHz) and 2 (D2O, 400 MHz) |
本文报道了1, 2;5, 6-双-O-异丙叉基-3-C-硝甲基-α-D-呋喃阿洛糖(化合物1)在酸性条件下选择性脱除5, 6-异丙叉基得到C-3位构型保持的水解产物2;若经过Moffatt脱水、选择性水解5, 6-异丙叉基的同时发生氧杂-Michael加成后得到非预期的水解产物2′.通过对化合物2′的1D NMR和2D NMR谱图进行研究,对其1H和13C NMR信号进行了全归属,并将其与化合物2的NMR数据进行了对比.
| [1] | FILICHEV V V, BRANDT M, PEDERSEN E B. Synthesis of an aza analogue of 2-deoxy-D-ri-bofuranose and its homologues[J]. Carbohydr Res, 2001, 333: 115-122. DOI: 10.1016/S0008-6215(01)00132-X. |
| [2] |
ZHANG E, ZHANG Z, SUN W, et al. Structural elucidation of addition product from 3-oxoxylose and nitromethane[J].
Chinese J Magn Reson, 2014, 31(2): 278-283.
张恩, 张召, 孙伟, 等. 3-氧化木糖与硝基甲烷加合产物的结构确定[J]. 波谱学杂志, 2014, 31(2): 278-283. |
| [3] |
WANG M, WANG M C, ZHAO X J, et al. NMR characteristics and crystal structure of cytarabine HepDirect prodrug MB07133[J].
Chinese J Magn Reson, 2015, 32(3): 518-527.
王明, 王民昌, 赵小璟, 等. 阿糖胞苷HepDirect前药MB07133的波谱特征与晶体结构[J]. 波谱学杂志, 2015, 32(3): 518-527. DOI: 10.11938/cjmr20150313. |
| [4] | ZHANG Q R, KE Y, CHENG W Y, et al. 1, 2;5, 6-Di-O-isopropylidene-3-C-nitro-methyl-α-D-allofuranose[J]. Acta Cryst, Sect E:Struct Rep Online, 2011, 67(6): 1402. DOI: 10.1107/S1600536811017314. |
| [5] | ROSENTHAL A, ONG K S. Synthesis of branched-chain nitro and amino sugars via the nitromethane synthesis[J]. Tetrahedron Lett, 1969, 10(45): 398l-3983. |
| [6] | ROSENTHAL A, ONG K S, BAKER D. Synthesis of branched-chain nitro and amino sugars by the nitromethane route[J]. Carbohydr Res, 1970, 13(1): 113-125. DOI: 10.1016/S0008-6215(00)84901-0. |
| [7] | RJABOVS V, OSTROVSKIS P, POSEVINS D, et al. Synthesis of building blocks for carbopeptoids and their triazole isoster assembly[J]. Eur J Org Chem, 2015, 25: 5572-5584. |
| [8] | LUGININA J, RJABOVS V, BELYAKOV S, et al. On moffatt dehydration of glucose-derived nitro alcohols[J]. Carbohydr Res, 2012, 350: 86-89. DOI: 10.1016/j.carres.2011.12.020. |
| [9] | TURKS M, RODINS V, ROLAVA E, et al. A practical access to glucose-and allose-based (5+5) 3-spiropseudonucleosides from a common intermediate[J]. Carbohydr Res, 2013, 375(12): 5-15. |
| [10] | SATO K I, YOSHIMURA J, SHIN C G. Branched-chain sugars Ⅸ. Reaction of 3, 6-anhydro-1, 2-O-isopropylidene-α-ribo-hexofuranos-3-ulose with nitromethane or hydrogen cyanide[J]. B Chem So Jpn, 1977, 50(5): 1191-1194. DOI: 10.1246/bcsj.50.1191. |
| [11] | NUTT R F, DICKINSON M J, FREDERICK W, et al. Branched-chain sugar nucleosides. Ⅲ. 3′-C[J]. J Org Chem, 1968, 33(55): 1789-1795. |
| [12] | SAITO Y, ZEVACOB T A, AGROFOGLIO L A. Chemical synthesis of 13C labeled anti-HIV nucleosides as mass-internal standards[J]. Tetrahedron, 2002, 58(47): 9593-9603. DOI: 10.1016/S0040-4020(02)01246-2. |
| [13] |
LIU L S. Rule and essence of chemical shift[J].
Chinese J Magn Reson, 1997, 14(3): 257-261.
刘林生. 化学位移的规律和本质[J]. 波谱学杂志, 1997, 14(3): 257-261. |
| [14] |
YU H G, LIU S X, SONG G Q. NMR study of amino sugar[J].
Acta Chemical Sinica, 1989, 47: 760-764.
俞汗钢, 刘树勋, 宋国强. 氨基糖的核磁共振研究[J]. 化学学报, 1989, 47: 760-764. DOI: 10.3321/j.issn:0251-0790.1989.07.019. |
 2017, Vol. 34
2017, Vol. 34 
