室温离子液体[1–5]在多种工业领域已经被广泛用作溶剂体系[6–8].离子液体具有多种优良的理化性能,比如极低的蒸汽压、相当高的分解温度、回收再利用的成本低廉等.室温离子液体通常由1个有机阳离子和1个有机阴离子构成[3].使用最为广泛的一类离子液体由1-烷基-3-甲基咪唑阳离子和六氟磷酸根阴离子(PF6-)构成(图 1).
|
图 1 1-烷基-3-甲基咪唑阳离子和六氟磷酸根阴离子(PF6-)构成的离子液体分子结构通式 Figure 1 General molecular formula of ionic liquid composed of 1-alkyl-3-methylimidazolium cations and hexafluorophosphate anion (PF6-) |
需要指出的是,尽管许多离子液体分子具有重要的化工及商业应用,但是它们潜在的环境影响及可能的毒性危害却并没有得到系统研究,尤其是烷基咪唑盐体系.最近,离子液体“绿色溶剂”和“环境友好”的标签被一些研究者质疑[9–12].Salzer[9]认为这类有机咪唑盐体系的离子液体遇到强热时,会产生毒性和腐蚀性,因为它们会热分解,特别是PF6-阴离子,现有的研究[13–17]表明它们遇到强热会分解,并释放出氟化氢(HF)和三氟化氧磷(POF3),热分解的机理跟含水量有关.这些研究小组通常使用差示扫描量热法(DSC)、热重分析法(TGA)、热解气相质谱(pyrolysis-GC)等方法来分析推断分解机理,但是这些方法都只能观测到热分解后的状态,无法看到热分解反应细节,而原位核磁共振(NMR)方法可以直接观测分解反应过程的细节,并且可以在较宽的温度范围内进行观测.
在本文的工作中,原位变温1H NMR、19F NMR和31P NMR等技术被用于跟踪1-丁基-3-甲基咪唑阳离子(C4mim+)和PF6-构成的离子液体[C4mim][PF6]在特定温度下的热分解过程,表征并定量分析了分解产物,提出了合理的热分解机理.
1 实验部分 1.1 仪器及试剂Varian Mercury 300型NMR谱仪,配备变温PFG探头;杨氏NMR样品管(J. Young NMR tube)购于Wilmad公司;无水1-丁基-3-甲基咪唑六氟磷酸盐购于Acros公司.DMSO-d6购自CIL公司.
1.2 NMR实验在直径为5 mm的杨氏NMR样品管中加入1-丁基-3-甲基咪唑六氟磷酸盐离子液体,用毛细管封装DMSO-d6作内标,连接到真空线上抽真空排出氧气,密封后置入探头中.
1H NMR的工作频率为299.6 MHz,谱宽为4 496 Hz,采样点数为6 407,激发脉冲翻转角为12˚,弛豫延迟时间为8 s.31P NMR的工作频率为121.3 MHz,谱宽为12 255 Hz,采样点数为16 384,激发脉冲翻转角为90˚,弛豫延迟时间为8 s.19F NMR的工作频率为281.9 MHz,谱宽为33 783 Hz,采样点数为65 536,激发脉冲翻转角为90˚,弛豫延迟时间为8 s.
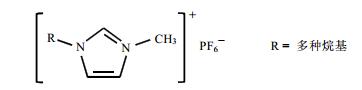
2 结果与讨论 2.1 离子液体的1H NMR分析图 2显示的是[C4mim][PF6]在12个不同温度下的1H NMR谱堆积图.样品被加热到设定温度保持2 h,在当前温度采样.在25 ℃的谱图中,根据已知文献[24]报道,δH 8.4附近的峰归属于H-c,δH 7.4处的宽峰归属于H-a和H-b,δH 0~2处的峰从高场到低场依次为丁基上的-CH3和中间两个-CH2,δH 2.5处为DMSO-d6的溶剂峰,δH 4.0处两个峰归属于为丁基上氮原子相连的-CH2.从堆积图中可以看出,温度范围在25~80 ℃区间内,[C4mim][PF6]分子的质子信号没有发生明显的变化,即该分子大部分保持稳定状态.
|
图 2 [C4mim][PF6]在不同温度下的1H NMR谱 Figure 2 1H NMR spectra of [C4mim][PF6] keeping at different temperature for two hours |
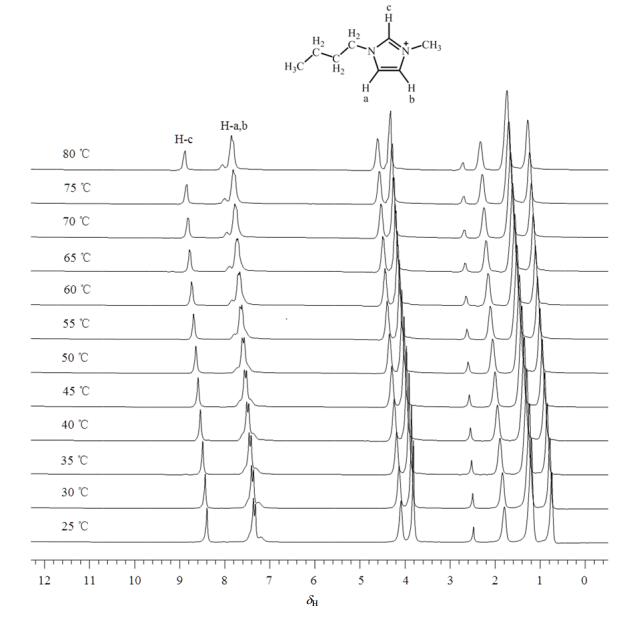
图 3显示的是[C4mim][PF6]在80 ℃下保持不同时间的1H NMR谱图.在80 ℃下保持10 min后,在δH9.6处出现一个新的宽峰;30 min后这个新峰位移到了δH11.2处;40 min后该峰又位移到δH12.0处,并且峰形变得尖锐;之后该峰就保持在δH12.0处.这个新峰归属于HF.同时,取出NMR样品管后,可以发现样品管的内管壁变的浑浊了,这个现象说明样品管内可能有腐蚀玻璃的成分生成.在80 ℃下的动力学谱图表明,HF的量逐渐变多,并且随着时间的延长,其向低场方向移动,可能的原因一方面是HF与玻璃产生了作用导致向低场位移,另一方面是刚开始产生的HF量比较少,随着HF的量增多,其分子内氢键使得HF的NMR信号向低场方向位移.

|
图 3 [C4mim][PF6]在80 ℃下保持不同时间的1H NMR谱图 Figure 3 1H NMR spectra of [C4mim][PF6] keeping for different times at 80 ℃ |
图 4显示的是[C4mim][PF6]在80 ℃加热前和加热后的31P NMR谱.加热前在25 ℃采集的31P NMR谱(图 4下图)显示受19F核的J偶合影响,31P NMR谱峰裂分成6重峰,偶合常数JP-F= 710 Hz.在80 ℃温度下保温2 h,再降温至25 ℃采集的谱图(图 4上图)显示31P NMR除了6重峰外,还出现了一组宽峰致使基线不平整,这表明至少溶液存在两种不同状态的磷原子[19].这组新出现的宽峰被指认为新产生的PF5,这个归属可以用19F NMR谱来佐证,具体的谱图细节将在2.3节中讨论.

|
图 4 [C4mim][PF6]的31P NMR谱图.下:加热前在25 ℃条件下采样;上:80 ℃温度下保温2小时后降温至25 ℃时采样 Figure 4 31P NMR spectra of [C4mim][PF6]. The bottom spectrum was acquired at 25 ℃ before heating. The top spectrum was acquired at 25 ℃ after keeping for 2 hours at 80 ℃ |
图 5显示的是[C4mim][PF6]在80 ℃加热前和加热后的19F NMR谱图.加热前在25 ℃采集的19F NMR谱(图 5下图)显示受31P核的J偶合影响,19F NMR谱峰裂分成双峰,偶合常数JP-F= 709 Hz,这与31P NMR谱(图 4)中测得的偶合常数吻合.加热到80 ℃保温2 h后,再降温到25 ℃采集的谱图(图 5上图)显示,除了δF77处原有的双峰外,在δF-3处出现了1个新峰和1个宽峰,这两个峰归属于不同状态下的HF,其中一个是自由态的HF,另外一个是与样品管内壁发生化学作用的HF.19F NMR谱中δF -3处峰的归属也可以与1H NMR谱中(图 3)的指认互相佐证[20].将1H NMR谱和19F NMR谱做对比可以发现,19F NMR谱的分辨率更高,并且信息量更大.此外,有趣的是在原有双峰的高场区域的δF71和δF62处新出现了两组双峰,当δF77处的积分面积为100时,它们的积分面积分别为0.2和0.4,而偶合常数分别为922 Hz和964 Hz.这个结果表明氟原子与磷原子出现了两种新的结合方式,也就是有两种新的氟磷化合物生成.这两组新的氟磷化合物的31P NMR谱信号可能就是图 4中80 ℃时出现的宽峰.文献[21–23]中报道的通过计算化学的方法得出的PF5的偶合常数JP-F= 929 Hz,这表明新出现的两组峰可能与PF5有关.

|
图 5 [C4mim][PF6]的19F NMR谱图.下:加热前在25 ℃条件下采样;上:80 ℃温度下保温2 h后降温至25 ℃时采样 Figure 5 19F NMR spectra of [C4mim][PF6]. The bottom spectrum was acquired at 25 ℃ before heating. The top spectrum was acquired at 25 ℃ after keeping for 2 hours at 80 ℃ |
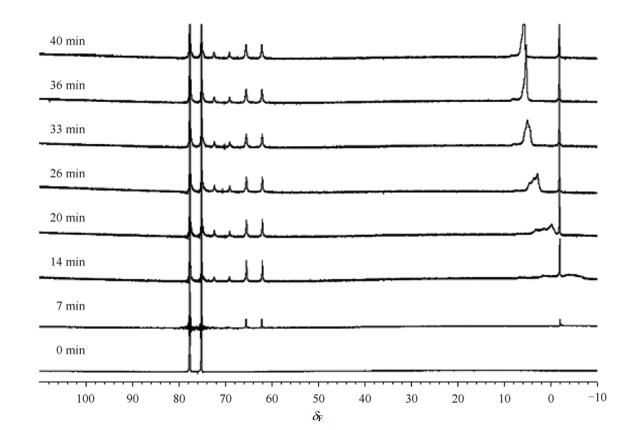
为了更加深入的研究[C4mim][PF6]分子热分解的过程及机理,设计了一组新的原位19F NMR实验.将样品加热到80 ℃后,持续观测40 min.图 6是这组实验谱图的堆图,表 1是实验中各个时间节点的积分值的定量结果,设定δF77处的双峰的积分面积为100.19F NMR谱图表明在80 ℃下,经过7 min,HF就会生成,对应于谱图中δF-3处的单峰.另外,图 6中的7 min处的谱图中在δF62处出现了一个双峰,归一化积分面积是0.21,偶合常数JP-F= 964 Hz,与文献[21–23]中报道的通过计算化学的方法得出的PF5的偶合常数相比较,将这个峰归属于新生成的自由态PF5(表 1中化合物B).14 min后,HF的归一化积分面积增加到0.78并且有宽峰出现,这组宽峰表明HF开始与NMR样品管内壁的玻璃发生反应.同时,δF62处双峰的归一化积分面积增加到0.41,此外,又有一组新峰出现在δF71处,也是一个双峰,归一化积分面积是0.09,偶合常数JP-F= 922 Hz,这个峰被归属于PF5的复合物(表 1中化合物A).加热继续时,δF-3处的尖峰的积分值不再发生变化,这表明HF的量不再改变,但是δF4处的宽包峰的量还在持续增加,这表明溶液中自由态HF一直在与样品管内壁玻璃发生反应,并且峰形也逐渐变得尖锐.在26 min时,δF 62和δF 71处的峰的积分值达到稳定,不再继续随时间变化,它们的比值是7:3(根据表 1中的第4行26 min时的数据值计算得到).
|
图 6 在80 ℃下保持不同时间的[C4mim][PF6]的19F NMR谱图 Figure 6 19F NMR spectra of [C4mim][PF6] keeping for different time at 80 ℃ |
| 表 1 [C4mim][PF6]在80 ℃条件下保持不同时间的19F NMR谱的归一化积分面积a Table 1 Normalized integrationsa for 19F NMR spectra of [C4mim][PF6] keeping for different time at 80 ℃ |
基于以上的1H、31P、19F NMR谱图分析结果,可以推断出[C4mim][PF6]离子液体可能的热分解机理如图 7所示,当温度达到80 ℃时,[C4mim][PF6]分子开始分解,产生摩尔分数至少为0.5%的PF5和少于1%的HF.这意味着含有6个共价键的PF6-断裂掉1个共价键后生成PF5分子,并释放出1个氟原子去进攻咪唑环,并夺取咪唑环2-位上的氢原子形成HF分子,HF会与样品管内壁的玻璃反应,使得样品管变得浑浊不透明.丢掉一个氢原子后的咪唑环形成一个卡宾,与部分PF5形成复合物,最终自由态PF5和卡宾/PF5复合物达到平衡,其比例是7:3.

|
图 7 [C4mim][PF6]离子液体可能的热分解机理 Figure 7 Possible thermal decomposition mechanism of the [C4mim][PF6] ionic liquid |
由于离子液体在工业上具有潜在的巨大应用价值,而离子液体的热稳定性质会影响离子液体的应用范围、操作温度、工艺条件等,因此对它们的热稳定性质的研究显得尤为重要.在本文中,原位变温多核NMR技术被用于研究[C4mim][PF6]离子液体的热稳定性.之前的报道中,这类离子液体的热分解温度被认为是高于200 ℃,然而通过NMR监测实验却发现,在温度低至80 ℃时,[C4mim][PF6]分子便发生了少量分解,生成少量PF5的和HF,其中HF分子中的氢原子来源于咪唑环2-位上的氢原子.咪唑环丢掉这个氢原子后形成了一个卡宾,可与PF5形成复合物.最终热分解达到平衡态时,自由态PF5和卡宾/PF5复合物的比例是7:3.
| [1] | HUDDLESTON J G, WILLAUER H D, SWATLOSKI R P, et al. Room temperature ionic liquids as novel media for 'clean' liquid-liquid extraction[J]. Chem Comm, 1998, 16: 1765-1766. |
| [2] | SEDDON K R. Ionic liquids for clean technology[J]. J Chem Tech Biotech, 1997, 68(4): 351-356. DOI: 10.1002/(ISSN)1097-4660. |
| [3] | CHAUVIN Y, OLIVIER H. Nonaqueous ionic liquids as reaction solvents[J]. Chemtech, 1995, 25(1): 26-30. |
| [4] | SEDDON K R. Room-temperature ionic liquids:neoteric solvents for clean catalysis[J]. Kinet Catal, 1996, 37(5): 693-697. |
| [5] | HALLETT J P, WELTON T. Room-temperature ionic liquids:solvents for synthesis and catalysis[J]. Chem Rev, 2011, 111(5): 3508-3576. DOI: 10.1021/cr1003248. |
| [6] | HOLBREY J D, SEDDON K R. The phase behaviour of 1-alkyl-3-methylimidazolium tetrafluoroborates; ionic liquids and ionic liquid crystals[J]. J Chem Soc Dalton Trans, 1999, 13: 2133-2140. |
| [7] | WELTON T. Room-temperature ionic liquids. solvents for synthesis and catalysis[J]. Chem Rev, 1999, 99(11): 2071-2083. |
| [8] | KEIM W, WASSERSCHEID P. Ionic liquids-new solutions for transition metal catalysis[J]. Angew Chem Int Ed, 2000, 39(21): 3772-3789. DOI: 10.1002/(ISSN)1521-3773. |
| [9] | SALZER A. Ionic liquids:not so green[J]. Chem & Eng News, 2002, 80(17): 4. |
| [10] | ROGERS R D. Reply to Ionic liquids:Not so green[J]. Chem & Eng News, 2002, 80(17): 4-5. |
| [11] | HASSOUN E A, ABRAHAN M, AL-GHAFRI V K, et al. Cytotoxicity of the ionic liquid, 1-N-butyl-3-methyl imidazolium chloride[J]. Res Commun Pharmacol Toxicol, 2002, 7(1): 23-31. |
| [12] | SWATLOSKI R P, HOLBREY J D, ROGERS R D. Ionic liquids are not always green:hydrolysis of 1-butyl-3-methylimidazolium hexafluorophosphate[J]. Green Chem, 2003, 5: 361-363. DOI: 10.1039/b304400a. |
| [13] | WAZER J R. Phosphorous and its Compounds[M]. New York: Wiley, 1958. |
| [14] | VISSER A E, SWATLOSKI R P, REICHERT W M, et al. Traditional extractants in nontraditional solvents:groups 1 and 2 extraction by crown ethers in room-temperature ionic liquids[J]. Ind Eng Chem Res, 2000, 39(10): 3596-3604. DOI: 10.1021/ie000426m. |
| [15] | LALL S I, MANCHENO D, CASTRO S, et al. Polycations. Part X. LIPs, a new category of room temperature ionic liquid based on polyammonium salts[J]. Chem Commun, 2000, 24: 2413-2414. |
| [16] | GUBICZA L, NEMESTOTHY N, FRATER T, et al. Enzymatic esterification in ionic liquids integrated with pervaporation for water removal[J]. Green Chem, 2003, 5: 236-239. DOI: 10.1039/b211342m. |
| [17] | KROON M C, BUIJS W, PETERS J, et al. Quantum chemical aided prediction of the thermal decomposition mechanisms and temperatures of ionic liquids[J]. Thermochim Acta, 2007, 465(1): 40-47. |
| [18] | YOGESH R J, DAE Y C. Synthesis of symmetrical organic carbonates via significantly enhanced alkylation of metal carbonates with alkyl halides/sulfonates in ionic liquid[J]. J Org Chem, 2005, 70(26): 10774-10777. DOI: 10.1021/jo051722h. |
| [19] |
LI Y Z, QIU L, YIN Q Y, et al. Spectroscopy study on synthesis of diisopropyl coumarin-3-phosphate by 31P NMR[J].
Chinese J Magn Reson, 2016, 33(1): 133-141.
李远哲, 邱莉, 尹秋月, 等. 31P NMR在二异丙基香豆素-3-膦酸酯合成中的应用研究[J]. 波谱学杂志, 2016, 33(1): 133-141. DOI: 10.11938/cjmr20160113. |
| [20] |
LI Y, LI L S, LAN Y J. Calculation of 19F NMR chemical shifts of fluoroaromatics[J].
Chinese J Magn Reson, 2012, 29(2): 258-277.
李燕, 李临生, 兰云军. 氟苯类化合物19F NMR化学位移的计算[J]. 波谱学杂志, 2012, 29(2): 258-277. |
| [21] | JAMESON C J, JAMESON A K, WILLE S. Effects of intermolecular interactions and intramolecular dynamics on nuclear resonance in nitrogen trifluoride, phosphorus trifluoride, phosphoryl fluoride, and phosphorus pentafluoride[J]. J Phys Chem, 1979, 83: 3372-3378. DOI: 10.1021/j100489a012. |
| [22] | MICHAL J. Ab initio study of the shielding and spin-spin coupling constants in ClF3, PF3 and PF5[J]. Chem Phys Lett, 2004, 385(1, 2): 122-126. |
| [23] | CHRISTOPHE R, LAURENT M, JEANPIERRE D, et al. Berry pseudorotation mechanism for the interpretation of the 19F NMR spectrum in PF5 by Ab initio molecular dynamics simulations[J]. Chem Phys Chem, 2006, 7(2): 407-413. DOI: 10.1002/cphc.v7:2. |
| [24] | CAMMARATA L, KAZARIAN S G, SALTER P A, et al. Molecular states of water in room temperature ionic liquids[J]. Phys Chem Chem Phys, 2001, 3(23): 5192-5200. DOI: 10.1039/b106900d. |
 2017, Vol. 34
2017, Vol. 34 
