文章信息
- 李东北, 许帅, 喻志武
- LI Dong-bei, XU Shuai, YU Zhi-wu
- 固体核磁共振技术在骨基生物材料研究中的应用
- Application of Solid-State NMR to Bone and Bone Biomaterials
- 波谱学杂志, 2017, 34(1): 115-129
- Chinese Journal of Magnetic Resonance, 2017, 34(1): 115-129
- http://dx.doi.org/10.11938/cjmr20170114
-
文章历史
收稿日期: 2016-02-02
收修改稿日期: 2017-01-05


DOI:10.11938/cjmr20170114
随着社会和经济的高速发展,人们面临越来越大的生活和工作压力,健康问题越来越被人们所重视.以骨质疏松症为代表的骨疾病在老年人口中的发病率逐渐升高,甚至危害着整个国民的身体健康,因此需要大量的骨基生物材料来改善或提高他们的生活水平[1-4].骨基生物材料包含天然骨头和人工合成的一类具有天然骨类似功能的生物材料.临床上解决骨缺损常用的治疗手段主要是骨移植技术,而自体骨移植、异体骨移植和异种骨移植都存在一定的局限性,因此各种骨基生物材料成为近年来研究的热点.对骨基生物材料结构的表征,了解其结构与生物活性的关系,对于预防、治疗骨头和牙齿相关的疾病有着极其重要的临床意义.目前,骨基生物材料的表征手段有X射线衍射分析、X射线光电子能谱和同步辐射扩展、X射线精细结构谱、红外光谱、拉曼光谱、电子显微镜技术和热分析等[5-11].然而,这些表征技术在原子、分子水平上得到的骨基生物材料的微观结构信息总不能令人满意,而且有时候还需要对样品进行处理后再表征,从而无法原位获得其结构信息.随着固体核磁共振(NMR)技术的发展,其已成为研究骨基生物材料微观结构的强有力手段之一[12-22].一方面,固体NMR技术是研究各种核周围的不同局域环境及中短程相互作用,既可对结晶度较高的固体物质进行结构分析,也可以用于结晶度较低的或非晶态物质的结构分析,因此已成为X射线衍射、中子衍射和电子衍射等研究长程有序结构表征方法的重要补充;另一方面,固体NMR技术可分析多种核自旋相互作用,每一种核自旋相互作用都可能包含着丰富的结构和动力学信息;同时固体NMR技术还具有定量分析、对样品无损伤以及可针对特定的原子类型等优势.因此,固体NMR技术在骨基生物材料的微观结构研究方面正发挥着独特的作用.
固体NMR技术已经被广泛应用于各种骨基生物材料的微观结构研究,例如用固体NMR技术研究离子掺杂对羟基磷灰石生物材料微观结构的影响[12, 13, 23-25];利用固体NMR技术研究骨中羟基磷灰石的生物矿化过程、化学组成和结构信息[26, 27];利用固体NMR技术研究蛋白和骨矿物界面的分子识别机制[28];利用质子高分辨魔角旋转(1H MAS)固体NMR技术揭示骨头中的羟基离子及水分子对骨结构影响的时间分辨动力学性质[16, 17];13C交叉极化魔角旋转(13C CP/MAS)固体NMR技术研究骨头中的柠檬酸盐对骨矿物的影响[18];43Ca MAS固体NMR技术揭示骨钙蛋白Osteocalcin与骨矿物表面的相互作用[15];以及29Si MAS固体NMR技术研究生物玻璃骨基材料的微观结构等[19, 20].随着固体NMR技术的发展,各种复杂固体NMR实验也越来越多地应用于骨基生物材料的微观结构研究,如REDOR NMR[21, 29, 30]、多量子魔角旋转NMR(MQ-MAS NMR)[15, 31]和二维固体异核相关NMR谱技术(如HETCOR[17, 32]和HMQC[21]).在此,本文主要综述了近年来各种固体NMR技术在骨基生物材料研究中的应用进展.
1 羟基磷灰石微观结构的高分辨固体NMR研究羟基磷灰石[hydroxyapatite,HA;分子式为Ca10(PO4)6(OH)2]是构成人体骨骼和牙齿的主要无机成分,具有良好的生物相容性、骨传导性和骨诱导性,因此在骨组织工程领域有广泛的应用前景[33-35].骨头的主要无机成分除羟基磷灰石之外,通常还含有少量的阳离子和阴离子,如Na+、Mg2+、F-等.尽管这些微量离子的含量很低,但是它们对骨头的功能有着重要的影响.例如,Na+在骨重塑过程中发挥作用[36, 37],Mg2+的缺失将会导致骨流失[38],而F-则有助于改善龋齿的恶化[39],因此深入研究这些微量离子的局域环境对于了解骨的结构和功能有重要意义.固体NMR技术是研究材料微观结构的强有力手段,下面简要介绍利用固体NMR技术研究HA的微观结构以及离子掺杂对其结构的影响.
1.1 固体NMR技术研究F-掺杂对羟基磷灰石(HA)微观结构的影响大量的临床研究发现,在酸性环境下,F-掺杂的羟基磷灰石(FHA)比HA更稳定,对细胞分化和骨头生长都有促进作用.在牙釉质中,含氟量高的FHA相对于含氟量低的FHA更能阻止牙齿的溶解,可以降低蛀牙的发生.因此,FHA被广泛应用于牙科和整形外科手术中.正基于FHA在医学上的潜在应用,科学界做了很多关于它的研究,大多数是关于其制备方法、热力学性质和化学性质的研究,然而不同F-掺杂量对HA结构的影响几乎没有系统的研究.最近,Chen等人[12]利用固体NMR技术研究了不同F-掺杂量对HA微观结构的影响(如图 1所示). 图 1(a)是一系列不同F-含量(F-在FHA样品中的质量百分比)的FHA样品的1H MAS NMR谱,在HA样品中主要有两个信号,化学位移为δH 0.10左右的信号归属为羟基峰,另一个化学位移为δH 5.33左右的信号归属为HA表面吸附的水分子信号.随着F-含量的增加,羟基的化学位移逐渐向高频移动并且峰高降低.此外,还发现当F-含量增加到1.59 wt%时,在化学位移为δH1.60左右和δH 1.00左右处出现了两个新的信号,归属为与晶格空位有强烈结合作用的结构水分子.当F-含量继续增加到2.2 wt%和2.94 wt%时,只观察到化学位移为δH 5.33左右的表面吸附水的信号以及δH 1.60左右处的结构水峰,表明此时羟基离子已完全被F-所取代. 图 1(b)是一系列不同F-含量的FHA的43Ca MAS NMR谱,观察到两种不同局域环境的钙物种,即Ca (Ⅰ) 和Ca (Ⅱ) 存在.其中Ca (Ⅰ) 配位数为9,Ca (Ⅱ) 配位数为7.随着F-含量的增加,Ca (Ⅱ) 物种的化学位移逐渐向高频移动,然而Ca (Ⅰ) 的化学位移没有变化,表明随着F-含量的增加,通过减小Ca (Ⅱ)-O的键长改变了Ca (Ⅱ) 位点的化学环境,但是对Ca (Ⅰ) 几乎没有影响. 图 1(c)是一系列不同氟含量的FHA的31P MAS NMR谱,HA样品在化学位移为δP 2.75左右处观察到一个共振峰. F-含量从0 wt%增加到1.59 wt%时,该峰的化学位移逐渐向高频移动;F-含量从1.93 wt%增加到2.94 wt%,化学位移值始终是δP 3.20左右. 图 1(d)是一系列不同F-含量的FHA的19F MAS NMR谱,随着F-含量的增加,F-信号峰的强度逐渐增加,证明F-逐渐取代HA晶格中的羟基.固体NMR从原子、分子水平上分析了F-掺杂对HA微观结构的影响,这些实验结果对于人们改善含氟HA材料性能具有指导意义.
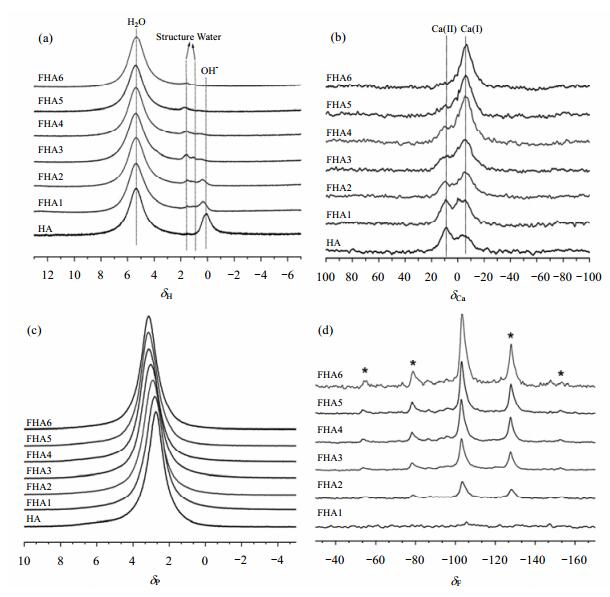
|
| 图 1 一系列不同F-含量的FHA样品的一维谱图. (a) 1H NMR谱图;(b) 43Ca NMR谱图;(c) 31P NMR谱图;(d) 19F NMR谱图(HA:0 wt%;FHA1:0.54 wt%;FHA2:0.83 wt%;FHA3:1.59wt%;FHA4:1.93 wt%;FHA5:2.2 wt%;FHA6:2.94 wt%)[12] Fig. 1 (a) 1H NMR spectra, (b) 43Ca NMR spectra, (c) 31P NMR spectra, and (d) 19F NMR spectra of fluorohydroxyapatites containing different fluorine levels (HA: 0 wt%, FHA1: 0.54 wt%, FHA2: 0.83 wt%, FHA3: 1.59 wt%, FHA4: 1.93 wt%, FHA5: 2.2 wt%, and FHA6: 2.94 wt%)[12] |
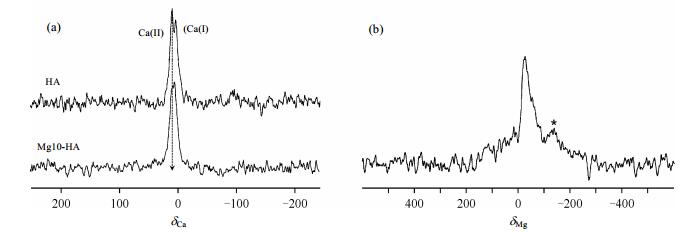
Mg是骨头和牙齿中重要的微量元素,在骨头的新陈代谢中起着关键的作用.在成骨细胞的早期,Mg2+可以促进成骨细胞的增殖.另外,Mg2+的缺乏会导致骨质疏松和骨流失[38].尽管有很多光谱学技术(如红外,拉曼)可以用来研究Mg2+掺杂的HA,但是很难获得高分辨的光谱学数据,因此难以确定Mg2+在HA中的取代位置及其存在状态. Laurencin等人[13]首次采用天然丰度的43Ca和25Mg固体NMR技术研究了掺杂Mg2+的HA结构(如图 2所示).从图 2(a)中可以看出,较之于HA样品,Mg2+掺杂的Mg10-HA样品(Mg2+在Mg10-HA样品阳离子中摩尔比例为10%)的Ca (Ⅱ) 峰的相对强度降低了,表明Mg2+替代了HA中的Ca (Ⅱ) 位点.另外,作者还通过天然丰度的25Mg固体NMR实验研究了Mg2+周围的局域环境[如图 2(b)所示],由于25Mg的天然丰度和旋磁比(γ)都较低,而且Mg10-HA样品中Mg2+的含量也不高,因此即使在19.6 T的高场下25Mg固体NMR信号的信噪比仍然较差.虽然从谱图本身难以获得Mg2+周围准确的局域环境信息,但还是可以从较复杂的谱图中获取一些相关信息,比如能观察到一个较尖锐的信号峰以及底部非常宽的信号,表明样品中Mg2+周围存在许多不同的局域环境,这样导致了Mg2+的四极偶合常数不同,从而使得25Mg NMR谱十分复杂.作者还通过EXAFS实验和理论计算进一步验证了固体NMR实验所获得的结果.因此,采用固体NMR技术研究HA中Mg2+的结构特征,有助于人们认识这些阳离子在骨头中的生物作用.
生物矿化是指在生物体内形成无机矿物质的过程.通过特定的有机模板的调控使无机物在无机-有机界面处成核并缓慢生长,最终得到具有一定形状和结构的无机-有机复合材料.关于生物矿化过程的研究一直都是个热点,有些研究小组采用体外实验和天然矿化体系[40-42],试图解释有机模板是如何控制晶体的成核和生长过程;还有人做了大量的研究,试图分析无机晶体的形貌与生物大分子或与有机模板之间的关系[43-45].但是,人们对于参与生物矿化作用的蛋白质的结构和功能之间的关系知之甚少. Statherin(SN)蛋白是唾液中一种富含酪氨酸和脯氨酸的磷酸蛋白,可防止釉质脱矿,刺激脱矿的牙釉质再矿化,使新萌出的牙齿逐渐再矿化成熟.关于SN蛋白与HA之间的作用,目前仍然不清楚.有人认为SN蛋白是通过N端的带电残基来识别HA表面空间排布的阳离子,也有人认为它们仅仅是通过简单的静电作用相结合.实际上,SN蛋白N端的15个氨基酸(SN-15多肽)对控制HA的生长有活性作用. Chen等人[14]创造性地在HA制备过程中加入多肽SN-15,使吸收在HA表面的多肽量有明显的提高,然后采用固体NMR以及其他表征手段研究了SN-15和HA的相互作用机制. 图 3(a)是SN-15多肽N端的第6个赖氨酸(K6)和第12个甘氨酸(G12)均被13C标记后的SN15KG样品的二维13C-13C相关谱,作者对K6和G12之间的交叉峰按顺序做了归属,发现K6的化学位移值与SN-15在游离态下所呈现的螺旋构象一致. 图 3(b)是SN15KG和SN15KG-HA9(在pH=9.0环境下,SN15KG吸附在HA上)的二维13C-13C相关叠加谱,发现G12的化学位移没有明显改变,而且K6观察到两组交叉峰. SN15KG-HA9样品中主要组成(占比66%)的Cα化学位移值和游离态的SN-15所观察到的化学位移极其相似,然而次要组分(占比34%)的化学位移值和无规卷曲状态的SN-15的化学位移值相似,表明SN-15和HA之间可能存在两种相互作用机制.其中次要组分的机理可能是由于多肽在K6端点发生了构象改变,从螺旋结构变成无规卷曲结构,然而G12附近区域的构象没有发生明显变化.另一方面,主要组分的作用机理可能是由于SN-15和HA表面以静电作用结合,因此SN-15的主链构象并没由于多肽的诱导而发生明显变化.由于制备的纳米HA的表面不均匀,这也可能导致存在两种相互作用机制.另外,SN蛋白和HA相互作用的热力学研究也表明存在这样的两种相互作用机制.
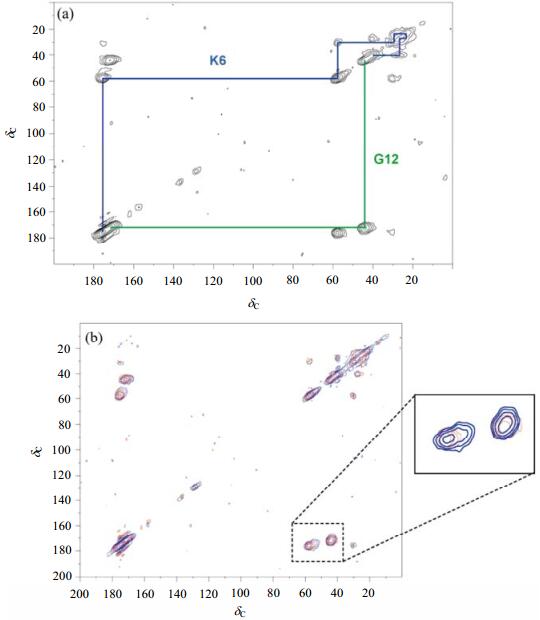
|
| 图 3 (a) SN15KG的二维13C-13C相关谱图(图中,残基K6和G12的交叉峰信号分别被标出来);(b) SN15KG(红色)和SN15KG-HA9(蓝色)的二维13C-13C相关叠加谱图(插入放大图是残基K6和G12的Cα-C'交叉峰信号)[14] Fig. 3 (a) 13C-13C correlation spectrum measured for the SN15KG sample. The cross-peaks of the residues K6 and G12 are assigned sequentially. (b) Overlay 13C-13C correlation spectrum of SN15KG (red) and SN15KG-HA9 (blue). The inset highlights the Cα-C'cross-peaks of K6 and G12[14] |
骨头是一种组成复杂的复合物材料,有着层次分明的结构.骨头主要由两个部分组成:有机成分和无机成分,两者有序结合,使骨头具有各种机械性能,并且二者在骨头中均发挥着独特的生物作用.骨头的有机成分主要由有机基质组成,其中90%的有机基质是I型胶原蛋白,剩下的10%大约是由200种非胶原蛋白分子组成,这些蛋白分子在骨头中发挥着重要的调控作用,例如:调控骨头矿化、促进骨头生长和骨头中钙和磷的吸收等[46-50].骨头的无机成分主要由羟基磷灰石(HA)纳米晶构成.另外,无机成分中通常还含有多种微量的阴离子和金属阳离子,例如CO32-、F-、Na+和Mg2+等,这些微量的离子对骨头的结构与功能有着重要的影响[39, 51, 52].尽管骨头的结构组成极其复杂,其很多组成元素都是NMR可观察核,因此高分辨率固体NMR技术可以用来研究骨头的微观结构,这对于认识骨头中各种成分所起的作用,以及预防和治疗骨疾病都具有重要的意义. 图 4所示的是骨头的结构组成及骨头中可能的固体NMR研究对象的示意图.
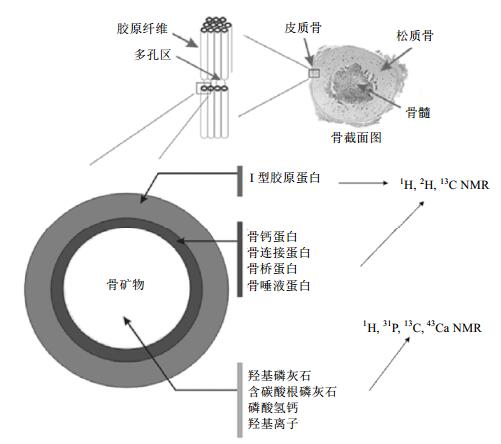
|
| 图 4 骨头的结构组成及骨头中固体NMR研究对象的示意图 Fig. 4 Schematic diagram of the structure of the bone and research objects in bone by solid-state NMR |
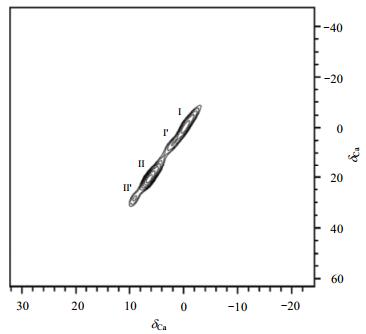
Ca2+是构成人体骨骼和牙齿的主要成分,且维持人体所有细胞的正常生理状态,都要依赖Ca2+的存在.可以说,人体很多系统的功能都与Ca2+有关,Ca2+代谢平衡对于维持生命和健康起到至关重要的作用.获得骨头中Ca2+的储存和运输机制以及Ca2+和骨头中各种蛋白的相互作用,不仅对于理解骨矿化和骨重塑有着重要意义,而且对于认识退行性关节病(如骨关节炎)也十分重要. 43Ca是旋磁比和天然丰度均很低的四极核,普通固体NMR技术观察十分困难. Xu等人[15]首次通过天然丰度的43Ca MAS NMR技术研究了HA和掺杂碳酸根的磷灰石(Carbonated Apatite,CHA)两类模型化合物以及牛皮质骨样品(如图 5所示),发现在HA样品、5% CHA样品和10% CHA样品(CHA样品中分别含有质量分数为5%和10%的CO32-)的43Ca NMR谱上均有两个不同的信号峰,表明它们都有两种不同局域环境的Ca2+存在,即Ca-Ⅰ和Ca-Ⅱ两个配位点.进一步拟合发现HA和CHA的四极偶合常数和不对称因子相同,表明在这两个模型化合物的配位数相同,只是配体存在差异.对于牛骨样品没有观察到Ca-Ⅱ位点,表明骨样品中钙的配位环境与模型化合物不相同.但是,通过拟合同样发现在牛皮质骨中仍然存在着Ca-Ⅱ位点,且四极作用较大,所以难以观察. Xu等人[15]还通过多量子NMR(MQ NMR)技术研究了骨钙蛋白OC和HA的相互作用,图 6所示的是43Ca富集(57.9%)的5% CHA样品与骨钙蛋白OC混合后的二维43Ca MQ-MAS NMR谱图,清楚地揭示了存在两个较强的信号峰,化学位移分别位于δCa -0.1(Ca-Ⅰ) 和δCa 6.7(Ca-Ⅱ),且Ca-Ⅰ/Ca-Ⅱ的强度比为3:4.另外,还观察到了两个相对强度较弱的信号,化学位移分别为δCa 2.4和δCa 9.5,这两个信号在没有混合骨钙蛋白OC的5% CHA样品中并不存在,因此这两个峰很可能是骨钙蛋白OC分别和Ca-Ⅰ、Ca-Ⅱ结合引起的.因此,43Ca MAS NMR技术可以用来研究骨样品中钙的配位环境及其与骨钙蛋白OC的相互作用,这有助于人们认识骨矿化以及骨的形成过程.

|
| 图 5 (a)~(e) 依次为羟基磷灰石(HA)、5%掺杂碳酸根的羟基磷灰石(CHA)、10% CHA、去蛋白后的皮质骨和皮质骨的天然丰度43Ca NMR实验谱图(左边图)以及对应的Ca-Ⅱ和Ca-Ⅰ模拟图(右边图)[15] Fig. 5 Natural-abundance 43Ca NMR spectra of (a) hydroxyapatite, (b) 5% carbonated apatite, (c) 10% carbonated apatite, (d) deproteined cortical bone, and (e) cortical bone samples (left column). The simulated Ca-Ⅱ and Ca-Ⅰ are also plotted for a comparison (right column)[15] |
骨头的无机成分主要是羟基磷灰石(HA),从其结构式不难理解骨头中存在OH-.然而,由于骨头中含有一定量的水分子、蛋白质及其他有机小分子生物聚合物,导致骨头中OH-的检测一直都是个难题,传统的湿化学分析和红外光谱分析都难以检测其存在.另外,大多数研究骨头中OH-含量的分析方法都需要对样品进行预处理,破坏蛋白键,使骨头中的有机基质溶解或者腐蚀以消除其对检测的干扰.但是对样品的预处理同时也会对骨头的结构和组成造成一定的影响. Cho等人[16]巧妙地利用固体NMR技术解决了骨头中OH-的检测难题. 图 7(a)是四个样品(老鼠皮质骨、牛皮质骨、95% HA/5%磷酸氢钙(brushite,BRU;分子式:CaHPO4·2H2O)和10% HA/90% BRU人工模拟骨的1H和31P一维固体NMR谱图.从图 7(a)可以发现:在人工模拟骨样品中能够清楚的观察到化学位移位于δH 0.2处的OH-信号,以及位于δH 5.8处的吸附水峰的信号.然而,对于两个骨头样品只能观察到一个非常宽的共振峰信号,该宽峰可能是水、有机基质和HA共同作用的结果,并不能观察到OH-的信号.另外,图 7(b)所示的1H-31P CP/MAS NMR技术也难以直接揭示OH-基团的存在. 图 7(c)和(d)分别为95% HA/5% BRU和牛皮质骨样品的二维1H-31P异核相关谱(1H-31P HETCOR),对比两个谱图可以明确观察到在δH 0.3处出现了一个较强的交叉峰信号,而且图 7(b)揭示了骨样品中有机基质中的磷含量非常低,因此可以确定有机基质不会干扰实验结果.只有31P和1H原子间的核间距小于1 nm,在HETCOR谱中才会检测出1H-31P的交叉峰信号,因此可以明确将δH0.3的信号峰归属为牛皮质骨样品中的OH-信号.由此可见,固体NMR技术是研究骨头这类复杂材料的强有力工具.
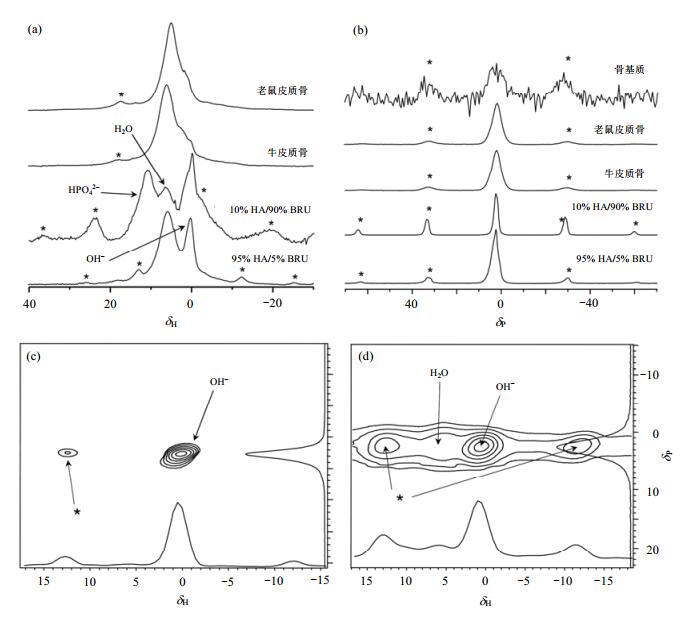
|
| 图 7 95% HA/5% BRU,10% HA/90% BRU,牛皮质骨和老鼠皮质骨样品的1H MAS NMR谱图(a) 和1H-31P CP/MAS NMR谱图(b);95% HA/5% BRU (c) 和牛皮质骨样品(d) 的二维1H-31P HETCOR谱图[16] Fig. 7 1H MAS NMR spectra (a) and 1H-31P CP/MAS NMR spectra (b) of 95% HA/5% BRU, 10% HA/90% BRU and specimens of cryogenically ground rat and bovine cortical bone. 2D 1H-31P HETCOR spectra of 95% HA/5% BRU (c) and bovine cortical bone (d)[16] |
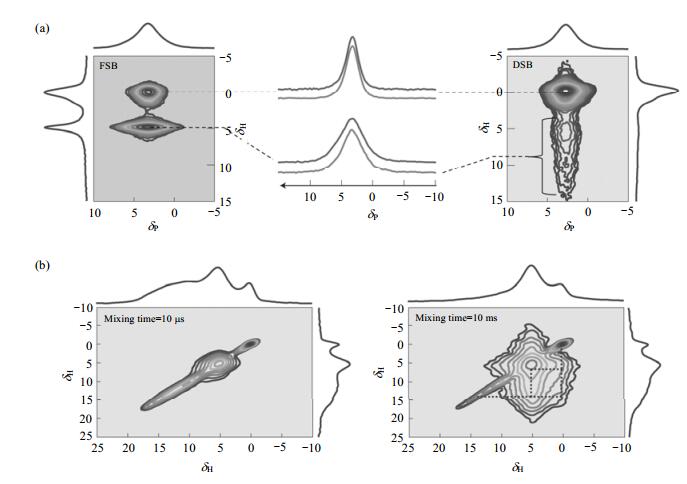
骨头中羟基磷灰石(HA)晶体的生长调控机制一直是研究热点,已获得的研究成果证实骨头中的胶原蛋白、蛋白多糖和非胶原蛋白是调控骨头中HA晶体结构的关键成分[53-55].除此之外,水作为骨头中主要成分之一,对HA晶体的调控也发挥着重要作用. Wang等人[17]利用固体NMR、广角度X射线散射和透射电子显微镜等技术手段,揭示了水分子通过覆盖在HA晶核表面的层状无定型磷酸钙来调控HA晶体的取向. 图 8(a)是未经任何化学预处理的新鲜绵羊骨头样品(FSB)和室温下仅用层流烘干的绵羊骨头样品(DSB)的二维1H-31P HETCOR谱图.二维异核相关谱清楚地揭示了两个骨样品都存在两种局域环境不同的磷酸盐.对于干燥后的骨样DSB来说,尽管两个交叉峰所对应的磷物种的化学位移接近,但线宽不同.比较尖锐的交叉峰是磷物种与HA的OH-所形成,其对应的线宽是660 Hz;而另一个较宽的交叉峰则对应的是磷物种与HPO42-以及残留的水所形成,其对应的线宽为1 680 Hz.尖锐的磷物种可以归属为HA晶核中的PO43-,而较宽的磷物种则被归属为HA表面的无序磷酸盐相.十分有趣的是,FSB和DSB各自较窄的31P NMR谱峰参数基本一样,说明磷酸根物种和OH-不受脱水干燥的影响,然而干燥脱水过程会对较宽的磷物种信号有明显的影响,证明了较宽的31P NMR谱峰在HA晶体的表面层.为了进一步研究无序磷酸盐相与HA晶体的关系,作者又采取了基于磷滤波的二维质子交换谱实验进行研究[如图 8(b)所示],该实验能消除骨头有机基质中质子的影响. 图 8(b)明显地观察到了OH-、HPO42-以及残留水之间存在相关峰,表明无序磷酸盐相与HA晶体存在于同一种纳米晶里面.增加混合时间后,发现3种质子物种还能形成交叉峰,说明水分子紧密吸附在HA晶体的表面层.固体NMR实验证明了水分子在HA表面的吸附能力直接取决于HA晶体表面是否存在高度亲水性的无序磷酸盐层,而且通过调控表面的无序磷酸盐层的生长来控制HA晶体的取向.
骨头中的主要承载材料是含有碳酸根的磷灰石纳米晶和胶原蛋白,尤其是磷灰石纳米晶的厚度(约3 nm,相当于4个磷灰石晶胞的尺寸)对骨头的力学性能有着重要影响,例如可以防止裂纹扩展.尽管骨头中磷灰石纳米晶的尺寸和形状已经被广泛研究[56, 57],但其厚度为什么维持在一定的值(约3 nm),科学界一直没有给出一个合理的解释.更清楚地认识控制骨头中磷灰石纳米晶厚度的影响因素,不仅可以帮助我们治疗和预防各种骨头疾病,而且可以合成更适宜于人体的生物纳米材料. Hu等人[18]利用固体NMR技术研究了3种动物骨头中的柠檬酸盐[如图 9所示]. 图 9(a)~(c)是鱼、鸟以及牛骨的13C NMR谱图,所观察到的主要信号是来自于骨样品有机基质中的胶原蛋白.为了确定柠檬酸盐的存在,作者进一步采用了13C{31P} REDOR NMR实验研究了牛骨样品.在13C NMR化学位移分别为δC 182、δC 169、δC 76和δC 49处观察到4个信号峰,其中δ 169处的峰可归属为磷灰石纳米晶中微量的CO32-.早期的研究中也曾观察到δC 182和δC 76两个信号[53, 58],但是δC 49这个信号之前从未观察到,作者将δC 182、δC 76和δC 49这3个峰归属为与磷灰石纳米晶表面键合的柠檬酸盐.为了进一步佐证归属,作者将牛骨本身具有的柠檬酸盐清除掉,然后用13C标记的柠檬酸盐浸泡,使牛骨样品和13C标记的柠檬酸盐结合,以获得更强的13C NMR信号[如图 9(e)细线所示],扣除胶原蛋白背景信号后,在δC 182、δC 76和δC 49处出现了柠檬酸盐的信号峰[如图 9(e)粗线所示].四水合柠檬酸钙标样品的13C NMR实验进一步证实了这3个信号是来源于柠檬酸盐[如图 9(f)所示].采用偶极去相实验,进一步把与质子有弱相互作用的非质子化碳区分出来[如图 9(g)所示].采用同样的偶极去相时间,对牛骨样品进行偶极去相实验,除运动性较强的甲基峰之外,发现其余共振峰的位置与四水合柠檬酸钙完全匹配,因此可以彻底将δC 182、δC 76和δC 49这3个峰归属为与磷灰石纳米晶表面键合的柠檬酸盐. Hu等人[18]还采用13C{31P} REDOR NMR实验研究了柠檬酸盐与磷灰石纳米晶之间的距离,发现柠檬酸盐的3个羧基和磷灰石纳米晶表面的距离均为0.3~0.45 nm.因此,固体NMR技术揭示了柠檬酸盐能够与羟基磷灰石的表面紧密键合,促使羟基磷灰石纳米晶稳定,同时抑制磷酸钙层的进一步形成,因而可以阻止晶体进一步生长变厚.
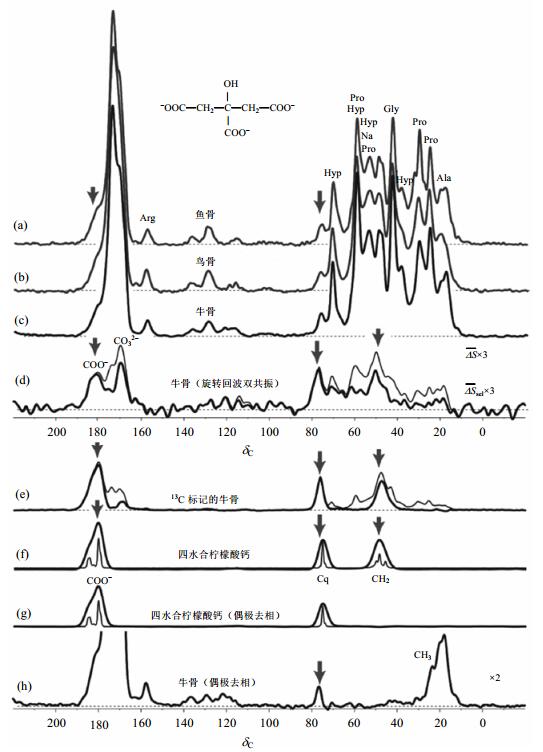
|
| 图 9 (a)~(c) 鱼、鸟以及牛骨的13C NMR谱图;(d) 牛骨的13C{31P}REDOR NMR谱图;(e) 去除柠檬酸盐的牛骨和13C的柠檬酸盐结合后的13C NMR谱图(细线);扣除胶原蛋白背景信号后的柠檬酸盐的13C NMR谱图(粗线);(f) 四水合柠檬酸钙的13C NMR谱图;(g) 40 μs偶极去相时间后的四水合柠檬酸钙13C NMR谱和(h) 牛骨的弱C-H偶合的13C NMR谱图.图中箭头代表柠檬酸盐信号[18] Fig. 9 13C NMR spectra of bone, of organic residues at the interface with apatite, and of 13C-labeled citrate in bone. (a) Fish bone; (b) avian bone; and (c) bovine bone. (d) Spectra of 13C near 31P in bovine bone. (e) Thin line: Spectrum of bovine bone with uniformly 13C-labeled bound citrate, introduced after (partial) removal of native citrate. Thick line: Same data after subtraction of the collagen background. (f) Spectrum of calcium citrate. (g) Same as (f) after 40 μs dipolar dephasing. (h) Spectrum of bovine bone after 40 μs dipolar dephasing. Citrate signals are highlighted by arrows[18] |
除了羟基磷灰石之外,生物玻璃也是骨基生物材料的一个重要分支.生物玻璃可以促进骨细胞生长,并具备连结硬组织和软组织的能力,因此被认为具有应用前途的生物骨基替代材料,可用于再生、修复和替换骨骼系统.生物玻璃的组成和结构对其生物活性有重要影响,关于其结构的研究,尽管有很多谱学手段,比如X射线和红外光谱,但是固体NMR技术能够从原子、分子水平上揭示生物玻璃的微观结构及某些重要金属离子的配位环境.此外,生物玻璃中的金属离子是如何参与生物机体的修复,也可以通过固体NMR技术获得一些重要的信息.
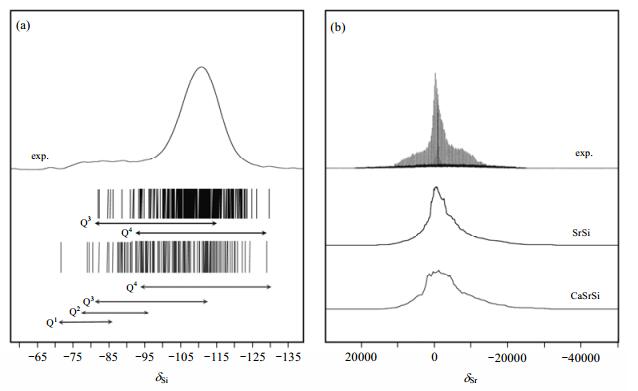
3.1 固体NMR技术研究Sr2+在生物玻璃中的局域环境人体中约99%的锶元素(Sr)存在于骨头中,它能促进骨头的形成,抑制骨吸收[59, 60],是生物医学上非常重要的一种元素.另外,Sr2+还可以促进成骨细胞的分化和提高碱性磷酸酶的活性[61-63].因此,掺杂Sr2+的骨基生物材料一直以来都被广泛关注.许多学者对掺杂Sr2+的生物玻璃做了大量的研究,然而直到现在,Sr2+在生物玻璃中的局域环境研究依然没有确切的实验证据. Bonhomme等人[19]利用87Sr固体NMR技术结合计算模拟,研究了生物玻璃中Sr2+的局域环境. 图 9是标记的生物玻璃B75-Sr10(76.9SiO2-17.6CaO-5.5SrO, mol%)的29Si和87Sr NMR谱图,图 9(a)中主要能观察到化学位移位于δSi -110的主峰,可以归属为Q4和Q3单元.为了对29Si NMR谱有一个更清楚的认识,作者还计算了模拟玻璃SrSi(93.4SiO2-6.6SrO, mol %)以及生物玻璃B75-Sr10中各个Q位点的29Si NMR化学位移分布,发现生物玻璃B75-Sr10的Q 值分布与SrSi玻璃的模型更接近,表明采用溶胶凝胶法合成B75-Sr10的过程中已经发生了相分离,导致形成了含Sr2+的硅酸盐纳米域. 图 9(b)所示的是B75-Sr10生物玻璃所对应的87Sr NMR实验谱图,以及模拟玻璃CaSrSi(76.9SiO2-17.6CaO-5.5SrO, mol %)和SrSi所对应的模拟谱图.对于生物玻璃B75-Sr10样品能观察到一个非常宽的87Sr NMR信号,说明在该生物玻璃中肯定不存在高度对称的Sr-O型配位环境.另外,谱图中还有一个非常宽的信号,表明存在十分大的四极偶合常数(约为75 MHz),且在δSr 0附近还观察到一个较尖锐的信号,可认为生物玻璃中还存在中等强度的四极偶合常数(25 MHz≤CQ≤35 MHz),因此说明B75-Sr10生物玻璃中Sr2+的局域环境十分复杂.另外,通过对比还能发现,87Sr NMR的谱图信号与SrSi所对应的模拟谱图更接近,表明Sr2+主要聚集在硅酸盐纳米域中,这与29Si NMR谱所观察到的现象一致.由于Sr2+是一种闭壳型抗磁性阳离子,所以很少有谱学手段能获得其局域环境,尤其是对于生物玻璃这类无序或无定型的材料更加困难.固体NMR技术对短程有序十分敏感,因此该技术成为研究生物玻璃的一种强有力的工具.
固体NMR技术已经在骨基生物材料的研究中显示出独特优势,不需要经过任何处理就可以分析骨头的微观结构.固体NMR技术可以用来研究其无机矿物和胶原蛋白等有机成分之间的界面相互作用,这可以说是目前唯一的方法.该技术还可以用来研究骨头等骨基生物材料中微量金属离子对其结构和生物矿化的影响.另外,固体NMR技术还可以与磁共振成像(MRI)联用研究骨再生和评估人体健康程度.随着固体NMR技术的发展和实验样品处理上的改进,越来越多的复杂固体NMR实验将被用来研究骨基生物材料的高分辨结构、骨蛋白与无机矿物质之间的相互作用以及骨头的生物矿化机理,如15N/31P REDOR NMR、二维同核/异核相关谱技术、动态核极化(DNP)固体NMR灵敏度增强技术以及顺磁弛豫增强(PRE)固体NMR技术.随着低频NMR技术的发展,39K、25Mg、17O和43Ca这些低频四极核的观测逐渐实现,尤其是天然丰度的43Ca MAS NMR实验的实现,必将为骨基生物材料的结构研究提供更清晰的视野.另外,固体NMR技术结合其他实验技术(如EXAFS),将帮助人们从更广泛的角度和更深的层次认识骨基生物材料的结构和生物矿化机制.有理由相信,在未来,固体NMR技术在骨基生物材料的研究中所发挥的作用将会越来越大,所给出的有些信息也将会是其他实验技术所无法获得的.
| [1] | JOHNELL O, KANIS J A. An estimate of the worldwide prevalence and disability associated with osteoporotic fractures[J]. Osteoporosis Int, 2006, 17(12): 1726-1733 DOI:10.1007/s00198-006-0172-4 |
| [2] | GULLBERG B, JOHNELL O, KANIS J A. World-wide projections for hip fracture[J]. Osteoporosis Int, 1997, 7(5): 407-413 DOI:10.1007/PL00004148 |
| [3] | MELTON L J. Hip fractures:A worldwide problem today and tomorrow[J]. Bone, 1993, 14(S): 1-8 |
| [4] | MELTON L J, KAN S H, FRYE M A, et al. Epidemiology of vertebral fractures in women[J]. Am J Epidemiol, 1989, 129(5): 1000-1011 DOI:10.1093/oxfordjournals.aje.a115204 |
| [5] | BOCK R M, MCENTIRE B J, BAL B S, et al. Surface modulation of silicon nitride ceramics for orthopaedic applications[J]. Acta Biomater, 2015, 26: 318-330 DOI:10.1016/j.actbio.2015.08.014 |
| [6] | WU C, ZHANG Y, ZHU Y, et al. Structure-property relationships of silk-modified mesoporous bioglass scaffolds[J]. Biomaterials, 2010, 31(13): 3429-3438 DOI:10.1016/j.biomaterials.2010.01.061 |
| [7] | VANI R, GIRIJA E K, ELAYARAJA K, et al. Hydrothermal synthesis of porous triphasic hydroxyapatite/(alpha and beta) tricalcium phosphate[J]. J Mater Sci Mater Med, 2009, 20(S1): 43-48 |
| [8] | ZHANG Y, VENUGOPAL J R, EL-TURKI A, et al. Electrospun biomimetic nanocomposite nanofibers of hydroxyapatite/chitosan for bone tissue engineering[J]. Biomaterials, 2008, 29(32): 4314-4322 DOI:10.1016/j.biomaterials.2008.07.038 |
| [9] | HUTCHENS S A, BENSON R S, EVANS B R, et al. Biomimetic synthesis of calcium-deficient hydroxyapatite in a natural hydrogel[J]. Biomaterials, 2006, 27(26): 4661-4670 DOI:10.1016/j.biomaterials.2006.04.032 |
| [10] | HU Q L, LI B Q, WANG M, et al. Preparation and characterization of biodegradable chitosan/hydroxyapatite nanocomposite rods via in situ hybridization:A potential material as internal fixation of bone fracture[J]. Biomaterials, 2004, 25(5): 779-785 DOI:10.1016/S0142-9612(03)00582-9 |
| [11] | DUPONT L, GUILLON E, BOUANDA J, et al. EXAFS and XANES studies of retention of copper and lead by a lignocellulosic biomaterial[J]. Environ Sci Technol, 2002, 36(23): 5062-5066 DOI:10.1021/es025764o |
| [12] | CHEN J, YU Z, ZHU P, et al. Effects of fluorine on the structure of fluorohydroxyapatite:A study by XRD, solid-state NMR and Raman spectroscopy[J]. J Mater Chem B, 2015, 3(1): 34-38 DOI:10.1039/C4TB01561D |
| [13] | LAURENCIN D, ALMORA-BARRIOS N, DE LEEUW N H, et al. Magnesium incorporation into hydroxyapatite[J]. Biomaterials, 2011, 32(7): 1826-1837 DOI:10.1016/j.biomaterials.2010.11.017 |
| [14] | CHEN P H, TSENG Y H, MOU Y, et al. Adsorption of a statherin peptide fragment on the surface of nanocrystallites of hydroxyapatite[J]. J Am Chem Soc, 2008, 130(9): 2862-2868 DOI:10.1021/ja076607y |
| [15] | XU J, ZHU P, GAN Z, et al. Natural-abundance 43Ca solid-state NMR spectroscopy of bone[J]. J Am Chem Soc, 2010, 132(33): 11504-11509 DOI:10.1021/ja101961x |
| [16] | CHO G Y, WU Y T, ACKERMAN J L. Detection of hydroxyl ions in bone mineral by solid-state NMR spectroscopy[J]. Science, 2003, 300(5622): 1123-1127 DOI:10.1126/science.1078470 |
| [17] | WANG Y, VON EUW S, FERNANDES F M, et al. Water-mediated structuring of bone apatite[J]. Nat Mater, 2013, 12(12): 1144-1153 DOI:10.1038/nmat3787 |
| [18] | HU Y Y, RAWAL A, SCHMIDT-ROHR K. Strongly bound citrate stabilizes the apatite nanocrystals in bone[J]. Proc Natl Acad Sci USA, 2010, 107(52): 22425-22429 DOI:10.1073/pnas.1009219107 |
| [19] | BONHOMME C, GERVAIS C, FOLLIET N, et al. 87Sr solid-state NMR as a structurally sensitive tool for the investigation of materials:Antiosteoporotic pharmaceuticals and bioactive glasses[J]. J Am Chem Soc, 2012, 134(30): 12611-12628 DOI:10.1021/ja303505g |
| [20] | WATTS S J, HILL R G, O'DONNELL M D, et al. Influence of magnesia on the structure and properties of bioactive glasses[J]. J Non-Cryst Solids, 2010, 356(9, 10): 517-524 |
| [21] | LAURENCIN D, WONG A, CHRZANOWSKI W, et al. Probing the calcium and sodium local environment in bones and teeth using multinuclear solid state NMR and X-ray absorption spectroscopy[J]. Phys Chem Chem Phys, 2010, 12(5): 1081-1091 DOI:10.1039/B915708E |
| [22] | BRAUN M, HARTMANN P, JANA C. 19F and 31P NMR spectroscopy of calcium apatites[J]. J Mater Sci Mater Med, 1995, 6(3): 150-154 DOI:10.1007/BF00120291 |
| [23] | KOLMAS J, KURAS M, OLEDZKA E, et al. A solid-state NMR study of selenium substitution into nanocrystalline hydroxyapatite[J]. Int J Mol Sci, 2015, 16(5): 11452-11464 DOI:10.3390/ijms160511452 |
| [24] | KOLMAS J, JAKLEWICZ A, ZIMA A, et al. Incorporation of carbonate and magnesium ions into synthetic hydroxyapatite:The effect on physicochemical properties[J]. J Mol Struct, 2011, 987(1-3): 40-50 DOI:10.1016/j.molstruc.2010.11.058 |
| [25] | MARCHAT D, ZYMELKA M, COELHO C, et al. Accurate characterization of pure silicon-substituted hydroxyapatite powders synthesized by a new precipitation route[J]. Acta Biomater, 2013, 9(6): 6992-7004 DOI:10.1016/j.actbio.2013.03.011 |
| [26] | GRÖGER C, LUTZ K, BRUNNER E. NMR studies of biomineralisation[J]. Prog Nucl Magn Reson Spectrosc, 2009, 54(1): 54-68 DOI:10.1016/j.pnmrs.2008.02.003 |
| [27] | KOLODZIEJSKI W, et al. New Techniques in solid-state NMR[M]. Berlin: Springer, 2005. |
| [28] | GOOBES G, STAYTON P S, DROBNY G P. Solid state NMR studies of molecular recognition at protein-mineral interfaces[J]. Prog Nucl Magn Reson Spectrosc, 2007, 50(2, 3): 71-85 |
| [29] | BRADLEY J V, BRIDGLAND L N, COLYER D E, et al. NMR of biopolymer-apatite composites:Developing a model of the molecular structure of the mineral-matrix interface in calcium phosphate biomaterials[J]. Chem Mater, 2010, 22(22): 6109-6116 DOI:10.1021/cm101730f |
| [30] | BARHEINE S, HAYAKAWA S, OSAKA A, et al. Surface, interface, and bulk structure of borate containing apatitic biomaterials[J]. Chem Mater, 2009, 21(14): 3102-3109 DOI:10.1021/cm900204q |
| [31] | Cheng R H(郑人豪), Wu Z(吴振), Huang P C(黄柏琦), et al. Sensitivity enhancement of multiple quantum and satellite transition magic angle spinning spectra by optimizing the initial state(优化初始脉冲增强多量子跃迁及卫星跃迁魔角旋转谱灵敏度)[J]. Chinese J Magn Reson(波谱学杂志), 2015, 32(2): 363-372 |
| [32] | Wang F F(王粉粉), Chen T H(陈铁红), Sun P C(孙平川). Heterogeneous structure and miscibility of phenylboronic acid-rich chitosan nanoparticles as revealed by advanced solid-state NMR(先进固体核磁共振揭示苯硼酸-壳聚糖纳米粒子非均匀结构和相容性)[J]. Chinese J Magn Reson(波谱学杂志), 2015, 32(2): 354-362 |
| [33] | LEGEROS R Z, LIN S, ROHANIZADEH R, et al. Biphasic calcium phosphate bioceramics:Preparation, properties and applications[J]. J Mater Sci Mater Med, 2003, 14(3): 201-209 DOI:10.1023/A:1022872421333 |
| [34] | GAUTHIER O, BOULER J M, AGUADO E, et al. Macroporous biphasic calcium phosphate ceramics:Influence of macropore diameter and macroporosity percentage on bone ingrowth[J]. Biomaterials, 1998, 19(1-3): 133-139 DOI:10.1016/S0142-9612(97)00180-4 |
| [35] | KLEIN C, DEGROOT K, DRIESSEN A A, et al. Interaction of biodegradable beta-whitlockite ceramics with bone tissue:An in vivo study[J]. Biomaterials, 1985, 6(3): 189-192 DOI:10.1016/0142-9612(85)90008-0 |
| [36] | GINTY F, FLYNN A, CASHMAN K D. The effect of dietary sodium intake on biochemical markers of bone metabolism in young women[J]. Brit J Nutr, 1998, 79(4): 343-350 DOI:10.1079/BJN19980058 |
| [37] | ITOH R, SUYAMA Y. Sodium excretion in relation to calcium and hydroxyproline excretion in a healthy Japanese population[J]. Am J Clin Nutr, 1996, 63(5): 735-740 |
| [38] | RUDE R K, GRUBER H E. Magnesium deficiency and osteoporosis:Animal and human observations[J]. J Nutr Biochem, 2004, 15(12): 710-716 DOI:10.1016/j.jnutbio.2004.08.001 |
| [39] | FEATHERSTONE J D B. Prevention and reversal of dental caries:Role of low level fluoride[J]. Community Dent Oral, 1999, 27(1): 31-40 DOI:10.1111/com.1999.27.issue-1 |
| [40] | AIZENBERG J, BLACK A J, WHITESIDES G M. Control of crystal nucleation by patterned self-assembled monolayers[J]. Nature, 1999, 398(6727): 495-498 DOI:10.1038/19047 |
| [41] | WEINER S, ADDADI L. Design strategies in mineralized biological materials[J]. J Mater Chem, 1997, 7(5): 689-702 DOI:10.1039/a604512j |
| [42] | STUPP S I, BRAUN P V. Molecular manipulation of microstructures:Biomaterials, ceramics, and semiconductors[J]. Science, 1997, 277(5330): 1242-1248 DOI:10.1126/science.277.5330.1242 |
| [43] | CAO M, WANG Y, GUO C, et al. Preparation of ultrahigh-aspect-ratio hydroxyapatite nanofibers in reverse micelles under hydrothermal conditions[J]. Langmuir, 2004, 20(11): 4784-4786 DOI:10.1021/la0498197 |
| [44] | DONNERS J, NOLTE R J, SOMMERDIJK N. Dendrimer-based hydroxyapatite composites with remarkable materials properties[J]. Adv Mater, 2003, 15(4): 313-316 DOI:10.1002/adma.200390076 |
| [45] | SARDA S, HEUGHEBAERT M, LEBUGLE A. Influence of the type of surfactant on the formation of calcium phosphate in organized molecular systems[J]. Chem Mater, 1999, 11(10): 2722-2727 DOI:10.1021/cm991022r |
| [46] | HOANG Q Q, SICHERI F, HOWARD A J, et al. Bone recognition mechanism of porcine osteocalcin from crystal structure[J]. Nature, 2003, 425(6961): 977-980 DOI:10.1038/nature02079 |
| [47] | REES S G, SHELLIS R P, EMBERY G. Inhibition of hydroxyapatite crystal growth by bone proteoglycans and proteoglycan components[J]. Biochem Bioph Res Co, 2002, 292(3): 727-733 DOI:10.1006/bbrc.2002.6699 |
| [48] | BREKKEN R A, SAGE E H. SPARC, a matricellular protein:At the crossroads of cell-matrix communication[J]. Matrix Biol, 2001, 19(8): 816-827 |
| [49] | KNOTT L, BAILEY A J. Collagen cross-links in mineralizing tissues:A review of their chemistry, function, and clinical relevance[J]. Bone, 1998, 22(3): 181-187 DOI:10.1016/S8756-3282(97)00279-2 |
| [50] | PROCKOP D J, KIVIRIKKO K I. Collagens:Molecular biology, diseases, and potentials for therapy[J]. Annu Rev Biochem, 1995, 64: 403-434 DOI:10.1146/annurev.bi.64.070195.002155 |
| [51] | LANDI E, TAMPIERI A, MATTIOLI-BELMONTE M, et al. Biomimetic Mg-and Mg, CO3-substituted hydroxyapatites:Synthesis characterization and in vitro behaviour[J]. J Eur Ceram Soc, 2006, 26(13): 2593-2601 DOI:10.1016/j.jeurceramsoc.2005.06.040 |
| [52] | HEANEY R P. Role of dietary sodium in osteoporosis[J]. J Am Coll Nutr, 2006, 25(S3): 271-276 |
| [53] | WISE E R, MALTSEV S, DAVIES M E, et al. The organic-mineral interface in bone is predominantly polysaccharide[J]. Chem Mater, 2007, 19(21): 5055-5057 DOI:10.1021/cm702054c |
| [54] | HE G, DAHL T, VEIS A, et al. Nucleation of apatite crystals in vitro by self-assembled dentin matrix protein 1[J]. Nat Mater, 2003, 2(8): 552-558 DOI:10.1038/nmat945 |
| [55] | LANDIS W J, SONG M J, LEITH A, et al. Mineral and organic matrix interaction in normally calcifying tendon visualized in three dimensions by high-voltage electron microscopic tomography and graphic image reconstruction[J]. J Struct Biol, 1993, 110(1): 39-54 DOI:10.1006/jsbi.1993.1003 |
| [56] | WEINER S, WAGNER H D. The material bone:Structure-mechanical function relations[J]. Annu Rev Mater Sci, 1998, 28: 271-298 DOI:10.1146/annurev.matsci.28.1.271 |
| [57] | WEINER S, TRAUB W. Bone structure:From angstroms to microns[J]. Faseb J, 1992, 6(3): 879-885 |
| [58] | JAEGER C, GROOM N S, BOWE E A, et al. Investigation of the nature of the protein-mineral interface in bone by solid-state NMR[J]. Chem Mater, 2005, 17(12): 3059-3061 DOI:10.1021/cm050492k |
| [59] | BUEHLER J, CHAPPUIS P, SAFFAR J, et al. Strontium ranelate inhibits bone resorption while maintaining bone formation in alveolar bone in monkeys (Macaca fascicularis)[J]. Bone, 2001, 29(2): 176-179 DOI:10.1016/S8756-3282(01)00484-7 |
| [60] | GRYNPAS M, HAMILTON E, CHEUNG R, et al. Strontium increases vertebral bone volume in rats at a low dose that does not induce detectable mineralization defect[J]. Bone, 1996, 18(3): 253-259 DOI:10.1016/8756-3282(95)00484-X |
| [61] | ZHANG W, SHEN Y, PAN H, et al. Effects of strontium in modified biomaterials[J]. Acta Biomater, 2011, 7(2): 800-808 DOI:10.1016/j.actbio.2010.08.031 |
| [62] | ISAAC J, NOHRA J, LAO J, et al. Effects of strontium-doped bioactive glass on the differentiation of cultured osteogenic cells[J]. Eur Cell Mater, 2011, 21: 130-143 DOI:10.22203/eCM |
| [63] | RAFFALT A C, ANDERSEN J E, CHRISTGAU S. Application of inductively coupled plasma-mass spectrometry (ICP-MS) and quality assurance to study the incorporation of strontium into bone, bone marrow, and teeth of dogs after one month of treatment with strontium malonate[J]. Anal Bioanal Chem, 2008, 391(6): 2199-2207 DOI:10.1007/s00216-008-2171-0 |

本作品采用知识共享署名 4.0 国际许可协议进行许可。
 2017, Vol. 34
2017, Vol. 34