文章信息
- 王菲菲, 张聿梅, 何轶, 戴忠, 马双成, 刘斌
- WANG Fei-fei, ZHANG Yu-mei, HE Yi, DAI Zhong, MA Shuang-cheng, LIU Bin
- 雷酚内酯的波谱学数据与结构确证
- Spectral Analysis and Structural Elucidation of Triptophnolide
- 波谱学杂志, 2017, 34(1): 35-42
- Chinese Journal of Magnetic Resonance, 2017, 34(1): 35-42
- http://dx.doi.org/10.11938/cjmr20170105
-
文章历史
收稿日期: 2015-11-21
收修改稿日期: 2017-01-04


DOI:10.11938/cjmr20170105
2. 北京中医药大学 中药学院, 北京 100029
2. School of Chinese Materia Medica, Beijing University of Chinese Medicine, Beijing 100029, China
雷酚内酯(Triptophenolide,化学式为C20H24O3)由邓福孝等人[1]于1982年首次从福建泰宁县产雷公藤(Tripterygium Wilfordii Hook.f.)分离得到,是一种具有较强抑制肿瘤活性的二萜类化合物[见图 1(a)][2].雷公藤,又称山砒霜、断肠草或南蛇藤,最早记载于《神农本草经》,是卫矛科雷公藤属木质藤本植物,主要分布于我国长江流域以南山区和东北长白山区.雷公藤制剂具有多种药理作用,可用于治疗炎症、癌症、麻风病、慢性肾炎、系统性红斑狼疮等疾病[3].雷酚内酯是从雷公藤中分离得到的主要成分之一,中国食品药品检定研究院拟发行雷酚内酯对照品,为日后该类药物检验提供对照品支持.
|
| 图 1 已报道的雷酚内酯的结构式 Fig. 1 The structure of Triptophenolidein references |
关于雷酚内酯的结构目前已有多篇报道,于东防等人[4]于1990年用X-ray单晶衍射的方法修改了雷酚内酯的结构[见图 1(b)],但自此以后再没有相关文献分离得到图 1(b)所示的结构.樊希望等人[3]于2011年从雷公藤植物提取分离化合物并用X-ray单晶衍射方法确定结构,也得到了图 1(a)所示的雷酚内酯结构.通过文献查阅或利用化学物质登记号(CAS number)对化合物检索,一般也认为雷酚内酯的结构为图 1(a)所示.已经发表的文献中[1, 4, 5]仅报道了雷酚内酯的一维核磁共振氢谱(1H NMR)和碳谱(13C NMR)数据,对结构中的仲氢信号没有给予归属或归属有误,13C NMR主要信号的归属也有错误.我们参照已有文献[1, 4, 5],对雷酚内酯对照品的紫外吸收光谱(UV)、红外吸收光谱(IR)、质谱(MS)、NMR谱图(包括1H NMR、13C NMR、DEPT、1H-1H COSY、NOE、1H-13C HSQC和1H-13C HMBC谱图)进行了分析,对其1H NMR和13C NMR数据进行了全归属,确证了雷酚内酯对照品的化学结构.
1 实验部分雷酚内酯对照品原料由中国食品药品检定研究院提供,经高效液相色谱(HPLC)法测试纯度为99.92%.实验中其它所有试剂均为分析纯,购自上海国药集团化学试剂有限公司.
紫外光谱采用Agilent 8453紫外-可见分光光度计(美国Agilent)测定,红外光谱采用Nicolet 8700傅立叶变换红外光谱仪(美国Nicolet公司)测定,KBr压片.质谱用Agilent Technologies 7000C GC/MS Triple Quad(美国Agilent公司)测定,配备电子轰击离子源(EI源).
1H NMR、13C NMR、DEPT、1H-1H COSY、NOE、1H-13C HSQC和1H-13C HMBC谱均用Bruker AVⅢ HD 600型NMR谱仪(瑞士Bruker公司)测定,配备5 mm探头.1H NMR和13C NMR的工作频率分别为600.25 MHz和150.81 MHz,谱宽分别为12 019.23 Hz和36 057.69 Hz.DEPT-135谱宽与13C NMR谱图相同,NOE谱宽为10 775.91 Hz.2D NMR实验包括1H-1H COSY、1H-13C HSQC和1H-13C HMBC实验,均采用标准脉冲程序.1H-1H COSY的F2(1H)和F1(1H)维谱宽均为5 319.10 Hz,采样数据点阵t2×t1=1 024×1 024;1H-13C HSQC的F2(1H)和F1(13C)维谱宽分别为5 319.10 Hz和30 154.52 Hz,采样数据点阵t2×t1=1 024×1 024;1H-13C HMBC的F2(1H)和F1(13C)维谱宽分别为8 417.51 Hz和36 231.91 Hz,采样数据点阵t2×t1=1 024×1 024.
2 结果与讨论 2.1 UV谱图分析化合物在甲醇中的最大紫外吸收波长λMeOH max(nm)/吸收峰强度(AU)为203.0/0.85、218.0/0.42、273.0/3.0×10-2和279.0/3.0×10-2,分别为E2、E2、B和B吸收带.
2.2 IR谱图分析采用KBr压片法,化合物在IR吸收光谱中,3 520 cm-1和3 483 cm-1处峰为缔合羟基O-H伸缩振动强吸收峰;2 996 cm-1、2 875 cm-1、1 453 cm-1和1 373 cm-1处中强峰为甲基C-H的吸收峰;2 932 cm-1、726 cm-1处为亚甲基C-H的吸收峰;1 754 cm-1和1 739 cm-1处为酯键
化合物质谱采用EI电离源,得到本品的分子离子质荷比(m/z)为312,与理论值(312)一致.
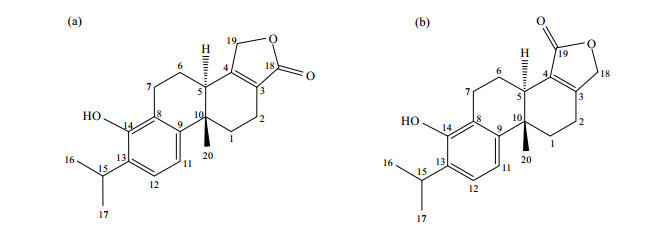
2.4 NMR谱图分析化合物的1H NMR谱显示有13组质子信号.结合1H-1H COSY(图 2)、1H-13C HSQC(图 3)和1H-13C HMBC(图 4)谱图分析和文献[1, 4, 5]比对,可归属高场区的3个甲基信号.其中,δH1.27(6H,d,J=7.0 Hz)为与次甲基相连的2个甲基质子信号H-16和H-17,δH1.03(3H,s)为与季碳相连的甲基质子信号H-20.在HSQC谱中,δC 22.4与H-20相关,被归属为C-20.在HMBC谱中,C-20与δH1.70和δH 2.52远程相关;而在HSQC谱中,δH1.70和δH 2.52同时与δC32.6相关,因此δH1.70和δH 2.52分别被归属为H-1a和H-1b,δC32.6被归属为C-1.在COSY谱中,δH2.40与H-1a、H-1b有偶合关系,被归属为H-2a.在HSQC谱中,δH2.40和δH2.52同时与δC18.2相关,因此δH2.52被归属为H-2b、δC18.2被归属为C-2.在NOE差谱(图 5)中,当照射H-1a(δH 1.70)时,δH 2.52(H-1b或H-2b)和δH 2.70信号增强.在HMBC谱中,H-1a与δC22.4(C-20)、δC 36.2和δC 40.9远程相关;DEPT谱中显示δC36.2为季碳,而且通过和文献[4, 5]比对,我们判断δC36.2为C-10,因此δC40.9被归属为C-5.在HSQC谱,δH 2.70与C-5相关,被归属为H-5.在COSY谱中,δH1.90和δH 2.01与H-5相关,被分别归属为H-6a和H-6b.在NOE谱中,当照射H-6b时,δH 2.70(H-5)、δH 2.90、δH 2.93信号增强;而且在COSY谱中,H-6a、H-6b分别与δH2.70(H-5)、δH 2.90和δH 2.93有偶合关系,因此δH2.90和δH 2.93被归属为H-7a和H-7b.在COSY谱中,δH 3.11与H-16和H-17相关,被归属为H-15.在HSQC谱中,δC27.0与δH3.11直接相关,被归属为C-15,在HMBC谱中,δH7.10(d,J=8.0 Hz)与C-15远程相关,归属为H-12.在COSY谱中,δH6.96(d,J=8.0 Hz)与H-12偶合,被归属为H-11.
|
| 图 2 雷酚内酯的1H-1H COSY谱 Fig. 2 1H-1H COSY spectrum of Triptophenolide |

|
| 图 3 雷酚内酯的1H-13C HSQC谱 Fig. 3 1H-13C HSQC spectrum of Triptophenolide |

|
| 图 4 雷酚内酯的1H-13C HMBC谱 Fig. 4 1H-13C HMBC spectrum of Triptophenolide |

|
| 图 5 雷酚内酯的NOE谱 Fig. 5 NOE spectra of Triptophenolide |
化合物的13C NMR谱显示20个信号峰,结合DEPT谱(图 6),显示化合物结构中存在8个季碳、4个叔碳、5个仲碳和3个伯碳.其中,上文已归属了C-1、C-2、C-5、C-10、C-15和C-20.在HSQC谱(图 3)中,δC22.5与δH1.27(H-16,17)相关,被归属为C-16和C-17.DEPT谱显示5个仲碳的化学位移分别为δC 18.2(C-2)、δC19.6、δC 22.7,δC 32.6(C-1)和δC 70.5.在HSQC谱中,δC19.6与δH1.90(H-6a)、δH 2.01(H-6b)相关,被归属为C-6;δC22.7与δH 2.90(H-7a)、δH2.93(H-7b)相关,被归属为C-7;所以剩余的δC 70.5被归属为C-19.在1H NMR谱中,δH4.8处有2组质子信号,一组与δC70.5(C-19)直接相关(见HSQC谱),归属为H-19;另一组宽单峰归属于羟基质子(-OH)信号.
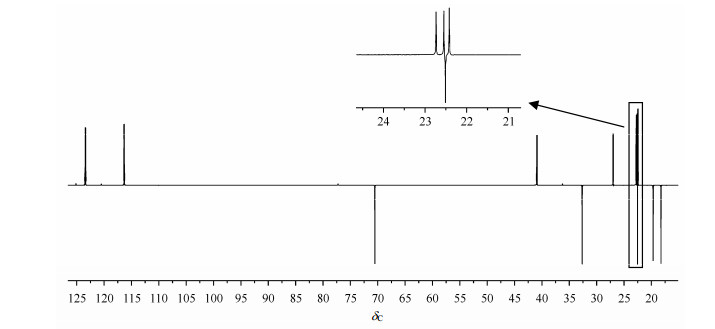
|
| 图 6 雷酚内酯的DEPT-135谱 Fig. 6 DEPT-135 spectra of Triptophenolide |
在HMBC谱中,δC174.2与δH 2.52(H-2b)远程相关,被归属为C-18,该碳为季碳,表明化合物雷酚内酯的结构与图 1(a)相符.在HSQC谱中,δC116.3、δC 123.4分别与δH 6.96(H-11)、δH 7.10(H-12)相关,被分别归属为C-11和C-12.在HMBC谱中,δC 120.5(季碳)与δH4.80(-OH)和δH 6.96(H-11)远程相关,被归属为C-8;δC 131.0(季碳)与δH1.27(H-16, 17)、δH 4.80(-OH)、δH 6.96(H-11)远程相关,被归属为C-13;δC 143.9(季碳)与δH1.03(H-20)、δH 2.52(H-1b)、δH 2.90(H-7a)、δH 2.93(H-7b)和δH 7.10(H-12)相关,被归属为C-9;δC 150.8(季碳)与δH 2.90(H-7a)、δH 2.93(H-7b)和δH 7.10(H-12)远程相关,被归属为C-14;δC 162.9(季碳)与δH2.52(H-1b)和δH 4.80(H-19)远程相关,被归属为C-3;因此δC 125.2被归属为C-4.
在已发表的有关雷酚内酯结构鉴定的文献中,H-1a、H-1b、H-5和H-6b质子信号文献[1, 4, 5]未归属,H-2a、H-7a和H-7b文献[4, 5]归属有误.C-2、C-4、C-5、C-6、C-7、C-8、C-9、C-13、C-15、C-18和C-19碳原子信号文献[4, 5]归属有误.雷酚内酯的1H NMR、1H-1H COSY和NOE数据归属见表 1.13C NMR、DEPT、HSQC和HMBC数据归属见表 2.
| Position | dH | dH[5] | Multiplicity | Proton number | 1H-1H COSY | NOE |
| 1a* | 1.70 | m | 1H | H-1b, H-2a, H-2b | H-1b, H-2b, H-5 | |
| 1b* | 2.52 | m | 1H | H-1a, H -2a | ||
| 2a** | 2.40 | 2.53 | m | 1H | H-1a, H-1b, H-2b, H-19 | |
| 2b | 2.52 | 2.53 | m | 1H | H-1a, H-2a, H-19 | |
| 5* | 2.70 | m | 1H | H-2a, H-2b, H-6a, H-6b, H-19 | ||
| 6a* | 1.90 | m | 1H | H-7a, H-7b, H-5 | ||
| 6b* | 2.01 | m | 1H | H-7a, H-7b, H-5 | H-5, H-7a, H-7b, H-19 | |
| 7a** | 2.90 | 2.86 | m | 1H | H-6a, H-6b | |
| 7b** | 2.93 | 2.86 | m | 1H | H-6a, H-6b | |
| 11 | 6.96 | 6.96 | d, J=8.0 Hz | 1H | H-12 | |
| 12 | 7.10 | 7.07 | d, J=8.0 Hz | 1H | H-11 | |
| 15 | 3.11 | 3.10 | m | 1H | H-16, H-17 | |
| 16, 17 | 1.27 | 1.27 | d, J=7.0 Hz | 6H | H-15 | |
| 19 | 4.80 | 4.80 | m | 2H | H-2a, H-2b, H-5 | |
| 20 | 1.03 | 1.03 | s | 3H | ||
| -OH | 4.80 | 4.80 | m | 1H | ||
| *为文献[5]中未明确归属的质子信号;**为文献[5]中归属错误的质子信号 | ||||||
| Position | dC | dC[5] | DEPT | HSQC | HMBC |
| 1 | 32.6 | 32.7 | CH2 | + | H-20 |
| 2** | 18.2 | 19.7 | CH2 | + | H-1a |
| 3 | 162.9 | 162.7 | C | H-1b, H-19 | |
| 4** | 125.2 | 120.5 | C | - | |
| 5** | 40.9 | 27.0 | CH | + | H-1a, H-1b, H-6, H-7, H-20 |
| 6** | 19.6 | 22.7 | CH2 | + | - |
| 7** | 22.7 | 18.2 | CH2 | + | H-5 |
| 8** | 120.5 | 143.9 | C | H-11, -OH | |
| 9** | 143.9 | 130.9 | C | H-1b, H-7, H-12, H-20 | |
| 10 | 36.2 | 36.2 | C | H-1a, H-1b, H-6, H-11, H-20 | |
| 11 | 116.3 | 116.3 | CH | + | - |
| 12 | 123.4 | 123.4 | CH | + | - |
| 13** | 131.0 | 125.2 | C | H-16, H-17, H-11, -OH | |
| 14 | 150.8 | 150.7 | C | H-12, H-7 | |
| 15** | 27.0 | 40.9 | CH | + | H-12, H-16, H-17 |
| 16 | 22.5 | 22.5 | CH3 | + | H-15 |
| 17 | 22.5 | 22.5 | CH3 | + | H-15 |
| 18** | 174.2 | 70.5 | C | H-2b | |
| 19** | 70.5 | 174.1 | CH2 | + | - |
| 20 | 22.4 | 22.3 | CH3 | + | H-1a, H-1b, H-11 |
| **为文献[5]中归属错误的13C NMR信号 | |||||
通过NMR谱图分析确定了雷酚内酯对照品结构为图 1(a)所示,与文献[1-3, 5]报道结构一致.由DEPT、1H-13C HSQC和1H-13C HMBC谱修正和补充了文献[1, 4, 5]中雷酚内酯1H和13C NMR数据.以上分析结果确证了雷酚内酯对照品的化学结构,为含雷酚内酯药物的质量控制奠定了基础.
| [1] | DENG F X(邓福孝), ZHOU B N(周炳南), SONG G Q(宋国强), et al. Research fromTripterygium Wilfordii Hook. F.(雷公藤化学成分的研究Ⅲ.两种新二萜内酯--雷酚内酯甲醚和雷酚新内酯的分离及结构)[J]. Acta Pharmaceutica Sinica(药学学报), 1982, 17(2): 146-150 |
| [2] | XU B(徐斌), DU J O(杜俊鸥). Study on polarographic catalytic wave of triptophenolide(雷酚内酯的极谱催化波研究)[J]. Chinese Journal of Analysis Laboratory(分析试验室), 2005, 24(4): 49-52 |
| [3] | FAN X W(樊希望), LIU L H(刘力恒), WEI W X(韦万兴), et al. One stereoisomer of triptophenolide isolated from Tripterygium Wilfordii Hook. F. by high-speed countercurrent chromatography(高速逆流色谱分离雷公藤中的雷酚内酯异构体)[J]. Natural Product Research and Development(天然产物研究与开发), 2011, 23(6): 1049-1051 |
| [4] | YU D F(于东防), HU B H(胡邦豪), CHEN G P(陈国平), et al. Structure cture revision of Triptophenolide(雷酚内酯的结构修正)[J]. Acta Pharmaceutica Sinica(药学学报), 1990, 25(12): 929-931 |
| [5] | LIU Z Z(刘珍珍), ZHAO R H(赵荣华), ZOU Z M(邹忠梅). Chemical constituent root bark of Tripterygium hypoglaucum(昆明山海棠根皮化学成分的研究)[J]. China J Chinese Materia Modica(中国中药杂志), 2011, 36(18): 2503-2506 |
| [6] | XUE J(薛璟), JIA X B(贾晓斌), CHEN Y(陈彦), et al. Chemical constituents of Tripterygium wilfordii Hook.f and its toxicity(雷公藤化学成分及其毒性研究进展)[J]. China J Traditional Chinese Medicine and Pharmacy(中华中医药杂志), 2010, 25(5): 726-733 |

本作品采用知识共享署名 4.0 国际许可协议进行许可。
 2017, Vol. 34
2017, Vol. 34



