文章信息
- 李英俊, 李继阳, 靳焜, 曹欣
- LI Ying-jun, LI Ji-yang, JIN Kun, CAO Xin
- 含苯并咪唑环N-酰腙衍生物的NMR研究
- An NMR Study of a Novel N-Acylhydrazone Derivative Containing Benzimidazole Moiety
- 波谱学杂志, 2017, 34(1): 25-34
- Chinese Journal of Magnetic Resonance, 2017, 34(1): 25-34
- http://dx.doi.org/10.11938/cjmr20170104
-
文章历史
收稿日期: 2016-08-05
收修改稿日期: 2017-01-04


DOI:10.11938/cjmr20170104
2. 大连理工大学 精细化工国家重点实验室, 辽宁 大连 116023
2. State Key Laboratory of Fine Chemicals, Dalian University of Technology, Dalian 116023, China
近年来,许多含酰腙骨架(-CONHN=)的N-酰腙(NAH)化合物因可产生许多生物活性,如抗肿瘤[1-4]、抗糖尿病[5]、抗血栓[6]、抗病毒[7]、止痛抗炎[8]、抗结核[9]和抗HIV[10]等而引起了人们极大的关注.而含苯并咪唑(BZM)环的衍生物也表现出多种生物活性,如抗癌、抗增殖、抗肿瘤、抗糖尿病、抗炎、抗菌、抗病毒、抗氧化和杀虫等[11].若将苯并咪唑和酰腙骨架这两个药效团聚集在同一分子中,所形成的新分子有望进一步改善和拓宽上述两类化合物的生物活性.本课题组在前期工作[12-14]基础上,设计并合成了一个新化合物1,即N'-[(4-N, N-二甲基) 苯基]亚甲基-2-(4-甲基苯氧甲基) 苯并咪唑-1-乙酰肼(化学结构见图 1).本文利用元素分析、红外光谱和多种核磁共振(NMR)技术(包括1H NMR、13C NMR、1H-1H COSY、NOESY、1H-13C HSQC、1H-13C HMBC及变温1H NMR技术)确定了新化合物1的结构,对其两种异构体[A(E/cis) 和B(E/trans)]的1H和13C NMR信号进行了全归属,给出了相应的偶合常数(J值),分析了异构体所占的比例.NMR分析结果表明,在DMSO-d6中,E/cis异构体含量为74.2%,而E/trans异构体的含量为25.8%.本文的研究结果对此类化合物1H和13C NMR信号的归属以及其结构与活性关系的研究具有重要意义.

|
| 图 1 N'-[(4-N,N-二甲基)苯基]亚甲基-2-(4-甲基苯氧甲基)苯并咪唑-1-乙酰肼(新化合物1)的化学结构 Fig. 1 Chemical structure of 2-[2-(4-methylphenoxymethyl)-1H-benzimidazol-1-yl]-N'-{[4-(dimetilamino)phenyl]methylene}acetohydrazide (new compound 1) |
1H NMR、13C NMR、1H-1H COSY、NOESY、1H-13C HSQC和1H-13C HMBC实验均在Bruker 500型超导NMR谱仪上完成; 变温1H NMR谱实验均在Bruker 400型超导NMR谱仪上完成; 红外光谱从德国TENSOR 27型红外分光光度计上获得, KBr压片; 元素分析在德国Elementar公司Vario EL Ⅲ元素分析仪上完成.DMSO-d6(氘代率为99.9%, CIL, 含0.03% TMS) 购自北京恒思锐科贸有限公司.
1.2 NMR实验样品新化合物1溶于DMSO-d6,以TMS为内标.实验温度为297.5 K,1H和13C NMR的工作频率分别为500.03 MHz和125.73 MHz,谱宽分别为10 330.6 Hz和29 761.9 Hz.变温1H NMR谱的测试温度分别为298.15 K和363.15 K,NMR的工作频率均为400.21 MHz,谱宽均为10 000.0 Hz.2D NMR(1H-1H COSY、NOESY、1H-13C HSQC和1H-13C HMBC)实验均采用标准脉冲序列.1H-1H COSY的F2(1H)和F1(1H)维谱宽均为6 097.6 Hz,采样数据点阵为t2×t1=2 048×256;NOESY的F2(1H)和F1(1H)维谱宽均为6 024.1 Hz,混合时间为0.8 s,采样数据点阵为t2×t1=2 048×256;1H-13C HSQC的F2(1H)和F1(13C)维谱宽分别为6 097.6 Hz和20 827.8 Hz,采样数据点阵为t2×t1=2 048×256;1H-13C HMBC的F2(1H)和F1(13C)维谱宽分别为6 097.6 Hz和27 927.4 Hz,采样数据点阵为t2×t1=2 048×256.
2 结果与讨论 2.1 新化合物1的元素分析和红外光谱分析元素分析C26H27N5O2,理论值(%)为C 70.73、H 6.16、N 15.86;实测值(%)为C 70.90、H 6.39、N 15.75.
红外光谱(KBr, cm-1):3 200(vNH),3 062(v=CH),2 940和2 861(vC-H),1 691(vC=O),1 609(vC=N),1 603、1 507和1 468(vC=C),1 231和1 182(vC-O).
元素分析和红外光谱数据初步验证了此化合物的结构.
2.2 新化合物1的NMR谱分析在本研究中,以DMSO-d6作为溶剂测得了新化合物1的1H NMR谱(图 2).观察它的1H NMR谱发现,高场区[图 2(b)]-CH2-和-CH3质子信号峰的数目以及低场区[图 2(c)]-NH-和-CH=N质子信号峰的数目均大于理论数目,并且是成对出现的.同样,新化合物1的13C NMR谱(图 3)也有谱线增多的现象.这说明目标化合物可能存在着两种异构体A和B.
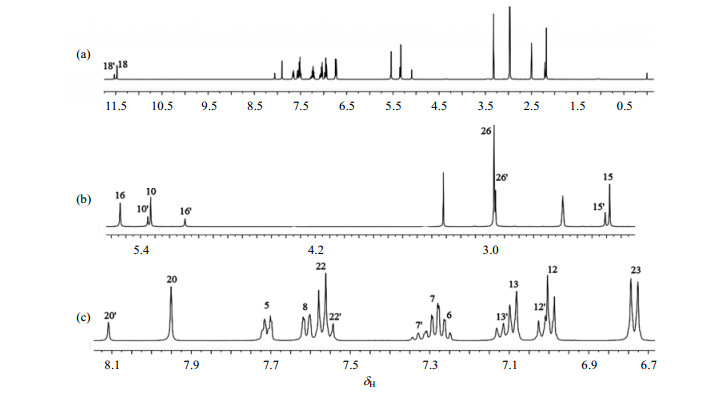
|
| 图 2 新化合物1的1H NMR谱. (a) 为全图,(b) 和(c) 分别为(a) 中高场和低场区的放大图 Fig. 2 (a) Full 1H NMR spectrum of compound 1, (b) Partial 1H NMR spectrum of compound 1 (dH 2.0~5.6), (c) Partial 1H NMR spectrum of new compound 1 (δH 6.7~8.1) |
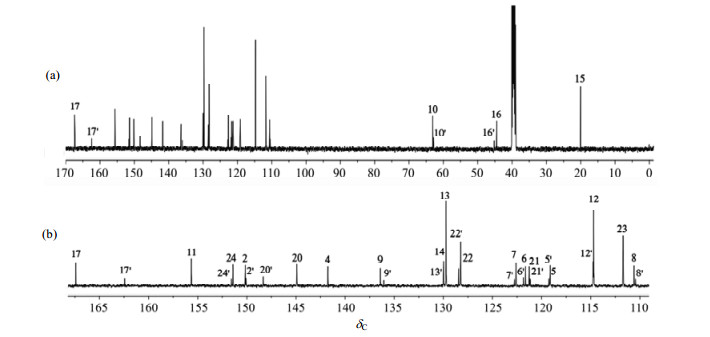
|
| 图 3 新化合物1的13C NMR谱,(a) 全图,(b) 局部放大谱图 Fig. 3 Full (a) and partial (δC 110~170) (b) 13C NMR spectra of new compound 1 |
根据文献[12, 15-17]可知,N-酰腙类化合物存在关于C=N双键的E/Z几何异构体及关于-CONH-基团的cis/trans构象异构体(图 4).含有亚胺键的化合物在极性较大的溶剂中(如DMSO-d6),C=N双键主要以E异构体的形式存在,而-CONH-基团在cis/trans旋转异构体之间相互转化,存在着cis/trans两种形式的构象异构体[15],即发生图 4中的Ⅰ和Ⅲ之间的转化.所以,新化合物1的1H和13C NMR谱的谱线有增多的现象.
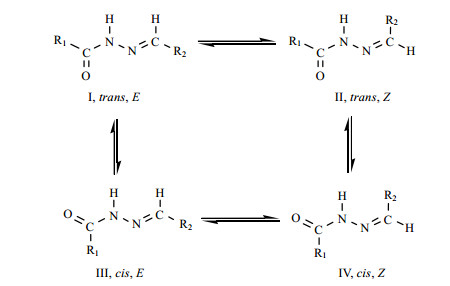
|
| 图 4 N-酰腙类化合物的E/Z几何异构体和cis/trans构象异构体 Fig. 4 E/Z geometrical isomer and cis/trans amid conformer of N-acylhydrazones |
为了证明新化合物1在DMSO-d6中存在着E/cis和E/trans两种形式的构象异构体,本文利用1H NMR、13C NMR、1H-1H COSY、NOESY、1H-13C HMBC、1H-13C HSQC以及变温1H NMR技术对新化合物1进行了1H和13C NMR谱峰归属.为了便于谱峰的归属,将新化合物1两种异构体(A和B)的相关原子进行编号(图 5).
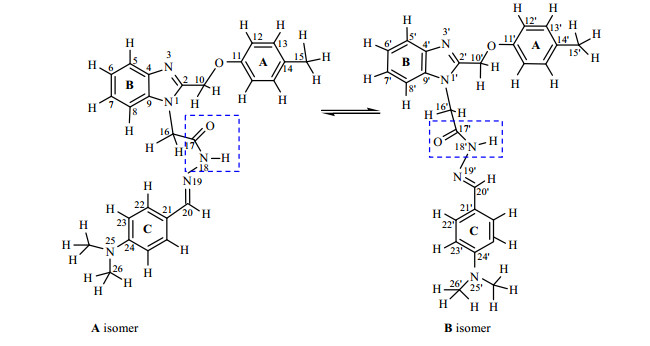
|
| 图 5 新化合物1的两种异构体A和B的结构及原子编号.方框所示部位为两种异构体区别较大的地方 Fig. 5 tructures and atomic labels for isomer A and B of new compound 1. The largest difference of A and B was displayed in the box |
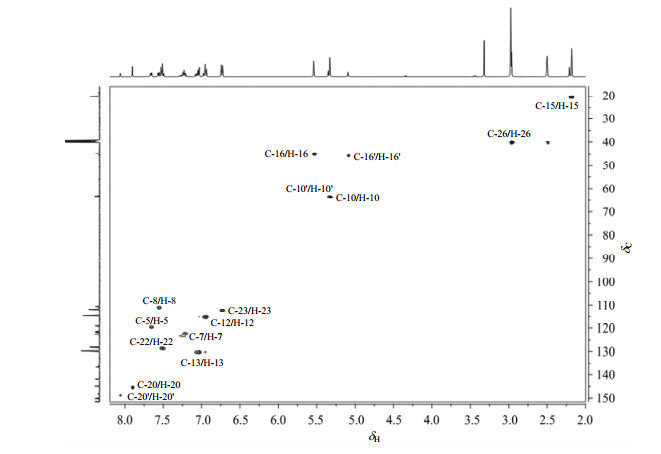
根据1H NMR谱(图 2)可知,高场区[图 2(b)]δH 2.18和δH 2.97处的峰可直接归属为H-15与H-26.再根据HSQC谱(图 6)即可确定相应的C-15(δC 20.0)和C-26(δC 39.7).由HSQC谱可知,除了C-15/H-15、C-26/H-26存在交叉峰外,C-15还与δH 2.21存在交叉峰,C-26还与δH 2.96存在交叉峰,所以δH 2.21和δH 2.96可分别归属为H-15'和H-26'.根据13C NMR谱(图 3)可知,δC 167.4和δC 162.4可直接归属为C-17和C-17'.由HMBC谱(图 7)可以看出,C-17(δC 167.4)与δH 5.54和δH 11.48、C-17'(δC 162.4)与δH 5.09和δH11.53存在着长程相关,根据化学位移和积分面积,δH 5.54和δH 11.48可分别归属为H-16和H-18,δH 5.09和δH11.53分别归属为H-16'和H-18'.再根据HSQC谱,即可分别归属出C-16(δC 44.5)和C-16'(δC 45.2).图 2(b)中δH 5.33和δH5.35处的峰即可直接归属为H-10和H-10'.由HSQC谱即可归属C-10(δC 63.1)和C-10'(δC 62.9).由HMBC谱可知,H-16(δH 5.54)与δC 150.2和δC 136.4、H-16'(δH 5.09)与δC 150.1和δC 136.1存在着远程耦合,所以δC 150.2和δC 136.4可归属为C-2和C-9,δC 150.1和δC 136.1归属为C-2'和C-9'.至此,低场的质子信号δH 11.48(H-18)和δH 11.53(H-18')、碳原子信号δC 167.4(C-17)和δC 162.4(C-17'),高场的-CH2-和-CH3质子及其相应的碳原子信号以及季碳δC 150.2(C-2)、δC150.1(C-2')和δC 136.4(C-9)、δC136.1(C-9')得到了归属.
|
| 图 6 新化合物1的1H-13C HSQC谱 Fig. 6 1H-13C HSQC spectrum of new compound 1 |

|
| 图 7 新化合物1的1H-13C HMBC谱,(a) 为全图,(b) 为部分放大图 Fig. 7 Full (a) and partial expanded (b) 1H-13C HMBC spectra of new compound 1 |
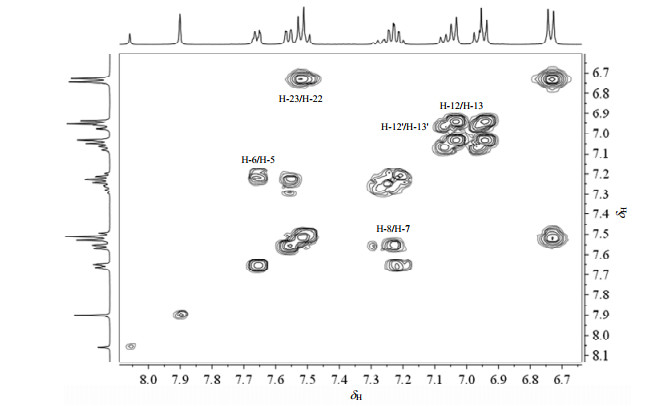
A环的归属:由HMBC谱可知,H-10(δH 5.33)和H-10'(δH5.35)与δC 155.6存在远程偶合,则δC 155.6归属为C-11,δC 155.6与δH 7.04和δH 7.07存在着远程偶合,因此δH 7.04和δH 7.07分别归属为H-13和H-13'.在1H-1H COSY谱(图 8)中,H-13和H-13'与δH 6.95和δH 6.97存在交叉峰,则δH 6.95和δH 6.97分别归属为H-12和H-12'.由HMBC谱可看出,H-12与δC 130.0存在着相关峰,所以δC 130.0为C-14.由HSQC谱,可确定出C-12(δC 114.7)和C-12'(δC 114.8)及C-13(δC 129.7)和C-13'(δC 130.0).
|
| 图 8 新化合物1的1H-1H COSY谱 Fig. 8 Partial 1H-1H COSY spectrum of new compound 1 |
B环的归属:由HMBC谱可知,C-9(δC 136.4)与δH 7.66和δH 7.24存在着长程相关,则δH 7.66和δH 7.24归属为H-5和H-7.通过1H-1H COSY谱可看出,H-5与δH 7.21、H-7与δH 7.56存在交叉峰,则δH 7.21和δH 7.56分别归属为H-6和H-8.在HMBC谱中,H-8与δC 141.7存在长程相关,所以δC 141.7归属为C-4.再根据HSQC谱,可确定出C-5(δC 119.1)、C-6(δC 121.6)、C-7(δC 122.6)、C-8(δC 110.6).根据1H NMR中H-5、H-6和H-8的吸收峰面积可知,H-5'、H-6'和H-8'分别与H-5、H-6和H-8的吸收峰重叠,因此H-5'与H-5、H-6'与H-6、H-8'与H-8的化学位移相同.同理,根据HMBC和HSQC谱可归属出H-7'(δH 7.28)、C-5'(δC 119.3)、C-6'(δC 121.8)、C-7'(δC 122.8)和C-8'(δC 110.4).由于H-6'与H-6及H-8'与H-8吸收峰重叠,所以在HMBC谱上没有观察到它们与C-4'的交叉峰.
C环的归属:由HMBC谱可知,H-18(δH 11.48)与δC 144.9、δC 144.9与δH 7.52、δH 7.52与δC 151.4存在远程耦合,所以δC 144.9、δH 7.52和δC 151.4被分别归属为C-20、H-22和C-24.此外,H-18'(δH 11.53)与δC 148.3、δC 148.3与δH 7.50、δH 7.50与δC 151.6存在长程相关,则δC 148.3为C-20'、δH 7.50为H-22'、δC 151.6为C-24'.再根据1H-1H COSY谱和HSQC谱,可确定出H-23(δH 6.74)、C-23(δC 111.7)、H-20(δH 7.90)、C-22(δC 128.2)、H-20'(δH 8.06)、C-22'(δC 128.5).最后,由HMBC谱可知,H-23与δC 121.3和δC 121.2存在长程相关,则δC 121.3和δC 121.2被分别归属为C-21和C-21'.
至此,新化合物1的两个异构体A和B的1H和13C NMR信号归属完毕(表 1).
| Position | δC** | δH (J/Hz) | HSQC | COSY | HMBC | NOESY | |||
| A | B | A | B | ||||||
| 1 (1') | / | / | / | / | / | / | / | / | |
| 2 (2') | 150.2 | 150.1 | / | / | / | / | / | / | |
| 3 (3') | / | / | / | / | / | / | / | / | |
| 4 (4') | 141.7 | - | / | / | / | / | H-6, 8 (-) | / | |
| 5 (5') | 119.1 | 119.3 | 7.66 (d, J=7.0 Hz) | - | +(-) | H-6 (-) | H-7 (-) | / | |
| 6 (6') | 121.6 | 121.8 | 7.21 (td, J=7.6, 1.3 Hz) | - | +(-) | H-5, 7 (-) | H-8 (-) | / | |
| 7 (7') | 122.6 | 122.8 | 7.24 (td, J=7.5, 1.3 Hz) | 7.28 (td, J=7.0, 0.5 Hz) | +(+) | H-6, 8 (-) | H-5 (-) | / | |
| 8 (8') | 110.6 | 110.4 | 7.56 (dd, J=7.0, 1.0 Hz) | 7.56 (dd, J=7.0, 1.0 Hz) | +(-) | H-7 (-) | H-6 (-) | H-16 (-) | |
| 9 (9') | 136.4 | 136.1 | / | / | / | / | H-5, 7, 16 (-) | / | |
| 10 (10') | 63.1 | 62.9 | 5.33 | 5.35 | +(+) | / | / | H-12 (H-12') | |
| 11 (11') | 155.6 | - | / | / | / | / | H-10, 13 (-) | / | |
| 12 (12') | 114.7 | 114.8 | 6.95 (d, J=9.0 Hz) | 6.97 (d, J=8.5 Hz) | +(+) | H-13 (H-13') | / | H-10 (-) | |
| 13 (13') | 129.7 | 130.0 | 7.04 (d, J=8.5 Hz) | 7.07 (d, J=8.5 Hz) | +(+) | H-12 (H-12') | H-15 (-) | H-15 (H-15') | |
| 14 (14') | 130.0 | - | / | / | / | / | H-12 (-) | / | |
| 15 (15') | 20.0 | - | 2.18 | 2.21 | +(-) | / | H-13 (-) | H-13 (H-13') | |
| 16 (16') | 44.5 | 45.2 | 5.54 | 5.09 | +(+) | / | H-18 (-) | H-8 (H-8') | |
| 17 (17') | 167.4 | 162.4 | / | / | / | / | H-16, 18 (-) | / | |
| 18 (18') | / | / | 11.48 | 11.53 | / | / | / | H-20 (H-20') | |
| 19 (19') | / | / | / | / | / | / | / | / | |
| 20 (20') | 144.9 | 148.3 | 7.90 | 8.06 | +(+) | / | H-22 (H-22') | H-18 (H-18') | |
| 21 (21') | 121.3 | 121.2 | / | / | / | / | H-23 (-) | / | |
| 22 (22') | 128.2 | 128.5 | 7.52 (d, J=9.0 Hz) | 7.50 (d, J=9.0 Hz) | +(+) | H-23 (-) | H-20 (H-20') | / | |
| 23 (23') | 111.7 | - | 6.74 (d, J=9.0 Hz) | - | +(-) | H-22 (-) | H-26 (-) | H-26 (-) | |
| 24 (24') | 151.4 | 151.6 | / | / | / | / | H-22 (H-22') H-26 (H-26') | / | |
| 25 (25') | / | / | / | / | / | / | / | / | |
| 26 (26') | 39.7 | - | 2.97 | 2.96 | +(-) | / | / | H-23 (-) | |
| “/”表示没有信号峰;“-”表示应该有信号峰,但图中未观察到.Position、HSQC、COSY、HMBC和NOESY五栏中括号外表示异构体A的信息,括号内表示异构体B的信息. | |||||||||
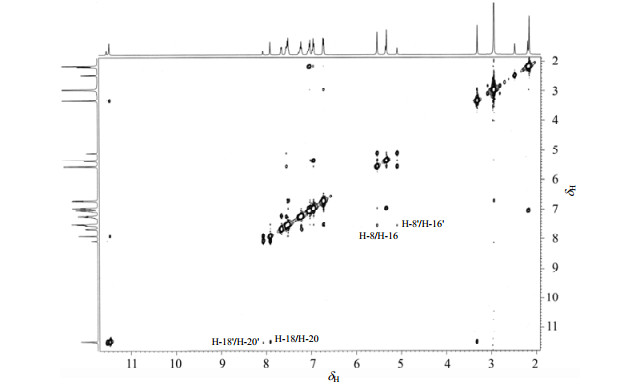
NOESY谱对于确定化合物的结构、构型和构象非常有效[18, 19].为了确定两种异构体A和B的空间结构,测试了NOESY谱(图 9).由NOESY谱可知:H-8与H-16、H-18与H-20存在着交叉峰,这说明H-8与H-16、H-18与H-20空间上距离也较近,应在同一侧.因H-16与H-18无交叉峰,说明H-16与H-18空间上距离较远,它们不在同一侧.由1H NMR谱图可以看到,A的信号积分面积大于B,而由文献[15, 16]可知,在DMSO-d6中,E/cis异构体占优势,所以A结构中C=O的氧原子与N-H中的氢原子(H-18)应在同一侧,为E/cis构象;而B则为E/trans构象,所以B结构中C=O中的氧原子与N-H中的氢原子(H-18')在异侧.由NOESY谱,还观察到H-8'与H-16'以及H-18'与H-20'也存在着交叉峰,说明H-8'与H-16'在同一侧,H-18'与H-20'在同一侧.由上述讨论可以确定出新化合物1的A和B两种异构体的空间结构如图 5所示.
|
| 图 9 新化合物1的NOESY谱 Fig. 9 NOESY spectrum of new compound 1 |
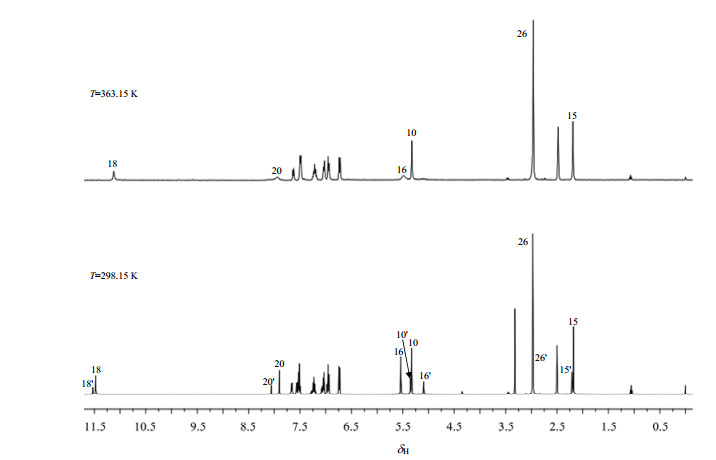
由变温1H NMR谱(图 10)可知:当温度升高至90℃时,H-18与H-18'、H-20与H-20'、H-15与H-15'、H-26与H-26'、H-10与H-10'和H-16与H-16'信号峰分别合并,说明新化合物1是以A(E/cis)和B(E/trans)两种异构体混合物形式存在,A与B是旋转异构体,在室温DMSO中,因酰胺的C (O)-N单键旋转受阻,可以清楚地看到两种异构体的信号峰,但高温时因酰胺C (O)-N单键的快速旋转使它们的信号峰合并.
|
| 图 10 新化合物1的变温1H NMR谱 Fig. 10 1H NMR spectra of new compound 1 at various temperatures in DMSO-d6 |
根据1H NMR谱中H-16与H-16'、H-18与H-18'和H-20与H-20'峰面积的平均值,可求出新化合物1的两种异构体A和B的含量分别为74.2%和25.8%.
3 结论运用1D和2D NMR技术,对新化合物1即苯并咪唑环N-酰腙衍生物的两种异构体(A和B)的1H和13C NMR谱带进行了全归属,确证了它们的立体化学结构及异构体所占的比例.实验结果表明,此新化合物1在DMSO中存在着E/trans和E/cis两种异构体的互变.在室温时,E/cis异构体含量为74.2%,而E/trans异构体的含量为25.8%.
| [1] | DANIEL A R, GUILHERME A F S, ANA C S F, et al. Design, synthesis, and pharmacological evaluation of novel N-acylhydrazone derivatives as potent histone deacetylase 6/8 dual inhibitors[J]. J Med Chem, 2016, 59(2): 655-670 DOI:10.1021/acs.jmedchem.5b01525 |
| [2] | GAO G R, LIU J L, MEI D S, et al. Design, synthesis and biological evaluation of acylhydrazone derivatives as PI3K inhibitors[J]. Chinese Chem Lett, 2015, 26(1): 118-120 DOI:10.1016/j.cclet.2014.10.016 |
| [3] | YU X F, SHI L Q, KE S Y. Acylhydrazone derivatives as potential anticancer agents:Synthesis, bio-evaluation and mechanism of action[J]. Bioorg Med Chem Lett, 2015, 25(24): 5772-5776 DOI:10.1016/j.bmcl.2015.10.069 |
| [4] | CONGIU C, ONNIS V. Synthesis and biological evaluation of novel acylhydrazone derivatives as potential antitumor agents[J]. Bioorg Med Chem, 2013, 21(21): 6592-6599 DOI:10.1016/j.bmc.2013.08.026 |
| [5] | BOUHADIR K H, KOUBEISSI A, MOHSEN F A, et al. Novel carbocyclic nucleoside analogs suppress glomerular mesangial cells proliferation and matrix protein accumulation through ROS-dependent mechanism in the diabetic milieu. Ⅱ. Acylhydrazonefunctionalized pyrimidine[J]. Bioorg Med Chem Lett, 2016, 26(3): 1020-1024 DOI:10.1016/j.bmcl.2015.12.042 |
| [6] | SATHLER P C, LOURENÇO A L L, RODRIGUES C R, et al. In vitro and in vivo analysis of the antithrombotic and toxicological profile of new antiplatelets N-acylhydrazone derivatives and development of nanosystems determination of novel NAH derivatives antiplatelet and nanotechnological approach[J]. Thromb Res, 2014, 134(2): 376-383 DOI:10.1016/j.thromres.2014.05.009 |
| [7] | TIAN B H, HE M Z, TANG S X, et al. Synthesis and antiviral activities of novel acylhydrazone derivatives targeting HIV-1 capsid protein[J]. Bioorg Med Chem Lett, 2009, 19(8): 2162-2167 DOI:10.1016/j.bmcl.2009.02.116 |
| [8] | HERNÁNDEZ P, CABRERA M, LAVAGGI M L, et al. Discovery of new orally effective analgesic and anti-inflammatory hybrid furoxanyl N-acylhydrazone derivatives[J]. Bioorg Med Chem, 2012, 20(6): 2158-2171 DOI:10.1016/j.bmc.2012.01.034 |
| [9] | TAN O U, OZADALI K, YOGEESWARI P, et al. Synthesis and antimycobacterial activities of some new N-acylhydrazone and thiosemicarbazide derivatives of 6-methyl-4, 5-dihydropyridazin-3(2H)-one[J]. Med Chem Res, 2012, 21(7): 2388-2394 |
| [10] | YONEDA J D, ALBUQUERQUE M G, LEAL K Z, et al. Docking of anti-HIV-1 oxoquinoline-acylhydrazone derivatives as potential HSV-1 DNA polymerase inhibitors[J]. J Mol Struct, 2014, 1074(25): 263-270 |
| [11] | YADAV G, GANGULY S. Structure activity relationship (SAR) study of benzimidazole scaffold for different biological activities:A mini-review[J]. Eur J Med Chem, 2015, 97(5): 419-443 |
| [12] | LI Y J(李英俊), WANG Y(王营), JIN K(靳焜), et al. NMR study on 5-aryl-2-furfuraldehyde hydrazones(5-芳基-2-呋喃甲醛腙的NMR谱研究)[J]. Chinese J Magn Reson(波谱学杂志), 2005, 22(1): 7-14 |
| [13] | LI Y J(李英俊), YU Y(于洋), XU Y T(许永廷), et al. Synthesis and characterization of dihydrazide derivatives containing benzimidazole ring(含苯并咪唑环二酰肼衍生物的合成与结构表征)[J]. Chinese J Org Chem(有机化学), 2013, 33(7): 1551-1558 DOI:10.6023/cjoc201301009 |
| [14] | LI Y J(李英俊), LUO T C(罗潼川), XU Y T(许永庭), et al. NMR Spectroscopic Characterization of 2-aryloxymethyl-1H-benzimidazole acetic acid hydrazides(2-芳氧甲基苯并咪唑-1-乙酰肼的NMR谱的表征)[J]. Chinese J Magn Reson(波谱学杂志), 2013, 30(2): 233-246 |
| [15] | ZHOU M Q, EUN Y J, GUZEI I A, et al. Structure-activity studies of divin:an inhibitor of bacterial cell division[J]. Med Chem Lett, 2013, 4(9): 880-885 DOI:10.1021/ml400234x |
| [16] | KAHVECI B, YıLMAZ F, MENTESE E, et al. Microwave-assisted synthesis of some novel benzimidazole derivatives containing imine function and evaluation of their antimicrobial activity[J]. J Heterocycl Chem, 2014, 51(2): 982-990 |
| [17] | BAYRAK H, DEMIRBAS A, KARAOGLU S A, et al. Synthesis of some new 1, 2, 4-triazoles, their mannich and schiff bases and evaluation of their antimicrobial activities[J]. Eur J Med Chem, 2009, 44(3): 1057-1066 DOI:10.1016/j.ejmech.2008.06.019 |
| [18] | CHAI J(柴江), WANG X(王欣), LI H M(李慧敏), et al. A two-dimensional NMR study on steroid glycosides extracted from Trillium tschonoskii(延龄草中2个甾体皂苷的2D NMR研究)[J]. Chinese J Magn Reson(波谱学杂志), 2015, 32(1): 105-115 |
| [19] | JIANG D(姜丹), XU J(徐佳). Stereochemistry and spectral assignment of thebaine derivatives:A 1D NOESY NMR study(一维NOE NMR技术用于蒂巴因衍生物的立体结构研究)[J]. Chinese J Magn Reson(波谱学杂志), 2015, 32(1): 95-104 |

本作品采用知识共享署名 4.0 国际许可协议进行许可。
 2017, Vol. 34
2017, Vol. 34



