文章信息
- 周秋菊, 向俊锋, 唐亚林, 崔洁, 武宁宁
- ZHOU Qiu-ju, XIANG Jun-feng, TANG Ya-lin, CUI Jie, WU Ning-ning
- 纯位移核磁共振氢谱及其应用
- Pure Shift Proton NMR Spectroscopy and Its Applications
- 波谱学杂志, 2016, 33(3): 502-513
- Chinese Journal of Magnetic Resonance, 2016, 33(3): 502-513
- http://dx.doi.org/10.11938/cjmr20160315
-
文章历史
收稿日期: 2015-10-22
收修改稿日期: 2016-07-10


DOI:10.11938/cjmr20160315
2. 中国科学院 化学研究所, 北京 100190;
3. 中国科学院大学, 北京 100049
2. Institute of Chemistry, Chinese Academy Sciences, Beijing 100190, China;
3. University of Chinese Academy of Sciences, Beijing 100049, China
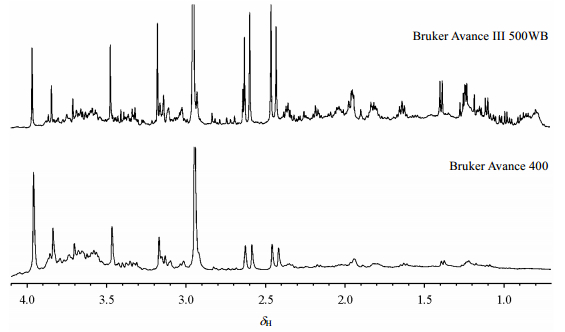
氢核(亦称质子)不仅有很高的天然丰度(高达99.985%),还有很高的旋磁比(γ=2.67×108 rad·s-1·T-1),这使它成为核磁共振(NMR)检测最灵敏的原子核;但是,与其他磁性原子核的NMR谱图相比,1H NMR谱有两个明显缺点:一是谱图分辨率低;二是分子中自旋数目增多时易出现严重的信号重叠现象,尤其是像多糖这类分子中有大量相似结构单元的样品.提升NMR谱仪的磁场强度或者使用多维NMR技术可以在一定程度上改善谱图的分辨率.但是,即使使用磁场强度高达22.3 T的谱仪(质子共振频率为950 MHz),含有数十个质子的化合物的1H NMR信号重叠现象仍然很严重[1];而且,因磁场强度的增加或者超低温探头的发展而提高的检测灵敏度,使生物体液、天然产物等复杂混合物体系中一些低浓度组分的信号也能被检测出来,而低浓度组分信号的出现,会使1H NMR谱图显得更加拥挤(参见图 1,本文除图 1下图使用配备BBO探头的Bruker Avance 400 NMR谱仪采集之外,其他谱图均使用配备BBFO探头的Bruker Avance III 500WB NMR谱仪采集).
|
| 图 1 使用不同场强的核磁共振波谱仪采集的成人尿液核磁共振氢谱局部图 Fig. 1 Partial 1H NMR spectra of adult's urine recorded at two NMR spectrometers |
导致1H NMR信号重叠的因素有两个:质子化学位移范围窄(多集中在δ0~10之间);质子耦合效应导致的信号多重裂分.当分子中化学环境相近的质子数目增加时,后者是引起信号重叠的最主要原因.因此,早在1963年,也即在刚刚出现第一台超导型NMR谱仪(Varian, 220 MHz)[2]之后,Ernst和Primas就开始探索能同时消除所有自旋-自旋耦合的方法[3].当然,直接使用传统的宽带异核去耦技术来实现对氢核的全去耦是行不通的[4].经过13年的努力,Ernst团队终于提出了一种通过间接方式获取全去耦氢谱(纯位移核磁共振氢谱,pure shift 1H NMR spectroscopy)的技术[5],即利用二维J-分辨谱图的特殊投影消除标量耦合.在随后的几十年中,陆续出现了一些获取全去耦氢谱的技术[6-13].不过,这些技术都需要借助于2D NMR实验的间接维、数据处理较为复杂、与传统氢谱相比灵敏度较低,这些缺点限制了它们的应用.当然,多维NMR技术的发展和仪器磁场强度的提高,在一定程度上也降低了波谱学家们获取全去耦氢谱的渴求.但是,自2010年起,基于Klaus Zangger和Heinz Sterk的工作[10],Morris团队在获取纯位移核磁共振氢谱技术研究方面取得了突破性进展[14-20],使全去耦氢谱实验变得更加简单、灵敏度更高、实用性更强;而且,他们通过宽带质子去耦技术得到的核磁共振氢谱的分辨率与超高场仪器(至少是3 GHz或高于3 GHz)所得常规氢谱的理论分辨率相当[16, 21].而自1945年发现NMR现象以来,经过科学家和仪器制造商们近70年的努力,才于2009年诞生一台1 GHz商业化的NMR波谱仪[22].因此,通过纯位移核磁共振氢谱技术来提高氢谱的分辨率要比依赖于仪器磁场强度的提升更为实用.
1 获取纯位移核磁共振氢谱的技术纯位移核磁共振氢谱亦称宽带同核去耦核磁共振氢谱.由于消除了J耦合效应,即分子中磁等价质子因邻近质子J耦合作用导致的多重裂分信号融合成一个单峰、且单峰所处位置为该质子的化学位移,所以纯位移核磁共振氢谱只包含化学位移信息.多重裂分信号在普通氢谱中分布可达数十个赫兹(Hz),而纯位移氢谱的信号只有一个共振信号的宽度(通常在2 Hz左右),因此,正如图 2(实验参数见表 1)所示,纯位移氢谱与传统氢谱相比分辨率有显著提高;而且,由于多重裂分融合成一个单峰时,单峰强度是多重裂分信号强度的加和,这在一定程度上弥补了纯位移技术检测灵敏度较低的缺点.
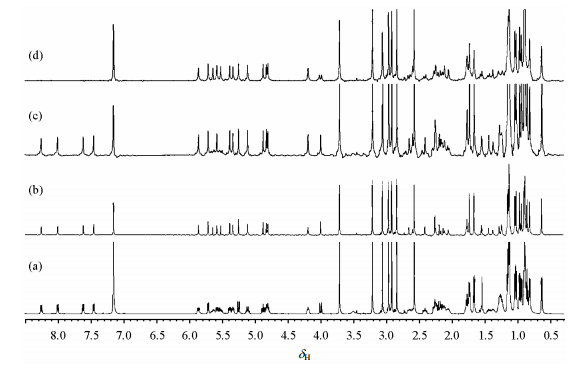
|
| 图 2 采用常规氢谱技术和3种同核去耦技术采集的25 mmol/L环孢霉素A氘代苯溶液的核磁共振氢谱. (a)常规氢谱;(b) PSYCHE氢谱;(c) ZS去耦氢谱;(d) BIRD去耦氢谱.脉冲序列分别采用:(a) zg30, (b) reset_psyche_1d, (c) zg_zshd, (d) zg_bbhd(脉冲序列代码源自于Bruker Topspin Version 3.5) Fig. 2 1H NMR spectra of cyclosporine A dissolved in C6D6 (25 mmol/L) recorded by using four different pulse sequences: (a) zg30, (b) reset_psyche_1d, (c) zg_zshd, (d) zg_bbhd (The name of pulse sequences are copied from Bruker Topspin Version 3.5) |
| 去耦序列 | BIRD | ZS | PSYCHE | |
| 等待时间 | 2 s | 2 s | 2 s | |
| 累加次数 | 512 | 512 | 32 | |
| 空扫次数 | 16 | 4 | 4 | |
| 中心频率 | 2500 Hz | 2500 Hz | 2500 Hz | |
| 谱宽 | 6000 Hz | 6000 Hz | 6000 Hz | |
| 采样点数 | 8192 | 8192 | 6144 | |
| 检测通道 | channel1: 1H channel2: 13C | channel1: 1H | channel1: 1H | |
| 选择性脉冲(及脉宽) | SPNAM30: Bip720, 50, 20, 1 (p44: 332.800 ms) SPNAM36: Gaus1_180r.1000 (p48: 10123.65 ms) | SPNAM30: Bip720, 50, 20, 1 (p44: 240 ms) SPNAM37: Crp_psyche.20 (p48: 30000 ms) | ||
| 梯度通道 | GPNAM0 | RECT.1 | RECT.1 | |
| GPNAM1 | SMSQ10.100 | SMSQ10.100 | SMSQ10.100 | |
| GPNAM2 | SMSQ10.100 | SMSQ10.100 | ||
| GPNAM3 | SMSQ10.100 | SMSQ10.100 | ||
| GPNAM4 | SMSQ10.50 | |||
| GPNAM5 | SMSQ10.50 |
获取纯位移核磁共振氢谱的方法有很多[21, 23-26],如J-分辨去耦[5]、恒时去耦[6]、时间反转去耦[7]、BIRD[8, 9]去耦、ZS去耦[10, 25-28]、Anti z-COSY去耦[11, 12]、Pell-Keeler去耦[13]、PSYCHE去耦[18]等.考虑到已有较全面的相关综述[21, 23]报道,本文只对BIRD、ZS、PSYCHE这三种颇受关注的技术进行综述.这三种方法共同特点是:在检测时,样品中都只有一部分质子的NMR信号是需要被记录的,而还有一部分质子的NMR信号是需要被压制的.为了便于叙述,我们将前者称作“活性质子”,后者称作“惰性质子”、不过使用不同的技术,活性质子和惰性质子分别有不同的含义.
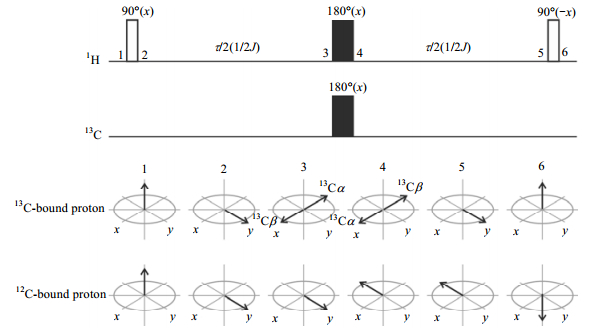
1.1 BIRD序列Garbow等人[8, 9]于1982年首次报道了双线性转动去耦(bilinear rotational decoupling,BIRD)技术.该技术将样品中与碳原子键合质子分成两类:第一类是与13C核键合的质子,去耦谱中观测的信号属于这类质子,即为活性质子;第二类是与12C核键合的质子,这些质子也是引起耦合裂分的质子,去耦谱中这类质子的信号被压制,即为惰性质子.BIRD脉冲单元利用J耦合(1JCH)在这两类质子之间引入180°相位角(参见图 3).BIRD脉冲单元包括4个射频脉冲:首先发射一个90°射频脉冲激发所有质子;在质子演化1/(2×1JCH)的时间后,同时发射两个180°强脉冲分别激发质子和13C核;再等质子演化1/(2×1JCH)的时间后,再发射一个90°射频脉冲激发所有质子.由于异核耦合作用,活性质子在两个演化期内既有化学位移演化,也有异核耦合演化,且在两个同步的180°强脉冲激发时,还感受到来自13C核的180°脉冲作用,因此,在第二个90°脉冲作用之后,惰性质子纵向磁化矢量位于旋转坐标系的z轴负方向,而活性质子纵向磁化矢量则位于旋转坐标系的z轴正方向.等待一个合适的弛豫时间(即等到惰性质子的纵向磁化矢量为0时)再发射90°强脉冲时,只有活性质子被激发,此时得到的谱图即为纯位移去耦氢谱.
由于BIRD去耦技术观测的是与13C核键合的质子,而13C核天然丰度只有1.1%,因而检测灵敏度只有常规氢谱的1.1%;BIRD无法对同碳二氢(即2JHH)去耦,且那些不与碳原子键合的质子在去耦谱中是没有信号的[如图 2(d)的d 7.3~8.5];对于样品中1JCH数值差异较大的样品,去耦灵敏度较低.BIRD技术主要优点是对强耦合体系去耦效果好,且不产生伪信号.BIRD单元能被嵌入到常规HSQC脉冲序列的第三维而得到去耦1H-13C HSQC谱[29],检测灵敏度不会降低,但是采样时间会比常规HSQC长一些,这是BIRD技术另外一个优势.Morris等人[30]将BIRD单元用于DOSY实验,去耦简化了谱图便于分析.最近报道[31]的动态核极化与实时BIRD联用技术—HyperBIRD技术,克服了BIRD去耦技术灵敏度较低的缺点,为纯位移核磁共振技术的发展开创了新起点.
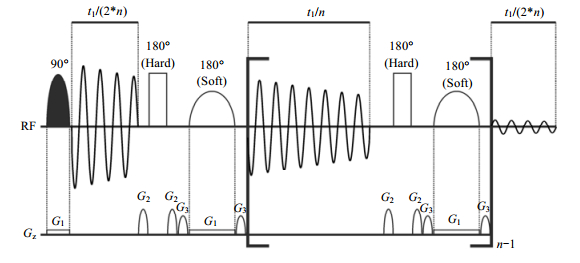
1.2 ZS序列Zangger和Sterk[10]于1997年首次报道了片层选择性去耦方法(Zangger-Sterk,亦称slice-selective decoupling,ZS),该方法灵敏度低、数据处理复杂,实用性并不突出.2013年,Meyer和Zangger[27, 28]报道了第二代ZS技术,其脉冲序列示意图见图 4,标记有G1的实线矩形图标表示弱梯度场G1,黑色半椭圆形图标表示90°射频脉冲,实线矩形图标表示180°硬脉冲,实线半椭圆形图标表示180°选择性软脉冲.G1和90°射频脉冲的共同作用实现片层的选择性激发;180°硬脉冲和G1存在时的180°选择性脉冲的共同作用实现同核去耦.第二代ZS技术(因第一代ZS已被第二代ZS所取代,所以本文中ZS特指第二代ZS)不但克服原有ZS技术的缺陷,而且还能很容易地被嵌入到常规二维和三维同核脉冲序列中,如TOCSY、NOESY,以简化二维谱图、利于谱图解析[27].
同BIRD单元类似,ZS技术也需要将质子分为活性质子和惰性质子两个子集.ZS是通过片层选择性来实现这种分类的,即先用一个弱的线性磁场梯度G1将样品分层,使处于不同片层感受到的磁场强度不同,然后在每一个片层内联合使用弱梯度场存在下的180°选择性脉冲和一个非选择性180°硬脉冲,将该层质子分为活性质子和惰性质子.梯度场G1的大小可根据公式(1)计算.
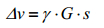 (1)
(1)
其中是谱宽(单位:Hz)、γ是质子的旋磁比(单位:rad·s-1·T-1)、G是梯度场强度(单位:10-4 T·cm-1)、s是检测线圈长度(单位:cm).如果在检测线圈长度为1 cm的500 MHz波谱仪上采集谱宽为5 000 Hz的氢谱,所需梯度场强度为1.17×10-4 T/cm.
每个片层内同核去耦原理与使用组合脉冲实现的对1H去耦13C NMR谱原理类似,即在采集活性质子(如对质子去耦13C NMR谱中的13C核)的信号时,对惰性质子(如对质子去耦13C NMR谱中的质子)进行反转,从而实现同核去耦.在发射选择性脉冲前后,活性质子分别发生标量耦合演化和标量耦合重聚,因此,去耦脉冲应该在演化期中心时刻发射.因为每个被激发的信号来自于样品的一个薄片层,因而,与常规氢谱技术相比,ZS技术灵敏度较低,且取决于选择性脉冲激发的选择性(一般而言,激发带宽为200 Hz、梯度为2×10-4 T·cm-1时,ZS技术的灵敏度为常规氢谱的2.40%[21]).激发带宽取决于相互耦合质子的化学位移之差.如果相互耦合质子的化学位移之差几乎为0,必须使用超高选择性脉冲.激发带宽越窄,灵敏度就越低.所以,ZS技术的实用性受灵敏度限制,对强耦合体系去耦效果不好(参见文献[23]的图 2).
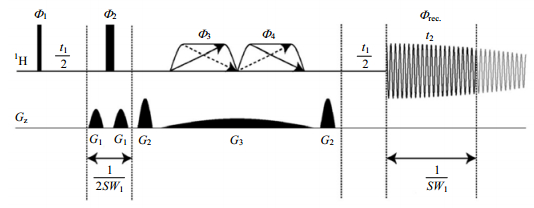
1.3 PSYCHE序列PSYCHE(pure shift yielded by cHirpexcitation)是Morris团队[18]最近才开发出来的、实用性很强的同核宽带去耦技术,脉冲序列示意图见图 5.PSYCHE与anti z-COSY实验相似,只不过,PSYCHE用两个对称的、低功率的、频扫chirp脉冲(Φ3和Φ4)取代了anti z-COSY实验中两个小角度硬脉冲.这种替换使PSYCHE有效地克服了anti z-COSY实验的很多缺点:比如anti z-COSY实验需要较长的最短采样时间和复杂的数据处理;anti z-COSY实验既不能有效地处理非单量子相关转移也不能有效地对强耦合体系去耦[12, 18, 21].
Chirp脉冲是一组扫频小角度(β)脉冲链.两个Chirp脉冲联用的结果是被观测的活性质子在刺激回波处重聚,却不影响惰性质子.而两个Chirp脉冲,再加上一个180°硬脉冲(Φ2)和一个弱磁场梯度脉冲(G3),它们共同作用的结果就是:活性质子的净演化不变,惰性质子被反转,零量子相关和交叉峰相干通路被抑制.根据文献[12]理论推算,这里的活性质子和惰性质子的区分是纯粹统计意义上的数值,活性质子所占比例为cos2β,惰性质子则为2sin2β.统计学区分法要优于空间位置区分法(如ZS方法)和天然丰度极低的异核耦合区分法(如BIRD方法)[23].
2 纯位移核磁共振氢谱的应用 2.1 简化复杂样品的氢谱核磁共振波谱是小分子、中等尺寸有机分子和生物分子结构解析时最常用的工具.对于含有数十个自旋的分子,尤其是不同局部含有相似基团的分子(如多糖、复合物、脂质体、芳香族化学物、寡聚体、反应混合物等),当它们一维氢谱太复杂而出现模棱两可的结果时,有机化学家和波谱学家会使用COSY和HSQC等二维实验增加分辨率来解决信号重叠的问题.但是,当二维实验结果仍然存在信号重叠时,纯位移技术则能简化谱图以便信号归属和结构指认[28, 32].例如,在360 MHz的仪器上使用ZS去耦技术所得蔗糖分子氢谱能将δ 4.8处两个化学位移仅相差3.6 Hz的羟基信号完全分开[10];分析士的宁及其某个未知降解产物的混合物时,因为士的宁和该降解产物在δ 1.36附近都有一个质子信号,耦合引起的多重裂分使这两个信号宽度接近24 Hz,且裂分相互重叠无法进行准确的信号归属,但是,在500 MHz的仪器上使用纯位移技术,就能够把这两个化学位移相差4 Hz的信号区分开,这使谱图解析变得更加简单[21].
2.2 代谢组学或天然产物粗提物研究高分辨核磁共振氢谱可用于分析尿液或者血浆内内源物质或者药物代谢,因此,可以用于临床生物化学、毒性和药物代谢研究[33].高场仪器11.57 T(质子共振频率为500 MHz)使复杂的生物流体的检测灵敏度和信号分布范围都提高了.但是,即使在这种高场仪器上,生物流体如尿液的谱图(参见图 1)仍然存在严重重叠,δ 0.7~4.0区域尤为明显[33],那些较弱的信号(源自于多重裂分以及低浓度代谢产物信号叠加)曾被认为是化学噪音(即在自由感应衰减中产生的、无法归属的数字化信号)[34].这些低浓度代谢产物又在NMR检测范围之内,由于它们的信号重叠严重,用单脉冲实验只能得到一个很宽的峰轮廓,而且那些代谢产物个体浓度可能接近NMR检测最低极限(当前小于10 nmol/mL),它们无法被灵敏度本就较低的二维NMR技术检测出来.这造成许多内源性代谢物无法进行信号归属;对于某些化学噪音较大的区域,仅凭单脉冲实验是无法进行准确定量分析的.磁场强度越高,分辨率越大,因此更多的信号能被分开,但是,灵敏度的增加也提高了检测最低限,所以,高场强也增加了谱图的复杂程度.因此,化学噪音和低浓度代谢产物引起的问题依然有待解决.
相比于COSY和固相萃取色谱-核磁共振(SPEC-NMR)联用技术,纯位移技术也许能更有效地解决这种由化学噪音和低浓度代谢产物引起的信号重叠问题[33].因为SPEC-NMR需要分离并破坏生物流体;而为获得较好的信噪比,COSY采样时间较长.而使用J-分辨去耦谱就能将血浆样品氢谱化学位移在δ 3~4的复杂重叠完全区分开[33];Williams等人[35]用J-分辨去耦顺利在甲基乙酰辅酶A硫解酶缺乏症患者尿液中检测到2-甲基-3-羟基丁酸酯和甲基巴豆酰甘氨酸这两种标记物;在500 MHz的仪器上使用纯位移技术,能把KG1a(AML cancer model)细胞粗提物在δ 0.5~4.4的重叠信号完全分开[12].
2.3 扩散系数测定NMR是最常用的结构鉴定技术,但是分析混合物时,该方法会受到限制.因为常规核磁共振波谱信号不能把信号分配给各个组分.解决这个问题的方法之一就是使用DOSY技术,可以根据各组分自扩散系数(分子尺寸)对信号进行虚拟分离[30, 36-45].
通过宽带同核去耦消除标量耦合可以克服扩散序谱中信号重叠问题,从而便于提取每一个组分的扩散系数,并进一步准确指认出每一个组分的信号.例如,Larive等人[46]使用2D-J-DOSY技术,将蔗糖在δ 3.5处的三重峰信号从葡萄糖六磷酸盐的多重裂分中提取出来,确保了自扩散系数的准确性;Cobas等人[47]使用二维同核去耦DOSY技术和标准LED-BPPSTE DOSY实验[48]分析了复杂混合物(蔗糖、β-环糊精和SKF-38393盐酸盐)中各组分的自扩散系数,实验结果显示,使用二维同核去耦DOSY实验能更为简单、更为直观地提取各组分的扩散系数;Keeler等人[12]使用antiz-COSY去耦DOSY实验,使奎宁、geraniol和camphene混合物在δ 1~2的重叠信号完全分开,便于准确提取每一个组分的自扩散系数;Morris等人[30]将BIRD单元用于DOSY实验,使用400 MHz仪器就能把2-甲基-1丙醇和2, 3-二甲基-2-丁醇在δ 0.9~2.7的重叠信号完全分开,使信号归属准确无误;Zangger等人[44]开创的空间选择性去耦DOSY技术,不仅适用于简单小分子混合物(乙醇、丙醇、异丙醇、正丁醇、N-甲基单乙醇胺和2-烯丙醇六种醇混合物),能有效地把δ 3.5~4.0和δ 0.8~1.5的重叠信号完全分开,而且还适用于复杂的大分子体系.例如在十二肽(KGGEAAEAEAEK,亦称MT3-多肽)、1-肉豆蔻-sn-甘油-3-磷酸胆碱(MHPC)和各种单体氨基酸混合溶液去耦DOSY谱图中,多数信号重叠被消除,MT3-多肽和MHPC形成的复合物MT3-hp、MHPC、各种单体氨基酸分别处于不同扩散条带.
3 结论到目前为止,纯位移技术主要是针对信号重叠严重的氢谱,也有少数应用于13C均匀标记的大分子碳谱去耦.纯位移去耦原理适用于任何有同核耦合的磁性原子核.近几年开发的第二代纯位移技术,如实验设置简单的BIRD和ZS一维去耦技术,以及灵敏度较高的PSYCHE二维去耦技术,将会受到普通NMR用户的欢迎;而最近报道的动态核极化与实时BIRD的联用技术——HyperBIRD技术,势必会为纯位移核磁共振技术在代谢组学、天然产物、活体波谱等领域的应用提供新思路.
致谢: 感谢国家自然科学基金联合基金项目(U1432250)的支持!感谢奥地利格拉茨大学Klaus Zangger教授和N. Helge Meyer博士、英国曼彻斯特大学Gareth A. Morris教授和布鲁克(北京)科技有限公司工程师吕娟、单璐、高玉波、贾连伟等提供技术咨询和技术支持!| [1] | Hansen P I, Larsen F H, Motawia S M, et al. Structure and hydration of the amylopectin trisaccharide building blocks-Synthesis, NMR, and molecular dynamics[J]. Biopolymers , 2008, 89 (12) : 1 179-1 193 DOI:10.1002/bip.21075 |
| [2] | Emsley J W, Feeney J. Forty years of progress in nuclear magnetic resonance spectroscopy[J]. Prog Nucl Magn Reson Spectrosc , 2007, 50 (4) : 179-198 DOI:10.1016/j.pnmrs.2007.01.002 |
| [3] | Ernst R R, Primas H. Nuclear magnetic resonance with stochastic high-frequency fields-(a simple example to theory of systems with a stochastic hamiltonian)[J]. Helvetica Physica Acta , 1963, 36 (5) : 583 |
| [4] | Shaka A J, Keeler J. Broadband spin decoupling in isotropic liquids[J]. Prog Nucl Magn Reson Spectrosc , 1987, 19 : 47-129 DOI:10.1016/0079-6565(87)80008-0 |
| [5] | Aue W P, Karhan J, Ernst R R. Homonuclear broad band decoupling and two-dimensional J-resolved NMR spectroscopy[J]. J Chem Phys , 1976, 64 (10) : 4 226-4 227 DOI:10.1063/1.431994 |
| [6] | Bax A, Mehlkopf A F, Smidt J. Homonuclear broadband-decoupled absorption spectra, with linewidths which are independent of the transverse relaxation rate[J]. J Magn Reson , 1979, 35 (1) : 167-169 |
| [7] | Soerensen O W, Griesinger C, Ernst R R. Time reversal of the evolution under scalar spin-spin interactions in NMR. Application for.omega.1 decoupling in two-dimensional NOE spectroscopy[J]. J Am Chem Soc , 1985, 107 (25) : 7 778-7 779 DOI:10.1021/ja00311a101 |
| [8] | Garbow J R, Weitekamp D P, Pines A. Bilinear rotation decoupling of homonuclear scalar interactions[J]. Chem Phys Lett , 1982, 93 (5) : 504-509 DOI:10.1016/0009-2614(82)83229-6 |
| [9] | Bax A. Broadband homonuclear decoupling in heteronuclear shift correlation NMR spectroscopy[J]. J Magn Reson , 1983, 53 : 517-520 |
| [10] | Zangger K, Sterk H. Homonuclear broadband-decoupled NMR spectra[J]. J Magn Reson , 1997, 124 (2) : 486-489 DOI:10.1006/jmre.1996.1063 |
| [11] | Oschkinat H, Pastore A, Pfandler P, et al. Two-dimensional correlation of directly and remotely connected transitions by zeta-filtered COSY[J]. J Magn Reson , 1986, 69 (3) : 559-566 |
| [12] | Pell A J, Edden R A E, Keeler J. Broadband proton-decoupled proton spectra[J]. Magn Reson Chem , 2007, 45 (4) : 296-316 DOI:10.1002/(ISSN)1097-458X |
| [13] | Pell A J, Keeler J. Two-dimensional J-spectra with absorption-mode lineshapes[J]. J Magn Reson , 2007, 189 (2) : 293-299 DOI:10.1016/j.jmr.2007.09.002 |
| [14] | AguilarJ A, Nilsson M, Bodenhausen G, et al. Spin echo NMR spectra without J-modulation[J]. Chem Commun , 2012, 48 (6) : 811-813 DOI:10.1039/C1CC16699A |
| [15] | AguilarJ A, Colbourne A A, Cassani J, et al. Decoupling two-dimensional NMR spectroscopy in both dimensions: pure shift NOESY and COSY[J]. Angew Chem Int Edit , 2012, 51 (26) : 6 460-6 463 DOI:10.1002/anie.201108888 |
| [16] | Aguilar J A, Faulkner S, Nilsson M, et al. Pure shift 1H NMR: A resolution of the resolution problem?[J]. Angew Chem Int Edit , 2010, 49 (23) : 3 901-3 903 DOI:10.1002/anie.201001107 |
| [17] | Aguilar J A, Nilsson M, Morris G A. Simple proton spectra from complex spin systems: pure shift NMR spectroscopy using BIRD[J]. Angew Chem Int Edit , 2011, 50 (41) : 9 716-9 717 DOI:10.1002/anie.201103789 |
| [18] | Foroozandeh M, Adams R W, Meharry N J, et al. Ultrahigh-resolution NMR spectroscopy[J]. Angew Chem Int Edit , 2014, 53 (27) : 6 990-6 992 DOI:10.1002/anie.201404111 |
| [19] | Morris G A, Aguilar J A, Evans R, et al. True chemical shift correlation maps: a TOCSY experiment with pure shifts in both dimensions[J]. J Am Chem Soc , 2010, 132 (37) : 12 770-12 772 DOI:10.1021/ja1039715 |
| [20] | Foroozandeh M, Adams R W, Nilsson M, et al. Ultrahigh-resolution total correlation NMR spectroscopy[J]. J Am Chem Soc , 2014, 136 (34) : 11 987-11 869 |
| [21] | Zangger K. Pure shift NMR[J]. Prog Nucl Magn Reson Spectrosc , 2015 (86, 87) : 1-20 |
| [22] | www.bruker.com/products/mr/nmr/magnets/magnets/avance-1000/overview.html[OL]. |
| [23] | Adams R W. Pure Shift NMR Spectroscopy[M]. London: John Wiley & Sons, Ltd., 2014 |
| [24] | Sakhaii P, Haase B, Bermel W, et al. Broadband homodecoupled NMR spectroscopy with enhanced sensitivity[J]. J Magn Reson , 2013, 233 : 92-95 DOI:10.1016/j.jmr.2013.05.008 |
| [25] | Meyer N H, Zangger K. Boosting the resolution of 1H NMR spectra by homonuclear broadband decoupling[J]. Chemphyschem , 2014, 15 (1) : 49-55 DOI:10.1002/cphc.v15.1 |
| [26] | Meyer N H, Zangger K. Viva la Resolución! Enhancing the resolution of 1H NMR spectra by broadband homonuclear decoupling[J]. Synlett , 2014, 25 (7) : 920-927 DOI:10.1055/s-00000083 |
| [27] | Meyer N H, Zangger K. Simplifying proton NMR spectra by instant homonuclear broadband decoupling[J]. Angew Chem Int Edit , 2013, 52 (28) : 7 143-7 146 DOI:10.1002/anie.201300129 |
| [28] | Meyer N H, Zangger K. Enhancing the resolution of multi-dimensional heteronuclear NMR spectra of intrinsically disordered proteins by homonuclear broadband decoupling[J]. Chem Commun , 2014, 50 (12) : 1 488-1 490 DOI:10.1039/C3CC48135B |
| [29] | Sakhaii P, Haase B, Bermel W. Experimental access to HSQC spectra decoupled in all frequency dimensions[J]. J Magn Reson , 2009, 199 (2) : 192-198 DOI:10.1016/j.jmr.2009.04.016 |
| [30] | Nilsson M, Morris G A. Pure shift proton DOSY: Diffusion-ordered 1H spectra without multiplet structure[J]. Chem Commun , 2007, 9 : 933-935 |
| [31] | Donovan K J, Frydman L. HyperBIRD: A sensitivity-enhanced approach to collecting homonuclear-decoupled proton NMR spectra[J]. Angew Chem Int Edit , 2015, 127 (2) : 604-608 DOI:10.1002/ange.v127.2 |
| [32] | Aguilar J A, Nilsson M, Morris G A. Simple proton spectra from complex spin systems: pure shift NMR spectroscopy using BIRD[J]. Angew Chem Int Edit , 2011, 50 (41) : 9 890-9 891 |
| [33] | Foxall P J D, Parkinson J A, Sadler I H, et al. Analysis of biological fluids using 600 MHz proton NMR spectroscopy: Application of homonuclear two-dimensional J-resolved spectroscopy to urine and blood plasma for spectral simplification and assignment[J]. J Pharmaceut Biomed , 1993, 11 (1) : 21-31 DOI:10.1016/0731-7085(93)80145-Q |
| [34] | Wilson I D, Fromson J, Ismail I M, et al. Proton magnetic resonance spectroscopy of human urine: Excretion of 1-(3'-carboxypropyl)-3, 7-dimethylxanthine by man after dosing with oxpentifylline[J]. J Pharmaceut Biomed , 1987, 5 (2) : 157-163 DOI:10.1016/0731-7085(87)80018-3 |
| [35] | Williams S R, Iles R A, Chalmers R A. Spin-echo and two-dimensional 1H nuclear magnetic resonance studies on urinary metabolites from patients with 2-methylacetoacetyl CoA thiolase deficiency[J]. Clin Chim Acta , 1986, 159 (2) : 153-161 DOI:10.1016/0009-8981(86)90048-3 |
| [36] | Tanner J E. Use of the stimulated echo in NMR diffusion studies[J]. J Chem Phys , 1970, 52 (5) : 2 523-2 526 DOI:10.1063/1.1673336 |
| [37] | Morris K F, Johnson C S. Diffusion-ordered two-dimensional nuclear magnetic resonance spectroscopy[J]. J Am Chem Soc , 1992, 114 (8) : 3 139-3 141 DOI:10.1021/ja00034a071 |
| [38] | Lin M F, Shapiro M J, Wareing J R. Screening mixtures by affinity NMR[J]. J Org Chem , 1997, 62 (25) : 8 930-9 931 DOI:10.1021/jo971183j |
| [39] | Lin M F, Shapiro M J, Wareing J R. Diffusion-edited NMR-affinity NMR for direct observation of molecular interactions[J]. J Am Chem Soc , 1997, 119 (22) : 5 249-5 250 DOI:10.1021/ja963654+ |
| [40] | JohnsonJr C S. Diffusion ordered nuclear magnetic resonance spectroscopy: Principles and applications[J]. Prog Nucl Magn Reson Spectrosc , 1999, 34 (3, 4) : 203-256 |
| [41] | Hodge P, Monvisade P, Morris G A, et al. A novel NMR method for screening soluble compound libraries[J]. Chem Commun , 2001, 3 : 239-240 |
| [42] | Zhou Q J, Li L, Xiang J F, et al. Screening potential antitumor agents from natural plant extracts by G-quadruplex recognition and NMR methods[J]. Angew Chem Int Edit , 2008, 47 (30) : 5 590-5 592 DOI:10.1002/anie.v47:30 |
| [43] | Zhou Q J, Li L, Xiang J F, et al. Fast screening and structural elucidation of G-quadruplex ligands from a mixture via G-quadruplex recognition and NMR methods[J]. Biochimie , 2009, 91 (2) : 304-308 DOI:10.1016/j.biochi.2008.10.011 |
| [44] | Glanzer S, Zangger K. Directly decoupled diffusion-ordered NMR spectroscopy for the analysis of compound mixtures[J]. Chemistry , 2014, 20 (35) : 11 171-11 175 DOI:10.1002/chem.201402920 |
| [45] | NilssonM, Gil A M, Delgadillo I, et al. Improving pulse sequences for 3D diffusion-ordered NMR spectroscopy: 2DJ-IDOSY[J]. Anal Chem , 2004, 76 (18) : 5 418-5 422 DOI:10.1021/ac049174f |
| [46] | Lucas L H, Otto W H, Larive C K. The 2D-J-DOSY experiment: Resolving diffusion coefficients in mixtures[J]. J Magn Reson , 2002, 156 (1) : 138-145 DOI:10.1006/jmre.2002.2536 |
| [47] | CobasJC, Martin-Pastor M. A homodecoupled diffusion experiment for the analysis of complex mixtures by NMR[J]. J Magn Reson , 2004, 171 (1) : 20-24 DOI:10.1016/j.jmr.2004.07.016 |
| [48] | Wu D H, Chen A D, Johnson C S. An improved diffusion-ordered spectroscopy experiment incorporating bipolar-gradient pulses[J]. J Magn Reson , 1995, 115 (2) : 260-264 DOI:10.1006/jmra.1995.1176 |
 2016, Vol. 33
2016, Vol. 33