文章信息
- 李成伟, 范东伟, 姜佳岐, 杜国红, 王为民
- LI Cheng-wei, FAN Dong-wei, JIANG Jia-qi, DU Guo-hong, WANG Wei-min
- 核磁共振技术测量生物骨密度的设备及方法
- Measuring Bone Mineral Density with NMR
- 波谱学杂志, 2016, 33(3): 468-478
- Chinese Journal of Magnetic Resonance, 2016, 33(3): 468-478
- http://dx.doi.org/10.11938/cjmr20160312
-
文章历史
收稿日期: 2016-03-15
收修改稿日期: 2016-07-11


DOI:10.11938/cjmr20160312
2. 北京大学首钢医院, 北京 100144;
3. 北京大学第三医院, 北京 100191
2. Shougang Hospital, Peking University, Beijing 100144, China;
3. Peking University Third Hospital, Beijing 100191, China
骨质疏松症多发于中老年女性群体,并伴随多种并发症,会严重降低患者的生活质量甚至威胁患者生命.根据全国老龄办2015年统计数据显示,未来二十年将会是我国人口老龄化急速发展阶段,老年人口将从2.12亿增加到4.18亿.因此骨质疏松症的预防和检测研究非常重要.但是骨质疏松症病程缓慢且无明显病理改变,患者不易察觉,因此如何准确诊断骨质疏松症成为重中之重.
骨形态计量和骨生物力学测量是反映骨质量、骨强度和诊断骨质疏松的准确方法,可以客观反映骨骼微细结构及骨微小损伤.但是该检测方法有创,而且患者多为中老年人群,因此其临床应用受到了限制.目前,骨质疏松症以双能X射线吸收(Dual Energy X-ray Absorptiometry, DEXA)测量的骨密度值(Bone Mineral Density,BMD)作为临床诊断标准.但是利用DEXA方法测得的BMD值在骨质疏松骨折与非骨折病人之间有很大的重叠,有研究[1]表明BMD只能反映60%~70%骨强度的变化.而且DEXA方法具有一定剂量的辐射,且跨时期比较性不好,这在一定程度上限制了它的应用.
近年来核磁共振成像(Magnetic Resonance Imaging,MRI)技术发展迅速,由于其具有对人体无害、精确度高等特点,越来越受到医学领域的重视. MRI技术在骨科中的应用发展尤其迅速,主要应用于骨骼退变性疾病、骨骼创伤、骨肿瘤及骨转移瘤与软组织病变等方面的鉴别与诊断.但是传统MRI技术中仪器回波时间约在毫秒(ms)量级,导致弛豫时间极短的骨组织成分信号不能被检测.近年来对于超短回波时间序列的发展使得测量骨骼中短弛豫组分信号成为可能[2-6].它的主要原理是利用了骨骼中自由水、结合水等与骨骼强度的关系[7-10]. Nyman等人[8]针对皮质骨的研究结论表明,在T2弛豫时间谱上,弛豫较快的部分与骨骼矿物质中的氢核相关,弛豫速度适中的为束缚水,弛豫较慢的为自由水.他们还发现束缚水与骨骼的强度和韧度有关,而自由水与骨骼弹性模型反相关. Fernandez-Seara等人[10]利用可交换水的扩散特性测量了骨骼含水量,发现含水量与矿物质含量反相关. Horch等人[11]采用自由感应衰减(Free Induction Decay,FID)序列对人体皮质骨的核磁共振波谱信号进行了分析,发现骨骼中存在四种明显的质子峰和五种微观解剖结构元.杜江等人[12]将牛股骨皮质骨信号区分为T2弛豫时间较快和T2弛豫时间较慢的两部分,并由此来评价骨骼的孔隙度.其研究成果表明,通过超短回波时间(Ultra-short Echo Time,UTE,指仪器回波时间小于100 ms)序列测量得出的骨骼孔隙度与用微计算机断层扫描技术(Micro-Computed Tomography,Micro-CT)测得的孔隙度相关程度很高[13].
为了缩短回波时间至100 ms以内,之前研究大多数采用梯度回波(Gradient Echo,GE)序列来进行骨组织的测量或者成像.而GE测得的数据为T2,并非真正的骨组织本身的T2弛豫时间.而且磁场的不均匀性会使得T2弛豫衰减加快,因此T2不能准确反映骨骼本身的孔隙结构变化.
之前的相关磁共振技术诊断骨质疏松症的研究中,大都围绕检测骨结构的异常开展工作,忽视了对骨量变化的研究.本文通过改进核磁共振硬件,缩短CPMG测量序列的回波时间,测得骨骼样本的T2弛豫时间谱,不仅能由此测得骨骼组织的BMD数值,更可以从中分析骨骼样本的孔隙结构等特征.核磁共振T2弛豫时间谱能够全面反映样本的骨量情况和骨骼结构特征,在骨质疏松症的诊断和疗效评估中有着良好的应用前景.
1 核磁共振及T2弛豫时间谱基本原理 1.1 核磁共振基本原理核磁共振信号来源于原子核与磁场之间的相互作用,质子数为奇数的原子核(如氢核)能产生核磁共振现象.生物体的有机组织中含有大量的氢核,当用Lamor频率去激发处在磁场中的生物体组织时,可以观察到很强的核磁共振信号.弛豫是核磁共振中极其重要的物理量,它表征磁化矢量在受到射频场的激发下产生核磁共振时,从偏离平衡态到再次恢复到平衡态的过程.核磁共振中有两种作用机制不同的弛豫,分别为T1弛豫和T2弛豫.在回波时间很短的条件下,两种弛豫均能反映骨骼组织的孔隙结构,但T1弛豫时间测量时间更长,故本文采用CPMG序列测量T2弛豫时间[14].
1.2 T2弛豫时间谱反演算法[15]由于骨骼中存在不同大小的孔隙,而不同大小孔隙对应的T2弛豫时间长短不同,因此,本文中测量得到的自旋回波信号是一系列单个孔隙自旋回波信号的叠加,如(1)式所示:
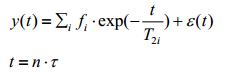 (1)
(1)
fi为第i类孔隙在总孔隙中所占的份额;T2i为第i类孔隙的T2弛豫时间;τ为回波间隔时间,n为回波间隔个数,t为总回波时间长度;ε(t)为随机噪声序列.通过求解出各类孔隙的T2弛豫时间T2i以及各类孔隙在总孔隙中所占的份额fi,即可得到相应的T2弛豫时间谱.
为了求解上述(1)式方程,先构建目标函数(2)式:
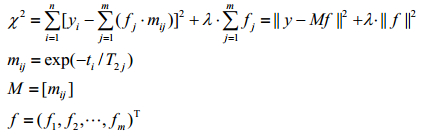 (2)
(2)
mij为时域第i维、空间域第j维的拉普拉斯变换因子;M为mij对应的大小为i×j的变换矩阵;ti为时域第i维对应的时间长度;λ为平滑因子;f为幅度;χ2为相应的目标函数;yi为选取的n维时域中第i维对应的磁共振信号;fj为m维T2空间域中第j维对应的孔隙在总孔隙中所占的份额.对幅度f的第k个分量求极值(k=1, 2, …,m)并使其等于0可得(3)式:
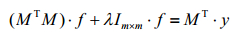 (3)
(3)
为m×m阶单位矩阵;对(3)式作线性变化,令f=MT·c,c为一常数,即可使m维的T2空间域的解变换到n维时域空间来解.将此变换带入(3)式,并选择合适的λ值,即可通过(4)式求出方程(1)式的最小二乘解:
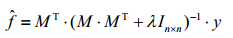 (4)
(4)
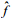
本文采用上述变换反演算法,选取适合的平滑因子λ为0.05、反演时间范围为1~10 000 ms、布点数为100、布点方法采用以10为底的对数(lg)布点方式,进行数学反演处理,得到T2弛豫时间谱.
2 材料与方法 2.1 大鼠股骨BMD值测量大鼠骨骼样本由北京大学医学部试验动物科学部提供,其中所进行的医学试验符合中国《试验动物管理条例》与北京市《试验动物福利伦理审查指南》的要求.取6月龄4只(编号为a1~a4)和12月龄10只(编号为b1~b10)的卵巢摘除的大鼠离体股骨进行试验. 6月龄大鼠体长约20 cm,体重约300 g;12月龄大鼠体长约20 cm,体重约600 g.本文采用美国HOLOGIC公司Discovery A型双能X线骨密度仪测量大鼠骨密度BMD数值.
2.2 骨骼中的T2弛豫时间分布股骨内部为骨小梁组成的多孔结构.骨小梁将骨骼内部空间分割包围,形成形状和大小不一的孔隙,孔隙中央填充脂肪(骨髓),水包覆在脂肪外部并与孔隙表面接触.在外磁场的作用下,骨骼产生核磁共振现象时,孔隙中央填充的脂肪由于扩散系数较小且被限制在孔隙中间位置,因而很少与孔隙表面接触,产生的表面弛豫效应较弱,故其T2弛豫时间比较长,基本不随孔隙大小变化而变化;而脂肪外部包覆的水由于扩散系数较大且与孔隙表面充分接触,故会产生较强烈的表面弛豫现象,从而产生较强烈的T2弛豫.不同大小孔隙中的水分子与孔隙表面接触几率不同,产生的T2弛豫亦不同,因此可以通过测量对于孔隙大小敏感的水分子的质子核磁共振信号来反映骨骼中孔隙的结构特征.由于骨骼组织中存在不同大小的孔隙,不同大小的孔隙的弛豫时间不同,因此核磁共振测量得到的不是一个单一的值,而是在一定范围内的一个分布即T2弛豫时间谱.
根据快扩散表面弛豫模型[16, 17],单个孔隙内的氢核弛豫可用一个弛豫时间来描述,此时T2可表示为
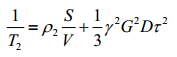 (5)
(5)
D为扩散系数;G为磁场不均匀性,它与磁场强度成正比;τ为回波间隔;为表面弛豫强度;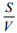
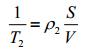 (6)
(6)
从上(6)式可看出,样本中单个孔隙内的T2弛豫时间与该孔隙的比表面积(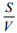
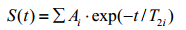 (7)
(7)
其中,S(t)为利用CPMG序列测得的总的核磁共振信号强度;Ai表示弛豫时间为T2i的组份所占的比例,即为与T2i对应的一定孔径的孔隙体积占总孔隙体积的比例.本文采用第1节中所述的方法对(7)式进行数学反演,即可得到相应的T2弛豫时间分布,即T2谱.
2.3 核磁共振谱仪设计本文设计了一台0.5 T核磁共振分析系统用来测量大鼠股骨样本T2弛豫时间谱.如图 1所示,该系统包括计算机控制终端(1)、单板磁共振控制器单元(2)、信号放大及开关控制单元(3)和磁体单元(4)四个组成部分.计算机控制终端用于控制整套设备系统的工作流程,同时接收并处理单板磁共振控制器单元采集的信号,得到T2弛豫时间谱.单板磁共振控制器单元包括频率合成及激励信号发射部分和数字检波及数字信号处理部分,用于产生磁共振序列并采集得到核磁共振信号.本文将多个高度集成的电子芯片集成在单板磁共振控制器电路板上,极大地简化了磁共振设备的结构,使得设备具有良好的便携性和可移动性.信号放大及开关控制单元包括低噪声前置放大器、射频放大器、射频开关和Q-switch开关,用于放大采集到的信号和控制射频线圈的开和关.磁体单元带有一个水平放置的磁体(磁场强度为0.5 T,磁体空气隙为100 mm),探测线圈采用发射接收共用线圈(内径为60 mm).该系统既可用于离体生物骨骼样本测量,也可用于活体生物样本测量,非常适用于生物医学领域的应用.
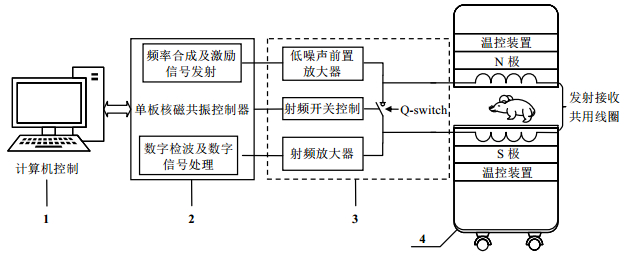
|
| 图 1 大鼠股骨T2弛豫时间核磁共振分析系统 Fig. 1 NMR system for analysis of T2relaxation |
为了缩短设备的回波时间,我们在该核磁共振系统中增加了自行研制的线圈品质因子切换开关(Q-switch),用来实现线圈发射、接收工作状态之间的高速切换,可以将回波时间缩短至100 ms以内,达到超短回波时间(UTE)范围. 图 2为Q-Switch原理图,当线圈Coil处于发射的状态时,射频功率加在LC谐振探头上,MOS管Q1和Q2不导通;当射频功率发射结束时,脉冲使能信号EN_SIG经过驱动芯片TSC4429放大后,通过变压器Transformer同时加到两个MOS管的栅极和源极上,此时MOS打开,漏极与源极之间导通,从而将探头上的射频功率主动释放,使得线圈Coil可以在10 ms内迅速进入接收状态,大大缩短了收发公用线圈在发射和接收两种状态之间切换的时间.试验时采用测量序列为CPMG序列,共振频率为21 MHz,回波时间为80 ms,累加扫描4次,恢复时间为1 000 ms,采样点数为2 048.
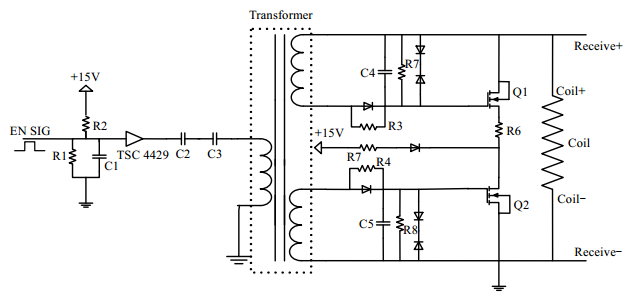
|
| 图 2 Q-switch原理图 Fig. 2 Schematic diagram of Q-switch |
采用CPMG序列,对两组样品进行T2弛豫时间谱测定.对测得信号进行数学反演得到样品对应的T2弛豫时间谱数据.据Joanne等人[18]的研究结果发现,皮质骨的平均T2弛豫时间约在0.4~0.5 ms之间.本文选取处于该值范围的T2弛豫时间谱峰进行数据分析. 图 3给出了6月龄与12月龄大鼠股骨样本T2弛豫时间谱. 图 3结果显示,谱线信号强度及峰值对应的T2弛豫时间有明显变化.
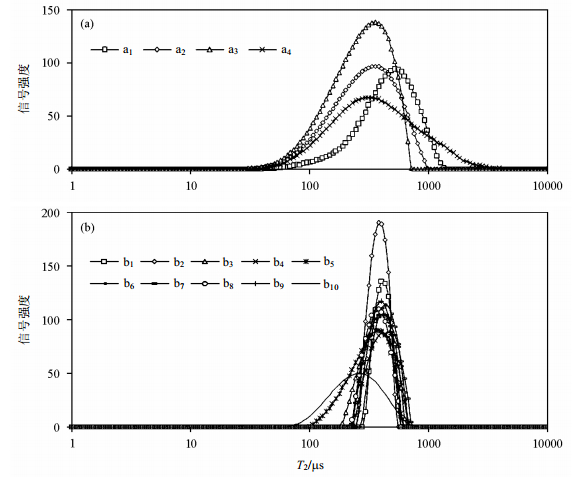
|
| 图 3 (a) 6月龄和(b) 12月龄大鼠股骨T2弛豫时间谱 Fig. 3 T2 relaxation time spectra of (a) six-month and (b) twelve-month rat's femurs |
选取核磁共振试验中测得的T2弛豫时间谱的谱线峰值与DEXA方法测得的BMD值进行比照(结果参见表 1),并对两者进行回归分析(结果如图 4所示).
| No. | Average BMD/(g/cm2) * | T2/ms ** |
| a1 | 0.2546 | 520 |
| a2 | 0.3022 | 360 |
| a3 | 0.3197 | 360 |
| a4 | 0.3328 | 320 |
| b1 | 0.2621 | 450 |
| b2 | 0.2685 | 420 |
| b3 | 0.2691 | 400 |
| b4 | 0.2732 | 420 |
| b5 | 0.2746 | 400 |
| b6 | 0.2801 | 400 |
| b7 | 0.2836 | 390 |
| b8 | 0.2901 | 400 |
| b9 | 0.3016 | 360 |
| b10 | 0.3210 | 340 |
| a: 6月龄大鼠,b: 12月龄大鼠;*通过DEXA方法测得,**通过核磁共振方法测得. | ||
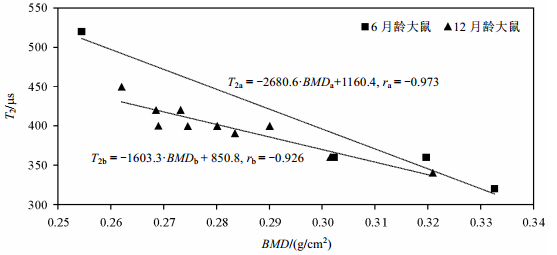
|
| 图 4 大鼠股骨T2弛豫时间与BMD相关性分析 Fig. 4 Correlativity of T2relaxation time and BMD for six-month and twelve-month rats'femurs |
由图 4可以发现,峰值T2弛豫时间与BMD数值呈现负相关,6月龄和12月龄大鼠股骨的相关系数(r)绝对值均大于0.90,表明二者之间相关程度较高.
3.2 讨论骨质疏松症在临床上上表现为利用DEXA方法测得的BMD数值低,从而利用BMD计算得到的临床判别标准T值小于甚至远小于-1[19].虽然骨质疏松症发生时,骨骼宏观结构并未改变,但是活检可以发现骨骼内部孔隙增大,对应到核磁共振T2弛豫时间谱上表现为的T2弛豫时间增长.因此骨骼样本的T2弛豫时间理论上应该与BMD数值负相关.本研究结果表明,峰值T2弛豫时间与BMD之间确实符合负相关特征.其原因是峰值T2弛豫时间代表了骨骼样本中体积比例占最大的特定大小的孔隙,而这部分孔隙也是骨质疏松症产生时变化最明显、最敏感的孔隙组分.
对上述样本的骨密度数值与峰值T2弛豫时间进行线性拟合,可以得出拟合公式(8)式,表 2中给出了两组样本的拟合结果(拟合直线如图 4所示).
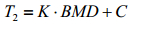 (8)
(8)
| Age group | K/[g/(cm2·ms)] | C/(g/cm2) | r |
| 6 month | -2680.6 | 1160.4 | -0.973 |
| 12 month | -1603.3 | 850.8 | -0.926 |
根据这种关系,可以设计一种利用核磁共振技术测量生物骨密度的新方法.具体测量方案为:
(1)按照年龄、性别、种群等数据划分测量对象为相应小组,对于每一小组选取具有代表性的样本利用DEXA方法测量骨密度BMD数值,并利用本文方法测量相应T2弛豫时间谱;
(2)将测得的BMD数值与相应的峰值T2弛豫时间按上述方法进行处理和进行线性拟合,得到T2与BMD数值之间的关系式;
(3)利用大样本数据对上述公式进行修正,得到相对误差允许范围内的精确斜率和截距;
(4)根据待测对象的年龄、性别、种群等数据将其划入特定小组,然后测量其相应骨骼的T2弛豫时间谱,再根据修正后的关系式计算出BMD数值.
为验证利用上述方法的准确性,选取同一批编号为1~4的12月龄卵巢摘除大鼠离体股骨进行验证实验.首先测量得到4个样本的T2弛豫时间谱,再根据上述实验测得的关系式,计算得出相应的骨密度数据(BMD2,如表 3所示).与利用DEXA方法测得的大鼠股骨骨密度数据(BMD1)比较发现,4个样本BMD计算值与测量值的相对误差均小于5%,可见本方法精度较高,可以替代现有的DEXA方法准确测量骨密度数据.
| No. | BMD1/(g/cm2) | T2/ms | BMD2/(g/cm2) | D/(g/cm2) | D/BMD1/% |
| 1 | 0.2691 | 400 | 0.2811 | 0.0120 | 4.49 |
| 2 | 0.2732 | 420 | 0.2687 | -0.0045 | -1.65 |
| 3 | 0.2955 | 370 | 0.2999 | 0.0044 | 1.48 |
| 4 | 0.3210 | 340 | 0.3186 | -0.0024 | -0.75 |
| BMD1:用DEXA方法测得的BMD数值;BMD2:根据T2与BMD之间的关系计算得到的BMD数值;D:两者差值 | |||||
上述测量方案具有测量速度快、重复性好、无电离辐射、对人体无害,可以反复测量等优点.而且这种方法不仅能够测量得到骨密度数值,还可以根据测得的T2弛豫时间谱,得到骨骼的孔隙大小、孔隙度等数据,从而更全面反映骨骼的结构和功能等相关特征,而这些数据是利用现有的DEXA方法无法测得的.
4 结论本文介绍了一种利用磁共振T2弛豫时间谱测量生物骨组织密度的设备和方法.通过增加线圈品质因子切换开关,将回波时间缩短至UTE范围,实现了骨骼样本中短弛豫时间组分信号的测量并获得来骨骼样本的核磁共振T2弛豫时间谱.通过分析T2弛豫时间谱,发现峰值T2弛豫时间与DEXA方法测得的骨密度之间存在良好线性关系,并据此提出了一种测量骨密度的核磁共振方法.该方法具有无电离辐射、测量速度快、重复性好等优点,在骨质疏松医学诊断中具有良好应用前景.
| [1] | Fanucci E, Manenti G, Masala S, et al. Multiparametercharacterisation of vertebral osteoporosis with 3-T MR[J]. Radiol Med , 2007, 112 (2) : 208-223 DOI:10.1007/s11547-007-0136-6 |
| [2] | Techawiboonwong A, Song H K, Wehrli F W. In vivo MRI of submillisecond T2 species with two-dimensional and three-dimensional radial sequences and applications to the measurement of cortical bone water[J]. NMR Biomed , 2008, 21 (1) : 59-70 DOI:10.1002/(ISSN)1099-1492 |
| [3] | Techawiboonwong A, Song H K, Leonard M B, et al. Cortical bone water: in vivo quantification with ultrashort echo-time MR imaging[J]. Radiology , 2008, 248 (3) : 824-833 DOI:10.1148/radiol.2482071995 |
| [4] | Du J, Carl M, Bydder M, et al. Qualitative and quantitative ultrashort echo time (UTE) imaging of cortical bone[J]. J Magn Reson , 2010, 207 (2) : 304-311 DOI:10.1016/j.jmr.2010.09.013 |
| [5] | Wu Y, Ackerman J L, Chesler D A, et al. Density of organic matrix of native mineralized bone measured by water-and fat-suppressed proton projection MRI[J]. Magn Reson Med , 2003, 50 (1) : 59-68 DOI:10.1002/(ISSN)1522-2594 |
| [6] | Cao H, Ackerman J L, Hrovat M I, et al. Quantitative bone matrix density measurement by water-and fat-suppressed proton projection MRI (WASPI) with polymer calibration phantoms[J]. Magn Reson Med , 2008, 60 (6) : 1 433-1 433 DOI:10.1002/mrm.v60:6 |
| [7] | Ni Q, Nyman J S, Wang X, et al. Assessment of water distribution changes in human cortical bone by nuclear magnetic resonance[J]. Meas Sci Technol , 2007, 18 (3) : 715-723 DOI:10.1088/0957-0233/18/3/022 |
| [8] | Nyman J S, Ni Q, Nicolella D P, Wang X. Measurements of mobile and bound water by nuclear magnetic resonance correlate with mechanical properties of bone[J]. Bone , 2008, 42 (1) : 193-199 DOI:10.1016/j.bone.2007.09.049 |
| [9] | Wang X, Ni Q. Determination of cortical bone porosity and pore size distribution using a low field pulsed NMR approach[J]. J Orthop Res , 2003, 21 (2) : 312-319 DOI:10.1016/S0736-0266(02)00157-2 |
| [10] | Fernandez S, Wehrli S L, Takahashi M, et al. Water content measured by proton-deuteron exchange NMR predicts bone mineral density and mechanical properties[J]. J Bone Miner Res , 2004, 19 (2) : 289-296 |
| [11] | Horch R A, Nyman J S, Gochberg D F, et al. Characterization of 1H NMR signal in human cortical bone for magnetization resonance imaging[J]. Magn Reson Med , 2010, 64 (3) : 680-687 DOI:10.1002/mrm.v64:3 |
| [12] | Reni B, Won B, Eric D, et al. Ultrashort echo time (UTE) imaging with bi-component analysis: Bound and free water evaluation of bovine cortical bone subject to sequential drying[J]. Bone , 2012, 50 (3) : 749-755 DOI:10.1016/j.bone.2011.11.029 |
| [13] | Won C B, Shantanu P, Reni B, et al. Magnetic resonance imaging assessed cortical porosity is highly correlated with μCTporosity[J]. Bone , 2014, 66 : 56-61 DOI:10.1016/j.bone.2014.06.004 |
| [14] | 周小龙, 聂生东, 王远军, 等. 核磁共振二维谱反演技术综述[J]. 波谱学杂志 , 2013, 30 (2) : 293-305 Zhou Xiao-1ong, Nie Sheng-dong, Wang Yuan-jun, et al. A review on the inversion methods in 2D NMR[J]. Chinese J Magn Reson , 2013, 30 (2) : 293-305 |
| [15] | 王为民, 李培, 叶朝辉. 核磁共振弛豫信号的多指数反演[J]. 中国科学A辑 , 2001, 31 (8) : 730-736 Wang Wei-min, Li Pei, Ye Chao-hui. Multi-exponential inversion method for NMR relaxation signals[J]. Science in China(Series A) , 2001, 31 (8) : 730-736 |
| [16] | Brownstein K R, Tarr C E. Importance of classic diffusion in NMR studies of water in biological cells[J]. Phy Rev A , 1979, 19 (6) : 2 446-2 453 DOI:10.1103/PhysRevA.19.2446 |
| [17] | 宋一桥. 低场核磁共振:弛豫和扩散的多维实验[J]. 波谱学杂志 , 2015, 32 (2) : 141-149 Song Yi-qiao. Low field magnetic resonance: multi-dimensionalexperiments of relaxation and diffusion[J]. Chinese J Magn Reson , 2015, 32 (2) : 141-149 |
| [18] | Joanne E H, Graeme M B. MR imaging with ultrashort TE (UTE) pulse sequences: Basic principles[J]. Radiography , 2005, 11 (3) : 163-174 DOI:10.1016/j.radi.2004.07.007 |
| [19] | William D L, Robert A A, Ghada E F, et al. Application of the 1994 WHO classification to populations other than postmenopausal Caucasian women: the 2005 ISCD official positions[J]. J Clin Densitom , 2006, 9 (1) : 22-30 DOI:10.1016/j.jocd.2006.05.004 |
 2016, Vol. 33
2016, Vol. 33



