文章信息
- 万钱芬, 何庆华, 王玉兰
- WAN Qian-fen, HE Qing-hua, WANG Yu-lan
- 乙酰甲喹影响猪尿液代谢组的NMR研究
- Effects of Acute Mequindox Exposure on Urinary Metabonome in Pigs
- 波谱学杂志, 2016, 33(3): 406-414
- Chinese Journal of Magnetic Resonance, 2016, 33(3): 406-414
- http://dx.doi.org/10.11938/cjmr20160305
-
文章历史
收稿日期: 2015-11-06
收修改稿日期: 2016-07-11


DOI:10.11938/cjmr20160305
2. 深圳大学 化学与环境工程学院, 深圳 518060;
3. 中国科学院大学, 北京 100049
2. College of Chemistry and Environmental Engineering, Shenzhen University, Shenzhen 518060, China;
3. University of Chinese Academy of Sciences, Beijing 100049, China
乙酰甲喹又称为痢菌净,是喹噁啉1, 4-氮氧化衍生物.由于乙酰甲喹具有广谱的抗菌活性,从20世纪80年代被研制出来到现在,它一直在我国畜禽养殖业中有广泛的应用[1-4].比如,乙酰甲喹能治疗因鼠伤寒沙门氏菌、巴氏杆菌、大肠杆菌和变形杆菌感染导致的痢疾[5].但乙酰甲喹的使用并不是百利而无一害.有研究报道,乙酰甲喹长期暴露会造成机体肝脏[6, 7]、肾上腺[6, 8, 9]、肾脏[9]、睾丸[10]以及脾脏[7]的毒性损伤.乙酰甲喹的细胞毒性研究发现,它能诱导活性氧(ROS)的产生并激活线粒体介导的细胞凋亡途径[11].同时有研究发现,乙酰甲喹能上调TNFα、IL-6等细胞因子的表达从而引起炎症反应,最终导致肝脏以及脾脏的损伤[7].另有研究[10]报道,长期的乙酰甲喹处理能下调睾丸中类固醇激素合成急性调节蛋白(StAR)、胆固醇侧链裂解酶(P450scc)和17β-羟基类固醇脱氢酶(17β-HSD)mRNA的水平.
传统的毒理学研究方法只是针对毒物某个可能的毒性机制或者特定的毒性作用器官展开研究,而近年来日益蓬勃发展的代谢组学研究方法,因为能捕捉生物机体在生理、病理或者外源性刺激下发生的系统性代谢变化,使得其在毒物毒性机制的研究中有广泛的应用,比如代谢组学方法在溴苯[12]、CCl4[13]、黄曲霉毒素B1[14]、全氟辛酸[15]和氯化汞HgCl2[16]等毒性机制的研究. Zhao和Jiang等人[17-19]用代谢组学方法研究了急性以及亚慢性的乙酰甲喹暴露对昆明小鼠以及Wistar大鼠的系统性代谢影响.研究发现,乙酰甲喹能影响大鼠以及小鼠的血液、尿液以及肝脏的代谢组,发生变化的代谢物表明乙酰甲喹能影响机体的能量代谢、诱导氧化应激、损伤肝脏功能并扰乱肠道菌群的微生态[17, 18].同时,乙酰甲喹对大鼠以及小鼠的代谢影响表现出了种属差异性,比如:乙酰甲喹急性暴露后,大鼠体内糖酵解活动增强而三羧酸(TCA)循环途径被抑制[18],而小鼠体内则呈现相反的实验结果[17];大鼠尿液中还发现了与维生素B3循环相关的抗氧化途径[18]的改变.上述工作只是完成了乙酰甲喹对模式实验动物的系统性代谢影响研究,然而畜禽动物对乙酰甲喹的代谢应答仍然是不清楚的.
尿液代谢组分析在代谢组学研究中具有重要的地位.一方面因为尿液样品容易收集和储存;另一方面因为尿液样品中代谢物组成丰富,包括有机酸、有机碱、氨基酸、能量代谢相关代谢物、肠道菌群相关代谢物以及各种金属离子等[20, 21].
本文选用猪为动物模型,借助基于核磁共振(NMR)的代谢组学方法并结合多变量数据分析技术,研究乙酰甲喹急性暴露对猪尿液代谢组的影响,旨在充分认识乙酰甲喹的毒性,并补充乙酰甲喹在动物体内的代谢组数据,为其在畜牧业中的应用以及畜禽产品的安全评价提供数据参考.
1 实验部分 1.1 化学试剂乙酰甲喹由华中农业大学国家兽药残留基准实验室赠予;羧甲基纤维素钠购于上海Sigma-Aldrich公司;NaH2PO4·2H2O和K2HPO4·3H2O(分析纯)购于上海国药集团化学试剂有限公司;D2O(99%氘代)和2, 2, 3, 3-氘代三甲基硅烷丙酸钠(TSP,98%氘代)购于美国CIL(Cambridge Isotope Laboratories)公司;NaN3(分析纯)购于天津福晨化学试剂厂.
1.2 实验动物模型和样品收集7头猪体重为(36.0±2.9)kg,购于广州商业养猪场,并饲养于华南农业大学动物实验中心.猪能自由饮水和取食. 2周适应期后,通过灌胃给药方式给予每只猪含5%乙酰甲喹的0.5%羧甲基纤维素钠混悬液(乙酰甲喹换算浓度为10 mg/kg.bw).
收集乙酰甲喹给药前2 h猪的尿液样品,以及乙酰甲喹给药6 h、12 h、24 h、36 h、48 h、60 h、72 h、96 h、120 h和144 h后猪的尿液样品.每个时间点的尿液样品收集在2 h内完成,收集到的尿液样品放入液氮中速冻,并及时转置-80 ℃冰箱保存.
1.3 尿液样品制备和NMR检测 1.3.1 尿液样品的制备配置磷酸盐浓度为1.5 mol/L的缓冲溶液,其中NaH2PO4·2H2O和K2HPO4·3H2O的摩尔浓度比为1∶4,NaN3含量为0.1%,TSP含量为0.05%,D2O含量为100%.
取600 μL尿液和60 μL上述磷酸盐缓冲溶液充分混合,离心10 min(14 489 × g,4 ℃).然后取550 μL上清于5 mm NMR样品管中.
1.3.2 尿液样品NMR检测尿液样品的NMR检测在Bruker Avance ІІІ 600型NMR谱仪(配备TXI超低温探头,1H共振频率为600.13 MHz)上完成.尿液1H NMR实验的脉冲序列为Noesygppr1d [recycle delay(RD)-90˚-t1-90˚-tm-90˚-ACQ].谱图的采样参数:NMR谱宽(SW)为12 000 Hz,弛豫延迟时间(D1)为2 s,脉冲延迟时间(t1)为3 μs,混合时间(tm)为100 ms,采样点数(TD)为32 k,采样累加次数(NS)为64.
为了对尿液1H NMR图谱中的谱峰信号进行归属,还采集了二维J分解谱(J-resolved spectroscopy,J-Res),1H-1H同核相关谱(correlation spectroscopy,COSY),1H-1H同核质子全相关谱(total correlation spectroscopy,TOCSY),1H-13C异核单量子相关谱(heteronuclear single-quantum correlation,HSQC)以及1H-13C多键相关谱(heteronuclear multiple-bond correlation,HMBC),均采用标准脉冲序列.
1.4 核磁数据处理和数据分析方法尿液1H NMR图谱在经过加指数窗函数(1 Hz)、傅里叶变换、定标、基线和相位调整、谱峰漂移校正等处理后,导入AMIX软件(V3.9.5,Bruker Biospin)中对尿液NMR谱图δ 0.50~9.50区域进行分段积分(积分区间宽度为1.2 Hz).为了避免样品间压水效应的差异和尿素信号影响,去除谱图δ4.50~6.20区域.同时,为了消除不同尿液样品间水含量的差异,采用总面积归一化的方式进行归一化处理.最后,将处理好的数据导入SIMCA P软件包(V 12.0,Umetrics)中进行多变量统计分析.主成分分析(PCA)能给出实验处理后不同组别的分布情况,结果以得分图的形式呈现,利用某一个实验组样本在PCA图上第一主成分和第二主成分的得分平均值,可以在Excel中绘制该组随着时间的代谢动态变化轨迹图;偏最小二乘法判别分析(PLS-DA)能分析不同实验组别间是否存在统计学显著差异,排列验证能对PLS-DA模型的可靠性进行验证;正交偏最小二乘法判别分析(OPLS-DA)能最大程度的凸显出组间的差异,并可以通过绘制相关系数负载图,提取出对分组有贡献的差异代谢物,CV-ANOVA检验可以对OPLS-DA模型的有效性进行验证.上述多变量统计分析中,PCA分析采用中心化(ctr)的数据处理方式,PLS-DA以及OPLS-DA采用UV标准化的数据处理方式.
2 结果与讨论 2.1 猪尿液代谢物的1H NMR图谱归属图 1为乙酰甲喹给药前和给药后猪尿液的1H NMR图谱.根据谱峰的化学位移、裂分情况和耦合常数等信息,并结合一系列二维NMR图谱,图 1中的谱峰被指认为相应的代谢物.结果显示,尿液中包含氨基酸(丙氨酸、甘氨酸)、有机酸(乳酸、甲酸、乙酸)、有机碱(甲胺、二甲胺、氧化三甲胺)、TCA循环中间代谢物(柠檬酸、琥珀酸)、肌酐、对甲基苯酚、对甲酚葡萄糖醛酸、苯甲酸、马尿酸、苯乙酰甘氨酸等代谢物.直接比较乙酰甲喹处理前后的尿液1H NMR图谱发现,芳香区代谢物受乙酰甲喹影响较大.
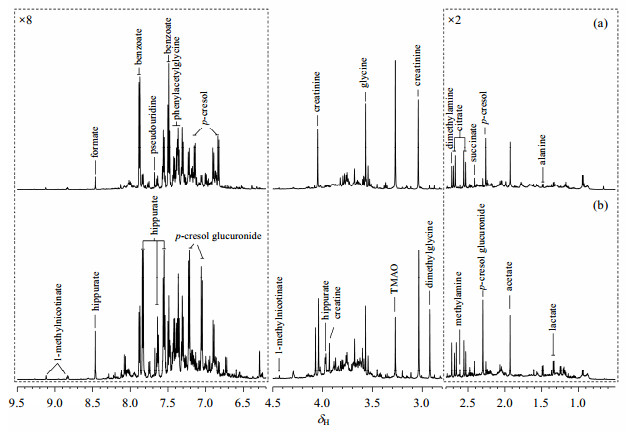
|
| 图 1 乙酰甲喹(a)给药前2 h和(b)给药后120 h的猪尿液1H NMR谱(600 MHz). δ 0.50~2.80和δ 6.20~9.50相对于δ 2.80~4.50分别纵向放大2倍和8倍 Fig. 1 600 MHz 1H NMR spectra of urine samples from pig 2 h before mequindox treatment (a) and 120 h after mequindox treatment (b). The spectra region of δ 0.50~2.80 and δ 6.20~9.50 were separately expanded 2 and 8 times compared with that of δ 2.80~4.50 |
为了分析乙酰甲喹给药后猪尿液代谢组随时间的动态变化,本研究对乙酰甲喹处理后多个时间点的尿液样品做了多变量统计分析.因为样品收集时间比较短,可以认为在此时间段内猪的尿液代谢组没有发生变化,因此可以利用给药前2 h(-2 h)猪的尿液样本作为后续时间点尿液样品的对照.将乙酰甲喹给药前和给药后的尿液NMR数据作PCA分析,并提取每个时间点PCA得分图上第一主成分(t[1])和第二主成分(t[2])的得分平均值,绘制尿液代谢组随时间的动态变化轨迹图(如图 2所示).从图中可以看到,乙酰甲喹给药后尿液代谢组发生了迅速的响应,并在给药36 h后趋于稳定.
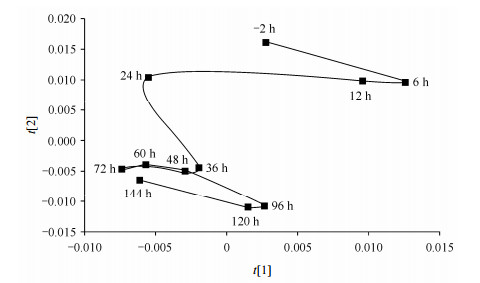
|
| 图 2 乙酰甲喹给药处理后由PCA得分图绘制的尿液代谢组动态变化轨迹图 Fig. 2 PCA trajectory plots obtained from the urine spectra of pig after mequindox treatmentc |
为了提取出乙酰甲喹处理前后猪尿液代谢组中的差异代谢物,本研究对猪尿液1H NMR数据进行了PLS-DA和OPLS-DA分析,并分别用排列实验和CV-ANOVA对模型的有效性做了验证,相应的模型验证参数以及显著性p值如表 1所示.多变量统计分析结果显示,乙酰甲喹给药影响了猪的尿液代谢组.乙酰甲喹给药不同时间后,尿液中发生显著变化的代谢物汇总在表 1中.以乙酰甲喹给药120 h为例(图 3),相关系数负载图中代谢物谱峰朝上表示乙酰甲喹处理后含量升高;朝下则反之.图中代谢物的颜色代表的是该代谢物对两组区分的贡献程度,颜色越深表示该代谢物在组间发生的变化越显著,对组间区分贡献越大.
| t/h | PLS-DA | OPLS-DA | Correlation Coefficients (|r|≥0.707)c, e | ||||
| R2X, Q2, PT a | pb | hippurate(δ 7.83) | benzoate(δ 7.87) | p-cresol glucuronide(δ 2.29) | p-cresol(δ 2.26) | creatine(δ 3.93) | |
| 6 | 0.33, 0.63, × | 0.020d | — | — | — | — | — |
| 12 | 0.31, 0.61, × | 0.140 | — | — | — | — | — |
| 24 | 0.29, 0.59, × | 0.045 | — | — | — | — | — |
| 36 | 0.30, 0.75, × | 0.014 | — | — | — | — | — |
| 48 | 0.32, 0.69, √ | 0.019 | — | — | — | 0.73 | — |
| 60 | 0.29, 0.77, √ | 0.012 | — | — | — | — | — |
| 72 | 0.40, 0.75, √ | 0.015 | — | — | -0.77 | 0.77 | -0.88 |
| 96 | 0.38, 0.84, √ | 0.009 | -0.75 | — | -0.77 | — | -0.90 |
| 120 | 0.38, 0.79, √ | 0.014 | -0.83 | 0.78 | -0.78 | 0.75 | -0.91 |
| 144 | 0.35, 0.75, √ | 0.020 | — | 0.85 | — | 0.91 | -0.84 |
| a R2X和Q2分别表示PLS-DA模型对原始数据的提取程度和PLS-DA模型的预测能力. PT表示PLS-DA模型的排列验证.×表示模型验证不通过,√表示模型验证通过. b OPLS-DA模型的经CV-ANOVA验证后的p值. c hippurate:马尿酸;benzoate:苯甲酸;p-cresol glucuronide:对甲酚葡萄糖醛酸;p-cresol:对甲基苯酚;creatine:肌酸. d PLS-DA模型的排列验证不通过,而OPLS-DA模型验证p < 0.05,仍判定模型不成立,组间无显著性差异. e “—”表示没有发生显著性变化,相关系数值为正表示乙酰甲喹给药后该代谢物在尿液中含量显著升高,相关系数值为负则反之. |
|||||||
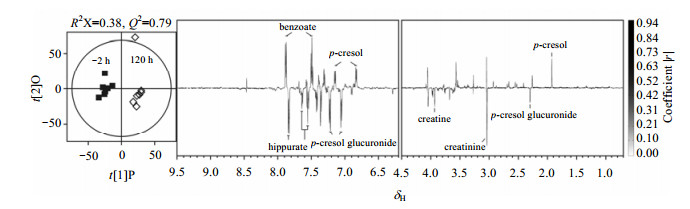
|
| 图 3 乙酰甲喹给药前2 h及给药后120 h,猪尿液1H NMR数据OPLS-DA模型得分图(左)以及相应的相关系数负载图(右) Fig. 3 OPLS-DA scores plot (left) and coefficient plots (right) obtained from comparison of 1H NMR spectra of pig urine between controls and mequindox treated pigs at 120 h post-exposure |
猪的尿液代谢组动态变化轨迹图(图 2)显示,乙酰甲喹给药36 h后,尿液代谢组的整体分布明显不同于给药前. 表 1中给药前后猪尿液NMR数据构建的PLS-DA模型显示,乙酰甲喹给药48 h后,猪尿液代谢组开始出现显著性变化,而这种代谢影响在给药144 h后仍然没有恢复.其中马尿酸、肌酸以及对甲酚葡萄糖醛酸在乙酰甲喹给药后浓度显著降低,而对甲基苯酚和苯甲酸则在给药后浓度显著升高.文献[22-24]报道,马尿酸、苯甲酸、对甲酚葡萄糖醛酸以及对甲基苯酚是食物中芳香族氨基酸在肠道菌群和生物体共代谢下的产物.首先,食物中芳香族氨基酸(酪氨酸及苯丙氨酸等)在肠道菌群微生物的代谢作用下变成苯甲酸和苯甲酚等[24]代谢物,然后这些代谢产物在生物体肝脏以及肠粘膜中代谢酶作用下发生甘氨酸化和葡萄糖醛酸化[22, 23],最后以马尿酸和对甲酚葡萄糖醛酸的形式随尿液排出体外.乙酰甲喹给药后,尿液中马尿酸、苯甲酸、对甲酚葡萄糖醛酸以及对甲基苯酚含量的变化提示肠道菌群组成发生了改变,而这可能同乙酰甲喹的抑菌作用相关.小鼠以及大鼠乙酰甲喹给药实验也显示肠道菌群代谢相关的代谢物发生了变化,比如马尿酸、苯乙酰甘氨酸、二甲基甘氨酸、三甲胺、三甲胺-N-氧化物和胆碱[17, 18].对甲基苯酚是对甲酚葡萄糖醛酸的葡萄糖醛酸化前体,在乙酰甲喹处理后升高,而对甲酚葡萄糖醛酸含量降低.这一现象可能说明乙酰甲喹不但影响了机体的肠道菌群组成,而且影响了代谢相关的酶的活性.苯甲酸作为马尿酸的甘氨酸化前体,在乙酰甲喹处理后含量升高,而马尿酸含量下降,这一现象也进一步支持了上述观点.然而,前人用大鼠和小鼠为动物模型研究乙酰甲喹对其尿液代谢组影响的工作[17, 18]中,并没有发现苯甲酸以及对甲基苯酚含量的显著性变化;而且乙酰甲喹暴露的小鼠以及大鼠模型中,发现尿液中马尿酸含量显著升高[17, 19];本研究发现肌酸在乙酰甲喹给药后含量显著下降,而Zhao等人[17, 18]发现大鼠和小鼠在急性乙酰甲喹处理后尿液中肌酸含量显著升高.这些都表明乙酰甲喹对动物机体代谢的影响具有种属差异.
本实验中乙酰甲喹的剂量(10 mg/kg.bw)是市面上猪以及牛口服乙酰甲喹的推荐剂量,该剂量给药后,猪尿液中除了肠道菌群相关代谢物和肌酸的变化外,其他代谢物的变化不明显.
3 结论本文采用基于NMR的代谢组学方法研究了乙酰甲喹急性给药对猪尿液代谢组的影响.结果发现,乙酰甲喹给药后48 h,尿液代谢组开始发生显著变化,而这种显著变化在给药后144 h仍未得到恢复.乙酰甲喹给药主要影响了尿液中肌酸、马尿酸、苯甲酸、对甲酚葡萄糖醛酸以及对甲基苯酚的含量.从发生变化的代谢物分析,乙酰甲喹给药影响了猪肠道菌群的微生态.乙酰甲喹给药后,猪尿液中苯甲酸、对甲基苯酚和肌酸含量的变化不同于乙酰甲喹对大鼠以及小鼠尿液组的影响,这提示了乙酰甲喹对动物内源性代谢的影响具有种属差异.上述研究工作为乙酰甲喹用药的生物安全提供了数据参考,并且补充了乙酰甲喹对动物内源性代谢影响的代谢组数据.
| [1] | Liu J, Ge X, Man O, et al. Catalytic characteristics of CYP3A22-dependent mequindox detoxification[J]. Catal Commun , 2011, 12 (7) : 637-643 DOI:10.1016/j.catcom.2010.12.029 |
| [2] | Ding H, Liu Y, Zeng Z, et al. Pharmacokinetics of mequindox and one of its major metabolites in chickens after intravenous, intramuscular and oral administration[J]. Res Vet Sci , 2012, 93 (1) : 374-377 DOI:10.1016/j.rvsc.2011.07.007 |
| [3] | Li G, Yang F, He L, et al. Pharmacokinetics of mequindox and its metabolites in rats after intravenous and oral administration[J]. Res Vet Sci , 2012, 93 (3) : 1380-1386 DOI:10.1016/j.rvsc.2012.02.015 |
| [4] | Tang X, Mu P, Wu J, et al. Carbonyl reduction of mequindox by chicken and porcine cytosol and cloned carbonyl reductase 1[J]. Drug Metab Disposition , 2012, 40 (4) : 788-795 DOI:10.1124/dmd.111.043547 |
| [5] | 黄勇旗, 李引乾, 杨亚军, 等. 乙酰甲喹在绵羊体内的药物动力学研究[J]. 西北农林科技大学学报(自然科学版) , 2008, 36 (2) : 77-81 Huang Yong-qi, Li Yin-qian, Yang Ya-jun, et al. Studies on the pharmacokinetics of mequindox in sheep[J]. Journal of Northwest A & F University. Natural Science Edition , 2008, 36 (2) : 77-81 |
| [6] | Ihsan A, Wang X, Huang X J, et al. Acute and subchronic toxicological evaluation of mequindox in Wistar rats[J]. Regul Toxicol Pharmacol , 2010, 57 (2, 3) : 307-314 |
| [7] | Wang X, Huang X J, Ihsan A, et al. Metabolites and JAK/STAT pathway were involved in the liver and spleen damage in male Wistar rats fed with mequindox[J]. Toxicology , 2011, 280 (3) : 126-134 DOI:10.1016/j.tox.2010.12.001 |
| [8] | Huang X J, Ihsan A, Wang X, et al. Long-term dose-dependent response of mequindox on aldosterone, corticosterone and five steroidogenic enzyme mRNAs in the adrenal of male rats[J]. Toxicol Lett , 2009, 191 (2, 3) : 167-173 |
| [9] | Huang X J, Wang X, Ihsan A, et al. Interactions of NADPH oxidase, renin-angiotensin-aldosterone system and reactive oxygen species in mequindox-mediated aldosterone secretion in Wistar rats[J]. Toxicol Lett , 2010, 198 (2) : 112-118 DOI:10.1016/j.toxlet.2010.05.013 |
| [10] | Ihsan A, Wang X, Liu Z, et al. Long-term mequindox treatment induced endocrine and reproductive toxicity via oxidative stress in male Wistar rats[J]. Toxicol Appl Pharmacol , 2011, 252 (3) : 281-288 DOI:10.1016/j.taap.2011.02.020 |
| [11] | Huang X J, Zhang H H, Wang X, et al. ROS mediated cytotoxicity of porcine adrenocortical cells induced by QdNOs derivatives in vitro[J]. Chemico-Biological Interactions , 2010, 185 (3) : 227-234 DOI:10.1016/j.cbi.2010.02.030 |
| [12] | Waters N J, Waterfield C J, Farrant R D, et al. Integrated metabonomic analysis of bromobenzene-induced hepatotoxicity: novel induction of 5-oxoprolinosis[J]. J Proteome Res , 2006, 5 (6) : 1448-1459 DOI:10.1021/pr060024q |
| [13] | Jiang L M, Huang J, Wang Y L, et al. Metabonomic analysis reveals the CCl4-induced systems alterations for multiple rat organs[J]. J Proteome Res , 2012, 11 (7) : 3848-3859 DOI:10.1021/pr3003529 |
| [14] | Zhang L M, Ye Y F, An Y P, et al. Systems responses of rats to aflatoxin B1 exposure revealed with metabonomic changes in multiple biological matrices[J]. J Proteome Res , 2011, 10 (2) : 614-623 DOI:10.1021/pr100792q |
| [15] | Ding L N, Hao F H, Shi Z M, et al. Systems biological responses to chronic perfluorododecanoic acid exposure by integrated metabonomic and transcriptomic studies[J]. J Proteome Res , 2009, 8 (6) : 2882-2891 DOI:10.1021/pr9000256 |
| [16] | Holmes E, Bonner F, Sweatman B, et al. Nuclear magnetic resonance spectroscopy and pattern recognition analysis of the biochemical processes associated with the progression of and recovery from nephrotoxic lesions in the rat induced by mercury (Ⅱ) chloride and 2-bromoethanamine[J]. Mol Pharmacol , 1992, 42 (5) : 922-930 |
| [17] | Zhao X J, Huang C Y, Lei H H, et al. Dynamic metabolic response of mice to acute mequindox exposure[J]. J Proteome Res , 2011, 10 (11) : 5183-5190 DOI:10.1021/pr2006457 |
| [18] | Zhao X J, Hao F H, Huang C Y, et al. Systems responses of rats to mequindox revealed by metabolic and transcriptomic profiling[J]. J Proteome Res , 2012, 11 (9) : 4712-4721 DOI:10.1021/pr300533a |
| [19] | Jiang L M, Zhao X J, Huang C Y, et al. Dynamic changes in metabolic profiles of rats subchronically exposed to mequindox[J]. Mol Biosyst , 2014, 10 (11) : 2914-2922 DOI:10.1039/C4MB00218K |
| [20] | 江李苗, 唐惠儒. 哺乳动物尿液中钙镁离子浓度的1H NMR测定方法[J]. 波谱学杂志 , 2013, 30 (1) : 80-85 Jiang Li-miao, Tang Hui-ru. An NMR method for determining concentrations of calaium and magnesium ions in mammalian urines[J]. Chinese J Magn Reson , 2013, 30 (1) : 80-85 |
| [21] | 蔡毅, 豪富华, 王玉兰. 昆明小鼠常见体液与组织代谢组的NMR分析[J]. 波谱学杂志 , 2013, 30 (1) : 55-68 Cai Yi, Hao Fu-hua, Wang Yu-lan. NMR-based metabonomics analysis of biofluids and tissues in kungming mice[J]. Chinese J Magn Reson , 2013, 30 (1) : 55-68 |
| [22] | Smith E A, Macfarlane G T. Enumeration of human colonic bacteria producing phenolic and indolic compounds: effects of pH, carbohydrate availability and retention time on dissimilatory aromatic amino acid metabolism[J]. J Appl Bacteriol , 1996, 81 (3) : 288-302 DOI:10.1111/jam.1996.81.issue-3 |
| [23] | Powell G M, Miller J J, Olavesen A H, et al. Liver as major organ of phenol detoxication[J]. Nature , 1974, 252 (5480) : 234-235 DOI:10.1038/252234a0 |
| [24] | Ramakrishna B S, Gee D, Weiss A, et al. Estimation of phenolic conjugation by colonic mucosa[J]. J Clin Pathol , 1989, 42 (6) : 620-623 DOI:10.1136/jcp.42.6.620 |
 2016, Vol. 33
2016, Vol. 33



