文章信息
- 孙伟, 高翔, 郭娟, 余向阳
- SUN Wei, GAO Xiang, GUO Juan, YU Xiang-yang
- 洛莫司汀的1H、13C NMR全归属
- An NMR Study on Lomustine
- 波谱学杂志, 2016, 33(2): 353-359
- Chinese Journal of Magnetic Resonance, 2016, 33(2): 353-359
- http://dx.doi.org/10.11938/cjmr20160217
-
文章历史
收稿日期: 2015-05-19
修订日期: 2016-04-15


DOI:10.11938/cjmr20160217
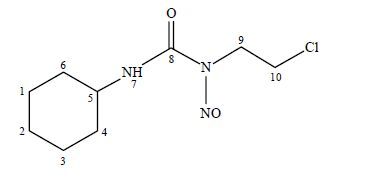
洛莫司汀为烷化剂类抗癌药,能与细胞成分的亲核集团发生烃化反应,以核酸为主要烃化功击对象,破坏DNA的结构,进而使细胞分裂停止.它对脑胶质瘤、肺癌和淋巴瘤等有较好的疗效,对中枢神经系统疾病和白血病也有一定的疗效.在对洛莫司汀的结构解析中,我们发现尚且没有文献对它的结构进行详细的1H和13C NMR归属;尤其是重叠严重的环己烷区,文献未对每个氢原子进行指认归属.我们利用核磁共振(NMR)技术对洛莫司汀的结构(图 1)进行了表征,应用1H NMR、13CNMR、DEPT135、1H-13C HMBC、1H-13C HSQC、1H-1H COSY和1H-1H NOESY等技术对其1H和13C NMR信号进行了准确、详细的归属,并对文献[2]中的错误归属进行了更正.
|
| 图1 洛莫司汀的化学结构 Fig.1 Chemical structure of Lomustine |
1H NMR、13C NMR、DEPT135、1H-1H COSY、1H-1H NOESY、1H-13C HSQC和1H-13C HMBC实验均在Bruker AVANCE III 400型超导NMR谱仪上完成,采用BBO- 5 mm多核宽带探头和内径为5 mm的NMR样品管(ST-500,NORELL).洛莫司汀购买于上海阿拉丁试剂公司;CDCl3(氘化率为99.8%,CIL,含0.03% TMS)购自青岛腾龙微波科技有限公司.
1.2 实验条件样品溶于CDCl3,以TMS为内标.实验温度为(295.0 ± 0.1)K,1H和13C NMR的工作频率分别为400.13 MHz和100.61 MHz,谱宽分别为801 2.8 Hz和24 038.5 Hz.
DEPT135采用仪器自带的标准脉冲序列deptsp135,谱宽为16 129.0 Hz.2D NMR实验包括梯度场1H-1H COSY、1H-13C HSQC、1H-13C HMBC及1H-1H NOESY等,均采用标准脉冲序列.1H-1H COSY、1H-1H NOESY的F2(1H)和F1(1H)维谱宽均为3 440.4 Hz,采样数据点阵t2 × t1 = 2 048 × 256,NOESY混合时间为0.6 s;1H-13C HSQC和1H-13C HMBC的F2(1H)和F1(13C)维谱宽分别为2 525.3 Hz和14 492.8 Hz,采样数据点阵t2 × t1 = 1 024 × 256.
2 结果与讨论 2.1 1D NMR谱图分析化合物洛莫司汀分子式为C9H16ClN3O2,相对分子量为233.70.
从洛莫司汀的1H NMR谱(图 2)中,通过化学位移、峰型与积分面积,推测dH6.79 (d,J = 8.0 Hz,1H)为H-7;由于Cl原子的电负性大于N原子,据此暂定dH 4.18 (t,J = 8.0 Hz,2H)为H-10[2],dH3.50 (t,J = 8.0 Hz,2H)为H-9[2],其具体归属需要借助HMBC谱图;dH3.88 (m,1H)为H-5,dH1.21~2.07通过积分面积判断含有10个氢原子,应为己环上的氢原子,由于谱峰重叠严重,归属须借助于其它谱图.

|
| 图2 洛莫司汀的1H NMR谱图 Fig.2 1H NMR spectra of Lomustine |
由13C NMR谱与DEPT135谱(图 3),观察到谱图中出现了1个叔碳(dC49.9,归属为C-5),1个季碳(dC 151.8,归属为C-8)和5个仲碳(dC 40.0、38.9、33.0、25.3、24.7).化合物洛莫司汀实际包含7个仲碳,但C-1和C-3、C-4和C-6各为磁等价原子,化学位移重叠,故在图中只看到5个仲碳信号,具体归属需通过HSQC和HMBC谱图进一步确定.

|
| 图3 洛莫司汀的13C NMR和DEPT135谱 Fig.3 13C and DEPT135 NMR spectra of Lomustine |
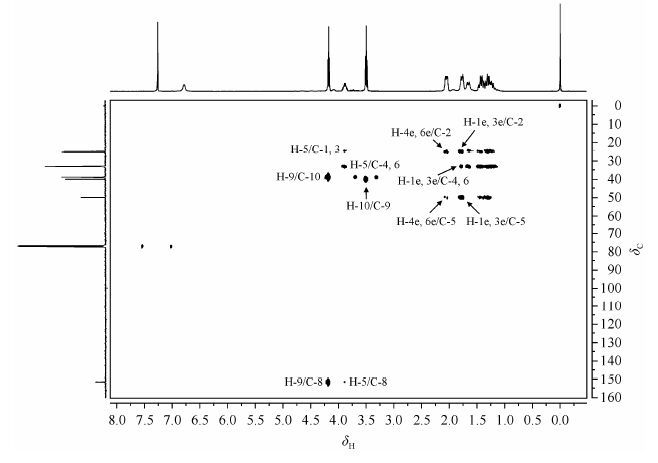
由HSQC(图 4)中可以看出dH6.79没有与之相关的碳原子,进一步证明它是H-7;dC 151.8没有相关的氢原子,进一步证明它是C-8;dC40.0和38.9分别与dH4.18和3.50相关,暂时归属为C-10和C-9;dC 33.0与dH2.03~2.07和1.26~1.34相关,dC 24.7与dH 1.75~1.80和1.37~1.48相关,dC 25.3与dH 1.63~1.68和1.17~1.25相关;dC49.9与dH3.88相关.

|
| 图4 洛莫司汀的HSQC谱图(295 K) Fig.4 HSQC spectrum of Lomustine (295 K) |
在HMBC谱(图 5)中,C-8与dH 4.18和3.88有交叉峰,这进一步证明了dH3.88归属为H-5的正确性;也说明dH 4.18应该是H-9,而不是先前归属的H-10.所以dC40.0被归属为C-9,dH3.50被归属为H-10,dC38.9被归属为C-10,dC49.9被归属为C-5.
|
| 图5 洛莫司汀的HMBC谱图(295 K) Fig.5 HMBC spectrum of Lomustine (295 K) |
除dC 25.3外,余下没有归属的碳原子均与H-5相关,因此dC25.3被归属为C-2;dH1.63~1.68和1.17~1.25被归属为H-2.受N原子的电负性影响,相对于H-1和H-3,H-4和H-6的化学位移向低场位移,所以dH2.03~2.07和1.26~1.34被归属为H-4和H-6;dH1.75~1.80和1.37~1.48被归属为H-1和H-3;dC33.0被归属为C-4和C-6;dC24.7被属为C-1和C-3.
H-4e处于C2—C3和C5—C6的去屏蔽区,H-6e处于C1—C2和C4—C5的去屏蔽区,H-4a、H-6a分别处于C3—C4和C5—C6的去屏蔽区,所以dH2.03~2.07 (m,2H)为H-4e、H-6e,处于低场;同理可得dH 1.75~1.80 (m,2H)为H-1e、H-3e;dH 1.63~1.68(m,1H)为H-2e.dH 1.26~1.34(m,2H)与H-4e、H-6e存在同碳耦合,被归属为H-4a、H-6a;同理dH 1.37~1.48(m,2H)为H-1a、H-3a;dH 1.17~1.25 (m,1H)为H-2a.
在NOESY谱图中,可以看到H-7与H5、H-4e、H-6e、H-4a、H-6a、H-1e和H-3e均有相关,H-5与H-4e、H-6e、H-4a、H-6a、H-1a和H-3a均有相关,但没有看到H-5与H-2的相关交叉峰,这说明洛莫司汀结构呈椅式构象.由此推断洛莫司汀的空间构象应如图 6所示.

|
| 图6 洛莫司汀的空间构象 Fig.6 The spatial conformation of Lomustine |
洛莫司汀的1H NMR和13CNMR信号全归属结果见表 1.利用HMBC,我们纠正了文献[2]归属错误的信号——H-9和H-10.Cl-CH2中的亚甲基相对于NCH2的亚甲基处于高场,这可能是因为C=O吸电子效应使得链接N-CH2具有更强的吸电子能力,从而使得洛莫司汀H-9上的电子云密度低于H-10,H-9相对于H-10位于低场,这与文献[1]报道正好相反.
| Position | dC | dH (J/Hz) | HSQC | 1H -1H COSY | HMBC |
| 1 | 24.7* | 1.37~1.48(1H,m,H-1a)* 1.75~1.80(1H,m,H-1e)* | + | H-2,6 | H-2,3,5,6, |
| 2 | 25.3* | 1.17~1.25(1H,m,H-2a)* 1.63~1.68(1H,m,H-2e)* | + | H-1,3 | H-1,3,4,6 |
| 3 | 24.7* | 1.37~1.48(1H,m,H-3a)* 1.75~1.80(1H,m,H-3e)* | + | H-2,4 | H-1,2,4,5 |
| 4 | 33.0* | 1.26~1.34(1H,m,H-4a)* 2.03~2.07(1H,m,H-4e)* | + | H-3 | H-2,3,5,6 |
| 5 | 49.9* | 3.88(1H,m) | + | H-4,6,7 | H-1,3,4,6 |
| 6 | 33.0* | 1.26~1.34(1H,m,H-6a)* 2.03~2.07(1H,m,H-6e)* | + | H-1,5 | H-1,2,4,5 |
| 7 | / | 6.79(1H,s) | / | H-5 | / |
| 8 | 151.8 | / | / | / | H-5,9 |
| 9 | 40.0 | 4.18(2H,t,8.0)** | + | H-10 | H-10 |
| 10 | 38.9 | 3.50(2H,t,8.0)** | + | H-9 | H-9 |
| *为文献[2]中未明确归属的碳原子和氢原子信号;**为文献[1]中归属错误的氢原子信号 | |||||
运用1D和2D NMR技术,我们分析和归属了洛莫司汀所有的1H和13C NMR信号,确证了它的立体化学结构.特别是对谱峰重叠严重的环己烷区进行了指认,并对文献报道的NMR数据进行了纠正和补充.
| [1] | William L, Shive M S. Synthesis of specifically 15N- and 13C-labeled a ntitumor (2-Haloethyl)nitrosoureas. The study of their conformations in solution by nitrogen-15 and carbon-13 nuclear magnetic resonance and evidence for stereoelectronic control in their aqueous decomposition[J]. J Org Chem, 1981, 46:5309–5321. |
| [2] | 苏军, 孟庆伟, 赵伟杰. 固体光气法合成洛莫司汀[J].中国药物化学杂志, 2003, 13 (3) : 170–171 . Su Jun, Meng Qing-wei, Zhao Wei-jie, et al. Synthesis of lomustine utilizing triphosgene[J].Chinese J Med Chem, 2003, 13(3):170–171. |
| [3] | 蒋虹, 王强, 刘新友. 一种新的六氢喹啉衍生物的NMR研究[J].波谱学杂志, 2007, 24 (1) : 9–15 . Jiang Hong, Wang Qiang, Liu Xin-you. A new derivative of hexahydroquinolin studied by NMR spectroscopy[J].Chinese J Magn Reson, 2007, 24(1):9–15. |
| [4] | 孙伟, 魏永锋, 白银娟. α-山竹黄酮的NMR研究[J].波谱学杂志, 2008, 25 (2) : 257–264 . Sun Wei, Wei Yong-feng, Bai Yin-juan, et al. An NMR study of α-mangostin[J].Chinese J Magn Reson, 2008, 25(2):257–264. |
| [5] | 赵玉梅, 刘力军, 缪振春. 选择性远程DEPT和选择性NOESY技术用于苷类化合物的结构研究[J].波谱学杂志, 2008, 25 (3) : 342–348 . Zhao Yu-mei, Liu Li-jun, Miao Zhen-chun. Structural determination of an aglycome by long-range DEPT and selective NOESY techniques[J].Chinese J Magn Reson, 2008, 25(3):342–348. |
| [6] | 杨秀伟. 应用2D NMR技术研究羌活苷的结构[J].波谱学杂志, 2006, 23 (4) : 429–441 . Yang Xiu-wei. Application of NMR for structural dedication of forbesoside[J].Chinese J Magn Reson, 2006, 23(4):429–441. |
| [7] | 谭小健, 王海顷, 蒋华良. 8α-OH马尾杉碱B的结构鉴定[J].化学学报, 2000, 58 (11) : 1386–1392 . Tan Xiao-jian, Wang Hai-Qing, Jiang Hua-liang, et al. Structure assignment of 8α-OH phlegmariurine B[J].Acta Chimica Sinica, 2000, 58(11):1386–1392. |
| [8] | 左爱华, 程孟春, 卓荣杰. Z-藁本内酯降解产物的UPCL-QTOF-MS和NMR结构鉴定[J].药学学报, 2013, 48 (6) : 911–916 . Zuo Ai-hua, Chen Meng-chun, Zhuo Rong-jie, et al. Structure elucidation of degradation products of Z-ligustilide by UPLC-QTOF-MS and NMR spectroscopy[J].Acta Pharmaceutica Sinica, 2013, 48(6):911–916. |
 2016, Vol. 33
2016, Vol. 33



