文章信息
- 周志, 林中祥
- ZHOU Zhi, LIN Zhong-xiang
- C60-脱异丙基脱氢枞胺衍生物的NMR光谱分析
- NMR Analysis of C60-Deisopropyldehydroabietylamine Derivative
- 波谱学杂志, 2016, 33(2): 345-352
- Chinese Journal of Magnetic Resonance, 2016, 33(2): 345-352
- http://dx.doi.org/10.11938/cjmr20160216
-
文章历史
收稿日期: 2015-08-02
修订日期: 2016-04-13


DOI:10.11938/cjmr20160216
2. 南京林业大学 化学工程学院, 江苏 南京 210037
2. College of Chemical Engineering, Nanjing Forestry University, Nanjing 210037, China
脱氢枞胺是松香的重要改性产品之一,是歧化松香胺的主要成分,是一种具有三环二萜结构的光学活性碱.C60具有独特的碳笼结构,在化学反应中表现缺电子烯烃性质[1],可发生各种环加成反应[2-4].C60与松香类化合物发生环加成反应可生成多种功能性富勒烯衍生物[5-11].近期,我们以脱氢枞胺为起始原料,通过C-7位氧化产物与对甲苯磺酰肼反应生成酰腙而得到碳烯中间体,再与C60发生1,3-偶极环加成反应,合成了新化合物N,N-四氯邻苯二甲酰基-13-硝基-7,7-C60-脱异丙基脱氢枞胺[12](化合物1如图 1所示).目前,有关C60-脱异丙基脱氢枞胺衍生物的研究很少,特别是C60-脱异丙基脱氢枞胺衍生物结构的NMR归属尚未见文献报道.本文利用1H-1H COSY和ROESY,1H-13C HSQC和1H-13C HMBC等2D NMR技术对该化合物的1H和13C NMR信号进行了解析和谱峰归属,为表征类似化合物的分子结构提供了借鉴.

|
| 图1 N,N-四氯邻苯二甲酰基-13-硝基-7,7-C60-脱异丙基脱氢枞胺的结构 Fig.1 The structure of N,N-tetrachlorophthaloyl-13-nitro-7,7-C60-deisopropyldehydroabietylamine |
1D和2D NMR实验均在Bruker AVANCE 500型NMR波谱仪上进行.N,N-四氯邻苯二甲酰基-13-硝基-7,7-C60-脱异丙基脱氢枞胺按文献[12]的方法合成,分子式为C85H20N2O4Cl4.利用基质辅助激光解吸电离飞行时间质谱测得其分子量为1 274.1(基质:a-氰基-羟基肉桂酸,负离子检测模式).原料岐化松香胺(含脱氢枞胺70%),广西桂林化工厂;C60,河南濮阳市永新化学试剂公司;其余试剂均为分析纯.
1.2 测试条件样品溶于CDCl3,以TMS为内标,1H和13CNMR的工作频率分别为500.13 MHz和125.76 MHz,谱宽分别为10 330.58 Hz和29 761.90 Hz.2D NMR实验包括1H-13C HMBC、1H-13C HSQC、1H-1H COSY和1H-1H ROESY,均采用标准脉冲序列.1H-1H COSY的F2 (1H)和F1 (1H)维的谱宽均为6 251.63 Hz,采样数据点阵t2 × t1 = 1 024×256;ROESY的F2 (1H)和F1 (1H)维的谱宽均为6 251.63 Hz,采样数据点阵t2 × t1 = 2 048× 256;HSQC谱的F2 (1H)和F1 (13C)维的谱宽分别为6 251.63 Hz和22 636.80 Hz,采样数据点阵t2×t1 = 2 048×256;HMBC谱的F2 (1H)和F1 (13C)维的谱宽分别为6 251.63 Hz和22 636.80 Hz,采样数据点阵t2×t1 = 4 096×256.
2 结果与讨论 2.1 化合物1的1H NMR归属在1H NMR谱(表 1)中,根据化学位移、峰形及耦合常数可以直接确认芳香环上质子.处在低场区域的dH7.68 (1H,d,J = 8.7 Hz)、9.48 (1H,d,J = 2.5 Hz)、8.28 (1H,dd,J = 8.6,2.4 Hz)可分别归属为芳环上的H-11、H-14、H-12.
| No | dC | dH (J/Hz) | COSY | ROESY | HSQC | HMBC |
| 1 | 39.4 | 2.44 (1H,br d,12.4,H-1b) 1.77 (1H,td,12.3、4.4,H-1a) | H-1a,2 H-1b,2 | H-17,11,2,1a H-5,11,1b,3a | + | H-17,5 |
| 2 | 18.0 | 1.83~1.90 (2H,m) | H-3b,3a,1b,1a | H-16,3b,1b | + | / |
| 3 | 37.1 | 1.64 (1H,br d,13.2,H-3b) 1.48 (1H,td,12.8、4.9,H-3a) | H-3a,2 H-3b,2 | H-16,2,15b,3a H-5,15a,3b,1a | + | H-16,15a,15b |
| 4 | 41.0 | / | / | / | / | H-16,5,6b,15b,15a |
| 5 | 47.8 | 1.91 (1H,dd,10.6、9.3) | H-6b,6a | H-H-3a,1a,6a,15a | + | H-17,16,3b,15a, H-15b,6b,6a,1a |
| 6 | 27.8 | 3.67 (1H,dd,14.2、10.4,H-6b) 3.53 (1H,dd,14.3,8.9,H-6a) | H-5,6a H-5,6b | H-16,17,6a,15b H-5,6b,15b,15a | + | H-5 |
| 7 | 42.4 | / | / | / | / | H-6a,6b,14,11 |
| 8 | 134.5 | / | / | / | / | H-6b,11 |
| 9 | 160.3 | / | / | / | / | H-14,12,17,5 |
| 10 | 39.8 | / | / | / | / | H-17,5,6a,2,11 |
| 11 | 122.7 | 7.68 (1H,d,8.7) | H-12 | H-1b,1a,12,17 | + | / |
| 12 | 123.1 | 8.28 (1H,dd,8.6、2.4) | H-11,14 | H-11 | + | H-14 |
| 13 | 145.3 | / | / | / | / | H-14,12,11 |
| 14 | 124.6 | 9.48 (1H,d,2.5) | H-12 | / | + | H-12 |
| 15 | 50.1 | 3.83 (1H,d,13.9,H-15b) 3.64 (1H,d,13.9,H-15a) | H-15a H-15b | H-16,3b,6a,6b H-5,3a,6a | + | H-16,5 |
| 16 | 19.2 | 1.34 (3H,s) | / | H-17,6b,15b,2,3b | + | H-5,3a,15a,15b |
| 17 | 21.9 | 1.90 (3H,s) | / | H-16,1b,6b,11 | + | H-5,1a |
| 18 | 83.7 | / | / | / | / | H-6a,6b |
| 19 | 76.5 | / | / | / | / | H-6a |
| 1',6' | 129.8 | / | / | / | / | / |
| 2',5' | 127.4 | / | / | / | / | / |
| 3',4' | 140.4 | / | / | / | / | / |
| 7',8' | 164.5 | / | / | / | / | H-15a,15b |
| C60 | 149.0~137.8 | / | / | / | / | / |
在高场区域,有dH3.83 (1H,d,J = 13.9 Hz)、3.64 (1H,d,J = 13.9 Hz)两个双峰(d)和dH3.67 (1H,dd,J = 14.2,10.4 Hz)、3.53 (1H,dd,J = 14.3,8.9 Hz)、1.91 (1H,dd,J = 10.6,9.3 Hz)三个双重双峰(dd)(表 1).在HSQC谱(图 2)中,由于dH3.83、3.64都与dC50.1相关,dH3.67、3.53都与dC27.8相关,因此,dH3.83、3.64归属为H-15 (H-15b或H-15a),dH3.67、3.53归属为H-6 (H-6b或H-6a).dH1.91与H-6在COSY谱(图 3)中相关,归属为H-5.在ROESY谱(图 4)中,dH3.64、3.53与H-5信号相关,而dH3.83、3.67与H-5没有相关信号,因此,dH3.64、3.53分别归属为H-15α和H-6a,dH3.83、3.67分别归属为H-15b和H-6b.

|
| 图2 化合物1的HSQC谱 Fig.2 HSQC spectrum of compound 1 |
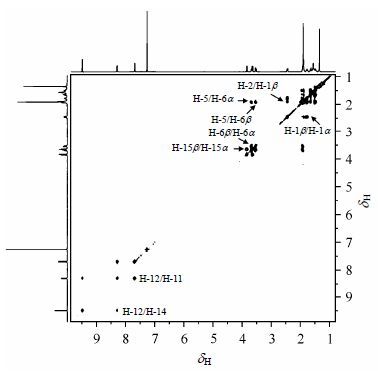
|
| 图3 化合物1的COSY谱 Fig.3 COSY spectrum of compound 1 |
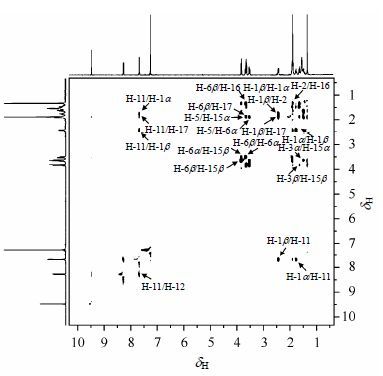
|
| 图4 化合物1的ROESY谱 Fig.4 ROESY spectrum of compound 1 |
dH1.34和dH1.90两个单峰(s)为两个甲基质子信号峰(表 1).在ROESY谱中,dH1.34与dH1.90、H-6b、H-15b均相关,而dH1.90与dH1.34、H-6β、H-11均相关,因此,dH1.34归属为H-16,dH1.90归属为H-17.
最后,dH2.44 (1H,br d,J = 12.4 Hz)、1.64 (1H,br d,J = 13.2 Hz)两个宽双峰(brd)和dH1.77 (1H,td,J = 12.3,4.4 Hz)、1.48 (1H,td,J = 12.8,4.9 Hz)二个三重双峰(td)以及dH1.83~1.90 (2H,m)一个多重峰(m)为剩余的三个亚甲基上质子的信号(表 1).
HSQC谱中,dH2.44、1.77与dC39.4相关,同时在ROESY谱中,dH2.44与H-17、H-11、H-2、dH1.77相关,dH1.77与H-5、H-11、dH2.44、1.48相关,故dH2.44(宽双峰)被归属为H-1b,dH1.77(td)被归属为H-1a.同样,HSQC谱中,dH1.64、1.48与dC37.19相关,而在ROESY谱中,dH1.64与H-16、H-2、H-15b、dH1.48相关,dH1.48与H-5、H-15a、H-1a、dH1.64相关,故dH1.64(宽双峰)被归属为H-3b,dH1.48(td)被归属为H-3a.所以dH1.83~1.90被归属为H-2.在COSY谱中,dH1.83~1.90与dH2.44、1.64、1.77、1.48均相关,这进一步证明了H-2归属的正确性.
2.2 化合物1的13CNMR归属化合物1的分子式为C85H20N2O4Cl4,分子中含有85个碳原子,在13CNMR谱 (图 5)中呈现66个碳信号峰.
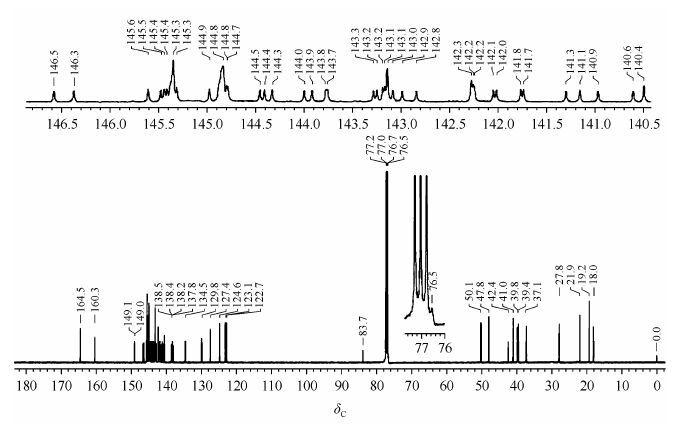
|
| 图5 化合物1的13CNMR谱 Fig.5 13C NMR spectra of compound 1 |
在13CNMR谱(表 1)中,处于低场的dC164.5可直接被归属为两个等价的酰胺羰基碳C-7'和C-8'[13],这一归属也从HMBC谱(图 6)中dC164.5与H-15b、H-15α的交叉峰得到证实.同时,dC127.4、129.8、140.4被归属为四氯邻苯二甲酰基苯环上的碳原子[14].苯环上C-3'和C-4'在甲酰基的对位,且与氯原子直接相连,去屏蔽效应最强,化学位移向低场位移最大;而C-1'和C-6'与甲酰基直接相连,化学位移亦向低场移动,故dC140.4、129.8被分别归属为C-3'和C-4'、C-1'和C-6',剩余的dC127.4归属为C-2'和C-5'.
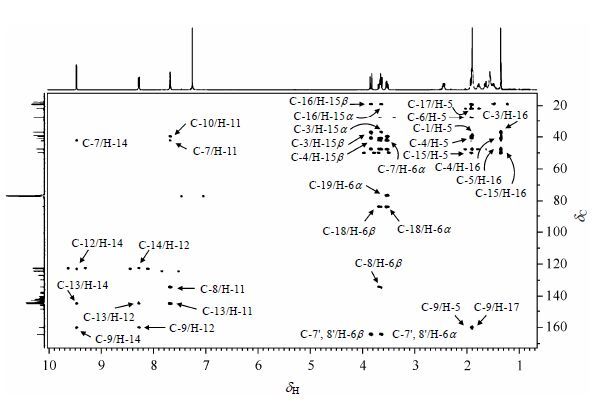
|
| 图6 化合物1的HMBC谱 Fig.6 HMBC spectrum of compound 1 |
在HSQC谱(图 2)中,dC19.2、21.9分别与H-16、H-17相关,故被归属为C-16、C-17两个甲基碳原子;dC18.0与H-2,dC39.4与H-1b、H-1α,dC37.1与H-3β、H-3α,dC27.8与H-6b、H-6a,dC50.1与H-15b、H-15a的交叉峰表明dC18.0、39.4、37.1、27.8、50.1分别为C-2、C-1、C-3、C-6、C-15五个亚甲基碳原子;从dC47.8与H-5的交叉峰可判定dC47.8为次甲基C-5;同样,由于dC122.7、123.1、124.6分别与H-11、H-12、H-14相关,被分别归属为芳香碳原子C-11、C-12、C-14.
在HMBC谱中,dC41.0与H-16、H-5、H-15a、H-15b、H-6b,dC134.5与H-6b、H-11,dC160.3与H-14、H-12、H-17、H-5,dC39.8与H-17、H-5、H-6a、H-2、H-11,dC145.3与H-14、H-12、H-11存在远程相关,所以dC41.0、134.5、160.3、39.8、145.3被分别归属为C-4、C-8、C-9、C-10、C-13五个季碳原子.另外,dC 42.4与H-6a、H-6b、H-14、H-11,dC83.7与H-6a、H-6b,dC76.5与H-6a存在远程相关,因此dC42.4被归属为C-7,dC83.7、76.5被归属为C60上sp3杂化的桥头碳原子C-18或C-19[15].脱异丙基脱氢枞胺的三个六元环中,与C60相连的六元环为半椅式构象,C-6在环平面的里侧(a位),H-6在空间上接近C-19.由于立体效应,使C-19的电子云密度增加,增大屏蔽效应,化学位移向高场移动,故dC76.5归属为C-19,dC 83.7归属为C-18.
13CNMR谱(图 5)中,在dC149.0~137.8区域,除去已归属的dC140.4 (C-3'、C-4')和dC145.3 (C-13),剩余的43个季碳原子的NMR信号被归属为C60上sp2杂化碳原子.除开桥头两个碳原子C-18、C-19,C60上还有58个碳原子,但谱图中只有43个碳原子共振信号,从13CNMR谱看,在dC 145.3、144.8、143.1、142.2、142.2、142.2处峰强度较大,说明C60上部分碳原子信号已发生重合.
3 结论该论文综合运用1D和2D NMR技术,解析并归属了N,N-四氯邻苯二甲酰基-13-硝基-7,7-C60-脱异丙基脱氢枞胺分子结构的1H和13C NMR信号,为表征类似化合物的结构提供了借鉴和参考.
| [1] | 孙健, 陈德文, 刘杨, 等. C60与某些萘胺衍生物光诱导电子转移反应的ESR研究[J].波谱学杂志, 1999, 16 (4) : 331–334 . Sun Jian, Chen De-wen, Liu Yang, et al. ESR study of photoinduced electrontransfer reaction between C60 and naphthylamine derivatives[J].Chinese J Magn Reson, 1999, 16(4):331–334. |
| [2] | 唐光诗, 朱鹤孙, 董树安. C60的加成反应[J].化学进展, 1997, 9 (3) : 300–310 . Tang Guang-shi, Zhu He-sun, Dong Shu-an. The addition reaction of C60[J].Prog Chem, 1997, 9(3):300–310. |
| [3] | 尚贞锋, 潘荫明, 王海翔, 等. C60加成反应的理论研究[J].高等学校化学学报, 1999, 20 (3) : 432–435 . Shang Zhen-feng, Pan Yin-ming, Wang Hai-xiang, et al. Theoretical study on the addition reaction mechanisms of C60[J].Chem J Chinese U, 1999, 20(3):432–435. |
| [4] | 王飞, 周清梅, 郑立平, 等. 叠氮烷烃环加成反应合成C60衍生物及其聚合物太阳电池的特性[J].高等学校化学学报, 2005, 26 (4) : 719–722 . Wang Fei, Zhou Qing-mei, Zheng Li-ping, et al. Synthesis of C60 fullerene derivatives by azide alkyl cyclo-addition and their optoelectronic performance[J].Chem J Chinese U, 2005, 26(4):719–722. |
| [5] | 丁霞, 林中祥, 邓慧敏. 氯化锌催化下C60与枞酸的反应[J].有机化学, 2007, 27 (2) : 252–254 . Ding Xia, Lin Zhong-xiang, Deng Hui-min. Reaction of C60 with abietic acid catalyzed by ZnCl2[J].Chinese J Org Chem, 2007, 27(2):252–254. |
| [6] | 高健, 林中祥, 邓慧敏, 等. 微波辐射下[60] 富勒烯与脱氢枞胺的加成反应[J].现代化工, 2007, 27 (S1) : 266–268 . Gao Jian, Lin Zhong-xiang, Deng Hui-min, et al. Additive reaction of[60] fullerene and dehydroabietylamine under microwave irradiation[J].Mod Chem Ind, 2007, 27(S1):266–268. |
| [7] | 熊垚, 林中祥, 范旭, 等. C60与N-羧甲基脱氢枞胺的1,3-偶极环加成反应研究[J].化学通报, 2009, 72 (5) : 474–477 . Xiong Yao, Lin Zhong-xiang, Fan Xu, et al. Study on 1,3-dipolar cycloaddition of C60 with N-carboxymethyl dehydroabietylamine[J].Chemistry, 2009, 72(5):474–477. |
| [8] | 范旭, 林中祥, 邓慧敏, 等. 水溶性C60-脱氢枞胺衍生物的合成及生物活性[J].南京林业大学学报:自然科学版, 2012, 36 (2) : 29–34 . Fan Xu, Lin Zhong-xiang, Deng Hui-min, et al. Synthesis and bioactivity study of water-soluble C60-dehydroabietylamine derivatives[J].J Nanjing Forestry Univ:Nat Sci Ed, 2012, 36(2):29–34. |
| [9] | 胡军强, 林中祥. >新型水溶性C60脱氢枞胺吡咯烷衍生物的合成及抗HIV活性[J].南京林业大学学报:自然科学版, 2013, 37 (2) : 147–150 . Hu Jun-qiang, Lin Zhong-xiang. Synthesis and anti-HIV activity of a novel water-soluble C60-dehydroabietylamine pyrrolidine derivative[J].J Nanjing Forestry Univ:Nat Sci Ed, 2013, 37(2):147–150. |
| [10] | 周志, 林中祥. 61-甲基-61-[12-(18-N-四氯邻苯二甲酰亚氨基)脱氢枞胺]-1,2-亚甲基富勒烯[60] 的合成[J].化学通报, 2015, 78 (1) : 80–84 . Zhou Zhi, Lin Zhong-xiang. Synthesis of 61-methyl-61-[12-(18-N-tetrachlorophthalimido) dehydroabietylamine]-1,2-methanofullerene[60][J].Chemistry, 2015, 78(1):80–84. |
| [11] | Zhou Z, Lin Z X, Liang D, et al. First synthesis of ring-B C60-substituted derivatives of N,N-(tetrachlorophthaloyl) dehydroabietylamine[J]. Tetrahedron, 2013, 69(1):43–49. |
| [12] | 周志, 林中祥. N,N-四氯邻苯二甲酰基-13-硝基-7,7-C60-脱异丙基脱氢枞胺的合成[J].合成化学, 2014, 22 (1) : 63–67 . Zhou Zhi, Lin Zhong-xiang. Synthesis of N,N-tetrachlorophthaloyl-13-nitro-7,7-C60-deisopropyldehydroabietylamine[J].Chinese J Synth Chem, 2014, 22(1):63–67. |
| [13] | 安艳捧, 杨晓艳, 李洪德, 等. 大鼠尿液中N-氧化烟酰胺和伪尿嘧啶核苷的NMR分析[J].波谱学杂志, 2014, 31 (2) : 232–242 . An Yan-peng, Yang Xiao-yan, Li Hong-de, et al. NMR analysis of nicotinamide N-Oxide and pseudouridine in rat urine[J].Chinese J Magn Reson, 2014, 31(2):232–242. |
| [14] | Ali I A I, Fathalla W. Synthesis of N-substituted-3,4,5,6-tetrachlorophthalimide using trichloroacetimidate C-C bond formation method[J]. Arkivoc, 2009, 13:193–199. |
| [15] | 刘书芝, 唐光诗. 60] 富勒烯衍生物的对称性、碳笼结构与富勒烯衍生物的对称性、碳笼结构与13C NMR谱[J].化学进展, 2004, 16 (4) : 561–573 . Liu Shu-zhi, Tang Guang-shi. Symmetry, cage structure of[60] fullerene derivatives and 13C NMR spectroscopy[J].Prog Chem, 2004, 16(4):561–573. |
 2016, Vol. 33
2016, Vol. 33



