文章信息
- 刘雅琴, 何玲, 余明新
- LIU Ya-qin, HE Ling, YU Ming-xin
- 新型拟肽cyclo[-RGD-ψ(triazole)-GD-]波谱学数据与结构确证
- An NMR Spectroscopy Study on Peptidomimetics Cyclo[-RGD-ψ(triazole)-GD-]
- 波谱学杂志, 2016, 33(2): 337-344
- Chinese Journal of Magnetic Resonance, 2016, 33(2): 337-344
- http://dx.doi.org/10.11938/cjmr20160215
-
文章历史
收稿日期: 2015-03-27
修订日期: 2016-04-08


DOI:10.11938/cjmr20160215
多肽RGD是一类含有精氨酸-甘氨酸-天冬氨酸(Arg-Gly-Asp)序列的短肽,广泛存在于生物体内,是整合素蛋白与其配体蛋白相互作用的识别位点,这类活性多肽小分子及其模拟物能阻断整合蛋白的粘附作用而抑制肿瘤组织的转移[1].关于RGD多肽的合成、结构改造、药理及临床研究方面的文献[5, 6]报道较少.我们对一种新型结构的RGD拟肽进行了较全面的光谱表征,测定了紫外吸收光谱(UV)、红外吸收光谱(FT-IR)及核磁共振(NMR),波谱(包括1H NMR、1H-1H COSY、13C NMR、DEPT、1H-13C HSQC和1H-13C HMBC)[7],并对所有谱峰进行了归属.通过上述多种波谱技术,我们确证了环状拟肽的结构.上述工作对拟肽的研究提供了更多的结构及波谱信息,为该类多肽的质量研究提供了较为全面的参考依据.

|
| 图1 拟肽cyclo[-RGD-ψ(triazole)-GD-]的化学结构 Fig.1 The structure of peptidomimetics cyclo[-RGD-ψ(triazole)-GD-] |
实验中的拟肽cyclo[-RGD-ψ(triazole)-GD-]由本实验室合成[8],拟肽按照固相多肽合成方法来进行,总体上的制备过程是:①树脂溶胀;②脱保护;③偶联;④再脱保护;⑤再偶联;⑥环合.
1.2 样品检测UV光谱用岛津UV-3150紫外分光光度计(日本岛津公司)测定;FT-IR光谱用Nicolet Nexus 470型红外光谱仪(美国Nicolet公司)测定,KBr压片;1H NMR、1H-1H COSY、13C NMR、DEPT、1H-13C HSQC和1H-13C HMBC谱均用Agilent DD2 600型NMR波谱仪(美国Agilent公司)测定,以D2O为溶剂,1H NMR的观测频率为599.77 MHz,13C NMR的观测频率为150.83 MHz,1H-1H COSY实验两维谱宽均为6 648.9 Hz,采样数据点阵t2×t1 = 1 024×256,HSQC实验中13C维谱宽为30 165.9 Hz,1H维谱宽为9 615.4 Hz,采样数据点阵t2×t1 = 1 024×256,HMBC实验中13C维谱宽为36 199.1 Hz,1H维谱宽为9 615.4 Hz,采样数据点阵t2×t1 = 1 024×256.
2 结果与讨论 2.1 UV光谱分析拟肽cyclo[-RGD-ψ(triazole)-GD-]在水溶液中的最大紫外吸收在267.00 nm处,是由共轭p→p*跃迁产生的吸收带,由于杂环中氮原子的未成键p电子对的p-p共轭作用,使紫外吸收红移.
2.2 FT-IR光谱分析拟肽cyclo[-RGD-ψ(triazole)-GD-]的FT-IR光谱测试采用KBr压片法.在FT-IR光谱中,3 375 cm-1宽峰为缔合羟基O-H伸缩振动吸收峰;3 216 cm-1为酰胺的N-H伸缩振动吸收峰;3 068 cm-1为不饱和烷烃的=C-H伸缩振动吸收峰;2 936 cm-1中强峰为亚甲基C-H的伸缩振动吸收峰;1 667 cm-1为酰胺C=O的伸缩振动吸收峰;1 538 cm-1为酰胺的N-H弯曲振动吸收峰;1 416 cm-1为羧酸的O-H面内弯曲振动吸收峰;1 384 cm-1为不饱和的N=N-N伸缩振动吸收峰;1 200 cm-1为酰胺的C-C-N弯曲振动吸收峰; 1 137 cm-1为C-OH的伸缩振动吸收峰;1 063 cm-1为C-NH2的伸缩振动吸收峰;1 019 cm-1为环状化合物中碳环的呼吸振动峰.具体的FT-IR光谱数据归属见表 1.
| Absorption/cm-1 | Mode of vibration | Group | Intensity |
| 3375 | ν O-H | -OH | 强且宽 |
| 3216 | ν N-H | -NH | 强 |
| 3068 | ν =C-H | =C-H | 中强 |
| 2936 | νas C-H,νs C-H | -CH2 | 中强 |
| 1667 | ν C=O | C=O(仲酰胺) | 强 |
| 1538 | d N-H | NH(仲酰胺) | 强 |
| 1416 | d O-H | OH(羧酸) | 中等 |
| 1384 | νs N=N-N | -N=N-N | 中等 |
| 1200 | d C-C-N | C-C-N | 强 |
| 1137 | ν C-O | C-OH | 强 |
| 1063 | ν C-N | C-NH2 | 强 |
| 1019 | 环呼吸振动 | 环状化合物中碳环 | 中等 |
在1H-1H COSY谱(图 2)中,dH 1.42~1.53与dH 1.60~1.88和dH 3.06~3.09相关,根据文献[1]、积分面积、化学位移和耦合裂分规律,dH 1.42~1.53应归属为H-15,dH 1.60~1.88应归属为H-14,dH 3.06~3.09应归属为H-16.在COSY谱中,dH 4.36~4.38与H-14和H-15相关,被归属为H-1.
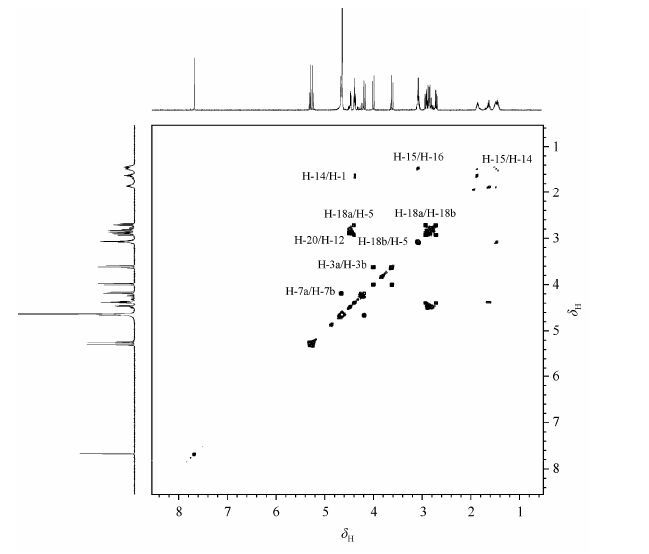
|
| 图2 拟肽cyclo[-RGD-ψ(triazole)-GD-]的1H-1H COSY谱 Fig.2 1H-1H COSY spectrum of peptidomimetics cyclo[-RGD-ψ(triazole)-GD-] |
13C NMR谱(图 3)显示样品含有21个碳原子;DEPT135谱(图 3)显示其中有8个仲碳和4个叔碳,其余均为季碳.在HSQC谱(图 4)中,dC 26.7、30.5、43.0和55.1分别与H-15、H-14、H-16和H-1相关,分别被归属为C-15、C-14、C-16和C-1.
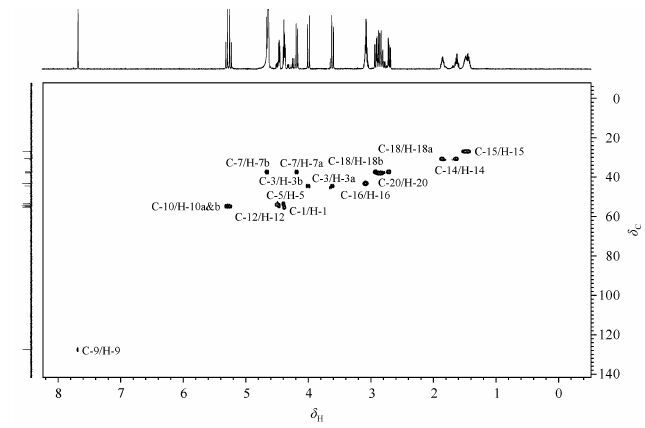
|
| 图3 拟肽cyclo[-RGD-ψ(triazole)-GD-]的DEPT135谱和13C NMR谱 Fig.3 DEPT135 and 13C NMR spectra of peptidomimetics cyclo[-RGD-ψ(triazole)-GD-] |
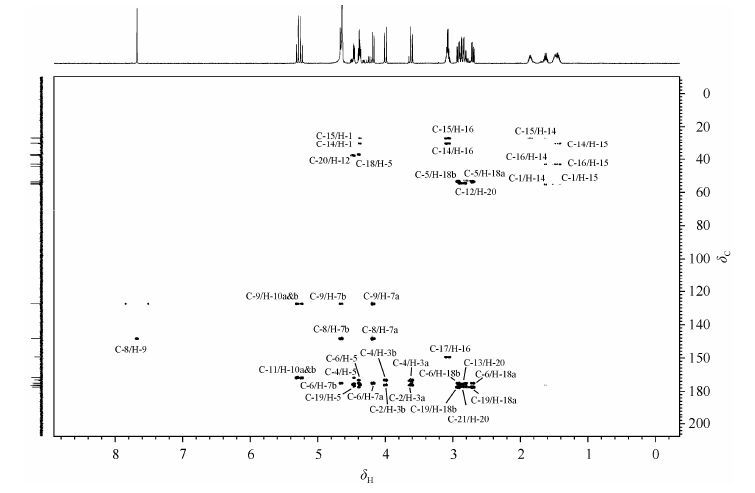
|
| 图4 拟肽cyclo[-RGD-ψ(triazole)-GD-]的1H-13C HSQC谱 Fig.4 1H-13C HSQC spectrum of peptidomimetics cyclo[-RGD-ψ(triazole)-GD-] |
在HMBC谱(图 5和图 6)中,dC 159.3与H-16远程相关,被归属为C-17;d C 176.1与H-1远程相关,被归属为C-2;C-2除与H-1相关外,还与dH 3.61、3.99远程相关,因此dH 3.61、3.99被归属为H-3a、3b.dC 44.3在HSQC谱中与H-3a、3b相关,被归属为C-3.在HMBC谱中,H-3除与C-2远程相关外,还与dC 173.1相关,因此dC 173.1被归属为C-4.

|
| 图5 拟肽cyclo[-RGD-ψ(triazole)-GD-]的1H-13C HMBC谱 Fig.5 1H-13C HMBC spectrum of peptidomimetics cyclo[-RGD-ψ(triazole)-GD-] |

|
| 图6 拟肽cyclo[-RGD-ψ(triazole)-GD-]的关键HMBC相关 Fig.6 Schematic diagram of the key signal of HMBC correlations for peptidomimetics cyclo[-RGD-ψ(triazole)-GD-] |
C-4在HMBC谱中除与H-3相关外,还与d H 4.38~4.40远程相关,因此dH 4.38~4.40被归属为H-5;dC 53.4在HSQC谱与H-5相关,被归属为C-5.dH 2.71和2.92在HMBC中与C-5远程相关,且在HSQC谱对应于同一个碳原子dC 37.1,因此dH 2.71、2.92被归属为H-18a、18b,dC 37.1被归属为C-18.在HMBC谱中,H-18除与C-5相关外,还与dC 175.0、177.4远程相关,而d C 175.0还与dH 4.18、4.65远程相关;dH 4.18、4.65在HSQC谱中对应于同一碳原子dC 37.2.因此dC 175.0被归属为C-6,dC 177.4被归属为C-19,dH 4.18、4.65被归属为H-7a、7b,dC 37.2被归属为C-7.在HMBC谱中,H-7除与C-6远程相关外,还与dC 127.3(叔碳)、148.3(季碳)相关,因此dC 127.3被归属为C-9,dC 148.3被归属为C-8.dH 7.68在HSQC谱中与C-9相关,被归属为H-9.
dH 5.24和5.30在HMBC谱中与C-9远程相关,被归属为H-10a、10b.dC 54.6在HSQC谱中与H-10a,10b相关,被归属为C-10.在HMBC谱中,H-10a,10b除与C-9相关外,还与dC 171.8远程相关,因此dC 171.8被归属为C-11.在HMBC谱中,C-11除与H-10a,10b相关外,还与dH4.45~4.47相关,因此dH 4.45~4.47被归属为H-12.dC 54.3在HSQC谱中与H-12相关,被归属为C-12.dH 2.86在HMBC谱中与C-12相关,被归属为H-20.dC 37.7在HSQC谱与H-20相关,被归属为C-20.在HMBC谱中,H-20除与C-12相关外,还与dC 175.3、176.6相关,而dC 175.3与H-1远程相关,因此dC 175.3被归属为C-13,dC 176.6被归属为C-21.环肽分子中所有的1H和13C NMR归属结果分别列于表 2和表 3.
| Position | dH | Multiplicity | Proton number | 1H-1H COSY |
| 15 | 1.42~1.53 | m | 2H | H-14,H-16 |
| 14 | 1.60~1.88 | m | 2H | H-1,H-15 |
| 18a | 2.71 | dd,J =7.8 Hz,16.8 Hz | 1H | H-5,H-18b |
| 18b | 2.92 | dd,J = 6.6 Hz,16.2Hz | 1H | H-5,H-18a |
| 20 | 2.86 | dd,J =7.2 Hz,12.6 Hz | 2H | H-12 |
| 16 | 3.06~3.09 | m | 2H | H-15 |
| 3a | 3.61 | d,J =17.4 Hz | 1H | H-3b |
| 3b | 3.99 | d,J =18.0 Hz | 1H | H-3a |
| 7a | 4.18 | d,J =15.6 Hz | 1H | H-7b |
| 7b | 4.65 | d,J =15.6 Hz | 1H | H-7a |
| 1 | 4.36~4.38 | m | 1H | H-14 |
| 5 | 4.38~4.40 | m | 1H | H-18a,H-18b |
| 12 | 4.45~4.47 | m | 1H | H-20 |
| 10a | 5.24 | d,J =16.8 Hz | 1H | / |
| 10b | 5.30 | d,J =16.8 Hz | 1H | / |
| 9 | 7.68 | s | 1H | / |
| Position | dC | DEPT | HSQC | HMBC |
| 15 | 26.7 | CH2 | H-15 | H-1,H-14,H-16 |
| 14 | 30.5 | CH2 | H-14 | H-1,H-15,H-16 |
| 18 | 37.1 | CH2 | H-18 | H-5 |
| 7 | 37.2 | CH2 | H-7 | / |
| 20 | 37.7 | CH2 | H-20 | H-12 |
| 16 | 43.0 | CH2 | H-16 | H-14,H-15 |
| 3 | 44.3 | CH2 | H-3 | / |
| 5 | 53.4 | CH | H-5 | H-18a,H-18b |
| 12 | 54.3 | CH | H-12 | H-20 |
| 10 | 54.6 | CH2 | H-10 | / |
| 1 | 55.1 | CH | H-1 | H-14,H-15 |
| 9 | 127.3 | CH | H-9 | H-7a,H-7b,H-10a,H-10b |
| 8 | 148.3 | C | / | H-7a,H-7b,H-9 |
| 17 | 159.3 | C | / | H-16 |
| 11 | 171.8 | C | / | H-10a,H-10b,H-12 |
| 4 | 173.1 | C | / | H-3a,H-3b,H-5 |
| 6 | 175.0 | C | / | H-5,H-7a,H-7b,H-18a,H-18b |
| 13 | 175.3 | C | / | H-1,H-12,H-20 |
| 2 | 176.1 | C | / | H-1,H-3a,H-3b |
| 21 | 176.6 | C | / | H-12,H-20 |
| 19 | 177.4 | C | / | H-5,H-18a,H-18b |
综上分析,目标化合物拟肽cyclo[-RGD-ψ(triazole)-GD-]的1H NMR和13C NMR归属与其结构式一致.拟肽的UV图谱显示出特征官能团,其FFIR光谱中进一步显示出各基团的特征吸收峰.各谱图归属合理,根据以上分析结果确证了拟肽cyclo[-RGD-ψ(triazole)-GD-]的化学结构.
| [1] | Pierschbacher M D, Ruoslahti E. Cell attachment activity of fibronectin can be duplicated by small synthetic fragments of the molecule[J]. Nature, 1984, 309(5963):30–33. |
| [2] | Kovacs Z, De Leon-Rodriguez L M. Conjugation of 1,4,7,10-tetraazacyclododecane-1,4,7,10-tetracetic Acid (DOTA) and its terivatives to peptides:synthesis,applications and future prospects[J]. Mini-Rev Org Chem, 2007, 4(4):281–291. |
| [3] | Wermuth J L. Goodman S, Jonczyk A, et al. Stereoisomerism and biological activity of the selective and superactive αvβ3 integrin inhibitor cyclo(-RGDfV-) and its retro-inverso peptide[J]. J Am Chem Soc, 1997, 119(6):1328-1335. |
| [4] | Rerat V, Dive G, Cordi A A, et al. Alpha v beta 3 integrin-targeting Arg-Gly-Asp (RGD) peptidomimetics containing oligoethylene glycol (OEG) spacers[J]. J Med Chem, 2009, 52(22):7029–7043. |
| [5] | 吴春丽, 李杰明, 魏会杰. 阿托伐他汀内酯的波谱学数据与结构确证[J].波谱学杂志, 2014, 31 (2) : 268–277 . Wu Chun-li, Li Jie-ming, Wei Hui-jie, et al. Spectral analysis and structural elucidation of atorvastatin lactone[J].Chinese J Magn Reson, 2014, 31(2):268–277. |
| [6] | 袁云飞, 洪海, 杨晓云. 嘧螨酯波谱学数据全归属[J].波谱学杂志, 2013, 30 (4) : 567–575 . Yuan Yun-fei, Hong Hai, Yang Xiao-yun, et al. Spectroscopic data of fluacrypyrim and interpretations[J].Chinese J Magn Reson, 2013, 30(4):567–575. |
| [7] | Liu Y Q, Zhang L H, Wan J P, et al. Design and synthesis of cyclo[-Arg-Gly-Asp-Ψ(triazole)-Gly-Xaa-] peptide analogues by click chemistry[J]. Tetrahedron, 2008, 64(47):10728–10734. |
| [8] | Liu X G, Yan X M, Mo W, et al. 1H NMR assignment and secondary structure of recombinant RGD-hirudin[J]. Magn Reson Chem, 2005, 43(11):956–961. |
 2016, Vol. 33
2016, Vol. 33



