文章信息
- 袁金伟, 尹秋月, 李远哲, 毛璞, 杨亮茹, 肖咏梅, 屈凌波
- YUAN Jin-wei, YIN Qiu-yue, LI Yuan-zhe, MAO Pu, YANG Liang-ru, XIAO Yong-mei, QU Ling-bo
- 新型1,3-大豆苷元并噁嗪衍生物的波谱学研究
- A Spectroscopy Study on Novel Daidzein [1,3] Oxazin Derivatives
- 波谱学杂志, 2016, 33(2): 327-336
- Chinese Journal of Magnetic Resonance, 2016, 33(2): 327-336
- http://dx.doi.org/10.11938/cjmr20160214
-
文章历史
收稿日期: 2015-06-29
修订日期: 2016-04-09


DOI:10.11938/cjmr20160214
2. 广西医科大学 药学院, 广西 南宁 530021
2. Pharmaceutical College, Guangxi Medical University, Nanning 530021, China
大豆苷元(7,4'-二羟基异黄酮,图 1)主要存在于豆科植物中,是异黄酮化合物中重要的一种,具有抗氧化、保护心血管、抗癌、类雌激素和治疗骨质疏松等广泛的药理活性[1-4],已被广泛用于食品、药品和化妆品等领域.但是,由于大豆苷元亲水性和亲脂性都较差,导致其口服生物利用度低,从而限制了其在临床上的广泛使用.因此,改善大豆苷元的水溶性或脂溶性,提高其药理活性已成为当前研究的热点[5, 6].1,3-苯并噁嗪类化合物具有抑菌、抗血小板凝聚、抗癌和抗肿瘤等广泛的生物活性[7, 8],且部分1,3-苯并噁嗪衍生物可作为自我免疫或炎症有关趋化因子受体(如CCR2和CCR5)的拮抗剂和潜在表皮生长因子受体(如EGFR酪氨酸激酶)的抑制剂等[9],其作为重要的药效团在药物分子设计中得到广泛应用.本文在超声波辅助下,以大豆苷元、正丁胺和37%的甲醛水溶液为原料,通过一锅煮的方法区域选择性地合成了2种新型的1,3-大豆苷元并噁嗪衍生物.通过SciFinder数据库检索,未发现其结构,由此判定这2种化合物为新的未报道的化合物.
|
| 图1 大豆苷元的化学结构 Fig.1 Structure of daidzein |
本文检测了这2种新型1,3-大豆苷元并噁嗪衍生物的1H和13CNMR图谱,应用DEPT、1H-1H COSY、1H-13C HSQC和1H-13C HMBC等2D NMR技术确证了化合物的结构,对其1H和13CNMR数据进行了全归属和较详细的解析;并且对大豆苷元待定的反应位点进行了确证.
1 实验部分 1.1 仪器及试剂NMR实验在Bruker Avance 400型超导NMR谱仪上测定,样品采用氘代二甲亚砜(DMSO-d6)(购自青岛腾龙微波科技有限公司)为溶剂,四甲基硅烷(TMS)为内标(δ 0.00);高分辨质谱(HR-MS)用美国Waters Micromass公司的Q-Tof MicroTM高分辨质谱仪测定,配备电喷雾离子源(ESI),样品采用甲醇(CH3OH)溶解.大豆苷元(98%)购自陕西慧科植物开发有限公司;叔丁醇(t-BuOH,99%,分析纯)、正丁胺(98%,化学纯)和37%甲醛水溶液(ACS级)均购自上海阿拉丁试剂公司;甲醇、氯仿等均为分析纯,购上海国药集团化学试剂有限公司;柱层析硅胶(300~400目)购自青岛海洋化工有限公司.
1.2 实验方法 1.2.1 1,3-大豆苷元并噁嗪衍生物的合成称取0.5 g(2.0 mmol)大豆苷元置于100 mL烧瓶中,加入10 mL叔丁醇和10 mL水,室温下搅拌溶解.然后向上述溶液中缓慢滴加2.0 mL 37%的甲醛水溶液和1.8 g(6.0 mmol)正丁胺的混合溶液.将烧瓶置于超声清洗器中在65℃下反应,通过薄层色谱(TLC)技术跟踪监测反应.反应结束后,减压蒸除溶剂,残液用硅胶柱层析提纯[洗脱剂:氯仿/甲醇(v/v) = 8/1],得到白色固体4a0.19 g,产率为50 %,熔点为183~184 ℃;红外光谱(IR) (KBr,cm-1):3 436 (-OH),3 085,2 964,2 852 (-CH3,-CH2),1 683 (C=O),1 282 (C-N);HR-MS m/z:C21H22NO4+ [M + H]+计算值为352.154 3,测值为352.154 4.得到白色固体4b0.27 g,产率为30 %,熔点为195~196 ℃;IR (KBr,cm-1):3 091,2 967,2 851 (-CH3,-CH2),1 685 (C=O),1 280 (C-N);HR MS m/z:C27H33N2O4+ [M+H]+计算值为449.243 5,测试值为449.243 4.4a与4b合成路线见图 2.
将化合物4a和4b分别溶于DMSO-d6溶剂中进行NMR测定.1H NMR的观测频率是400.13 MHz,90°脉宽为13.6 μs;13CNMR的观测频率是100.62 MHz,90°脉宽为6.5 μs;1H-1H COSY实验谱宽为8 012 Hz,累加次数为16,采样数据点阵t2× t1= 1 024 × 512,零填充后FT变换点阵F2× F1 = 2 048 × 1 024;HSQC实验中,13C维谱宽为24 038 Hz,1H维谱宽为8 012 Hz,采样数据点阵t2× t1=1 024 × 512;HMBC实验中,13C维谱宽为24 038 Hz,1H维谱宽为8 012 Hz,累加次数为16,d2= 1/2 JCH = 3.45 ms,采样数据点阵t2× t1= 1 024 × 512.
2 结果与讨论在目标化合物的合成中,首先是大豆苷元与甲醛、正丁胺在加热条件下通过Mannish反应生成单取代的胺甲基化产物;然后继续反应生成双取代的胺甲基化产物.在甲醛过量的条件下,大豆苷元的胺甲基化产物将会与甲醛继续发生环合反应形成噁嗪六元环,从而得到2种1,3-大豆苷元并噁嗪衍生物4a和4b.在大豆苷元发生第一步Mannish反应时,其结构中C-6、C-8和C-3'(5')都是可能反应的位点,该反应是否具有特定的反应位点?事实证明确实如此,具体的反应位点通过下面2种化合物1H和13CNMR数据的全归属进行了确证.
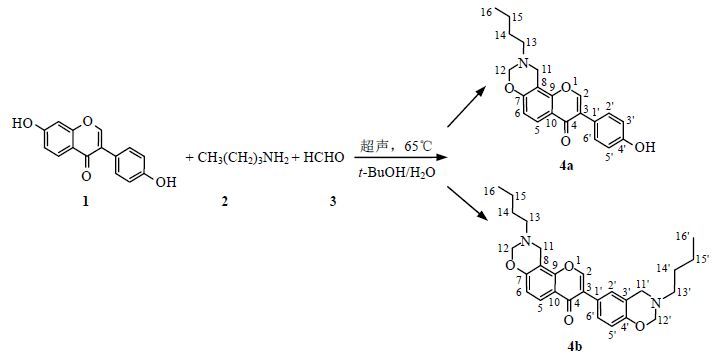
2.1 化合物4a的NMR解析在化合物4a的13CNMR谱中出现了19个信号,分别对应化合物结构中21个碳原子(其中C-2'与C-6',C-3'与C-5'重合).依据DEPT谱可以确定其中有个1伯碳、5个仲碳、5个叔碳和8个季碳.
在1H NMR谱中,根据质子化学位移和偶合裂分规律[10-12],高场区δH2.63 (2H,t,J = 7.2 Hz)、1.46 (2H,m)、1.26 (2H,m)和0.85 (3H,t,J = 7.2 Hz)分别归属为H-13、H-14、H-15和H-16;低场区δH8.27 (1H,s)归属为H-2.在1H-1H COSY谱中,δH2.63与1.46、δH1.46与1.26、δH1.26与0.85相关,进一步证明H-13、H-14、H-15和H-16归属的正确性,δH7.84 (1H,d,J = 8.8 Hz)和δH7.37 (2H,d,J = 8.6 Hz)在COSY谱中分别与 δH6.83 (3H,m)相关,说明δH7.84可能是H-5或H-6;δH7.37可能是H-2',6'或H-3',5';而δH 6.83则包含H-5或H-6和H-2',6'或H-3',5'.由于H-2',6'受到芳香杂环C环的去屏蔽效应影响,化学位移应该较H-3',5'大,处于较低场,所以δH 7.37被归属为H-2',6'.在13C NMR谱中,处于最低场的δC 175.2归属为羰基碳C-4.在HMBC谱中(图 3),C-4分别与δH8.27和7.84远程相关,因此δH7.84 (1H,d,J = 8.8 Hz)归属为H-5,则 δH 6.83 (3H,m)被归属为H-6和H-3',5'.由于H-12受到与其直接相连的杂原子——氮原子和氧原子的影响,其化学位移与H-11相比应该在较低场,所以δH4.95 (2H,s)和4.08 (2H,s)分别被归属为H-12和H-11.

|
| 图3 1,3-大豆苷元并噁嗪衍生物4a的HMBC图谱 Fig.3 HMBC spectrum of daidzein [1, 3] oxazin derivative 4a |
在HSQC谱(图 4)中,δC152.9、124.7、44.5、83.2、51.0、30.0、20.1、14.2和130.5分别与H-2、H-5、H-11、H-12、H-13、H-14、H-15、H-16和H-2',6'相关,应分别归属为C-2、C-5、C-11、C-12、C-13、C-14、C-15、C-16和C-2',6'.在HMBC谱中(图 3),δC 158.7分别与H-5、H-11和H-12远程相关,归属为C-7;δC 157.8分别与H-2',6'和H-3',5'远程相关,且处于较低场,归属为C-4';δC 154.5分别与H-2、H-5和H-11远程相关,归属为C-9;δC 124.2分别与H-2和H-2',6'远程相关,归属为C-3;δC 122.8分别与H-2和H-3',5'远程相关,归属为C-1'.由于H-6与H-3',5'信号峰重合,在HSQC图谱中不易对其碳质子信号进行归属,但是在HMBC图谱中,能够看出δC 115.4与H-2',6'远程相关,所以被归属为C-3',5',则δC 115.2被归属为C-6.在HMBC谱中,δC108.4与H-6和H-11远程相关,归属为C-8.在HMBC谱中,δC 124.7 (C-5)和δC 117.6 (C-10)分别与H-6远程相关;δC 83.2 (C-12)与H-11和H-13远程相关;δC51.0 (C-13)与H-11、H-12、H-14和H-15远程相关;δC 44.5 (C-11)与H-12和H-13远程相关;δC30.0 (C-14)与H-13、H-15和H-16远程相关;δC20.1 (C-15)与H-13和H-16远程相关;δC 14.2 (C-16)与H-14和H-15远程相关.这些相关信号峰的出现进一步证实上述各个碳原子归属的正确性.在13C NMR谱上最后一个未归属的季碳δC 117.6被归属为C-10.
通过2D NMR对化合物4a的1H NMR和13CNMR数据进行了全归属(表 1),可以初步确定NMR数据与其结构一致.同时证实,当大豆苷元发生第一步反应形成大豆苷元胺甲基化产物时,反应位点是8位.
| Position | δC | δH (J/Hz) | HSQC | 1H-1H COSY | HMBC |
| 2 | 152.9 | 8.27 (1H,s) | + | / | / |
| 3 | 124.2 | / | / | / | H-2,2',6' |
| 4 | 175.2 | / | / | / | H-2,5 |
| 5 | 124.7 | 7.84 (1H,d,8.8) | + | H-6 | H-6 |
| 6 | 115.2 | 6.83 (1H,m) | + | H-5 | / |
| 7 | 158.7 | / | / | / | H-5,6,11,12 |
| 8 | 108.4 | / | / | / | H-6,11 |
| 9 | 154.5 | / | / | / | H-2,5,11 |
| 10 | 117.6 | / | / | / | H-6 |
| 11 | 44.5 | 4.08 (2H,s) | + | / | H-12,13 |
| 12 | 83.2 | 4.95 (2H,s) | + | / | H-11,13 |
| 13 | 51.0 | 2.63 (2H,t,7.2) | + | H-14 | H-11,12,14,15 |
| 14 | 30.0 | 1.46 (2H,m) | + | H-13,15 | H-13,15,16 |
| 15 | 20.1 | 1.26 (2H,m) | + | H-14,16 | H-13,16 |
| 16 | 14.2 | 0.85 (3H,t,7.2) | + | H-15 | H-14,15 |
| 1' | 122.8 | / | / | / | H-2,3',5' |
| 2',6' | 130.5 | 7.37 (2H,d,8.6) | + | H-3',5' | H-3',5' |
| 3',5' | 115.4 | 6.83 (2H,m) | + | H-2',6' | H-2',6' |
| 4' | 157.8 | / | / | / | H-2',6',3',5' |
| 注:s表示单峰,d表示双峰,t表示三重峰,m表示多重峰;+表示存在相关;/表示没观测到信号. | |||||
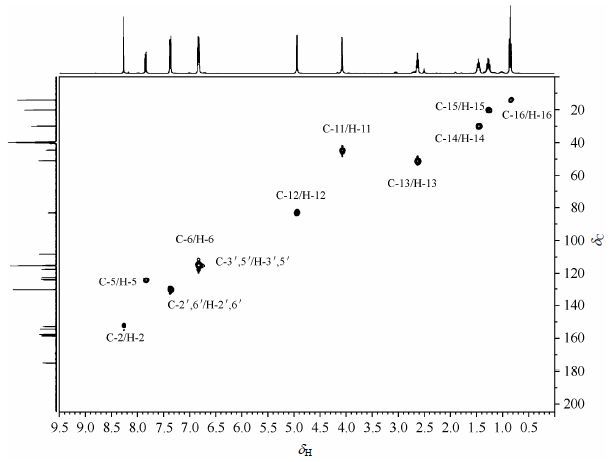
化合物4b的1H NMR与4a明显不同,虽然正丁基上四组质子的化学位移变化不大,但峰的裂分情况变得复杂,且积分面积是原来的2倍;在δH 4.90和4.00附近出现4个单峰,积分结果显示各包含2个质子,这些事实说明该化合物中含有2个带有正丁基的噁嗪环官能团.在化合物4b的1H NMR的低场区,与4a相比,峰变多但裂分很有规律性,且积分面积显示每个峰各包含1个质子,推测第二个含正丁基的噁嗪环与化合物4a的C-3',4'相连.δH 7.20 (1H,d,J = 2.0 Hz)的偶合常数为2.0 Hz,说明该质子位于苯环上,且受间位质子影响而裂分;δH 7.26 (1H,dd,J = 8.4 Hz,2.0 Hz),说明该氢原子受到苯环上邻位和间位质子共同影响而裂分;结合前面对化合物4b结构的推测可知,δH 7.20被归属为H-2',δH 7.26被归属为H-6',相应的δH 6.74 (1H,d,J = 8.4 Hz)被归属为H-5'.
通过化合物4b的2D NMR谱图(其HSQC和HMBC图谱分别见图 5和图 6),对化合物4b的1H NMR和13CNMR数据进行了全归属(表 2),可以初步确定NMR数据与其结构一致.同时证实,当大豆苷元与正丁胺和37%的甲醛发生反应时,反应位点是8位和3'或5',反应首先形成大豆苷元胺甲基化产物,继续发生环合反应则生成目标化合物4b.
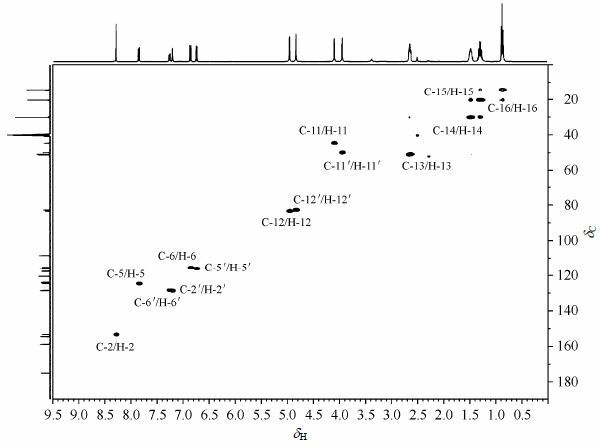
|
| 图5 1,3-大豆苷元并噁嗪衍生物4b的HSQC图谱 Fig.5 HSQC spectrum of daidzein [1, 3] oxazin derivative 4b |
| Position | δC | δH (J/Hz) | HSQC | 1H-1H COSY | HMBC |
| 2 | 153.2 | 8.29 (1H,s) | + | / | / |
| 3 | 123.9 | / | / | / | H-2,2' |
| 4 | 175.1 | / | / | / | H-2,5 |
| 5 | 124.7 | 7.85 (1H,d,8.8) | + | H-6 | H-6 |
| 6 | 115.3 | 6.86 (1H,d,8.8) | + | H-5 | H-5 |
| 7 | 158.8 | / | / | / | H-5,6,11,12 |
| 8 | 108.5 | / | / | / | H-6,11 |
| 9 | 154.5 | / | / | / | H-2,5,11 |
| 10 | 117.6 | / | / | / | H-6 |
| 11 | 44.6 | 4.09 (2H,s) | + | / | H-12,13 |
| 11' | 49.8 | 3.95 (2H,s) | + | / | H-2',12',13' |
| 12 | 83.3 | 4.96 (2H,s) | + | / | H-11,13 |
| 12' | 82.6 | 4.83 (2H,s) | + | / | H-11',13' |
| 13 | 51.0 | 2.64 (2H,m) | + | H-14(14') | H-11,12,14,15 |
| 13' | 50.7 | 2.64 (2H,m) | + | H-14(14') | H-11',12',14',15' |
| 14(14') | 30.0 | 1.48 (4H,m) | + | H-15(15') | H-13 (13'),H-16 (16') |
| 15(15') | 20.2 | 1.28 (4H,m) | + | H-16(16') | H-13 (13'),H-16 (16') |
| 16(16') | 14.2 | 0.89 (6H,t,7.2) | + | H-15(15') | H-14 (14'),H-15 (15') |
| 1' | 124.1 | / | / | / | H-2,H-5',H-6' |
| 2' | 128.6 | 7.20 (1H,d,2.0) | + | / | H-6',H-11' |
| 3' | 120.5 | / | / | / | H-5',H-11' |
| 4' | 154.3 | / | / | / | H-2',H-5',H-6',H-11',H-12' |
| 5' | 115.9 | 6.74 (1H,d,8.4) | + | H-6' | / |
| 6' | 128.4 | 7.26 (1H,dd,8.4,2.0) | + | H-5' | H-2' |
| 注:s表示单峰,d表示双峰,t表示三重峰,m表示多重峰;+表示存在相关;/表示没有检测到信号. | |||||
本文以大豆苷元、正丁胺和37%的甲醛水溶液为原料,在超声辅助下,通过一锅煮的方法区域选择性地合成了2种新型1,3-大豆苷元并噁嗪衍生物4a和4b.通过DEPT、1H-1H COSY、1H-13C HSQC和1H-13C HMBC等2D NMR谱图确证了目标化合物的结构,对其1H和13CNMR数据进行了全归属.
| [1] | Wu S Y, Brewer M S. Soy protein isolate antioxidant effect on lipid peroxidation of grouond beef and microsomal lipids[J]. J Food Sci, 1994, 59(4):702–706. |
| [2] | Colditz G A, Stampfer M J, Willett W C, et al. Type of postmenopausal hormone use and risk of breast cancer:12-year follow-up from the nurses' health study[J]. Cancer Causes Control, 1992, 3(5):433–439. |
| [3] | Yadav D K, Gautam A K, Kureel J, et al. Synthetic analogs of daidzein, having more potent osteoblast stimulating effect[J]. Bioorg Med Chem Lett, 2011, 21(2):677–681. |
| [4] | 彭游, 邓泽元, 叶志刚. 大豆苷元的前药修饰研究进展[J].化学通报, 2011, 74 (6) : 508–512 . Peng You, Deng Ze-yuan, Ye Zhi-gang. Progress in prodrug modification of daidzein[J].Chemistry, 2011, 74(6):508–512. |
| [5] | 陈晓岚, 石晓娜, 屈凌波, 等. 大豆苷元磷酰化产物的结构确定[J].波谱学杂志, 2007, 24 (1) : 85–90 . Chen Xiao-lan, Shi Xiao-na, Qu Ling-bo, et al. The phosphorylation reaction between daidzein and diisopropyl phosphite studied by NMR and ESI MS/MS[J].Chinese J Magn Reson, 2007, 24(1):85–90. |
| [6] | 刘谦光, 张尊听, 薛东. 大豆苷元磺化物的合成、晶体结构及活性研究[J].高等学校化学学报, 2003, 24 (5) : 820–825 . Liu Qian-guang, Zhang Zun-ting, Xue Dong. Synthesis, crystal structure and activity of sulfated daidzein[J].Chem J Chinese U, 2003, 24(5):820–825. |
| [7] | Wang S, Li Y, You Q, et al. Novel hexacyclic camptothec in derivatives. Part 1:Synthesis and cytotoxicity of camptothecins with an a-ring fused 1,3-oxazine ring[J]. Bioorg Med Chem, 2008, 18(14):4095–4097. |
| [8] | 唐子龙, 夏赞稳, 王宏清, 等. 2,3-二芳基-1,3-苯并噁嗪的合成及杀菌活性[J].应用化学, 2015, 32 (2) : 143–150 . Tang Zi-long, Xia Zan-wen, Wang Hong-qing, et al. Synthesis and fungicidal activities of 2,3-diaryl-1,3-benzoxazines[J].Chin J Appl Chem, 2015, 32(2):143–150. |
| [9] | Chen S, Li X, Wan S, et al. Synthesis of novel benzoxazinone compounds as epidermal growth factor receptor (EGRF) tyrosine kinase inhibitors[J]. Synthetic Commun, 2012, 42(19):2937–2946. |
| [10] | 赵天增. 核磁共振氢谱[M]. 北京: 北京大学出版社, 1983 : 107 -173 . Zhao Tian-zeng. Proton NMR Spectroscopy[M]. Beijing: Peking University Press, 1983 : 107 -173 . |
| [11] | 宁永成. 有机化合物结构鉴定与有机波谱学[M]. 北京: 科学出版社, 2000 . Ning Yong-cheng. Structural Identification of Organic Compounds and Organic Spectroscopy[M]. Beijing: Science Press, 2000 . |
| [12] | 袁金伟, 陈晓岚, 屈凌波, 等. 一种新型的喹啉-4-氨基磷酸酯衍生物的波谱学研究[J].波谱学杂志, 2009, 26 (1) : 95–102 . Yuan Jin-wei, Chen Xiao-lan, Qu Ling-bo, et al. Spectroscopic characterization of a novel quinoline-4-phosphoramidate derivative[J].Chinese J Magn Reson, 2009, 26(1):95–102. |
 2016, Vol. 33
2016, Vol. 33