文章信息
- 王强, 李玉江, 陶乐, 郭晓河, 董黎红, 宋传君, 常俊标
- WANG Qiang, LI Yu-jiang, TAO Le, GUO Xiao-he, DONG Li-hong, SONG Chuan-jun, CHANG Jun-biao
- 胞苷盐酸盐的质子化位置研究
- Positions of Protonation in Cytidine Hydrochloride Revealed by NMR Spectroscopy
- 波谱学杂志, 2016, 33(2): 281-287
- Chinese Journal of Magnetic Resonance, 2016, 33(2): 281-287
- http://dx.doi.org/10.11938/cjmr20160210
-
文章历史
收稿日期: 2015-06-01
修订日期: 2016-04-12


DOI:10.11938/cjmr20160210
2. 郑州大学 化学与分子工程学院, 河南 郑州 450001
2. College of Chemistry and Molecular Engineering, Zhengzhou University, Zhengzhou 450001, China
核苷类药物是当前治疗艾滋病的重要药物之一[1].目前用于治疗艾滋病的核苷类药物共有8种[2],但是由于病毒株变异产生耐药性及长期毒性等原因,需要设计合成新型的、低毒性的、能够抑制变异病毒株的核苷类药物[3-7].本实验室前期合成的2′-脱氧-2′-氟-4′-取代核苷即为这类化合物[8, 9].碱性药物与有机酸或者无机酸成盐后,能够提高水溶性、降低结晶纯化难度、增强稳定性并延长药物保质期[10].胞苷类药物具有碱性中心,可与酸成盐,成盐后其水溶性大大提高.胞苷含有两个氮原子,即两个质子受体,是哪个或者两个氮原子均接受质子,以及成盐后其核磁共振(NMR)谱的变化,目前还未见报道.本文研究了本实验室合成的两个4′-取代胞苷(化合物1和2,图 1)及其对应盐酸盐(化合物S1和S2,图 1)的成盐位置和成盐前后核磁共振氢谱(1H NMR)和碳谱(13C NMR)的化学位移变化.

|
| 图1 化合物1、2及其盐酸盐S1、S2的结构 Fig.1 The structures of compounds 1,2 and their hydrochloride salts S1,S2 |
根据文献[11]方法合成了本次实验用的核苷及其盐酸盐.
1.2 NMR实验 1.2.1 实验仪器所有常规NMR实验均在Bruker Avance 300型超导NMR波谱仪上于298 K下测定,其中1H NMR、13C NMR和DEPT-135采用5 mm QNP探头测定,其他2D NMR实验采用5 mm BBI探头测定.变温1H NMR实验在Bruker Avance 300型超导NMR谱仪上采用5 mm QNP探头测定,变温范围为293~333 K,步进10 K.
1.2.2 实验试剂实验用溶剂氘代二甲亚砜(DMSO-d6)和重水(D2O)均购自Aldrich公司,氘代率均为99.9%.DMSO-d6中含有0.03%(v/v)的内标四甲基硅烷(TMS),D2O中含有0.05 wt %的内标3-(三甲基硅基)氘代丙酸钠(TSP).
1.2.3 实验条件1H NMR的实验脉冲序列为zg30,共振频率为300.13 MHz,谱宽为6 kHz,90°脉宽为7.20 μs,采样时间为2.7 s,弛豫等待时间为2.0 s,扫描16次.13C NMR的实验脉冲序列为zgpg,共振频率为75.47 MHz,谱宽为22.7 kHz,90°脉宽为16 μs,采样时间为0.72 s,弛豫等待时间为2.0 s,扫描9 000次.DEPT-135实验脉冲序列为dept135,其他参数同13C NMR.1H-1H COSY实验脉冲序列为cosydfph,F2维(1H)和F1维(1H)谱宽均为2 185 Hz,采样数据点阵t2×t1 = 2 048×256,累加扫描8次,弛豫等待时间为2.0 s.HMQC的实验脉冲序列为hmqcgpqf,F2维(1H)谱宽为2 185 Hz,F1维(13C)谱宽为11 700 Hz,采样数据点阵t2×t1 = 2 048 ×256,累加扫描8次,弛豫等待时间为2.0 s.HMBC的实验脉冲序列为hmbcgplpndqf,其他参数同HMQC.DMSO-d6为溶剂时,1H NMR内标为TMS(δH 0.00),13C NMR内标为溶剂(δC 39.5);溶剂为D2O时,内标均为TSP(δH 0.00,δC 0.0).
所有样品的1H和13C NMR谱图数据经由1H NMR、13CNMR、DEPT-135、1H-1H COSY、HMQC和HMBC图谱联合解析确认.
文中所有图谱均用Mestrenova V10.0(Mestrelab Research,Spain)处理.
2 结果与讨论判断化合物的绝对构型,X-射线单晶衍射是最有力的工具.通过重结晶,我们得到了化合物S2的单晶,并通过X-射线单晶衍射得到了S2的一些具体结构信息.遗憾的是,X-射线单晶衍射不能够对S2中质子的位置进行确定,因此无法判断成盐位置在NH2还是N-3.
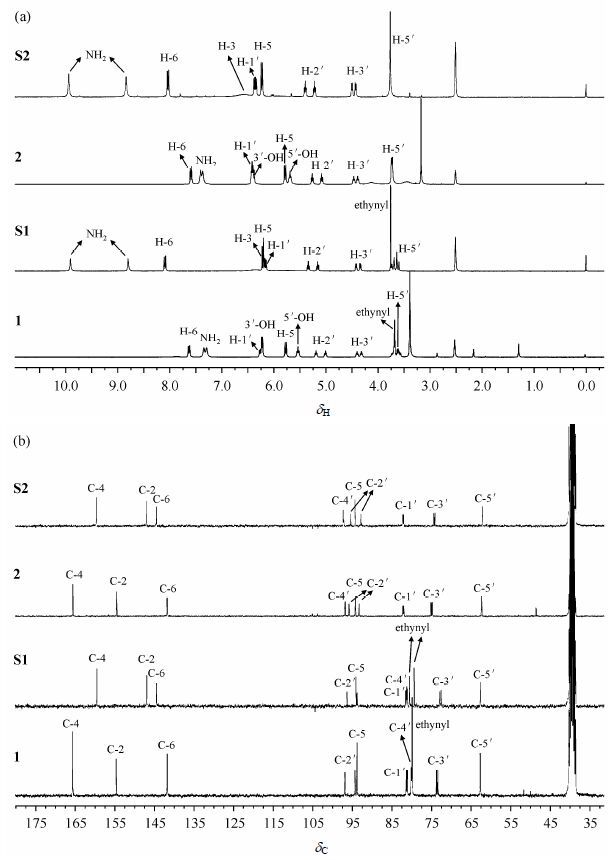
2.1 胞苷成盐前后的NMR数据分析化合物1、2及其盐酸盐S1,S2的1H和13C NMR谱图对比图见图 2(溶剂为DMSO-d6).
|
| 图2 化合物1、S1、2及S2的核磁共振(a)氢谱和(b)碳谱(DMSO-d6) Fig.2 (a) 1H and (b) 13C NMR spectra of compounds 1,S1,2 and S2 (DMSO-d6) |
图 2(a)中,化合物1中NH2的两个质子显示为两个宽峰且部分重叠,而成盐以后(化合物S1)这两个质子显示为两个独立的尖锐单峰,且较成盐前向低场位移;成盐后H-5和H-6稍稍向低场位移,这是由成盐后电荷的离域作用所致;而成盐前后糖环上质子的化学位移没有明显变化;成盐后3′-和5′-OH在1H NMR谱上消失,这可能是由于成盐后盐酸质子与溶剂中残留活泼质子之间的快速交换所致,由于3′-和5′-OH的消失,它们和相邻质子(H-3′、H-5′)之间的偶合也随之消失.化合物1和S1的13C NMR谱图[图 2(b)]显示:成盐以后化合物的C-2和C-4较成盐前向高场位移,但C-6向低场位移,这是由电子效应和中介效应的共同影响所致;除此之外,其他碳原子的化学位移成盐前后没有明显变化.化合物2成盐前后的变化趋势与化合物1相同.当溶剂改为D2O时(图未显示),除了因与D2O的交换导致活泼质子的信号消失外,其余变化趋势仍与在DMSO-d6溶剂中相同,这个结果表明该类化合物成盐后的成盐位置是固定的,不会因为溶剂的改变而发生变化.化合物1、2、S1和S2嘧啶环的1H和13C NMR数据见表 1和表 2.
| Position | δH (DMSO-d6) | δH (D2O) | ||||||
| 1 | S 1 | 2 | S2 | 1 | S1 | 2 | S2 | |
| H-5 | 5.78 | 6.23 | 5.75 | 6.21 | 6.05 | 6.26 | 6.06 | 6.22 |
| H-6 | 7.59 | 8.04 | 7.61 | 8.09 | 7.71 | 7.94 | 7.74 | 7.94 |
| NH2 |
7.33
7.28 |
9.91
8.80 |
7.41
7.37 |
9.94
8.84 |
/ | / | / | / |
| Position | δC (DMSO-d6) | δC (D2O) | ||||||
| 1 | S1 | 2 | S2 | 1 | S1 | 2 | S2 | |
| C-2 | 154.6 | 147.0 | 154.7 | 148.0 | 159.9 | 151.1 | 160.0 | 151.7 |
| C-4 | 165.6 | 159.6 | 165.7 | 159.5 | 169.1 | 162.3 | 169.1 | 162.8 |
| C-5 | 94.3 | 94.4 | 93.9 | 94.1 | 99.0 | 98.2 | 98.8 | 98.1 |
| C-6 | 141.8 | 144.5 | 141.8 | 144.5 | 144.8 | 147.6 | 145.0 | 147.6 |
除常用一维(1D)和二维(2D)NMR实验外,化合物2和S2的NMR变温实验也证明了成盐后位于δH 8.84和δH 9.94的两个尖锐单峰是NH2上的两个质子(图 3和图 4).当升温到313 K时,化合物2中NH2两个质子峰重合(图 3);随着温度的提高,化合物S2的相对于H-5处于cis和trans位的NH2质子在1H NMR谱中也表现出重合的趋势(图 4),且这两个质子的峰形均由尖锐逐渐变宽,由于仪器的限制实验只升温到333 K,如果能够继续提高温度,这两个质子必然会重合[1].这个结果说明化合物成盐后NH2两个质子自由旋转的位阻远远大于成盐前,另外,化合物2的3′-和5′-OH上质子的化学位移随着温度升高向高场位移,这是由温度升高导致分子间氢键断裂所致.

|
| 图3 化合物2在溶剂DMSO-d6中的变温1H NMR谱图 Fig.3 1H NMR spectra of compound 2 at different temperature in DMSO-d6 |

|
| 图4 化合物S2在DMSO-d6中的变温1H NMR谱图 Fig.4 1H NMR spectra of compound S2 at different temperature in DMSO-d6 |
综合所有数据,我们推断出这类核苷成盐的位置应该是在N-3而非NH2(图 5),因为假如胞嘧啶核苷的成盐位置在NH2上,成盐后C-4将向高场位移,而C-6和C-2将向低场位移;如果成盐位置在N-3,则C-2和C-4向高场位移,C-6向低场位移.这个结果与Becker等人[11-13]的研究结果类似.而且这一结果已经被本实验室苯胺、吡啶及其盐酸盐数据所证实(数据未列出).此外,成盐后NH2两个质子的化学位移超过1,说明C-4和NH2之间的键在成盐后具有部分双键性质,导致NH2的两个质子不能自由旋转,相对于H-5分别处于cis和trans位,从而造成化学位移的差异.

|
| 图5 质子化后胞苷的结构 Fig.5 The structure of protonated cytidine |
该文对4′-取代胞苷及其盐酸盐的1H和13C NMR谱图进行了研究.成盐前后碳原子化学位移的变化,表明了该类核苷成盐后的质子化位置在N-3而非NH2;成盐前后的质子的化学位移变化及变温1H NMR实验,表明C-4和NH2之间的共价键在成盐后具有部分双键性质.这一研究表明在探究有机物成盐的质子化位置方面,NMR是一个快捷方便的工具.
| [1] | Garima K, Ramendra K S. Anti-HIV drug development:structural features and limitations of present day drugs and future challenges in the successful HIV/AIDS treatment[J]. Curr Pharm Design, 2013, 19(10):1767–1783. |
| [2] | de Clercq E. Anti-HIV drugs:25 compounds approved within 25 years after the discovery of HIV[J]. Int J Antimicrob Ag, 2009, 33(4):307–320. |
| [3] | Siddiqui M A, Hughes S H, Boyer P L, et al. A 4'-C-ethynyl-2',3'-dideoxynucleoside analogue highlights the role of the 3'-OH in anti-HIV active 4'-C-ethynyl-2'-deoxy nucleosides[J]. J Med Chem, 2004, 47(21):5041–5048. |
| [4] | Ohrui H, Kohgo S, Kitano K, et al. Syntheses of 4'-C-ethynyl-β-D-arabino- and 4'-C-ethynyl-2'-deoxy-β-D-ribopentofuranosylpyrimidines and-purines and evaluation of their anti-HIV activity[J]. J Med Chem, 2000, 43(23):4516–4525. |
| [5] | Haraguchi K, Takeda S, Tanaka H. Ring opening of 4',5'-epoxynucleosides:A novel stereoselective entry to 4'-C-branched nucleosides[J]. Org Lett, 2003, 5(9):1399–1402. |
| [6] | Haraguchi K, Shimada H, Tanaka H, et al. Synthesis and anti-HIV activity of 4'-substituted 4'-thiothymidines:A new entry based on nucleophilic substitution of the 4'-acetoxy group[J]. J Med Chem, 2008, 51(6):1885–1893. |
| [7] | Smith D B, Kalayanov G, Sund C, et al. The design, synthesis, and antiviral activity of monofluoro and difluoro analogues of 4'-azidocytidine against hepatitis C virus replication:the discovery of 4'-azido-2'-deoxy-2'-fluorocytidine and 4'-azido-2'-dideoxy-2',2'-difluorocytidine[J]. J Med Chem, 2009, 52(9):2971–2978. |
| [8] | Wang Q, Li Y F, Song C J, et al. Synthesis and anti-HIV activity of 2'-deoxy-2'-fluoro-4'-C-ethynyl nucleoside analogs[J]. Bioorg Med Chem Lett, 2010, 20(14):4053–4056. |
| [9] | Wang Q, Hu W D, Wang S Y, et al. Synthesis of new 2'-deoxy-2'-fluoro-4'-azido nucleoside analogues as potent anti-HIV agents[J]. Eur J Med Chem, 2011, 46(9):4178–4183. |
| [10] | Stahl P H, Wermuth C G. Handbook of Pharmaceutical Salts-Properties, Selection, and Use[M]. Zurich: Wiley-VCH, 2002 . |
| [11] | Becker E D, Miles H T, Bradley R B. Nuclear magnetic resonance studies of methyl derivatives of cytosine[J]. J Am Chem Soc, 1965, 87(24):5575–5582. |
| [12] | Miles H T, Bradley R B, Becker E D. Tautomerism and site of protonation of 1-methylcytosine:proof by nuclear magnetic resonance spin-spin coupling[J]. Science, 1963, 142(3599):1569–1571. |
| [13] | Lech K, Hanna S G, Wlodzimierz K, et al. Comparative structural analysis of cytidine, ethenocytidine and their protonated salts Ⅲ. 1H, 13C and 15N NMR studies at natural isotope abundance[J]. Nucleic Acids Res, 1984, 12(4):2205–2223. |
 2016, Vol. 33
2016, Vol. 33



