文章信息
- 马婧, 孙鹏, 刘买利, 张许, 张先荣
- MA Jing, SUN Peng, LIU Mai-li, ZHANG Xu, ZHANG Xian-rong
- 大鼠脑组织含磷代谢物随年龄变化的NMR研究
- NMR-Based Analysis of Age-Related Changes of Phosphate Metabolites in Rat Brain
- 波谱学杂志, 2016, 33(2): 236-243
- Chinese Journal of Magnetic Resonance, 2016, 33(2): 236-243
- http://dx.doi.org/10.11938/cjmr20160206
-
文章历史
收稿日期: 2016-02-03
修订日期: 2016-04-09


DOI:10.11938/cjmr20160206
2. 波谱与原子分子物理国家重点实验室, 武汉磁共振中心(中国科学院 武汉物理与数学研究所), 湖北 武汉 430071
2. State Key Laboratory of Magnetic Resonance and Atomic and Molecular Physics, National Center for Magnetic Resonance in Wuhan(Wuhan Institute of Physics and Mathematics, Chinese Academy of Sciences), Wuhan 430071, China
人口老龄化已成为全球关注的重要问题.中国作为一个人口大国,人口老龄化问题尤为严重.预计到2050年,中国老龄人口将超过4亿人,接近人口总数的30%[1],随之而来的是衰老相关的退行性疾病发病率的显著升高,这将给社会经济发展及医疗资源带来沉重负担.在人体衰老过程中,细胞、组织和脏器功能呈渐进性失调.其中,神经系统退行性改变是衰老相关的人体机能衰退的主要表现之一,个体的学习、认知和运动等机能随衰老呈渐进性减退[2].机能的退行性减退与神经系统微结构改变密切相关,表现为神经元体积降低、细胞数量减少、皮层厚度的进行性变薄[3, 4].
年龄相关性脑组织微结构和功能改变往往伴随脑区神经化学成分的改变,因此脑区神经化学组分及含量的改变可反映其功能状态及神经病理变化[5].基因组扫描研究发现,脑组织中的基因表达情况与年龄相关:衰老个体的胶质细胞源性、炎症及细胞防御相关的基因表达上调;而神经元源性、细胞信号传递相关的基因表达下调[6].此外,脑组织代谢更活跃、耗氧量大,在高度活跃的代谢过程中产生大量活性氧可引起氧应激,进而引起脂质、蛋白质及DNA修饰,导致胶质细胞增多、钙离子及线粒体介导的神经元功能改变,是介导衰老相关神经元损伤的重要因素[6].
本课题组前期工作应用高分辨魔角旋转(HR MAS)1H NMR方法,研究了不同年龄Sprague-Dawley(SD)大鼠(幼年、中年和老年)各脑区的代谢变化.结果表明,随着年龄增长,学习记忆及运动调节相关脑区的代谢物均呈现特征性改变,其中能量代谢标志物如肌醇(myo-inositol)、肌酐(creatine)等含量明显增加;细胞膜代谢相关标志物如胆碱及磷酸化胆碱复合物的含量明显增加[7, 8].基于前期结果我们推测,细胞能量代谢及细胞膜代谢随年龄增长发生了改变.
细胞膜磷脂是脑组织的重要组成部分,其成分和含量的改变在衰老相关的神经退行性疾病中发挥重要作用[9].脑组织细胞能量代谢和细胞膜代谢会产生大量含磷复合物,如磷脂酰胆碱(phosphatidylcholine,PC)、磷酸胆碱(phosphorylcholine,PCh)、磷酸乙醇胺(phosphoethanolamine)、磷酸二酯(phosphodiesters)和甘油磷酸胆碱(glycerophosphocholine)[10].磷脂类物质成分及含量改变与疾病发生密切相关,有临床资料[11]报道,老年脑组织pH值降低,磷酸肌酸(phosphocreatine,PCr)含量显著升高.因此,应用核磁共振磷谱(31P NMR)可采集组织中含磷分子代谢物的结构和含量变化等信息,本研究通过应用31P NMR检测不同时期大鼠脑中含磷代谢物的变化,以期进一步明确这些物质在脑衰老过程中的变化,探讨脑衰老的可能分子机制,为脑衰老的临床早期诊断提供实验依据.
1 实验部分 1.1 仪器及试剂本实验中所用NMR谱仪为Bruker AVANCE III 500 MHz NMR谱仪;蛋白冷冻干燥机为Thermo公司MODULYOD-230;组织匀浆机为QIAGEN的Tissuelyzer.D2O和乙腈购自上海Sigma Aldrich公司;甲醇购自上海阿拉丁生化科技股份有限公司;氯仿购自上海江莱生物科技有限公司.
1.2 动物分组及处理此研究中所有的动物实验均遵照武汉大学动物伦理委员会发布的实验动物使用规则进行(许可证号:14016).清洁级SD大鼠从武汉大学动物实验中心处购得.大鼠断奶后随机分组并分笼喂养,室温控制在(25±3)℃,相对湿度为50%~70%,12 h交替照明.将各组(12只/每组)大鼠分别喂养至幼年(1~2月龄)、中年(5~6月龄)和老年(22~24月龄)阶段,分别处死取脑组织.
1.3 大鼠脑组织磷脂提取将大鼠用颈椎脱臼法处死,迅速取出脑组织并冻存于液氮中,以迅速终止可能的生理化学反应.冷冻后的脑组织放置在-80 ℃冰箱中保存.组织萃取在NMR实验前1 d进行,以进一步防止可能的生理化学反应影响实验测定结果.萃取在冰浴的表面皿上进行,称取60~80 mg脑组织在表面皿中切碎,随后用刀片把浆状的组织挑起至装有0.5 mL 50%冰乙腈溶液和一颗钢珠的2 mL玻璃离心管中.在 Tissuelyzer 上以20 Hz频率振荡破碎1.5 min,随后冰浴静置4 min;离心(4 ℃,10 000 rpm)10 min.将上清用甲醇/氯仿溶液(v∶v = 1∶3)反复提取3次.抽干有机溶剂,并冷冻干燥24 h.
1.4 大鼠脑组织提取物的31PNMR 检测在进行NMR实验前,将大鼠脑提取物冻干粉末溶解于550 μL D2O中,将溶解物转入NMR样品管中进行31P NMR检测.31P核的共振频率为202.4 MHz,实验温度为 25 ℃.采样参数设置如下:谱宽为6 075 Hz,采样点数为12 288,累加次数为8 192,空扫次数为4,弛豫等待时间为1 s.所得的31P NMR谱经傅里叶变换,以PCr定标(δP2.33).二维1H-31P异核相关谱(HETCOR)实验所用异核极化转移时间为71.4 ms,对应J耦合常数为7 Hz,直接维和间接维采样点分别为2 048和256,累加次数为64,空扫次数为32,弛豫等待时间为1 s.
1.5 统计分析实验数据采用SPSS Statistics统计软件处理,以均值±标准差(mean±SD)方式表示,组间比较采用单因素方差分析(one-way ANOVA)检验(p < 0.05).
2 结果与讨论 2.-1 不同年龄大鼠脑组织提取物的31P NMR谱图分析图 1是幼年、中年及老年大鼠脑组织提取物的典型31P NMR谱图.代谢物的归属根据相关文献报道[12, 13]进行.从图中可以看出,利用31P NMR波谱可以检测到大鼠脑组织的多种内源性含磷化合物,如PC、PCr、磷酸肌醇(myo-inositol phosphates,PmI)和PCh.且大鼠脑组织中含磷化合物的组成和强度随年龄增长均发生变化.老年大鼠脑组织中PCh和PC的含量明显减少,特别是PC,其信号在中年期就已经接近消失.另外可以发现,在低场区,这些物质的化学位移均有明显改变,这主要是由相关组织的离子浓度或者pH不同造成的.信号强度的变化提示可能某种物质的含量或结构随年龄发生了改变.需要指出的是:在实验过程中,无机磷(Pi)的含量会随着时间的增加而发生微弱改变,主要原因在于其他含磷代谢物的磷酸基团会发生解离.因此在具体实验过程中,我们为保持样品稳定性、减少实验误差,采样时间不超过40 min.
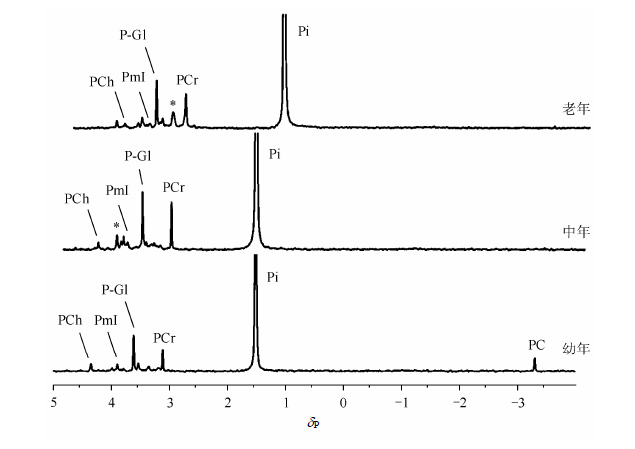
|
| 图1 幼年、中年及老年大鼠脑组织提取物的31P NMR谱图.PC: 磷脂酰胆碱;Pi:无机磷;PCr:磷酸肌酸;P-Gl:磷酸化葡萄糖;PmI:磷酸肌醇;PCh:磷酸胆碱;*:未确定的代谢物 Fig.1 31P NMR spectra of brain extract from SD rats at the stage of young,adult and old. PC: phosphatidylcholine; Pi: inorganic phosphorus; PCr: phosphocreatine; P-Gl: glucose phosphates; PmI: myo-inositol phosphates; PCh: phosphorylcholine; *: uncertain metabolites |
为进一步明确这些含磷代谢物的结构及组成变化,我们应用1H-31P HETCOR对组织提取物的成分进行了检测,结果见图 2.从图中可以看到,不同年龄大鼠脑组织提取物的相关谱存在明显差异.中年和老年大鼠脑提取物谱图中谱峰的数量明显增加,结合文献[14]可知,这些增加的物质为磷酸化葡萄糖(glucose phosphates,P-Gl).而且,虽然中年和老年大鼠脑组织提取物都存在P-Gl,但其相关谱的化学位移分布存在明显差异,表明P-Gl的磷酸化位点可能有所不同.这一结果提示,在老龄化过程中,大鼠脑组织中P-Gl可能存在不同的磷酸化位点.
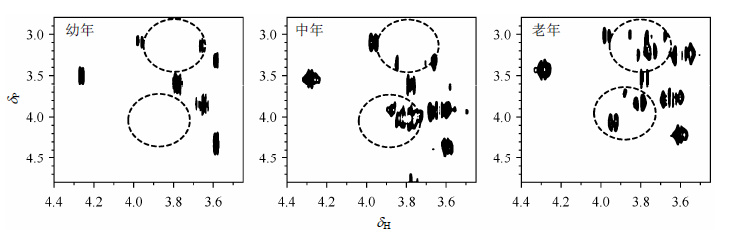
|
| 图2 幼年、中年及老年大鼠脑组织提取物的1H-31P异核相关谱.图中圈定区域显示不同年龄大鼠脑组织提取物的差别 Fig.2 1H-31P HETCOR spectra of brain extractions from SD rats at the stages of young,adult and old. The circled areas indicate the difference in brain metabolic profile of rat brain |
为了进一步明确这些含磷化合物与老龄化的关系,我们对这些组分的相对含量进行了统计分析.各组分的相对含量主要是通过对各组分峰的面积进行积分获得.为了便于对比不同样品,我们对总积分进行了归一化处理.对三个不同年龄组的含磷化合物的统计分析结果如图 3所示.从图中可以看出,PCr含量随年龄增长逐渐增加,在老年大鼠脑组织中显著增加.PCr为肌酸激酶反应中PCr-ATP能量转换的储备底物,参与维持神经细胞代谢过程中内环境ATP的相对稳定[15].PCr和肌酸(creatine,Cr)含量变化直接影响神经细胞线粒体能量转换,进而影响神经突触处的信息传递[16].PCr可缓冲高能磷酸盐代谢,还可减轻氧化应激所导致的神经损伤,对神经细胞功能发挥起保护作用[17].我们在前期的研究工作[7, 8]也发现,老年大鼠的学习记忆及运动调节相关脑区的Cr含量均显著升高.有研究[18]报道,Cr和PCr含量升高是线粒体生物能受损及氧化磷酸化降低的反映.据此推测,老年大鼠脑组织的线粒体结构和功能受损.
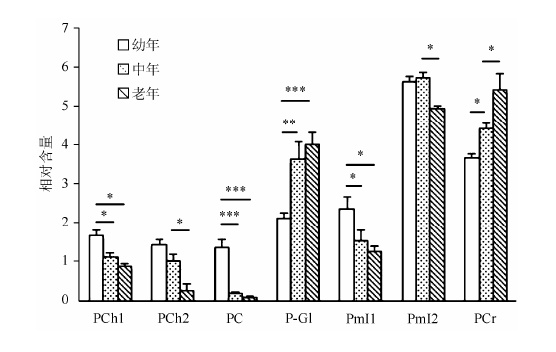
|
| 图3 幼年、中年及老年大鼠脑组织含磷化合物相对含量的统计分析.结果以平均值±标准差表示,*: p < 0.05,**: p < 0.01,***: p < 0.001.PCh1和PCh2分别为化学位移dP3.14和4.32处的PCh信号;PmI1和PmI2分别为化学位移dP3.61和3.86处的PmI信号 Fig.3 Relative levels of phosphate compounds in brain extractions of young,adult and aged rats. Results expressed as mean ± SD,*: p < 0.05,**: p < 0.01,***: p < 0.001. PCh1 and PCh2 are PCh signals at dP3.14 and 4.32,respectively; PmI1 and PmI2 are PmI signals at dP3.61 and 3.86,respectively |
与PCr相反,大鼠脑组织提取物中PmI、PCh和PC含量随着年龄的增长而减少,特别是PC,在中年大鼠脑组织中的含量就已明显降低.PC是髓鞘的主要组成成分,其含量随年龄增长降低暗示随着年龄增长,神经元损伤可能逐渐加剧.PmI在转录调控、mRNA转运、DNA修复及Ca2+浓度调节等生物过程中均发挥重要作用[19].有研究[20]报道,PmI含量降低可引起钙离子瞬态缩短,影响突触可塑性.而且工作记忆下降与前额叶脑区PmI含量降低也具有密切关系[21].我们以往的研究发现,老年大鼠学习记忆及运动调控相关脑区中的总肌醇含量均显著升高[7, 8].本研究发现,PmI含量在老年大鼠脑组织中含量显著下降.由此我们推测,老年大鼠脑组织中PmI含量降低可能与脑组织的功能下调有关.
葡萄糖几乎是脑组织能量的唯一来源,通过氧化磷酸化产生能量供脑组织代谢所需.本研究发现,老年及中年脑组织中P-Gl含量明显增加,而且老年与中年脑组织P-Gl可能存在不同的磷酸化位点.这些结果提示,老年脑组织可能出现糖利用障碍.但不同磷酸化位点葡萄糖的含量改变及其具体机制还有待进一步研究.
3 结论本研究在以往研究的基础上,应用31P NMR检测分析了不同年龄阶段大鼠脑组织提取物,明确了大鼠脑组织中含磷物质随年龄增长的代谢变化规律.结果表明,随年龄增长,大鼠脑组织PCr含量显著增加,而PC、PCh及PmI含量显著降低.此外,我们还发现不同磷酸化位点的葡萄糖含量在中、老年大鼠脑中呈显著差异.这些结果有助于理解衰老过程中的脑结构和功能退行性改变,其具体分子机制有待深入研究.
| [1] | Chen Z, Yu J, Song Y T, et al. Aging Beijing:Challenges and strategies of health care for the elderly[J]. Ageing Res Rev, 2010, 9(Suppl 1):S2–S5. |
| [2] | Wilson R S, Bienias J L, Berry-Kravis E, et al. The apolipoprotein E epsilon 2 allele and decline in episodic memory[J]. J Neurol Neurosurg Psychiatry, 2002, 73(6):672–677. |
| [3] | Morrison J H, Hof P R. Life and death of neurons in the aging brain[J]. Science, 1997, 278(5337):412–419. |
| [4] | Sowell E R, Peterson B S, Thompson P M, et al. Mapping cortical change across the human life span[J]. Nat Neurosci, 2003, 6(3):309–315. |
| [5] | Nicholson J K, Connelly J, Lindon J C, et al. Metabonomics:a platform for studying drug toxicity and gene function[J]. Nat Rev Drug Discov, 2002, 1(2):153–161. |
| [6] | Sibille E. Molecular aging of the brain, neuroplasticity, and vulnerability to depression and other brain-related disorders[J]. Dialogues Clin Neurosci, 2013, 15(1):53–65. |
| [7] | Zhang X R, Wu J F, Liu H L, et al. Age- and gender-related metabonomic alterations in striatum and cerebellar cortex in rats[J]. Brain Res, 2013, 1507:28–34. |
| [8] | Zhang X R, Liu H L, Wu J F, et al. Metabonomic alterations in hippocampus, temporal and prefrontal cortex with age in rats[J]. Neurochem Int, 2009, 54(8):481–487. |
| [9] | Norris S E, Friedrich M G, Mitchell T W, et al. Human prefrontal cortex phospholipids containing docosahexaenoic acid increase during normal adult aging, whereas those containing arachidonic acid decrease[J]. Neurobiol Aging, 2015, 36(4):1659–1669. |
| [10] | Reddy R, Keshavan M S. Phosphorus magnetic resonance spectroscopy:Its utility in examining the membrane hypothesis of schizophrenia[J]. Prostaglandins Leukot Essent Fatty Acids, 2003, 69(6):401–405. |
| [11] | Forester B P, Berlow Y A, Harper D G, et al. Age-related changes in brain energetics and phospholipid metabolism[J]. NMR Biomed, 2010, 23(3):242–250. |
| [12] | Lutz N W, Cozzone P J. Multiparametric optimization of 31P NMR spectroscopic analysis of phospholipids in crude tissue extracts[J]. Anal Chem, 2010, 82:5433–5400. |
| [13] | Fan T W M, Lane A N. Structure-based profiling of metabolites and isotopomers by NMR[J]. Prog Nucl Magn Reson Spectrosc, 2016, 92, 93:54–70. |
| [14] | Niere J O, Griffith J M, Grant B R. 31P NMR studies on the effect of phophite on Phytophthora palmivora[J]. J Gen Microbiol, 1990, 136(1):147–156. |
| [15] | Schlattner U, Tokarska-Schlattner M, Wallimann T, et al. Mitochondrial creatine kinase in human health and disease[J]. Biochim Biophys Acta, 2006, 1762(2):164–180. |
| [16] | Rambo L M, Ribeiro L R, Della-Pace I D, et al. Acute creatine administration improves mitochondrial membrane potential and protects against pentylenetetrazol-induced seizures[J]. Amino Acids, 2013, 44(3):857–868. |
| [17] | Cunha M P, Martin-de-Saavedra M D, Romero A, et al. Both creatine and its product phosphocreatine reduce oxidative stress and afford neuroprotection in an in vitro Parkinson's model[J]. ASN Neuro, 2014, 6(6):1759091414554945. |
| [18] | Oliveira J M. Mitochondrial bioenergentics and dynamics in Huntington's disease:Tripartite synapses and selective striatal degeneration[J]. J Bioenerg Biomembr, 2010, 42(3):227–234. |
| [19] | Tsui M M, York J D. Roles of inositol phosphates and inositol pyrophosphates in development, cell signaling and nuclear processes[J]. Adv Enzyme Regul, 2010, 50(1):324–337. |
| [20] | Windhorst S, Minge D, Bähring R, et al. Inositol-1,4,5-trisphosphate 3-kinase:A regulates dendritic morphology and shapes synaptic Ca2+ transients[J]. Cell Signal, 2012, 24(3):750–757. |
| [21] | López-Téllez J F, López-Aranda M F, Navarro-Lobato I, et al. Prefrontal inositol triphosphate is molecular correslate of working memory in nonhuman primates[J]. J Neurosci, 2010, 30(8):3067–3071. |
 2016, Vol. 33
2016, Vol. 33



