文章信息
- 宋懿朋, 李宁, 薛海斯, 李晶, 王玉兰
- SONG Yi-peng, LI Ning, XUE Hai-si, LI Jing, WANG Yu-lan
- 棕色脂肪组织和白色脂肪组织的代谢组学研究
- Metabonomics Analysis of Brown Adipose and White Adipose Tissues
- 波谱学杂志, 2016, 33(2): 208-223
- Chinese Journal of Magnetic Resonance, 2016, 33(2): 208-223
- http://dx.doi.org/10.11938/cjmr20160204
-
文章历史
收稿日期: 2015-05-14


DOI:10.11938/cjmr20160204
2. 中国科学院大学, 北京 100049;
3. 武汉大学 化学与分子科学学院, 湖北 武汉 430071
2. University of Chinese Academy of Sciences, Beijing 100049, China;
3. College of Chemistry and Molecular Sciences, Wuhan University, Wuhan 430071, China
在哺乳动物中存在着两种具有不同生物学作用的脂肪组织:白色脂肪组织(white adipose tissue,WAT)和棕色脂肪组织(brown adipose tissue,BAT).WAT的主要作用是存储能量,同时还能够作为内分泌器官分泌一系列脂肪因子来调节其它组织和器官[1]. 而BAT是一个产热器官,在机体的体温平衡调节中起着非常重要的作用,它能够使线粒体氧化呼吸链的氧化磷酸化解偶联,抑制三磷酸腺苷(adenosine triphosphate,ATP)的合成,从而使能量以热能的形式释放出来[2].现代社会中,不良的生活方式和充足的能量供应导致了肥胖发病率的显著提升.人类摄入的能量超过了机体的消耗,剩余的能量以WAT的形式存储在体内,而WAT的过度积累就称之为肥胖.研究表明,肥胖是引起一系列疾病例如糖尿病、心血管疾病、堵塞性睡眠综合症、哮喘、非酒精性脂肪肝和骨关节炎等的危险因素,研究肥胖机制能够显著提升人们对由肥胖引起的相关疾病的患病率和死亡率、以及由此增加的社会经济负担的认识[3].目前,激活BAT、或者将白色脂肪细胞转化为棕色脂肪细胞,以增加机体能量的消耗,被认为是治疗肥胖的潜在靶点,并且得到了人们越来越多的关注[4-7].鉴于BAT重要的生理意义和巨大的应用价值,充分理解BAT生理作用的分子基础、以及BAT和WAT的分子差异就显得尤为重要.
白色脂肪细胞胞浆90%以上的空间被一个由甘油三酯组成的单房大油滴所占据,细胞核和少量的线粒体被挤压到细胞周边[8].相比于白色脂肪细胞,棕色脂肪细胞中含有由甘油三酯组成的多房小油滴以及数目众多的结构正常的线粒体[8].此外,BAT中含有丰富的毛细血管和神经纤维[8].尽管在BAT中同样存在着大量的甘油三酯,但其主要功能是通过产热来消耗能量.BAT中特有的解偶联蛋白酶1(uncoupling protein 1,UCP1)是其产热功能的关键分子[2, 9].线粒体主要通过在线粒体内膜两侧形成质子浓度梯度来存储氧化还原反应过程中所产生的能量,并用来合成ATP以供机体使用.UCP1蛋白是一种存在于线粒体内膜的跨膜载体蛋白,能够消除线粒体内膜两侧的质子浓度梯度,使氧化磷酸化解偶联,因此氧化还原反应过程中产生的能量不能用来合成ATP,而是以热能的形式释放[9].除了UCP1基因外,Ⅱ型脱碘酶(DIO2)、跨膜糖蛋白(Elovl3)、过氧化物酶体增殖激活受体α(PPARα)、PPAR γ 受体共激活蛋白-1(PGC-1)、叉头框-C2(FOXC2),以及多种与线粒体合成和功能相关的转录因子在两种脂肪组织中均存在显著性差异[13, 14].
前人的研究主要集中在BAT和WAT的基因表达差异,以及差异表达的基因对BAT功能影响的研究上.然而,对这两种脂肪组织之间生化组成差异的研究较少.代谢组学是一种系统性分析方法,能够全面的研究代谢物组成整体(代谢组)及其变化规律[15, 16],且已经被广泛应用于肥胖相关的研究中,为理解肥胖发生发展的分子机制提供了新的线索[17-20].核磁共振(nuclear magnetic resonance,NMR)波谱技术能够同步非选择性的检测大量代谢物,这些代谢物涉及到多种代谢通路,如糖代谢、脂类代谢、氨基酸代谢、核苷酸代谢、胆碱代谢、胆汁酸代谢等.脂肪酸是脂肪组织中主要的能量存储形式和能量代谢的主要来源,并且参与质膜合成等多种重要生理过程,常用的分析方法为气相色谱(GC)法.对BAT和WAT进行代谢组和脂肪酸分析,有助于我们从生化基础的角度理解BAT的功能.因此,我们使用了基于NMR和GC技术的代谢组学研究方法研究了BAT和WAT代谢物组成的差异,并诠释了它与两种组织生物学作用的联系.
1 实验部分 1.1 化学试剂氘代三甲基硅丙酸[3-(trimethylsilyl)propionic-2,2,3,3-d4 acid sodium salt,TSP]和重水(D2O)购买于美国剑桥同位素实验室.高效液相色谱(HPLC)级别甲醇和正已烷、分析级别甲醇、三水合磷酸二氢钾、二水合磷酸二氢钠购买于上海国药集团化学试剂有限公司.
1.2 动物实验和样品收集12只5周龄的雄性SD大鼠购买于华中科技大学同济医学院实验动物中心.实验动物转运至中国科学院武汉物理与数学研究所无特定病原体(SPF)级别动物房时后处死.SD大鼠肩胛区的BAT和附睾处的WAT参考文献[21]确定位置并取出.所有样品在收集后立即使用液氮速冻,然后存放在-80 ℃冰箱中待检.
1.3 样品前处理取出100 mg左右的BAT和WAT,并使用600 μL的冰甲醇/水(v/v = 2/1)溶液和组织破碎仪(QIAGEN TissueLyser Ⅱ,德国)提取,组织破碎仪的频率设置为20 Hz,时间为90 s;经过组织破碎仪处理后的样品冰浴超声(超声时间1 min、间隔1 min,重复3次);将经过破碎和超声处理后的样品离心(10 000×g、4 ℃)10 min后取上清;重复上述过程2次,将3次样品提取的上清液混合;使用旋转蒸发仪去除甲醇;然后使用冷冻干燥机去除水份,得到水相代谢物的冻干粉末.将得到的冻干粉末融入600 μL 0.1 mol/L磷酸盐缓冲溶液(pH = 7.4,K2HPO4∶NaH2PO4 = 4∶1,0.1% NaN3,0.005% TSP,100% D2O),离心(10 000×g、4 ℃)10 min后取550 μL上清至直径为 5 mm的NMR样品管中待检.
BAT和WAT样品使用的甲酯化方法参考已发表文献[22, 23].取10 mg左右的BAT和WAT,加入500 μL HPLC级别甲醇,使用组织破碎仪破碎,组织破碎仪的频率设置为20 Hz,时间为90 s,重复3次;取100 μL匀浆(内含2 mg组织)放入玻璃离心管,并加入20 μL含有2,6-二叔丁基-4-甲基苯酚(butylated hydroxytoluene,BHT)的内标(十七烷酸甲酯1 mg/mL,二十三烷酸甲酯0.5 mg/mL,正己烷配置)和1 mL甲醇/正己烷(v/v = 4/1)混合液,充分混匀;液氮浴10 min后,加入100 μL乙酰氯,放置在暗处,室温下反应24 h;将上述玻璃离心管置于冰水混合物中,并使用2.5 mL 浓度为6%的碳酸氢钾溶液终止反应;加入200 μL正己烷,混匀离心(800×g、25 ℃)10 min后取上清;重复上述萃取过程3次,将3次取得的上清加入至色谱瓶中并放入通风橱中挥干[23].实验时,加入100 μL正已烷溶解,然后进行脂肪酸检测.
1.4 NMR检测和脂肪酸检测BAT和WAT的一维氢谱(1D 1H NMR)在配备5 mm TCI超低温探头的Bruker Avance ⅡI 600型NMR谱仪(Bruker,德国)上采集.采样温度为298 K,使用NOESY序列[24].在延迟等待时间(2 s)和混合时间(100 ms)期间使用预饱和压水技术压制水峰,谱宽为12 000 Hz,累加128次,采样点数为64 k.
为了归属1D 1H NMR谱峰信号,我们使用有代表性的BAT和WAT样品测试了一系列2D NMR谱图,包括J分解谱(1H J-Resolved spectroscopy,J-Res)、氢氢相关谱(1H-1H correlation spectroscopy,COSY)、氢氢全相关谱(1H-1H total correlation spectroscopy,TOCSY)、氢碳异核单量子相关谱(1H-13C heteronuclear single quantum correlation spectroscopy,1H-13C HSQC)和氢碳异核多键相干谱(1H-13C heteronuclear multiple bond correlation spectroscopy,1H-13C HMBC)等,所有2D NMR谱图均参照文献[25]采集和处理.
甲酯化后的样品使用GCMS-QP2010 Plus(岛津,日本)气相色谱仪检测,配备氢火焰离子检测器(GC-FID);使用的色谱柱型号为DB-225(长度为10 m,涂层厚度为0.1 m,内径为0.1 mm);进样量为1 μL,采取分流方式(分流比为60∶1)进样.进样口和检测器温度均为230 ℃.柱温程序如下:首先以115 ℃保持1 min;然后以25 ℃/min的速度升温至205 ℃,保持3 min;再以10 ℃/min的速度升温至230 ℃,保持3 min.
1.5 NMR谱图处理和多变量统计分析对得到的自由感应衰减信号(FID)添加1 Hz的线宽因子,进行傅里叶变换;然后使用Topspin V3.0软件(Bruker,德国)进行相位和基线校正,以TSP定标(δ 0.00);使用AMIX软件(Bruker,德国)进行分段积分,积分的区间为δ 0.5~9.8,积分间隔为1.2 Hz;为了避免残留水峰的影响,δ 4.7~5.12区域被删除;使用水相提取物干重对上述过程得到的数据集进行归一化处理.
使用SIMICA-P+ V12.0软件(Umetrics,瑞典)对归一化后的数据集进行多变量统计学分析.使用主成分分析(principal component analysis,PCA)方法对上述过程得到的数据集进行建模,并使用中心化(mean-center,ctr)处理.PCA分析能够提供不同组织中不同样品代谢组的轮廓协助发现潜在的异常点.去除异常点后,使用正交偏最小二乘法判别分析(orthogonal partial least squares-discriminant analysis,O-PLS-DA)方法对归一化后的数据集建模,并使用自适换算(auto scaling,mean-centering and scaled to unit variance,UV)标准化处理.O-PLS-DA模型能够提取对组间差异有贡献的变量(代谢物).为了避免O-PLS-DA模型发生过拟合,我们使用了7倍交叉验证和CV-ANOVA验证方法[26]进行了模型验证.我们提取了O-PLS-DA模型中的自变量x与相应变量y之间的协相关系数,然后通过回溯转换,并使用组内编写的Matlab(MathWorks,美国)脚本将其可视化为相关系数负载图.在相关系数负载图中,变量的指向提示了处理组中代谢物相对于对照组的升高或者降低;而协相关系数的绝对值代表着这个变量对区分两个组别的贡献的大小.不同模型中,根据95%置信度确定的协相关系数临界值(|r|)与所含样本量有关,例如当组内含有12个样品,|r|为0.553.
1.6 脂肪酸数据分析首先通过与混标色谱图(37种脂肪酸标准品)中色谱峰的保留时间进行比对,对GC-FID检测得到的色谱峰进行定性;然后使用GC仪器自带的GC-Solution软件(岛津,日本)对定性后的色谱峰进行手动积分,并通过内标对各种脂肪酸进行精确定量.各种脂肪酸含量具体计算公式如下:
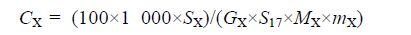 (1)
(1)
CX(μmol/g)为待测的脂肪酸的含量;SX为相应的脂肪酸的积分面积;GX为理论响应因子;S17是内标(十七碳脂肪酸甲酯的积分面积);MX为相应脂肪酸甲酯的摩尔质量(g/mol);mX为组织重量(mg).
除色谱图中出现的脂肪酸信号外,还需要通过计算得到下列值:总脂肪酸(total fatty acid,ToFA)、单不饱和脂肪酸(monounsaturated fatty acid,MUFA)、多不饱和脂肪酸(polyunsaturated fatty acid,PUFA)、饱和脂肪酸(saturated fatty acid,SFA)、n3系列脂肪酸、n6系列脂肪酸、PUFA/MUFA、PUFA/UFA、n6/n3、D5D(C20∶4n6/ C20∶3n6)、D6D(C18∶3n6/C18∶2n6)、SCD16(C16∶1n7/C16∶0)、SCD18(C18∶1n9/C18∶0)等.去除异常点后,使用双尾t检验对BAT和WAT脂肪酸的含量进行比较,p<0.05表示具有显著性差异.
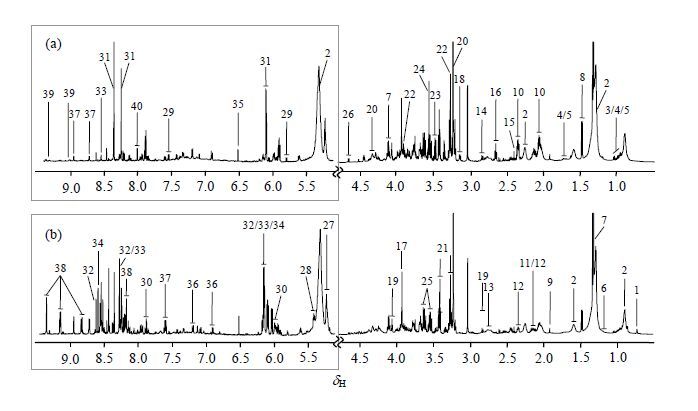
2 结果与讨论 2.1 NMR谱峰归属BAT和WAT的1D 1H NMR均谱如图 1所示.代谢物归属参考已发表的文献[25, 27],并结合一系列2D NMR谱图来确认(表 1).归属出的40种代谢物主要涉及糖类、氨基酸、核苷酸、脂质、胆碱等多种机体代谢通路以及机体与肠道菌群共代谢通路.
| No. | 代谢物 | Metabolites | Assignment | δH a | δC |
| 1 | 胆汁酸 | bile acid | CH3 | 0.74(s) | 20.8 |
| 2 | 脂质 | lipid | CH3 | 2.04(m) | 29.9 |
| (CH2)n | 0.89(m) | 16.8 | |||
| CH2CH2CO | 1.28(m) | 25.5 | |||
| CH2C=C | 1.59(m) | 27.6 | |||
| CH2CO | 2.24(m) | 36.5 | |||
| C=CCH2C=C | 2.75(m) | 28.4 | |||
| -CH=CH- | 5.30(m) | 130.93 | |||
| 3 | 缬氨酸 | valine | γ-CH3(1/2) | 1.00(d | 20.7 |
| γ-CH3(1/2) | 1.05(d) | 32.9 | |||
| β-CH | 2.28(m) | 32.8 | |||
| α-CH | 3.62(d) | 20.7 | |||
| 4 | 亮氨酸 | leucine | δ-CH3δ | 0.96(d) | 24.7 |
| β-CH2 | 0.97(d) | 24.2 | |||
| γ-CH | 1.70(m) | 1.72(m) | |||
| α-CH | 3.73(t) | 26.9 | |||
| 5 | 异亮氨酸 | isoleucine | δ-CH3 | 0.93(t) | 18.6 |
| β-CH3 | 1.00(d) | 16.8 | |||
| γ-CH2(1/2) | 1.25(m) | 1.46(m) | |||
| γ-CH2(1/2) | 0.97(d) | 24.2 | |||
| β-CH | 2.00(m) | 25.3 | |||
| α-CH | 3.66(d) | 24.7 | |||
| 6 | 3-羟基丁酸 | 3-D-hydroxybutyrate | CH3CH | 1.20(d) | 23.4 |
| β-CH2(1/2) | 4.15(m) | b | |||
| β-CH2(1/2 | 2.30(m) | b | |||
| β-CH2(1/2 | 2.39(m) | b | |||
| 7 | 乳酸 | lactate | α-CH3 | 4.12(q) | 71.4 |
| β-CH3 | 1.33(d) | 23.0 | |||
| 8 | 丙氨酸 | alanine | β-CH3 | 1.48(d) | 19.2 |
| α-CH | 3.78(q) | 53.5 | |||
| 9 | 乙酸 | acetate | CH3 | 1.92(s) | 26.4 |
| 10 | 谷氨酸 | glutamate | β-CH2 | 2.06(m) | 29.8 |
| γ-CH2 | 2.35(m) | 36.6 | |||
| α-CH | 3.75(m) | 57.7 | |||
| 11 | 谷氨酰胺 | glutamine | β-CH2 | 2.16(m) | 33.9 |
| γ-CH2 | 2.45(q) | b | |||
| α-CH | 3.77(m) | 57.4 | |||
| 12 | 氧化型谷胱甘肽 | GSSG | glutamate | ||
| β-CH2 | 2.17(m) | 29.0 | |||
| γ-CH2 | 2.54(m) | 34.1 | |||
| α-CH2 | 3.79(m) | 57.0 | |||
| cysteine | |||||
| β-CH2 | 2.97(m) | 40.8 | |||
| β-CH2 | 3.32(m) | 40.8 | |||
| α-CH2 | 4.77(m) | 55.5 | |||
| 13 | 苹果酸 | malate | CH2(1/2) | 2.37(dd) | 45.5 |
| CH2(1/2) | 2.67(dd) | 45.5 | |||
| CH | 4.30(dd) | 72.9 | |||
| 14 | 天冬氨酸 | aspartate | CH2 | 2.68(dd) | 39.3 |
| CH2 | 2.82(dd) | 39.3 | |||
| CH | 3.90(dd) | 55.2 | |||
| 15 | 琥珀酸 | succinate | CH2 | 2.41(s) | 36.9 |
| 16 | 亚牛磺酸 | hypotaurine | CH2S | 2.66(m) | 59.1 |
| CH2N | 3.36(t) | 36.5 | |||
| 17 | 肌酸 | creatine | CH3 | 3.04(s) | 39.8 |
| CH2 | 3.94(s) | 56.7 | |||
| 18 | 乙醇胺 | ethanolamine | CH2NH2 | 3.14(t) | 44.4 |
| CH2OH | 3.83(m) | 73.8 | |||
| 19 | 胆碱 | choline | N-(CH3)3 | 3.21(s) | 56.6 |
| N-CH2 | 3.52(t) | 70.4 | |||
| O-CH2 | 4.07(t) | 58.7 | |||
| 20 | 甘油磷酸胆碱 | glycerophosphocholine | N-(CH3)3 | 3.23(s) | 56.7 |
| N-CH2 | 3.68(m) | 65.4 | |||
| O-CH2 | b | b | |||
| P-CH2 | b | b | |||
| P-CH2 | 4.33(m) | 62.6 | |||
| 21 | 牛磺酸 | taurine | CH2 | 3.27(t) | 51.2 |
| SCH2N | 3.43(t) | 38.6 | |||
| 22 | 甜菜碱 | betaine | CH3 | 3.27(s) | 56.2 |
| CH2 | 3.91(s) | 66.7 | |||
| 23 | 磷酸单甲酯 | mono-methyl phosphate | O-CH3 | 3.47(d) | 54.4 |
| 24 | 甘氨酸 | glycine | α-CH2 | 3.56(s) | 44.4 |
| 25 | 甘油 | glycerine | 1-CH2OH | 3.57(dd) | 65.4 |
| 2-CH2OH | 3.66(dd) | 65.4 | |||
| CHOH | 3.79(m) | 74.6 | |||
| 26 | β-葡萄糖 | β-glucose | 2-CH | 3.24(m) | 77.1 |
| 4-CH | 3.40(m) | 72.3 | |||
| 3,5-CH | 3.46(m) | 78.3 | |||
| 6-CH2(1/2) | 3.76(dd) | 63.4 | |||
| 6-CH2 (1/2)1-CH | 3.90(dd) | 63.4 | |||
| 27 | α-葡萄糖 | α-glucose | 4-CH | 3.40(m) | |
| 2-CH | 3.40(m) | 74.3 | |||
| 3-CH | 3.54(dd) | 75.6 | |||
| 5-CH | 3.71(m) | 74.3 | |||
| 6-CH | 3.82(m) | 63.4 | |||
| 1-CH | 3.83(m) | 95.4 | |||
| 28 | 糖原 | glycogen | 1-CH | 5.42(dd) | 102.6 |
| 2~6-CH | 3.84(m) | b | |||
| 29 | 尿嘧啶 | uracil | 5-CH | 5.81(d) | 104.0 |
| 6-CH | 7.55(d) | 45.9 | |||
| 30 | 尿苷 | uridine | 2-CH(ribose) | 4.36(dd) | b |
| 5-CH(ring) | 5.91(d) | 105.5 | |||
| 1-CH(ribose) | 5.93(d) | 92.4 | |||
| 6-CH(ring) | 7.88(d) | 144.9 | |||
| 31 | 腺苷 | adenosine | CH2(1/2) | 3.91(dd) | 64.2 |
| CH2(1/2) | 3.93(dd) | 64.2 | |||
| 5-CH(ribose) | 4.28(dd) | 88.7 | |||
| 4-CH(ribose) | 4.44(dd) | 73.1 | |||
| a峰型:s,单峰;d,双峰;t,三重峰;q,四重峰;m,多重峰;dd,双重双峰;bs,宽单峰;b. 信号检测不到 a Multiplicity: s,singlet; d,doublet; t,triplet; q,quartet; m,multiplet; dd,doublet of doublets; bs,broad singlet; b. the signals were not detected. | |||||
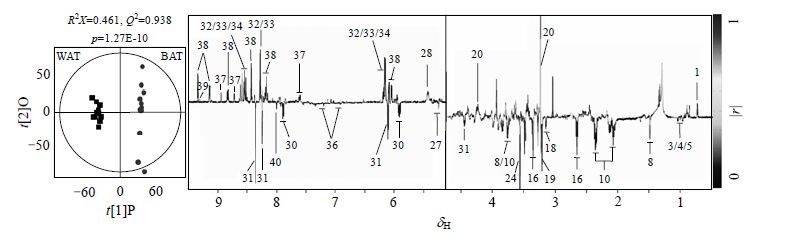
我们对BAT和WAT NMR谱图分段积分的数据集进行了O-PLS-DA建模,从而提取与两种组织差异相关的代谢物.O-PLS-DA模型验证参数、得分图和相关系数负载图均在图 2中显示,变化的代谢物与其相关系数总结在表 2中.相对于附睾WAT,BAT中胆汁酸、甘油磷酸胆碱、糖原、腺嘌呤核苷(AMP)、二磷酸核苷(ADP)、次黄嘌呤核苷酸(IMP)、烟酰胺、烟酰胺腺嘌呤二核苷酸(NAD+)和烟酰胺腺嘌呤二核苷酸磷酸(NADP+)等代谢物含量更高,而缬氨酸、亮氨酸、异亮氨酸、丙氨酸、谷氨酸、甘氨酸、络氨酸、亚牛磺酸、乙醇胺、胆碱、葡萄糖、尿苷、腺苷和鸟苷等代谢物含量较低.
|
| 图2 BAT和WAT比较的O-PLS-DA得分图(左)和相关系数负载图(右).具体的模型验证参数显示在得分图上方.向上表示代谢物在BAT组织中含量更高,向下表示代谢物在BAT组织中含量较低.变化的代谢物以及其相关系数在表 2中展示 Fig.2 O-PLS-DA scores plot (left) and coefficient loadings plot (right) derived from O-PLS-DA models constructed by WAT and BAT. Detailed parameters of validations of O-PLS-DA model are presented on the top of scores plot. Up indicates the metabolite in the BAT is higher as compared with WAT,while down denotes lower. Changed metabolites and their coefficients are shown in Table 2 |
| No. | 代谢物 | Metabolites | BAT vs. WAT (|r| = 0.576) |
| 1 | 胆汁酸 | bile acid | +0.924 |
| 3 | 缬氨酸 | valine | -0.854 |
| 4 | 亮氨酸 | leucine | -0.622 |
| 5 | 异亮氨酸 | isoleucine | -0.692 |
| 8 | 丙氨酸 | alaline | -0.729 |
| 10 | 谷氨酸 | glutamate | -0.964 |
| 16 | 亚牛磺酸 | hypotaurine | -0.874 |
| 18 | 乙醇胺 | ethanolamine | -0.912 |
| 19 | 胆碱 | choline | -0.873 |
| 20 | 甘油磷酸胆碱 | glycerophosphocholine | +0.761 |
| 24 | 甘氨酸 | glycine | -0.940 |
| 27 | α-葡萄糖 | α-glucose | -0.944 |
| 28 | 糖原 | glycogen | +0.881 |
| 30 | 尿苷 | uridine | -0.929 |
| 31 | 腺苷 | adenosine | -0.968 |
| 32 | 腺嘌呤核苷 | AMP | +0.713 |
| 33 | 二磷酸腺苷 | ADP | +0.646 |
| 34 | 次黄嘌呤核苷酸 | IMP | +0.923 |
| 36 | 络氨酸 | tyrosine | -0.871 |
| 37 | 烟酰胺 | nicotinamide | +0.897 |
| 38 | 烟酰胺腺嘌呤二核苷酸 | NAD+ | +0.939 |
| 39 | 烟酰胺腺嘌呤二核苷酸磷酸 | NADP+ | +0.826 |
| 40 | 鸟苷 | guanosine | -0.957 |
| “-”表示在BAT中含量比WAT低;“+”表示在BAT中含量比WAT高 “-”,lower in BAT; “+”,higher in BAT,as compared with WAT | |||
BAT和WAT中的脂肪酸含量以及两组之间的差异总结在图 3和表 3中.BAT和WAT的脂肪酸构成相似,但是多种脂肪酸含量具有显著性差异.相比于WAT,BAT中C10∶0、C16∶1、C18∶3n3、C20∶5n3、MUFA、UFA%、MUFA%、n6/n3、SCD16、SCD18和D5D等含量较低,而C18∶0、C20∶2、C20∶3n6、C20∶4n6、C22∶6n3、SFA%、PUFA/MUFA、PUFA/UFA、n3和D6D等含量更高.
| Fatty acids | WAT | BAT | p |
| C10∶0 | 53.3±27.7 | 9.0±6.5 | 2.88E-04** |
| C12∶0 | 109.8±59.4 | 68.8±32.1 | 6.77E-02 |
| C14∶0 | 104.8±40.9 | 115.3±33.2 | 5.43E-01 |
| C16∶0 | 517.9±118.2 | 563.9±135.6 | 4.16E-01 |
| C16∶1 | 48.4±10.9 | 31.1±17.3 | 1.25E-02* |
| C18∶0 | 152.6±57.1 | 282.4±112.3 | 5.84E-03** |
| C18∶1n9t | 321.3±53.4 | 270.1±64.8 | 6.18E-02 |
| C18∶1n9c | 41.9±9.4 | 41.5±9.6 | 9.23E-01 |
| C18∶2n6c/t | 554.0±131.6 | 505.4±126.9 | 4.01E-01 |
| C18∶3n3 | 17.2±4.0 | 7.9±2.6 | 5.91E-06** |
| C20∶2 | 2.7±1.1 | 7.3±2.5 | 1.36E-04** |
| C20∶3n6 | 2.8±0.2 | 9.4±2.2 | 5.22E-06** |
| C20∶4n6 | 37.1±6.1 | 65.2±16.1 | 2.71E-04** |
| C20∶5n3 | 4.7±0.8 | 3.6±0.6 | 2.72E-03** |
| C22∶6n3 | 16.7±3.1 | 46.4±12.3 | 2.08E-05** |
| ToFA | 1985.2±432.5 | 2099.2±555.3 | 6.04E-01 |
| UFA | 1046.7±203.4 | 988.0±220.6 | 5.33E-01 |
| PUFA | 635.2±136.8 | 645.4±157.1 | 8.75E-01 |
| MUFA | 411.5±67.9 | 342.6±74.3 | 3.88E-02* |
| SFA | 938.5±236.5 | 1111.2±363.4 | 2.08E-01 |
| UFA% | 0.530±0.023 | 0.477±0.046 | 5.60E-03** |
| PUFA% | 0.320±0.014 | 0.311±0.046 | 4.30E-01 |
| MUFA% | 0.210±0.015 | 0.166±0.024 | 7.67E-05** |
| SFA% | 0.470±0.023 | 0.523±0.046 | 5.60E-03** |
| Fatty acids | WAT | BAT | p value |
| PUFA/MUFA | 1.533±0.114 | 1.894±0.298 | 4.02E-03** |
| PUFA/UFA | 0.609±0.012 | 0.651±0.037 | 6.10E-03** |
| n3 | 7.7±1.4 | 11.6±2.7 | 5.13E-04** |
| n6 | 118.8±25.8 | 116.0±28.6 | 8.17E-01 |
| n6/n3 | 15.368±0.940 | 10.033±1.115 | 3.01E-10** |
| SCD16 | 0.095±0.015 | 0.060±0.038 | 2.07E-02* |
| SCD18 | 2.272±0.631 | 1.067±0.394 | 5.32E-05** |
| D5D | 13.107±3.244 | 6.916±0.600 | 7.29E-05** |
| D6D | 0.005±0.001 | 0.019±0.003 | 2.42E-07** |
| *0.01 ≤ p < 0.05,**p < 0.01 | |||
两种脂肪组织在糖代谢、氨基酸代谢、脂肪酸代谢、核苷酸代谢、胆碱代谢等多条代谢通路上均有显著性差异,且这些差异与两种组织不同的生物学作用密切相关.
2.4.1 糖代谢相对于WAT,BAT中具有较高含量的糖原和较低含量的葡萄糖.糖原是一种葡萄糖失水缩合后形成的支链多糖,主要产生和存在于肝脏和肌肉组织中.它是机体最重要的能量存储形式之一,可迅速转化为葡萄糖供机体氧化供能.过去的研究结果[28] 显示相对于WAT,BAT中的糖原合成活动较强,对于保持机体在寒冷状态下的葡萄糖平衡起着决定性作用.这与我们关于BAT中具有较高糖原含量的检测结果一致.BAT含有丰富的线粒体,可以氧化分解脂肪酸,并且在UCP1的作用下产热,是机体主要的产热器官[14].相对于WAT,BAT中具有较低含量的葡萄糖,这提示了葡萄糖可能也参与到BAT有氧氧化产热的能量代谢当中.
2.4.2 氨基酸代谢相对于WAT,BAT中支链氨基酸(缬氨酸、亮氨酸、异亮氨酸)、谷氨酸、甘氨酸以及络氨酸含量较低.BAT具有更高的代谢氨基酸的能力,腺苷酸脱氨酶、谷氨酰胺合成酶、谷氨酸脱氢酶以及天冬氨酸、丙氨酸和支链氨基酸的转氨酶的活性均比WAT高[29].在α-酮戊二酸的参与下,氨基酸首先在相应的转氨酶的作用下生成相应的α-酮酸以及谷氨酸,然后谷氨酸在谷氨酸脱氢酶的作用下生成α-酮戊二酸和氨.α-酮酸可以再生为其它非必需氨基酸或者参与能量代谢,转化成糖类及脂类或者直接氧化供能.而在谷氨酰胺合成酶的催化下,谷氨酸与氨发生反应生成谷氨酰胺.所以在BAT中,氨基酸的联合脱氨基作用更强.相比于WAT,BAT的氨基酸可能更多的参与了能量代谢.
2.4.3 核苷酸代谢相对于WAT,BAT中AMP、ADP、IMP、NAD+和NADP+含量更高,而尿苷、腺苷和鸟苷含量更低.BAT的产热功能与其线粒体内膜氧化磷酸化的解偶联作用有关,而氧化磷酸化的解偶联作用主要依赖于解偶联蛋白的作用.解偶联蛋白是线粒体的膜转运体,能够消除质子的电化学梯度,使氧化磷酸化解偶联,能量不能以ATP的形式存储,而是以热能的形式释放[30, 31].而BAT中,IMP、AMP和ADP含量较高可能与在BAT中ATP合成被抑制有关.腺苷和尿苷是合成IMP和AMP的前提,而且IMP和AMP相互转化,所以腺苷和尿苷的含量低可能与IMP、AMP和ADP的合成增加有关.
NAD是机体最重要的辅酶之一,NAD+是NAD的氧化形式.在代谢中,NAD参与氧化还原反应,起着传递电子的作用[32].NAD+能够从一个分子中接受电子转化为还原形式的NADH,NADH能够将电子传递给氧化呼吸链的下一个电子[32].BAT是机体重要的产热器官,含有丰富的线粒体[14].所以相比WAT,BAT中含有更高含量的NAD+.NADP+也是机体重要辅酶之一,主要参与合成反应,如脂质和核苷酸的合成[33].相比于WAT,BAT含有更高含量NADP+.我们同时检测到腺苷、尿苷和尿苷的降低,以及IMP、AMP和ADP的升高,所以我们猜测NADP+可能也参与了这一系列核苷酸的合成反应.
2.4.4 胆碱代谢相比于WAT,BAT中乙醇胺和胆碱含量较低,而甘油磷酸胆碱含量较高.在BAT中存在着编码胆碱/乙醇胺激酶的基因[34].胆碱和乙醇胺是细胞膜结构的重要组成成分,主要以甘油磷脂酰乙醇胺和甘油磷酸胆碱的形式存在.胆碱和乙醇胺激酶能够催化胆碱和乙醇胺生成磷酸胆碱和磷酸乙醇胺,然后再分别转化为甘油磷酸胆碱和甘油磷脂酰乙醇胺[35, 36].相比于WAT,BAT含有更多的线粒体,因此含有更多的质膜.我们推测BAT细胞具有合成甘油磷脂酰乙醇胺和甘油磷酸胆碱的能力,且质膜成分的合成代谢活跃.
2.4.5 脂肪酸代谢n3和n6系列不饱和脂肪酸均为机体不可缺少的脂肪酸,在调节糖类和脂类代谢,以及脂肪细胞的分化方面起着非常重要的作用[37, 38].n6系列多不饱和脂肪酸能够促进体外培养脂肪细胞的分化,以及在妊娠和哺乳期机体的脂肪组织的形成[37].n3系列的多不饱和脂肪酸能够抑制脂肪细胞分化过程中的脂肪聚集作用、促进脂质的代谢、预防肥胖和糖尿病等[38].相比于WAT,BAT中n6/n3比例下降以及n3脂肪酸含量的升高都提示了这两种组织中脂肪细胞分化和脂质代谢等方面存在的差异.
此外,相比于WAT,BAT中SCD16、SCD18以及D5D等比值较低.同时,我们发现BAT中MUFA、MUFA%、UFA%的降低,以及SFA%的升高.这些结果提示了在BAT中,多种去饱和酶的含量较低.
3 结论我们使用了基于NMR和GC技术的代谢组学方法系统的研究了BAT和WAT中水溶性代谢物组成和脂肪酸组成.通过多变量统计分析,发现两种组织中葡萄糖、糖原等糖类,缬氨酸、亮氨酸、异亮氨酸、丙氨酸、谷氨酸、甘氨酸、络氨酸、亚牛磺酸等多种氨基酸,AMP、ADP、IMP、烟酰胺、NAD+、NADP+、尿苷、肌苷、鸟苷等多种核苷酸类代谢物,甘油磷酸胆碱、乙醇胺、胆碱等胆碱类代谢物,以及多种脂肪酸的含量都有显著性差异.这些结果表明,在糖代谢中,BAT消耗更多的葡萄糖,合成更多的糖原;在氨基酸代谢中,BAT中氨基酸更多的参与了联合脱氨基作用;在核苷酸代谢中,BAT中消耗更多的核苷来合成与能量代谢相关的核苷酸;在脂肪酸代谢中,BAT中多种去饱和酶的活性较低,且n6/n3比例下降;在胆碱代谢中,BAT消耗更多的胆碱和乙醇胺来合成质膜成分甘油磷脂酰乙醇胺和甘油磷酸胆碱.上述结果为我们研究BAT功能的分子机制提供了新的线索和基础数据.
| [1] | Wood I S, Trayhurn P. Adipokines and the signaling role of adipose tissue in inflammation and obesity[J]. Future Lipidol, 2006, 1(1):81–89. |
| [2] | Costford S, Gowing A, Harper M E. Mitochondrial uncoupling as a target in the treatment of obesity[J]. Curr Opin Clin Nutr Metab Care, 2007, 10(6):671–678. |
| [3] | Malnick S D H, Knobler H. The medical complications of obesity[J]. QJM, 2006, 99(9):565–579. |
| [4] | Langin D. Recruitment of brown fat and conversion of white into brown adipocytes:Strategies to fight the metabolic complications of obesity?[J]. Biochim Biophys Acta, 2010, 1801(3):372–376. |
| [5] | Tan D X, Manchester L C, Fuentes-Broto L, et al. Significance and application of melatonin in the regulation of brown adipose tissue metabolism:relation to human obesity[J]. Obes Rev, 2011, 12(3):167–188. |
| [6] | Sasaki T, Shimpuku M, Kitazumi T, et al. Miglitol prevents diet-induced obesity by stimulating brown adipose tissue and energy expenditure independent of preventing the digestion of carbohydrates[J]. Endocr J, 2013, 60(10):1117–1129. |
| [7] | Zafrir B. Brown adipose tissue:Research milestones of a potential player in human energy balance and obesity[J]. Horm Metab Res, 2013, 45(11):774–785. |
| [8] | Cinti S. Transdifferentiation properties of adipocytes in the adipose organ[J]. Am J Physiol Endocrinol Metab, 2009, 297(5). |
| [9] | Mattson M P. Perspective:Does brown fat protect against diseases of aging?[J]. Ageing Res Rev, 2010, 9(1):69–76. |
| [10] | Cypess A M, Lehman S, Williams G, et al. Identification and importance of brown adipose tissue in adult humans[J]. N Engl J Med, 2009, 360(15):1509–1517. |
| [11] | Lee P, Greenfield J R, Ho K K Y, et al. A critical appraisal of the prevalence and metabolic significance of brown adipose tissue in adult humans[J]. Am J Physiol Endocrinol Metab, 2010, 299(4):E601–E606. |
| [12] | Lee P, Zhao J T, Swarbrick M M, et al. High prevalence of brown adipose tissue in adult humans[J]. J Clin Endocrinol Metab, 2011, 96(8):2450–2455. |
| [13] | Svensson P A, Jernas M, Sjoholm K, et al. Gene expression in human brown adipose tissue[J]. Int J Mol Med, 2011, 27(2):227–232. |
| [14] | Saely C H, Geiger K, Drexel H. Brown versus white adipose tissue:a mini-review[J]. Gerontology, 2012, 58(1):15–23. |
| [15] | Nicholson J K, Lindon J C, Holmes E. ‘Metabonomics’:Understanding the metabolic responses of living systems to pathophysiological stimuli via multivariate statistical analysis of biological NMR spectroscopic data[J]. Xenobiotica, 1999, 29(11):1181–1189. |
| [16] | Tang H R, Wang Y L. Metabonomics:A revolution in progress[J]. Prog Biochem Biophys, 2006, 33(5):401–417. |
| [17] | Hanzu F A, Vinaixa M, Papageorgiou A, et al. Obesity rather than regional fat depots marks the metabolomic pattern of adipose tissue:An untargeted metabolomic approach[J]. Obesity, 2014, 22(3):698–704. |
| [18] | Schafer N, Yu Z H, Wagener A, et al. Changes in metabolite profiles caused by genetically determined obesity in mice[J]. Metabolomics, 2014, 10(3):461–472. |
| [19] | Meierhofer D, Weidner C, Sauer S. Integrative analysis of transcriptomics, proteomics, and metabolomics data of white adipose and liver tissue of high-fat diet and rosiglitazone-treated insulin-resistant mice identified pathway alterations and molecular hubs[J]. J Proteome Res, 2015, 14(3):1643–1644. |
| [20] | Cummins T D, Holden C R, Sansbury B E, et al. Metabolic remodeling of white adipose tissue in obesity[J]. Am J Physiol-Endoc M, 2014, 307(3):E262–E277. |
| [21] | Rosell M, Kaforou M, Frontini A, et al. Brown and white adipose tissues:intrinsic differences in gene expression and response to cold exposure in mice[J]. Am J Physiol-Endoc M, 2014, 306(8):E945–E964. |
| [22] | Xu Z D, Harvey K, Pavlina T, et al. An improved method for determining medium- and long-chain FAMEs using gas chromatography[J]. Lipids, 2010, 45(2):199–208. |
| [23] | An Y P, Xu W X, Li H H, et al. High-fat diet induces dynamic metabolic alterations in multiple biological matrices of rats[J]. J Proteome Res, 2013, 12(8):3755–3768. |
| [24] | Zhao X J, Huang C Y, Lei H H, et al. Dynamic metabolic response of mice to acute mequindox exposure[J]. J Proteome Res, 2011, 10(11):5183–5190. |
| [25] | Li H D, Wei H, Wang Y, et al. Enhanced green fluorescent protein transgenic expression in vivo is not biologically inert[J]. J Proteome Res, 2013, 12(8):3801–3808. |
| [26] | Eriksson L, Trygg J, Wold S. CV-ANOVA for significance testing of PLS and OPLS ® models[J]. J Chemom, 2008, 22(11, 12):594–600. |
| [27] | Zhang L M, Ye Y F, An Y P, et al. Systems responses of rats to aflatoxin B1 exposure revealed with metabonomic changes in multiple biological matrices[J]. J Proteome Res, 2011, 10(2):614–623. |
| [28] | Madar Z, Harel A. Does the glycogen synthase (EC 2.4.1.21) of brown adipose tissue play a regulatory role in glucose homeostasis?[J]. Br J Nutr, 1991, 66(1):95–104. |
| [29] | Lopezsoriano F J, Alemany M. Activities of enzymes of amino acid metabolism in rat brown adipose tissue[J]. Biochem Int, 1986, 12(3):471–478. |
| [30] | Li Y G, Lasar D, Fromme T, et al. White, brite, and brown adipocytes:The evolution and function of a heater organ in mammals[J]. Can J Zool, 2014, 92(7):615–626. |
| [31] | Guillen C, Bartolome A, Vila-Bedmar R, et al. Bioenergetic mitochondrial protein machinery in brown adipose tissue[J]. J Cell Biochem, 2013, 114(10):2306–2313. |
| [32] | Belenky P, Bogan K L, Brenner C. NAD(+) metabolism in health and disease[J]. Trends Biochem Sci, 2007, 32(1):12–19. |
| [33] | Hanukoglu I, Rapoport R. Routes and regulation of NADPH production in steroidogenic mitochondria[J]. Endocr Res, 1995, 21(1, 2):231–241. |
| [34] | Yamazaki N. Identification of muscle-type carnitine palmitoyltransferase I and characterization of its atypical gene structure[J]. Biol Pharm Bull, 2004, 27(11):1707–1716. |
| [35] | Gibellini F, Hunter W N, Smith T K. Biochemical characterization of the initial steps of the Kennedy pathway in Trypanosoma brucei:the ethanolamine and choline kinases[J]. Biochem J, 2008, 415:135–144. |
| [36] | Tian Y, Jackson P, Gunter C, et al. Placental thrombosis and spontaneous fetal death in mice deficient in ethanolamine kinase 2[J]. J Biol Chem, 2006, 281(38):28438–28449. |
| [37] | Ailhaud G, Massiera F, Weill P, et al. Temporal changes in dietary fats:Role of n-6 polyunsaturated fatty acids in excessive adipose tissue development and relationship to obesity[J]. Prog Lipid Res, 2006, 45(3):203–236. |
| [38] | Flachs P, Rossmeisl M, Bryhn M, et al. Cellular and molecular effects of n-3 polyunsaturated fatty acids on adipose tissue biology and metabolism[J]. Clin Sci, 2009, 116(1, 2):1–16. |
 2016, Vol. 33
2016, Vol. 33