文章信息
- 韩伟健, 林晓彤, 郭娜, 陈俏, 张婷婷, 许枬
- HAN Wei-jian, LIN Xiao-tong, GUO Na, CHEN Qiao, ZHANG Ting-ting, XU Nan
- 泽泻盐制前后成分转化的1H NMR分析
- Changes of Chemical Constitution in Alismatis rhizoma after Saline Processing as Revealed by 1H NMR Analysis
- 波谱学杂志, 2016, 33(1): 117-124
- Chinese Journal of Magnetic Resonance, 2016, 33(1): 117-124
- http://dx.doi.org/10.11938/cjmr20160111
-
文章历史
- 收稿日期: 2015-03-31
- 收修改稿日期: 2016-01-21
中药炮制过程不仅发生化学成分量的变化[1],也发生质的变化[2].炮制后化学成分含量或降低[3]、或升高[4],从而造成中药炮制前后主治功能的改变[5].因此,炮制的实质就是导致中药化学成分转变的过程.因中药成分复杂,炮制前后发生变化的成分含量相对较低,使追踪、识别和捕获生制品和炮制品之间的差异成分缺乏有效手段.故揭示炮制过程中成分的转变是中药炮制基础研究的关键[6].
中药泽泻为泽泻科植物泽泻[Alisma orientalis(Sam.)Juzep]的干燥块茎.市售饮片主要有生饮片(生泽泻)和盐制片(盐泽泻)[7].传统理论认为,生泽泻利水泄热作用较强,常用于治疗小便不利、水肿、湿热黄疸、浊淋和湿热带下,如伤寒论的《五苓散》中用的是生饮片.盐制后泄热作用缓和,常以小剂量用于补益剂,如用于治疗阴虚火旺症.本课题组前期研究发现,泽泻盐制前后成分发生转变,其中变化显著的是含量较高的23-乙酰泽泻醇B和24-乙酰泽泻醇A[8, 9].为深入揭示盐制过程对泽泻成分的影响,有必要对其盐制前后成分变化进行整体性的考查,从而为解析盐制前后成分变化规律、及成分转变与功用变化的相关性提供科学依据.核磁共振氢谱(1H NMR)技术可同时检测样品中所有氢核信号,且重现性好、分析时间短,在分析复杂中药成分方面独具优势[10, 11, 12].因此,本文采用基于1H NMR的代谢组学方法分析了泽泻盐制过程中的化学成分变化,并建立了追踪、识别中药复杂成分在炮制过程中变化的分析方法.
1 实验部分 1.1 仪器与试剂Bruker Avance 600型核磁共振谱仪(布鲁克公司);超声波提取器(昆山市超声仪器有限公司,超声频率为250 Hz);Satorius电子天平(德国赛多利斯公司).氘代甲醇(上海国药集团化学试剂有限公司).
市售泽泻生饮片(14批),分别购于沈阳市和北京市的药房,经辽宁中医药大学王冰教授鉴定为植物泽泻[Alisma orientalis(Sam.)Juzep]的根茎.
泽泻盐制片的制备:依据《中国药典》收录的盐炙法[12],取泽泻生饮片,加质量分数为2%的NaCl水溶液拌匀、闷透,于160 ℃下分别炒制2、5和7 min,制成3种炮制条件的泽泻盐制片(每种盐制片包含14个样本).
1.2 实验方法 1.2.1 供试品的制备取泽泻生饮片和盐制片各5 g,粉碎,精密称取50 mg,置于5 mL EP管中,加入900 μL氘代甲醇(MeOD),于35 ℃超声处理30 min,离心10 min(14 000 rpm),取上清液600 μL至内径为5 mm的NMR样品管中,加入体积分数为3‰的四甲基硅烷(TMS),进行1H NMR图谱测试.
1.2.2 测试条件供试品在配备BBO探头的Bruker Avance 600型超导傅里叶变换核磁共振波谱仪上进行分析,采样温度为298.2 K,采用30度单脉冲程序zg30(Avance version:07/04/03)采集图谱.采样时间为5.453 s,谱宽为6 009.6 Hz,采样点数为64 k,累加次数为128,弛豫延迟为1 s.自由感应衰减信号(FID)经过傅立叶变换得到一维NMR图谱;以TMS定标(δ 0.00);然后手动进行基线和相位校正.
1.2.3 谱图处理和数据分析采用TOPSPIN V2.1软件处理原始图谱后,用Mnova软件对谱图进行分段积分(24 Hz),去除溶剂MeOD及水产生的共振信号区域(δH 3.15~3.35及δH 4.40~5.25),并将所有数据相对于TMS峰面积进行归一化,然后将数据导入SIMCA-p V11.5(Umetrics,Sweden)进行偏最小二乘法判别分析(PLS-DA).
2 结果与讨论 2.1 泽泻生饮片和盐制片的1H NMR谱图分析泽泻的次生代谢产物主要为C-30骨架的三萜(原萜烷)和C-15骨架的倍半萜.如图 1所示,以MeOD为提取溶剂的1H NMR谱的高场区显示了原萜烷类化合物的特征甲基质子信号δH 0.90、1.04、1.08、1.29和1.33,以及乙酰化物的特征信号δH 2.06[13];低场区则显示了愈创木烷型倍半萜类化合物烯烃质子H-6的特征信号δH 5.41[13].这表明以MeOD为提取和测试溶剂的1H NMR指纹图谱可以有效表征泽泻的主要次生代谢物(见图 2).与生饮片相比,盐制片的1H NMR谱图在高场和低场区都有较明显的变化,这表明盐制过程对泽泻的化学成分产生了较大的影响,而1H NMR技术能够很好地表征这些变化.
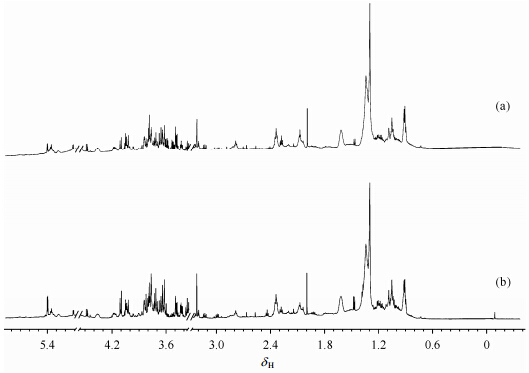
|
| 图 1 泽泻生制品饮片的1H NMR图谱.(a)泽泻生饮片,(b)泽泻盐制片,与(a)图相比放大20倍 Fig. 1 1H NMR spectra of Alismatis rhizoma and it products processed with saline in CD3OD.(a)raw slices of Alismatis rhizoma,(b)salt-processed slices of Alismatis rhizome,magnifying vertically 20 fold relative to(a) |
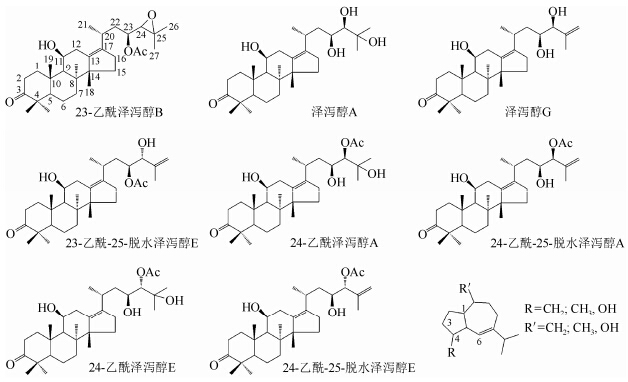
|
| 图 2 泽泻中主要化学成分的结构及母核 Fig. 2 Structures and carbon skeleton of chemical compound in Alismatis rhizoma |
将归一化处理后的1H NMR数据导入SIMCA进行PLS-DA分析,由得分矢量图(图 3)可以看出:泽泻生饮片和盐制片分别集中在不同区域,说明生饮片和盐制片成分差异较大;盐制5和7 min的两组样品部分重叠,但它们与盐制2 min的样品完全分离,说明盐制时间对成分影响较大,但影响达到一定程度后趋于稳定.该模型的t[1]和t[2]对X变量解释达81.4%;Q2为0.752,表明该模型稳定性很好.
由PLS-DA载荷矢量图(图 4)可以看出:δH 1.34对泽泻盐制片和生饮片在p[1]方向的分离贡献最大;δH 3.74、3.82、3.78、3.66、2.34、1.34、1.30和0.94则使样品在p[2]方向分离.其中,dH 3.78、3.82、3.66、3.74属于脂肪连氧碳上的质子信号,被归属为泽泻醇类化合物的甘油三酯侧链[13, 14];δH 1.34、0.94、1.30被归属为泽泻醇类化合物的甲基信号(泽泻中含量较高的泽泻醇类成分的部分1H NMR数据见表 1),由此提示泽泻醇类成分在盐制过程中可能发生了显著变化.综上可见,160 ℃条件下盐制时间的控制对泽泻醇类成分含量的影响至关重要;泽泻盐制过程中发生变化的成分可能包括23-乙酰泽泻醇B、24-乙酰泽泻醇A、泽泻醇G、24-乙酰泽泻醇E、24-乙酰-25脱水泽泻醇A、23-乙酰-25-脱水泽泻醇E、泽泻醇A和24-乙酰-25脱水泽泻醇E.
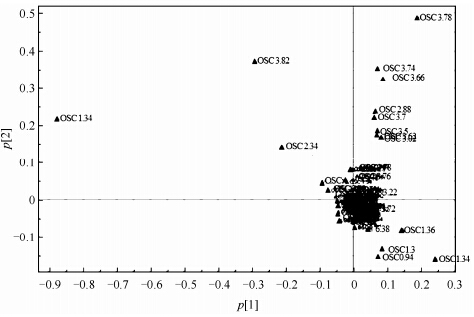
|
| 图 4 泽泻生饮片和盐制片1H NMR谱图的PLS-DA载荷矢量图 Fig. 4 PLS-DA obtained from the 1H NMRspectra of raw and salt-processed slices of Alismatis rhizoma in CD3OD |
| 化合物 | 结构中主要氢核的化学位移(dH) | ||||
| H-11 | H-23 | H-24 | H-26 | H-27 | |
| 23-乙酰泽泻醇B | 3.80 | 4.61 | 2.73 | 1.30 | 1.33 |
| 24-乙酰泽泻醇A | 3.83 | 3.83 | 4.60 | 1.16 | 1.34 |
| 泽泻醇G | 3.86 | 3.34 | 3.78 | 4.93,4.96 | 1.67 |
| 24-乙酰泽泻醇E | 3.81 | 3.51 | 4.76 | 1.23 | 1.30 |
| 24-乙酰-25脱水泽泻醇A | 3.83 | 4.72 | 4.20 | 4.91,4.94 | 1.67 |
| 23-乙酰-25-脱水泽泻醇E | 3.81 | 4.76 | 3.52 | 4.91,4.97 | 1.67 |
| 泽泻醇A | 3.88 | 3.75 | 3.00 | 1.22 | 1.27 |
| 24-乙酰-25脱水泽泻醇E | 3.81 | 4.76 | 3.66 | 4.97,4.98 | 1.67 |
泽泻的化学成分研究表明,泽泻的主要活性成分为原萜烷型三萜和愈创木完型倍半萜.其中三萜类成分的主要活性包括降血脂、利尿和抑制尿结石形成等,倍半萜类成分的主要活性为调节肾脏平滑肌收缩.这些化学成分的活性与泽泻的利水渗湿、降血脂功效基本吻合[13, 14, 15].因此,这些成分的吸收峰能够在泽泻饮片1H NMR谱图上很好的表征是分析泽泻炮制过程中成分变化的首要条件.本文先后采用多种溶剂作为提取和测试溶剂,因MeOD所得的1H NMR谱图能够较好表征上述两类化合物,故实验中选择MeOD作为提取和测试溶剂.
前期的高效液相色谱(HPLC)分析发现(见图 5)[8],泽泻市售生饮片与盐制片成分差异较大,而且不同批次市售泽泻盐制片的成分也有较大差异,提示盐制过程对泽泻的化学成分影响较大.深入研究化学成分在泽泻盐制过程中的变化,对泽泻盐制片的质量控制具有重要意义.
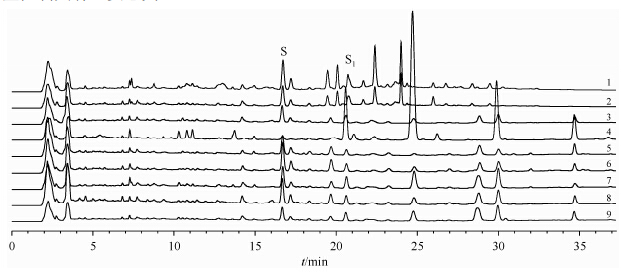
|
| 图 5 市售泽泻生饮片和盐制片的HPLC色谱图.1、2为泽泻生饮片,3~9为不同批次的市售泽泻盐制片.S:24-乙酰泽泻醇A,S1:23-乙酰泽泻醇B Fig. 5 HPLC spectra of purchased raw(1,2) and salt-processed(3~9)slices of Alismatis rhizoma in CD3OD S: Alisol A 24-acetate; S1: Alisol B 23-acetate |
原萜烷是泽泻的主要活性成分,有调节肾脏Na-K-ATP酶、降血脂和肾脏细胞的活性,与水盐代谢和脂代谢密切相关,其中降血脂代表性成分为23-乙酰泽泻醇B和24-乙酰泽泻醇A,二者盐制后含量有所降低.而其他三萜成分含量所有升高,可能是泽泻盐制后利尿作用增强、降血脂作用降低的主要原因,这与传统中医的“盐入肾”“热从水道而出”药理相吻合.
3 结论该文采用基于1H NMR的代谢组学方法对泽泻盐制过程中的成分转化进行了分析.揭示了在盐制过程中泽泻成分的变化特征,发现三萜类成分在泽泻盐制过程中变化显著.实验结果表明,1H NMR技术可有效识别、追踪炮制过程中成分转化,为深入解析泽泻盐制过程中成分转化机理提供可靠依据.
| [1] | Zeng Lin-yan(曾林燕), Song Zhi-qian(宋志前), Wei Zheng(魏征), et al. Isolation of chemical constituents produced in processing of Polygonati Rhizoma and their content changes(黄精炮制过程中新产生成分分离及含量变化)[J]. Chinese Traditional and Herbal Drugs(中草药), 2013, 44(12): 1 584-1 588. |
| [2] | Xu Nan(许枬), Jia Tian-zhu(贾天柱). Chemical reaction and products in processed Cibotium barometz(烫狗脊炮制过程的化学反应及产物研究)[J]. Chin J Chin Mater Med(中国中药杂志)), 2011, 36(15): 2 067-2 070. |
| [3] | Chen Yan(陈彦), Jia Xiao-bin(贾晓斌), Ding An-wei(丁安伟). Review on processing mechanism of Herba Epimedii and new idea(淫羊藿炮制机理研究回顾与新思路)[J]. CJTCMP(中国中医药杂志), 2010, 25(9): 1 439-1 443. |
| [4] | Chu Chu(楚楚), Chen Cen(陈岑), Li Xin-nuo(李行诺), et al. 红参炮制对质量影响的研究进展[J]. J Chin Med Mater (中药材), 2014, 37(5): 901-905. |
| [5] | Zhang Hong-da(张宏达), Xie Xue(谢雪), Chen Yu-zhu(陈昱竹), et al. The invigorating spleen function by Alisma orientalis before and after processing(泽泻麸制前后健脾作用研究)[J]. Chinese J Exp Trad Med Form (中国实验方剂学杂志), 2012, 18(10): 187-190. |
| [6] | Gao Fei(高飞), Fu Chao-mei(傅超美), Hu Hui-ling(胡慧玲), et al. Thinking about present situation and development trend of the mechanism during traditional chinese medicine processing(关于中药炮制机制研究现状与发展趋势的思考)[J]. Chinese J Exp Trad Med Form (中国实验方剂学杂志), 2013, 19(5): 352-355. |
| [7] | Committee for the Pharmacopoeia of People's Republic of China(国家药典委员会). Pharmacopoeia of P. R. China, Part 1. (中华人民共和国药典第一部)[S]. Beijing(北京): Chemical Industry Publishing House(中国医药科技出版社), 2010: 212-213 |
| [8] | Zhang Hong-da(张宏达). Study on Chemical Components and Activity of Raw and Processed Alismatis rhizome(泽泻炮制前后化学成分及药效学研究)[D]. Liaoning(辽宁): Liaoning University of Traditional Chinese Medicine(辽宁中医药大学), 2010. |
| [9] | Dai Xiao-huan(戴小欢), Qu Yan(曲琰), Jia Tian-zhu(贾天柱). Effect of processing methods on the content of essential component in products of Alismatis rhizome(不同炮制方法对泽泻中主要成分含量的影响)[J]. Jilin J Trad Chin Med (吉林中医), 2009, 29(4): 330-331. |
| [10] | Qin X W, Dai Y T, Liu N Q, et al. Metabolic fingerprinting by 1H NMR for discrimination of the two species used as Radix bupleuri[J]. Planta Med, 2012, 78(9): 926-933. |
| [11] | Song Ai-hua(宋爱华), Sha Yi(沙沂), Xu Xiao-xue(徐晓雪), et al. Differentiating Bupleurum bicaule from Bupleurum chinense using 1H NMR spectroscopy(基于1H NMR技术的锥叶柴胡与北柴胡鉴别研究)[J]. Chinese J Magn Reson(波谱学杂志), 2014, 31(2): 214-221. |
| [12] | Committee for the Pharmacopoeia of People's Republic of China(国家药典委员会). Pharmacopoeia of P. R. China, Part 1. (中华人民共和国药典第一部)[S]. Beijing(北京): Chemical Industry Publishing House(中国医药科技出版社), 2010: 附录II D炮制通则. |
| [13] | AN Yan-peng(安艳捧), Yang Xiao-yan(杨晓艳), Li Hong-de(李洪德), et al. NMR analysis of nicotinamide N-oxide and pseudouridine in rat urine(大鼠尿液中N-氧化烟酰胺和伪尿嘧啶核苷的NMR分析)[J]. Chinese J Magn Reson (波谱学杂志), 2014, 31(2): 232-242. |
| [14] | Nakajima Y, Satoh Y, Katsumata M, et al. Terpenoids of Alisma orientale rhizome and the crud drag alismatis rhizoma[J]. Phytochemistry, 1994, 36(1): 119-121. |
| [15] | Yoshikawa M, Hatakeyama S, Tanaka N, et al. Crud drug from aqutic plants. I. On the constituents of Alismatis rhizoma(1). Absolute stereostructures of alisols E 23-acetat, F, and G, new protostane-type triterpnens from Chinese Alismatis rhizoma[J]. Chem Pharm Bull, 1993, 41(11): 1 948-1 954. |
 2016, Vol. 33
2016, Vol. 33





