文章信息
- 陈少敏, 唐淳, 龚洲
- CHEN Shao-min, TANG Chun, GONG Zhou
- 铽离子-镧系金属结合标签的荧光探针的改进
- Improvement of Fluorescence Quantum Yield for Terbium (III)-Bound Lanthanide-Binding Tag
- 波谱学杂志, 2016, 33(1): 106-116
- Chinese Journal of Magnetic Resonance, 2016, 33(1): 106-116
- http://dx.doi.org/10.11938/cjmr20160110
-
文章历史
- 收稿日期: 2015-04-13
- 收修改稿日期: 2016-01-26
2. 中国科学院大学, 北京 100046
2. University of Chinese Academy of Sciences, Beijing 100049, China
镧系金属离子自发现以来,由于具有毫秒级别的荧光寿命[1]、荧光光谱具有>200 nm的斯托克斯位移以及荧光没有极性[2]等特点,被作为荧光探针在时间分辨的荧光检测、荧光成像和荧光共振能量转移检测等方面广泛使用[3, 4, 5, 6].
镧系金属结合标签(Lanthanide Binding Tag,LBT)起源于钙调蛋白,钙调蛋白具有EF-h and 结构,能够特异性结合钙离子,而钙离子与镧系金属离子的原子半径很相似[7],因此镧系金属离子可以代替钙离子[8, 9, 10].对缺乏钙离子结合位点的蛋白,镧系金属离子一般与在蛋白侧链引入的能特异性结合镧系金属离子的螯合剂[11, 12]结合.1995年,Szabo和合作者发现钙调蛋白中有一段与钙离子结合的loop区域表现出与铽离子(Tb3+)较大的结合倾向[13].基于这段loop区域,他们经过一系列筛选和改进,设计了一段小肽[14, 15, 16],提高了与镧系金属离子的结合能力.并在合适的位置引入色氨酸[17, 18],这段小肽定义为LBT.
LBT由15~20个氨基酸构成,能够特异性结合镧系金属离子(KD ≈10-9 mol/L)[15, 16].由于LBT的尺寸很小,一般不会对蛋白的结构及功能造成影响[19, 20, 21],可融合表达在蛋白质的碳端、氮端或者loop区域[22],还可以通过半胱氨酸连接在蛋白质上[23].
常用的LBT序列为YIDTNNDGWIEGDELLA,其中6个氨基酸(粗体标示)主链的羟基氧参加与镧系金属离子的配位(图 1)[21, 25].9号位的色氨酸对于镧系金属离子的敏化至关重要,因为镧系金属本身的消光系数低于10 L/mol·cm,不能被直接激发[24],需要周围“天线”吸收外部能量后传递给镧系金属离子进而被激发产生荧光,LBT上色氨酸的吲哚环行使“天线”功能.荧光光谱研究和晶体结构研究表明:LBT上没有水分子参与镧系金属离子的配位(O-H键震动会淬灭镧系金属离子荧光)[25],这对于镧系金属离子用于荧光光谱学研究是非常重要的,在设计突变时不能影响镧系金属离子的配位.

|
| 图 1 LBT上Tb3+的配位示意图,灰色小球为Tb3+,黑色字体标注参与配位的氨基酸 Fig. 1 The schematic of binding of Tb3+(gray sphere)on LBT,the amino acids involved in binding to Tb3+ are shown as sticks |
泛素(Ubiquitin,Ub)是一种广泛使用、纯化方便、不带有色氨酸、且结构刚性的蛋白质.本文中我们选取泛素作为载体,将LBT连接在泛素的碳端[22].在不影响镧系金属离子配位的基础上,对LBT进行了改造,通过增加LBT上“天线”(色氨酸或酪氨酸)的数量,研究“天线”的数目对于Ub-LBT(结合Tb3+)荧光量子产率的影响.
1 实验部分 1.1 样品制备 1.1.1 蛋白质突变引入我们采用Quick-change的方法将LBT的氨基酸序列插入到泛素的碳端[26].以增加LBT上吲哚环的数量且不影响镧系金属配位为原则,设计了五种突变型LBT(见表 1),并获得了五种突变型Ub-LBT原核表达质粒.
| 突变类型 | 突变后氨基酸序列* |
| LBT-WT | YIDTNNDGWIEGDELLA |
| LBT-T4W | YIDWNNDGWIEGDELLA |
| LBT-N6W | YIDTNWDGWIEGDELLA |
| LBT-I10W | YIDTNNDGWWEGDELLA |
| LBT-I10Y/T4W | YIDWNNDGWYEGDELLA |
| LBT-I10Y/D13W | YIDTNNDGWYEGWELLA |
| *粗体标示为突变后引入的酪氨酸和色氨酸 | |
采用融合表达的方法将携带有目标蛋白(Ub-LBT)的野生型和突变型质粒在大肠杆菌(BL21 star)中表达,非标记的蛋白在LB培养基中培养,培养温度为37 ℃,采用1 mmol/L IPTG 诱导4 h表达,离心(7 000 rpm)10 min收取菌液,取沉淀.然后高压破碎菌液,高速离心(20 000 rpm)20 min后,取上清进行蛋白质纯化.蛋白初步纯化采用DEAE离子交换树脂(GE Healthcare),根据目标蛋白(Ub-LBT)与杂蛋白带电量的不同将部分杂蛋白除去;然后采用Superdex-100(GE Healthcare),根据蛋白的大小对目标蛋白进一步纯化;接着采用Source Q(GE Healthcare)进行进一步精细分离.最后用电喷雾-四极杆-飞行时间质谱仪(ESI-Q-TOF-MS,Agilent)测定分子量为10 483.7,与现论分子量(10 484.8)一致,确实为目标蛋白;用可见分光光度计(津岛UV Probe)定量蛋白质浓度.
用于核磁共振(NMR)实验的、带有15N标记的Ub-LBT-WT在大肠杆菌(BL21 star)中表达,在M9培养基中培养,用15N标记的氯化铵作为氮源,培养温度为37 ℃,采用1 mmol/L IPTG诱导4 h表达.纯化,鉴定方式与非标记蛋白方法一致.
1.1.3 荧光光谱学实验样品制备表达纯化获得的蛋白质(Ub-LBT)与铽离子(Tb3+)进行结合反应:以蛋白质:Tb3+=1:20(摩尔浓度比)的比例混合,混匀后在室温静置10 min,即可获得Ub-LBT结合Tb3+的样品,用于荧光光谱扫描实验.反应缓冲体系为:10 mmol/L HEPES、100 mmol/L NaCl、pH = 6.5.
用10 mmol/L HEPES,100 mmol/L NaCl,pH = 6.5的缓冲溶液配置Tb3+浓度为 1 mmol/L的储液,用于荧光滴定实验.
1.1.4 NMR实验样品制备表达纯化获得的15N标记的蛋白质(Ub-LBT-WT)与镧系金属离子(镥离子,Lu3+)进行结合反应.因为Tb3+的顺磁性会让NMR信号衰减,故进行NMR实验时不使用Tb3+,而选用具有抗磁性质的Lu3+.蛋白质浓度为1 mmol/L,以蛋白质:Lu3+=1:1(摩尔浓度比)的比例混合,混匀后在室温静置10 min,获得Ub-LBT结合Lu3+的样品用于NMR实验.此反应缓冲条件为:10 mmol/L HEPES、100 mmol/L NaCl、pH = 6.5.
1.2 NMR实验采用三维(3D)NMR技术采集15N NOESY谱.使用Amicon浓缩管(Millpore,Billerica,MA)将蛋白样品置换到NMR实验所采用的缓冲液体系中,NMR实验采用的缓冲体系为:10 mmol/L NaAc、100 mmol/L NaCl、pH = 6.0.实验蛋白质浓度为 1 mmol/L,样品中加入10% D2O.NMR实验在Bruker AVIII600核磁谱仪上进行,温度为298 K,对应质子共振频率为600.13 MHz,扫描次数为32,混合时间为120 ms,间接维采样点数为128.
1.3 荧光光谱学实验荧光光谱实验采用的缓冲体系为:10 mmol/L HEPES、100 mmol/L NaCl、pH = 6.5.实验蛋白质浓度为3 μmol/L.荧光激发谱扫描实验:发射波长为543 nm;狭缝宽度设置为3 nm;激发谱扫描范围为230~330 nm.荧光发射谱扫描实验:激发波长为280 nm;狭缝宽度设置为3 nm;发射谱扫描范围为470~640 nm;采用300 nm的滤光片减弱激发光源对于发射谱检测的影响.荧光光谱仪为FluoroMax-4高灵敏一体式荧光光谱仪(HORIBA).
1.4 荧光滴定实验荧光滴定实验采用的缓冲体系为:10 mmol/L HEPES,100 mmol/L NaCl,pH = 6.5.Tb3+储液滴定Ub-LBT时,Ub-LBT浓度为3 μmol/L(由于Ub-LBT-WT与Tb3+解离常数约为10 nmol/L,为保证解离常数拟合的准确性,Ub-LBT-WT实验浓度为200 nmol/L),实验体积为2 mL,Tb3+储液浓度为1 mmol/L,每滴加1 μL到测试体积(2 mL)中,Tb3+离子浓度增加0.5 μmol/L.滴定过程中让样品充分结合后(搅拌3 min),采用荧光谱仪检测荧光强度的变化,检测激发波长为280 nm,发射波长为54 nm.共滴定了14个点,Tb3+浓度范围0~15 μmol/L.由于滴定过程中实验体积有变化,为了扣除体积变化对于荧光强度的影响,我们采用同样的滴定步骤用Tb3+滴定缓冲溶液,记录荧光强度的变化,最后在解离常数拟合时扣除体积变化对荧光强度造成的影响,最后对实验数据进行拟合,得到LBT与镧系金属离子的解离常数(KD).荧光光谱仪为FluoroMax-4高灵敏一体式荧光光谱仪(HORIBA).
2 结果与讨论 2.1 LBT-WT的主链归属与LBT的结构优化我们采集了15N标记的Ub-LBT-WT的NOESY谱,对LBT主链上氨基的氮原子和氢原子的化学位移进行了归属[图 2(a)].根据LBT的归属以及化学位移的分布说明在NMR实验条件下连接在泛素碳端的LBT具有二级结构单元.

|
| 图 2 (a)Ub-LBT-WT的归属结果,灰色字体代表LBT-WT的归属结果,黑色字体为Ub的归属;(b)野生型与五种突变型LBT采用分子动力学模拟得到的优化结构,棒状结构代表LBT自带(虚线方框)或突变(实线方框)后的氨基酸 Fig. 2 (a)The 1H-15N HSQC spectrum of Ub-LBT-WT,the assignments of Ub and LBT-WT are shown in block and gray,respectively;(b)Using molecular dynamics simulation to optimize structures of the LBT-WT and five mutant derivatives,the sticks structures are amino acids originally involving in LBT-WT(dotted box)or the mutants(solid line box) |
基于引言中提到的镧系金属离子的发光机制以及研究目的,我们在设计突变时主要考虑两点:(1)突变不能改变LBT上镧系金属离子的配位;(2)突变能够增加LBT的荧光量子产率.基于以上两点,我们不突变参与镧系金属离子配位的氨基酸,并且将特定的氨基酸突变为酪氨酸或色氨酸,以增加Ub-LBT上吲哚环的数量.我们设计五个突变:LBT-T4W、LBT-N6W、LBT-I10W、LBT-I10Y/D13W和LBT-I10Y/T4W,突变后LBT的结构如图 2(b)所示.我们通过荧光滴定和荧光光谱扫描实验,进一步研究突变对Ub-LBT与Tb3+结合能力的影响以及酪氨酸/色氨酸数量的增加对Ub-LBT荧光量子产率的影响.
2.2 突变改变了Ub-LBT与镧系金属离子结合强度Ub-LBT-WT与镧系金属离子具有很强的结合能力,解离常数能够达到纳摩(nmol/L)级别[图 3(a)],为了观察突变后Ub-LBT与镧系金属离子结合强度的变化,我们采用荧光滴定实验测定六种Ub-LBT与Tb3+的KD值.通过荧光滴定曲线,发现随着Tb3+浓度逐渐增加,野生和突变型蛋白的荧光发射强度也逐渐增加;当滴定体系中Tb3+浓度达到一定值时,荧光发射强度达到最大值;继续增加Tb3+浓度,荧光发射强度不再变化,说明此时Ub-LBT与的Tb3+结合达到饱和.我们可以将荧光发射强度相对于Tb3+浓度的变化进行拟合,得到了Tb3+与蛋白质的KD.KD为Tb3+与蛋白结合比例达到50%时Tb3+的浓度.KD越大,表示Tb3+与蛋白的结合能力越弱.
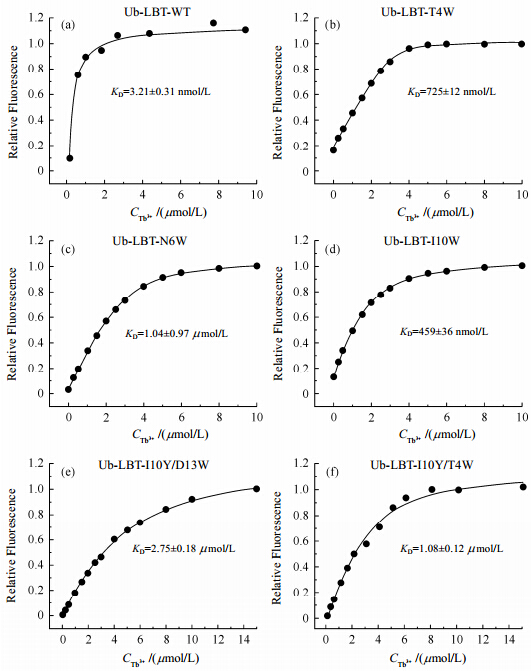
|
| 图 3 荧光滴定实验测定野生型和突变型Ub-LBT和Tb3+的结合强度 Fig. 3 The dissociation constant between Ub/LBT and Tb3+ calculated using fluorescence titration experiments |
采用Ub-LBT:Tb3+ =1:1(摩尔浓度比)结合方式进行拟合(图 3),发现荧光强度的实验值均匀的分布在拟合曲线附近,说明实验数据能够很好的拟合.通过拟合得到Ub-LBT-WT、Ub-LBT-T4W、Ub-LBT-N6W、Ub-LBT-I10W、Ub-LBT-I10Y/D13W、Ub-LBT-I10Y/T4W与Tb3+的解离常数分别为3.21 nmol/L,725 nmol/L,1.04 μmol/L,459 nmol/L,2.75 μmol/L,1.08 μmol/L(图 3).
与野生型Ub-LBT相比,五种突变型Ub-LBT与Tb3+的结合能力都有不同程度的减弱,其中N6W、I10Y/D13W和I10Y/T4W突变对LBT与Tb3+结合能力影响较大.Ub-LBT-T4W和Ub-LBT-I10W突变型与Tb3+的KD值处在纳摩级别;但是Ub-LBT- N6W、Ub-LBT-I10Y/D13W和Ub-LBT-I10Y/T4W与Tb3+的KD值变化明显,达到微摩级别.荧光滴定结果表明设计的五种突变都降低了Ub-LBT与Tb3+的结合能力.
荧光滴定的结果将用于指导下一步荧光光谱扫描实验:为了保证荧光强度能够反映荧光量子产率的变化,在荧光光谱扫描实验中需要保证金属离子结合的各蛋白浓度一致,所以针对KD不同的六种蛋白,在进行荧光扫描实验时需要对Tb3+浓度进行计算.
2.3 突变改变了Ub-LBT-Tb3+荧光量子产率我们通过扫描荧光激发谱与发射谱检测突变对Ub-LBT-Tb3+荧光量子产率的影响.在前面的荧光滴定实验中,五种突变都使Ub-LBT与Tb3+的结合强度减弱,在进行荧光扫描实验中为了保证结合金属离子的蛋白浓度一致,需要Tb3+浓度过量.实验中所有蛋白质浓度为3 μmol/L,要使与Tb3+结合能力最弱的Ub-LBT-I10Y/D13W(KD= 2.75 mmol/L)达到99%的结合,根据解离常数方程计算,需要的Tb3+浓度为300 μmol/L,即Tb3+浓度需要过量100倍.但金属离子浓度过高会引起蛋白质沉淀,所以综合考虑,我们选取了60 μmol/L的Tb3+进行实验(即Tb3+浓度过量20倍).在Tb3+浓度为60 μmol/L,蛋白浓度为3 μmol/L时,Ub-LBT-I10Y/D13W有效浓度可达97%,Ub-LBT-WT、Ub-LBT-T4W、Ub-LBT-N6W、Ub-LBT-I10W、Ub-LBT-I10Y/T4W的有效浓度都达到了99%.因此,Tb3+浓度过量20倍能够满足我们荧光扫描实验的要求,保证各结合金属离子的蛋白浓度基本一致.
将不同突变型的荧光激发谱叠加[图 4(a)]可以发现,五种突变型蛋白质与野生型相比:只有Ub-LBT-I10W的荧光强度发生减弱(Ub-LBT-WT的激发峰值为2.29×106,Ub-LBT-I10W的激发峰值为1.76×106).其他四个突变型Ub-LBT的荧光强度都有不同程度的增强,其中Ub-LBT-T4W的荧光强度(5.70×106)最大,强度为Ub-LBT-WT的2.5倍.此外,五种突变型Ub-LBT和野生型最大激发波长(表 2)都处于283 nm附近,没有发生变化,说明五种突变Ub-LBT中吲哚环之间都没有产生共轭从而使最大激发波长红移.图 4(b)为使用单因素方差分析对五种突变型和野生型的激发峰值进行统计学分析,结果表明五种突变型的荧光激发峰值与Ub-LBT-WT有显著性差异,说明在结合金属离子的蛋白浓度相同的实验条件下,吲哚环的增加会影响荧光激发强度.
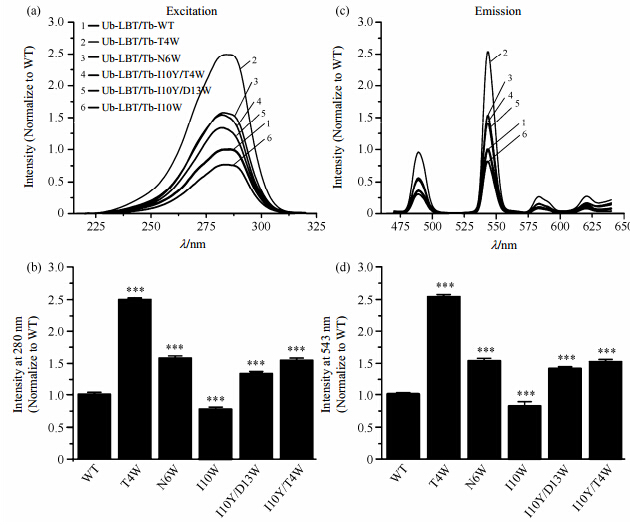
|
| 图 4 野生型和五种突变型Ub-LBT-Tb3+的激发谱(a)与发射谱(c):不同突变型的谱图用不同的数字表示,对每一种Ub-LBT-Tb3+的荧光谱扫描实验都重复5次,(a)图和(c)图线条表示5次实验的荧光强度平均值.六种Ub-LBT-Tb3+最大荧光激发峰(b)和发射峰(d)的统计学分析:激发波长和发射波长分别为280和543 nm,纵坐标表时将Ub-LBT-WT-Tb3+最大荧光强度定义为1时的相对荧光强度.数据的显著性采用单因素方差分析进行检验,“*”表示与Ub-LBT-WT存在差异的组,“*”的数量表示显著差异的程度 Fig. 4 The excitation spectra(a) and emission spectra(c)of LBT-WT and five mutant derivatives with different numbers. The fluorescence spectra of LBT scanning experiments were repeated 5 times,the line shows the average intensity of 5 times. The maximum fluorescence excitation intensity(b) and the maximum fluorescence emission intensity(d)of Ub-LBT,bars represent mean+SD form n=5 separate experiments; the asterisk(*)indicates p<0.05(one-way ANOVA test) |
将不同突变型的荧光发射谱叠加[图 4(c)],五种突变型的荧光发射强度的变化趋势与图 4(a)一致:与野生型相比,只有Ub-LBT-I10W的荧光发射强度减小(Ub-LBT-WT的发射峰值为1.93×106,Ub-LBT-I10W的发射峰值为1.58×106).其他四个突变型Ub-LBT的荧光发射强度都有不同程度的增加,其中Ub-LBT-T4W的荧光强度(4.90×106)相比野生型增强了1.5倍.同样使用单因素方差分析对五种突变型和野生型的发射峰值进行统计学差异比较[图 4(d)],结果表明五种突变型的荧光发射峰值与Ub-LBT-WT相比,都表现出显著的差异,说明在结合金属离子的蛋白浓度相同的实验条件下,吲哚环的增加会影响荧光发射强度.
在实验条件相同、有效实验浓度一致的情况下,荧光强度的变化可以反映荧光量子产率的变化.根据荧光光谱扫描结果我们发现(图 4,表 2):与Ub-LBT-WT相比,五种突变型中只有Ub-LBT-I10W的荧光量子产率降低,其他四种突变型的荧光量子产率都有不同程度的增加.其中Ub-LBT-T4W荧光量子产率增加最为明显,约增加了1.5倍;其次是Ub-LBT-N6W和Ub-LBT-I10Y/T4W,约增加了50%,Ub-LBT-I10Y/D13W荧光量子产率约增加了30%.这说明Ub-LBT上吲哚环数量的增加会引起荧光量子产率的变化.
| 基因型 | Ub-LBT-WT | Ub-LBT-T4W | Ub-LBT-N6W | Ub-LBT-I10W | Ub-LBT-I10Y/D13W | Ub-LBT-I10Y/T4W |
| 激发峰/(×106) | 2.29 | 5.70 | 3.61 | 1.76 | 3.06 | 3.54 |
| 发射峰/(×106) | 1.93 | 4.90 | 2.96 | 1.58 | 2.73 | 2.94 |
| 最大激发波长/nm | 282 | 287 | 284 | 284 | 283 | 282 |
在本文中,我们通过一系列的荧光滴定和荧光光谱扫描实验,研究了LBT上吲哚环数量的增加对LBT荧光特性的影响.实验表明在LBT上适当的位置引入吲哚环会影响LBT与Tb3+的结合能力,也会改变Ub-LBT-Tb3+的荧光量子产率.荧光量子产率的变化具体表现在:Ub-LBT-I10W的荧光量子产率减弱,Ub-LBT-T4W,Ub-LBT-N6W,Ub-LBT-I10Y/D13W、Ub-LBT-I10Y/T4W的荧光量子产率都有不同程度的增强,其中Ub-LBT-T4W约增强了1.5倍.
| [1] | Shannon R D. Revised effective ionic radii and systematic studies of interatomic distances in halides and chalcogenides[J]. Acta Crystallogr A, 1976, 32(5): 751-767. |
| [2] | Lakowicz J R, Keating S. Binding of an indole derivative to micelles as quantified by phase-sensitive detection of fluorescence[J]. J Biol Chem, 1983, 258(9): 5 519-5 524. |
| [3] | Hemmila I, Laitala V. Progress in lanthanides as luminescent probes[J]. J Fluoresc, 2005, 15(4): 529-542. |
| [4] | Bunzli J C G. Benefiting from the unique properties of lanthanide ions[J]. Acc Chem Res, 2006, 39(1): 53-61. |
| [5] | Liu Y S, Zhou S Y, Tu D T, et al. Amine-functionalized lanthanide-doped zirconia nanoparticles: optical spectroscopy, time-resolved fluorescence resonance energy transfer biodetection, and targeted imaging[J]. J Am Chem Soc, 2012, 134(36): 15 083-15 090. |
| [6] | Lehmusvuori A, Tapio A H, Maki-Teeri P, et al. Homogeneous duplex polymerase chain reaction assay using switchable lanthanide fluorescence probes[J]. Anal Biochem, 2013, 436(1): 16-21. |
| [7] | Martin R B, Richardson F S. Lanthanides as probes for calcium in biological-systems[J]. Q Rev Biophys, 1979, 12(2): 181-209. |
| [8] | Mulqueen P, Tingey J M, Horrocks W D. Characterization of lanthanide(III) ion binding to calmodulin using luminescence spectroscopy[J]. Biochemistry-US, 1985, 24(23): 6 639-6 645. |
| [9] | Ye Y M, Lee H W, Yang W, et al. Probing site-specific calmodulin calcium and lanthanide affinity by grafting[J]. J Am Chem Soc, 2005, 127(11): 3 743-3 750. |
| [10] | Biekofsky R R, Muskett F W, Schmidt J M, et al. NMR approaches for monitoring domain orientations in calcium-binding proteins in solution using partial replacement of Ca2+ by Tb3+[J]. Febs Lett, 1999, 460(3): 519-526. |
| [11] | Becker C F W, Clayton D, Shapovalov G, et al. On-resin assembly of a linkerless lanthanide(III)-based luminescence label and its application to the total synthesis of site-specifically labeled mechanosensitive channels[J]. Bioconjugate Chem, 2004, 15(5): 1 118-1 124. |
| [12] | Heffern M C, Matosziuk L M, Meade T J. Lanthanide probes for bioresponsive imaging[J]. Chem Rev, 2014, 114(8): 4 496-4 539. |
| [13] | Mackenzie C R, Clark I D, Evans S V, et al. Bifunctional fusion proteins consisting of a single-chain antibody and an engineered lanthanide-binding[J]. Immunotechnology, 1995, 1(2): 139-150. |
| [14] | Nitz M, Franz K J, Maglathlin R L, et al. A powerful combinatorial screen to identify high-affinity terbium(III)-binding peptides[J]. Chembiochem, 2003, 4: 272-276. |
| [15] | Franz K J, Nitz M, Imperiali B. Lanthanide-binding tags as versatile protein coexpression probes[J]. Chembiochem, 2003, 4: 265-271. |
| [16] | Martin L L, Sculimbrene B R, Nitz M, et al. Rapid combinatorial screening of peptide libraries for the selection of lanthanide-binding tags (LBTs)[J]. Qsar Comb Sci, 2005, 24(10): 1 149-1 157. |
| [17] | Bachilo S M, Balzano L, Herrera J E, et al. Narrow (n, m)-distribution of single-walled carbon nanotubes grown using a solid supported catalyst[J]. J Am Chem Soc, 2003, 125(37): 11 186-11 187. |
| [18] | Kilhoffer M C, Roberts D M, Adibi A O, et al. Investigation of the mechanism of calcium-binding to calmodulin-use of an isofunctional mutant with a tryptophan introduced by site-directed mutagenesis[J]. J Biol Chem, 1988, 263(32): 17 023-17 029. |
| [19] | Nitz M, Franz K J, Imperiali B. Development of new high affinity lanthanide binding tags (LBT) based upon the 20 commonly occurring amino acids[J]. Abstr Pap Am Chem S, 2002, 224: U173-U173. |
| [20] | Rajapakse H E, Miller L W. Time-resolved luminescence resonance energy transfer imaging of protein-protein interactions in living cells[J]. Methods Enzymol, 2012, 505: 329-345. |
| [21] | Selvin P R. Principles and biophysical applications of lanthanide-based probes[J]. Annu Rev Bioph Biom, 2002, 31(1): 275-302. |
| [22] | Barthelmes K, Reynolds A M, Peisach E, et al. Engineering encodable lanthanide-binding tags into loop regions of proteins[J]. J Am Chem Soc, 2011, 133(4): 808-819. |
| [23] | Su X C, Huber T, Dixon N E, et al. Site-specific labelling of proteins with a rigid lanthanide-binding tag[J]. Chembiochem, 2006, 7(10): 1 599-1 604. |
| [24] | Richardson F S. Terbium(III) and europium(III) ions as luminescent probes and stains for biomolecular systems[J]. Chem Rev, 1982, 82: 541-552. |
| [25] | Nitz M, Sherawat M, Franz K J, et al. Structural origin of the high affinity of a chemically evolved lanthanide-binding peptide[J]. Angew Chem Int Ed Engl, 2004, 43(28): 3 682-3 685. |
| [26] | El-Gewely M R. Site-Directed Mutagenesis and Protein Engineering: Proceedings of the International Symposium on Site-Directed Mutagenesis and Protein Engineering[C]. New York: Elsevier Science Publisher, 1991. |
 2016, Vol. 33
2016, Vol. 33




