文章信息
- 董涛, 梁思, 王慧, 杨晓冬
- DONG Tao, LIANG Si, WANG Hui, YANG Xiao-dong
- 一种用于fMRI的温度觉刺激装置的设计与验证
- Design and Evaluation of a Caloric Stimulation Device for fMRI Studies
- 波谱学杂志, 2016, 33(1): 54-65
- Chinese Journal of Magnetic Resonance, 2016, 33(1): 54-65
- http://dx.doi.org/10.11938/cjmr20160105
-
文章历史
- 收稿日期: 2015-04-02
- 收修改稿日期: 2016-01-22
2. 中国科学院大学, 北京 100049;
3. 中国科学院 苏州生物医学工程技术研究所, 江苏 苏州 215163
2. University of Chinese Academy of Sciences, Beijing 100049, China;
3. Suzhou Institute of Biomedical Engineering and Technology, Chinese Academy of Sciences, Suzhou 215163, China
基于脑血氧水平依赖(BOLD)的对比方法是由Ogawa等人[1]于1990年提出来用于脑功能磁共振成像技术(functional Magnetic Resonance Imaging,fMRI)的研究方法.近年来,BOLD/fMRI技术在人类脑科学研究中得到了越来越广泛的应用,是感觉、运动、认知、记忆和情感等[2, 3, 4, 5, 6]脑功能机制研究领域的主要研究手段之一.在心理疾病、神经疾病和精神疾病等[7, 8, 9]研究中,fMRI相对于其它研究手段有着较高的时间分辨率和空间分辨率.然而,要对人脑有全面的认识,需要对脑部相关神经处理机制,特别是对人体的五种基本感觉——视觉、听觉、嗅觉、味觉和触觉[10]的神经处理机制进行深入研究.其中触觉是一种广而复杂的感觉,具体又分为触压觉、痛觉和温度觉[11].本文主要针对触觉中的温度觉fMRI实验设计了一套温度刺激装置.人体的皮肤表面广泛分布着温度觉感受器,最新研究表明,对人体的冷热刺激可能会影响人体的愉悦程度[13].通过设计用于fMRI的温度觉刺激装置对温度觉进行相应的研究,可以进一步揭示其深层次的机制.
进行温度觉fMRI研究时,需要给予被试冷热刺激,一般是通过让被试刺激部位接触具有不同温度的物体表面来实现.早期实验一般是让被试进行fMRI实验的同时,触摸装有一定温度水的塑料瓶,整个实验周期长、精度低;同时温度的逸散可能会对采集的图像数据造成伪影.近来已经有公司推出了适用于fMRI的温度觉刺激装置,如国外的Medoc公司所研发的PATHWAY产品,可以在-10~54 ℃范围内以最快70 ℃/s的切换速度进行温度刺激,近几年来研究者均基本使用Medoc公司的刺激装置进行相关课题研究[14, 15].然而在国内,对于温度觉的fMRI研究还处于起步阶段,实验装置也主要是通过购买国外公司的相关产品,对于温度觉刺激装置的研究更是停留在空白阶段.
用于fMRI的温度觉刺激装置需满足以下五点要求[11, 12]:①实现多种温度的刺激;②避免引入无关刺激;③刺激强度可调;④刺激与成像时间同步;⑤电磁兼容.本文针对温度觉刺激和人体温度觉感受特点及具体要求设计了一套自动化刺激装置,能够辅助fMRI进行脑功能相关性研究.该装置使用微控制器(MCU)作为下位机的控制核心,通过串口与数字PID温控模块进行通讯,实现了对刺激端温度的精确控制.上位机使用LabVIEW平台编写相关软件,能够设置相应的刺激序列,通过数据采集卡将设定的温度值传递给下位机,实现上下位机之间的通讯.刺激序列采用16 ℃、40 ℃作为刺激温度、32 ℃作为对照温度,实验采用组块设计方法.装置验证实验使用Siemens 3.0 T MRI仪器及EPI序列进行相应的数据采集,实验数据采用基于MATLAB软件的DPARSF、SPM8工具包进行分析处理.实验结果可精确观察到温度觉的脑功能激活区域,验证了该装置的可行性.
1 温度刺激装置硬件设计 1.1 整体设计
刺激装置整体框架图如图 1所示.整个刺激装置分为温度刺激产生单元和控制单元两部分.其中温度刺激产生单元包括数字PID温控电路、刺激端和NTC传感器;控制单元包括上位机LabVIEW软件、美国国家仪器公司NI数据采集卡和MCU控制电路.

|
| 图 1 温度觉刺激装置框图 Fig. 1 Block diagram of caloric stimulation device |
系统的工作流程:实验开始前,用户在上位机LabVIEW软件界面,编写需要的实验刺激序列.实验开始时,刺激序列通过NI数据采集卡,将控制指令传送给MCU;MCU对获得的控制指令进行处理,并通过串口将处理后的温度值传递给数字PID温控模块;数字PID温控模块通过监测NTC传感器连续采集的刺激端的温度值来控制温度,利用PID算法可实时控制刺激端电流方向和大小,达到精确控制刺激端温度的目的.同时,数字PID温控模块将温度值通过串口传递给MCU,可在LCD屏幕上实时显示.
为满足电磁兼容要求,将控制单元和数字PID温控模块布置在操作室,只将刺激端放置在屏蔽室内,通过导线与操作室的电路相连.
1.2 温度刺激产生单元温度刺激产生单元主要由刺激端和数字PID温控模块组成,刺激端采用的是半导体制冷片(TEC),数字PID温控模块采用的是TCM型号的半导体制冷数字温控器.
TEC是利用Peltier效应进行加热或制冷的半导体PN结器件.所谓Peltier效应,是指在两种半导体材料组成的PN结两头加上直流电压,当直流电流通过这个PN结后,一端会吸热,而另一端会放热的现象.通常当有电流从TEC流过时,电流产生的热量会从TEC的一侧传递到另一侧,在TEC上产生“热”端和“冷”端.端面状态处于制冷还是发热取决于TEC中电流的方向.制冷量和发热量的大小与流过的电流大小有关——电流越大,产生的制冷量或发热量越大,但这并不是简单的线性关系.一般是通过数字PID网络来控制流过TEC的电流大小和方向,实现快速稳定调节目标物体温度的目的.后文统一将TEC称为刺激端.为满足温度觉fMRI实验中刺激端温度快速稳定的需求,数字PID温控模块可根据TEC型号设置合适的PID系数,实现±0.5 ℃的温控误差,使温度稳定时间控制在10 s内.为验证数字PID温控模块的性能,在3.1中设计了数字PID温控模块的功能验证实验.
1.3 控制单元刺激装置的控制单元由以下几部分组成:上位机LabVIEW软件、数据采集卡、微控制器模块和电源.如图 2(a)所示,数据采集卡采用的是与NI公司LabVIEW软件配套使用的USB6008.USB6008数据采集卡可提供8个模拟输入(AI)通道、2个模拟输出(AO)通道、12个数字输入/输出(DIO)通道以及一个带全速USB接口的32位计数器.

|
| 图 2 (a)温度觉刺激装置控制系统框架图;(b)微控制器系统软件功能框图 Fig. 2 (a)Block diagram of caloric stimulation device control system;(b)Function diagram of MCU system |
MCU模块采用MSP430F149单片机作为控制核心.MSP430F149是TI公司新开发的一种具有16位总线的带FLASH的单片机,性价比和集成度高,主要功能是获取上位机软件设定的温度值,然后通过串口向数字PID温控模块传递刺激序列的各项参数,设置刺激端温度值.同时,从数字PID温控模块反馈给微控制器的实时温度值通过LCD显示.其功能框图如图 2(b)所示.
2 刺激装置软件设计 2.1 上位机软件设计上位机软件基于LabVIEW平台开发.LabVIEW是一种程序开发环境,由美国国家仪器(NI)公司研制开发,使用的是图形化编辑语言G编写程序,产生的程序是框图的形式.基于LabVIEW平台开发软件简单高效、开发周期短,并且该平台能够与所选数据采集卡配套使用.
该软件分为“刺激序列设计”和“刺激序列执行”两个部分.“刺激序列设计”为实验人员提供可视化的软件界面来设定刺激序列,包括刺激温度值和温度持续时间等参数的设定;“刺激序列执行”是指实验人员发出“开始刺激”的指令后,软件控制数据采集卡根据设计好的刺激序列传递不同的温度值,控制刺激端实现不同的温度.“刺激序列执行”界面可同时显示“总实验进度”和“本次实验进度”两种不同状态.软件在PC上输出包含刺激温度和刺激时间点的记录文件,用于实现温度刺激和图像采集的同步[16].
2.2 微控制器软件设计微控制器软件的总体流程图如图3所示.整个软件既要与PC端通过NI数据采集卡实时通讯,接收来自于上位机软件的刺激序列;同时也要通过串口与数字PID温控模块进行通讯.上电后,对系统所用到的参数和接口进行初始化,并判断上位机软件是否有数据发送,当接收到数据后,对刺激序列进行相应的处理.然后判断指令“Vector = UARTOTX_VECTOR?”:如果指令正确,将刺激指令传递给数字PID温控模块,完成对刺激端温度的控制;如果指令错误,再判断指令“Vector = UARTORX_VECTOR?”,若指令正确,则系统接收来自PID数字温控模块传递过来的温度值,完成温度显示.

|
| 图 3 微控制器软件流程图 Fig. 3 Flow chart of microcontroller software |
在各个模块的调试过程当中,确定数字PID温控模块的PID参数最为重要.PID参数的确定能够影响TEC刺激端温度稳定时间及震荡幅度.验证实验中记录了刺激序列控制的实际温度变化数据.从图 4中可以看出如果允许温控误差在±0.5 ℃内,稳定时间可以控制在10 s内;如果误差允许在±0.2 ℃,稳定时间则需30~40 s.考虑到实验中需要温度快速稳定的特性,以及被试长时间触摸刺激端时会产生温度觉疲劳,我们允许装置的温控误差在±0.5 ℃.
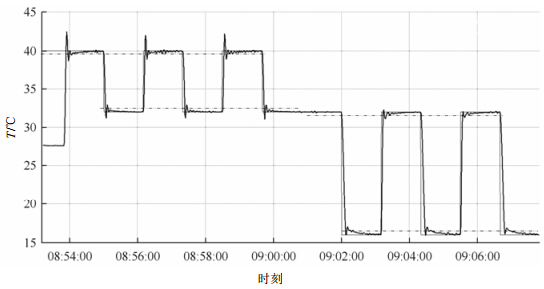
|
| 图 4 温度变化曲线 Fig. 4 Curve of temperature variation |
整个装置的测试过程中,设定了三种温度值:16 ℃、32 ℃和40 ℃,并预先将需要的刺激序列编写在LabVIEW软件中.刺激装置实物连接如图 5所示,用于刺激序列设计的上位机和刺激装置放置在控制室,他们之间通过数据采集卡进行通讯,刺激端放置在屏蔽室中,通过导线与刺激装置连接.刺激序列的温度设定及刺激持续时间会随刺激过程存储在PC中.

|
| 图 5 刺激装置实物连接图 Fig. 5 Connection diagram of the stimulation device |
实验采用右利手、无温度觉障碍的健康被试5名:男性2名、女性3名;年龄在23~26岁之间,平均年龄为24岁.实验前被试均签署“被试知情同意书”.扫描设备为Siemens 3.0 T Trio Tim MRI成像仪,扫描序列为EPI序列,重复时间TR为2 000 ms,回波时间TE为30 ms,层厚为3 mm,共33层覆盖全脑,扫描矩阵为64×64,视野FOV为220 mm× 220 mm.
实验前,均给被试做预实验,用以测定其对温度的承受能力.根据预实验结果,选定的实验温度值为:40 ℃(热刺激)、32 ℃(对照)和16 ℃(冷刺激).
4.2 实验设计实验采用组块设计的实验方法,刺激序列如图 6所示.在LabVIEW软件中分别设定刺激温度值:16 ℃和40 ℃,对照温度为32 ℃.在实验前给与被试40 s的静息时间,每个组块包含三次实验,每次实验时长为70 s.由3.1节可知,温度达到稳定的时间需要10 s,因此前10 s中的实验数据不作为有用数据;考虑到刺激时间过长会造成温度觉适应,每组温度刺激的后30 s实验数据也将不作分析.两组块分别采用间断式实验模式,总时长为880 s.

|
| 图 6 刺激序列 Fig. 6 Stimulation sequence |
实验前在LabVIEW软件中输入刺激序列,调整PC与MRI的系统时间至一致.启动刺激装置,开始刺激实验.当实验完成后,通过生成的刺激记录文件和图像中的成像时间,筛选出对应刺激序列的图像用于数据处理.
实验过程中,被试采取仰卧位、闭上眼睛、戴隔音耳罩、尽量保持静止、均匀呼吸、不主动感受刺激温度、以及不刻意辨别刺激温度种类.使用MRI仪器配套的呼吸监测装置记录被试呼吸情况,如果出现呼吸波不规律或其他异常应及时停止实验.实验结束后要求被试填写实验感受记录以掌握实验过程的真实情况.
4.4 数据处理实验数据处理使用基于Matlab软件的SPM8工具包进行脑激活分析.首先需要用DPARSF进行数据预处理,具体包括:图像格式转换(将MRI仪器采集的DICOM格式的数据转化为DCM格式)、时间层校正、头动校正、空间标准化和高斯平滑(半宽高FWHM为4 mm);然后根据实验中生成的刺激时间记录文件将MRI数据分为16 ℃、40 ℃和32 ℃三组,使用SPM8对筛选后图像进行个体统计分析、组分析,组分析数据处理过程中激活区P< 0.001,Cluster > 10(10个以上相连激活像素的脑区视为有意义激活区);最后以图像形式输出40 ℃和16 ℃的激活结果.
5 结果与讨论 5.1 实验结果在基于fMRI的温度觉实验中,5名被试均完成了实验.由于一名被试头部运动过大,将其数据剔除.其他4名被试的数据采用SPM8软件工具包进行数据处理,得到了较为理想的激活点.40 ℃和16 ℃数据激活点统计结果如表 1所示.
| 激活脑区 | BA分区 | 激活点坐标 | cluster | t-test | z-test | ||||||
| x | y | z | |||||||||
| 40℃ | Parietal Lobe(SII)(顶叶) | -4 | -56 | 60 | 13 | 75.13 | 4.56 | ||||
| Anterior Cingulate(前扣带回) | 32(32) | 2(-8) | 40(38) | 0(2) | 15(15) | 60.55(16.56) | 4.42(3.49) | ||||
| Thalamus_L(丘脑) | -14 | -34 | 6 | 18 | 42.35 | 4.18 | |||||
| Cerebellum Posterior Lobe(小脑后叶) | -32 | -80 | -44 | 16 | 39.00 | 4.12 | |||||
| Insula_L(脑岛) | 13 | -42 | 2 | -6 | 16 | 36.74 | 4.08 | ||||
| Frontal Lobe(mid)(中额叶) | 9 | -42 | 18 | 38 | 10 | 27.55 | 3.88 | ||||
| Frontal_Sup_Orb_L(眶部额上回) | -22 | 58 | -4 | 26 | 21.2 | 3.68 | |||||
| 16℃ | Anterior Cingulate(前扣带回) | 32(24) | 8(-2) | 34(30) | -8(-6) | 29 | 33.15(16.31) | 4.01(3.48) | |||
| Supp_Motor_Area_R(辅助运动区) | 6 | 6 | 4 | 68 | 11 | 33.07 | 4.01 | ||||
| Posterior Cingulate(后扣带回) | -4 | -50 | 12 | 14 | 30.38 | 3.95 | |||||
| Insula_R(脑岛) | 42 | 6 | -12 | 10 | 26.13 | 3.84 | |||||
| Cingulate Gyrus(扣带回) | 31 | 4 | -28 | 36 | 10 | 23.39 | 3.76 | ||||
| BA分区指尼安·布洛德曼(Korbinian Brodmann)分区系统.t-test和z-test表示统计学t检验与z检验,用来检验两个平均数之间差异显著的程度.参数:p < 0.001,cluster > 10,自由度= [1.0,3.0],体素大小=2.0×2.0×2.0 mm3. | |||||||||||
上述表格中显示了40 ℃和16 ℃刺激的激活区域,可以发现40 ℃刺激时,顶叶、前扣带回和丘脑激活强烈;小脑后叶、左侧脑岛、中额叶和眶部额上回激活较为强烈,40 ℃刺激主要脑区激活如图 7(a)、(b)、(c)所示.16 ℃刺激时,前扣带回、辅助运动区、后扣带回有强烈激活;右侧脑岛激活强度次之,16 ℃刺激主要激活脑区如图 7(d)、(e)、(f)所示.

|
| 图 7 40℃刺激脑激活图:(a)顶叶,(b)前扣带回,(c)丘脑. 16℃刺激脑激活图:(d)前扣带回,(e)辅助运动区,(f)后扣带回.(a)~(f)中,左上角数字表示脑区相应激活点位于成像扫描的层值数 Fig. 7 Brain MRI images activated at 40℃:(a)Parietal lobe,(b)Anterior cingulate,(c)Thalamus_L. brain MRI images activated at 16℃:(d)Anterior cingulate,(e)Supp_motor_area_R,(f)Posterior cingulated. The numbers in top left corner are scan layers in MRI of the activated points in brain |
许多神经影像技术己经证明人类大脑对皮肤冷热刺激的反应脑区一般包括躯体感觉皮层(SI和SII)、脑岛、前扣带回、前额叶皮质、辅助运动区、丘脑、小脑和顶叶皮层等[17, 18, 19, 20, 21].此外还发现在眶额皮层[22, 23]也有激活区域.躯体感觉区位于顶叶中央沟后面的中央后回,这里主管着热、冷、触、痛和本体觉等所有来自躯体的感觉;脑岛有助于感受身体状态,能够感受疼痛刺激,皮肤冷热刺激等;辅助运动区是用来管理躯体运动的感觉区域,可能由于实验中给与被试不同的冷热刺激,造成肌肉紧张,从而引起辅助运动区激活.脑岛、丘脑、小脑等部位部分区域也与辅助运动区有关.
Becerra等人[14]在1999年关于温热刺激对人脑激活区域的研究表明,41 ℃热刺激和46 ℃热刺激对人脑的激活区域相同,在额叶、前后扣带回、丘脑、运动皮层、躯体感觉皮层(SI和SII)、辅助运动区、脑岛和小脑部位都发现激活现象.Oliver等人[24]在冷热刺激对前庭皮层影响的研究中,对被试分别进行了冷热的刺激,在前脑岛、后脑岛、中央后回、腹外侧的部分枕叶和顶叶区域都发现激活现象.
实验中使用16 ℃和40 ℃作为刺激温度来研究人类大脑对皮肤冷热刺激的反应脑区.在两组实验中发现,前扣带皮层是公共激活区域.40 ℃刺激实验中,顶叶是属于躯体感觉皮层(SII),有研究表明经过皮肤(触摸,温度和疼痛)输入的主要感觉,会通过丘脑传递到顶叶[25].
本研究的主要目的是验证温度觉刺激装置的可行性,实验中分别给了冷热两种不同的温度觉刺激,实验结果显示了温度觉刺激的部分区域,初步验证了该装置的实用性.本次实验旨在验证刺激装置的功能特性,激活结果不作详细分析.
6 总结本文简要阐述了刺激装置的设计原理,详细介绍了刺激装置的硬件和软件设计的基本单元以及装置的功能实现流程.整个实验装置有较好的时间精度,并且能够实现刺激与成像的时间同步,满足fMRI脑功能实验的要求.最后使用该刺激装置对5名被试进行了温度觉的脑功能实验,实验结果初步验证了该装置的可行性.它的缺点主要是刺激温度区间较小(8~50 ℃);达到较低温度时,需要较长的稳定时间;而且装置不能自动与fMRI仪器同步,需要手动调整.
为了更好地满足温度觉fMRI实验的需要,fMRI温度觉刺激装置可以采取以下更复杂的设计以满足更多功能:在刺激端的散热面加入相应的散热较好的散热模块,使装置能够快速稳定在较低温度;实验装置中可接入蓝牙模块接收脉冲信号、开启刺激装置,以达到与fMRI仪器自动同步的效果.
致谢:本工作由中国科学院科研装备研制项目YZ201313和江苏省自然科学基金BK20131171支持.感谢华东师范大学上海市磁共振重点实验室杜小霞副教授在实验操作和数据处理等方面给予的热心指导.| [1] | Ogawa S, Lee T M, Kay A R, et al. Brain magnetic resonance imaging with contrast dependent on blood oxygenation[J]. P Nat Acad Sci USA, 1990, 87(24): 9 868-9 872. |
| [2] | Wang Min-rui(王敏锐). fMRI Research on Brain Mechanisms of Stroke and Normal Movement of the Hands and Feet(脑卒中者及正常人手足运动脑机制的fMRI研究)[D]. Hefei(合肥): Medical University of Anhui(安徽医科大学), 2013. |
| [3] | Zhou Gao-feng(周高峰), Wang Xiao-yi(王小宜), Huang Man-ping(黄满平), et al. BOLD-fMRI in sensory area and motor hand functional area with brain tumor in the central area(中央区良恶性脑肿瘤手运动及感觉功能区的BOLD-fMRI表现)[J]. J Cent South Univ (Med Sci) [中南大学学报(医学版)], 2008, 7: 576-581. |
| [4] | Zhou Yang(周扬). fMRI Studies on Face and Object Recognition in Human Anisometropic Amblyopia and Chinese Characters Recognition in Health People(屈光参差性弱视面孔及物体形觉认知和正常人群对汉字认知大脑皮层功能活动特征的fMRI研究)[D]. Chongqing(重庆): Third Military Medical University(第三军医大学), 2007. |
| [5] | Zhang Shu-ying(张鉥缨). BOLD-Functional Magnetic Resonance Imaging on Demonstrating the Brain Domains of Language、Memory of Patients With Epilepsy and Influencing of Antiepileptic Drugs on These Cerebral Areas(BOLD功能磁共振成像在癫痫患者语言、记忆功能区及其抗癫痫药物影响作用的研究)[D]. Chengdu(成都): Sichuan University(四川大学), 2007. |
| [6] | Xiang Ai-zhai(项爱斋), Zhang Yun-ting(张云亭), Zhang Quan(张权), et al. The activation of human affective system during passive music listening: A preliminary fMRI study(音乐刺激激活人脑情感系统的fMRI研究)[J]. Chinese Journal of Clinical Psychology(中国临床心理学杂志), 2006, 14(2): 215-217. |
| [7] | Kwong K K, Belliveau J W, Chesler D A, et al. Dynamic magnetic resonance imaging of human brain activity during primary sensory stimulation[J]. P Natl Acad Sci USA, 1992, 89(12): 5 675-5 679.. |
| [8] | Ogawa S, Tank D W, Menon R, et al. Intrinsic signal changes accompanying sensory stimulation: Functional brain mapping with magnetic resonance imaging[J]. P Natl Acad Sci USA, 1992, 89(13): 5 951-5 955. |
| [9] | Buckner R L, Bandettini P A, O'Craven K M, et al. Detection of cortical activation during averaged single trials of a cognitive task using functional magnetic resonance imaging[J]. P Natl Acad Sci USA, 1996, 93(25): 14 878-14 883. |
| [10] | Hsieh Chang-wei(谢长倭), Wu Jih-huah(吴季华), Hsieh Chao-hsien(谢昭贤), et al. The preliminary fMRI investigation of 10 Hz modulation laser acupuncture induced cerebral cortical activation in human(以功能磁共振造影初探10 Hz调制激光针灸刺激所引发人类大脑皮质的活化现象)[J]. Chinese J Magn Reson(波谱学杂志), 2010, 27(3): 369-378. |
| [11] | Wang Xiao-guan(王骁冠), Zhu Zhen-wei(祝祯伟), Yang Xiao-dong(杨晓冬), et al. Advances in automatic stimulation devices for functional magnetic resonance imaging(功能磁共振成像自动刺激装置研究进展)[J]. China Medical Devices (中国医疗设备), 2013, 28(1): 1-8. |
| [12] | Wang Xiao-guan(王骁冠), Wang Hui(王慧), Yang Xiao-dong(杨晓冬), et al. Design and evaluation of an olfactometer for fMRI studies(一种用于fMRI的嗅觉刺激装置设计与验证)[J]. Chinese J Magn Reson(波谱学杂志), 2014, 31(4): 477-487. |
| [13] | Rolls E T, Grabenhorst F, Parris B A. Warm pleasant feelings in the brain[J]. Neuroimage, 2008, 41(4): 1 504-1 513. |
| [14] | Becerra L R, Breiter H C, Stojanovic M, et al. Human brain activation under controlled thermal stimulation and habituation to noxious heat: An fMRI study[J]. Magn Reson Med, 1999, 41(5): 1 044-1 057. |
| [15] | Chen L M, Dillenburger B C, Wang F, et al. Differential fMRI activation to noxious heat and tactile stimuli in parasylvian areas of new world monkeys[J]. Pain, 2012, 153(1): 158-169. |
| [16] | Elliott C, Vijayakumar V, Zink W, et al. National instruments LabVIEW: A programming environment for laboratory automation and measurement[J]. JALA, 2007, 12(1): 17-24. |
| [17] | Davis K D, Kwan C L, Crawley A P, et al. Functional MRI study of thalamic and cortical activations evoked by cutaneous heat, cold, and tactile stimuli[J]. J Neurophysiol, 1998, 80(3): 1 533-1 546. |
| [18] | Brooks J C W, Zambreanu L, Godinez A, et al. Somatotopic organisation of the human insula to painful heat studied with high resolution functional imaging[J]. Neuroimage, 2005, 27(1): 201-209. |
| [19] | Craig A D, Reiman E M, Evans A, et al. Functional imaging of an illusion of pain[J]. Nature, 1996, 384(6 606): 258-260. |
| [20] | Craig A D, Chen K, Bandy D, et al. Thermosensory activation of insular cortex[J]. Nat Neurosci, 2000, 3(2): 184-190. |
| [21] | Tracey I, Becerra L, Chang I, et al. Noxious hot and cold stimulation produce common patterns of brain activation in humans: A functional magnetic resonance imaging study[J]. Neurosci Lett, 2000, 288(2): 159-162. |
| [22] | Casey K L, Minoshima S, Morrow T J, et al. Comparison of human cerebral activation pattern during cutaneous warmth, heat pain, and deep cold pain[J]. J Neurophysiol, 1996, 76(1): 571-581. |
| [23] | Craig A D, Chen K, Bandy D, et al. Thermosensory activation of insular cortex[J]. Nat Neurosci, 2000, 3(2): 184-190. |
| [24] | Fasold O, von Brevern M, Kuhberg M, et al. Human vestibular cortex as identified with caloric stimulation in functional magnetic resonance imaging[J]. Neuroimage, 2002, 17(3): 1 384-1 393. |
| [25] | [OL] http://www.ruf.rice.edu/-lngbrain/cglidden/parietal.html. |
 2016, Vol. 33
2016, Vol. 33




