文章信息
- 何保江, 徐秀娟, 杨伟平, 张文娟, 吴 瑞, 黄少华, 杨 盈, 柏正武
- HE Bao-jiang, XU Xiu-juan, YANG Wei-ping, ZHANG Wen-juan, WU Rui, HUANG Shao-hua, YANG Ying, BAI Zheng-wu
- 基质辅助NMR中色谱技术的研究进展
- Progresses in Matrixed Chromatographic NMR
- 波谱学杂志, 2015, 32(4): 699-706
- Chinese Journal of Magnetic Resonance, 2015, 32(4): 699-706
- http://dx.doi.org/10.11938/cjmr20150415
-
文章历史
- 收稿日期:2014-12-17
- 收修改稿日期:2015-10-23
2. 中国科学院 青岛生物能源与过程研究所,中国科学院生物基材料重点实验室,山东 青岛266101;
3. 武汉工程大学 化学与环境工程学院,湖北 武汉 430073
2. Key Laboratory of Biobased Materials, Qingdao Institute of Bioenergy and Bioprocess Technology, Chinese Academy of Sciences, Qingdao 266101, China ;
3. School of Chemical and Environment Engineering, Wuhan Institute of Technology, Wuhan 430073, China
BAI Zheng-wu, Tel: +86-27-87195680; E-mail: zhengwu_bai@yahoo.com.
核磁共振(Nuclear Magnetic Resonance,NMR)技术是提供分子结构信息最有效的工具之一.NMR与色谱技术(比如高效液相色谱等)进行联用[1],能够有效地给出复杂混合物中每种组分的含量及分子结构信息等数据,从而提高分析效率[2].但是该联用仪器的购置、使用及维护成本较高,制约了其实际应用.因此,NMR研究者试图从方法学上实现NMR技术定性、定量分析复杂混合物的目的.近年来出现的二维扩散排序NMR谱(Diffusion-Ordered NMR Spectroscopy,DOSY)技术就可以实现上述目标[3, 4].该项技术被誉为NMR中色谱技术(Chromatographic NMR,CNMR),其研究具有重要的理论意义和实际应用价值[5].
CNMR技术的核心是不同分析物的分子自扩散系数(D)必须存在着足够大的差异,才能够使得分析物信号在F1维(DOSY谱的扩散维)上像经典色谱一样分离开[6].但是经过理论和实践证明,单纯的分子自扩散行为并不能够保证CNMR技术胜任复杂混合物的分析.它必须借助于外力,尽量扩大分析物自扩散系数的差别,才能使得分析物信号在F1维上实现基线分离,真正实现CNMR技术在实际复杂混合物分离分析中的应用[7, 8, 9].在NMR转子或NMR样品管中加入色谱填料或高分子等基质(或称为虚拟的 “色谱固定相”(Virtual “Stationary Phases in chromatography”,VSP)是增加分子自扩散系数差别的一种行之有效的方法[1],所以发现或制备出分离性能好的VSP是CNMR技术成功应用于复杂混合物分析的一个关键步骤.
利用CNMR技术分析混合物组分是一项很有研究意义的工作.1999年,Gounarides等人[6]曾对脉冲梯度场NMR技术分析混合物中配体-受体相互作用的应用作了全面综述,对于DOSY与其他二维实验相联用实验技术也作了一些介绍.目前还未见关于基质辅助CNMR技术研究进展的文献综述,本文对该领域的最新研究进展进行综述.
1 基质辅助NMR中色谱技术及其应用 1.1 硅胶或功能化硅胶类基质Viel等人[1, 10]首先将功能化硅胶C18填料与目标混合物溶液填入用于NMR魔角旋转探头的4 mm氧化锆转子里进行DOSY分析,发现色谱填料的加入使得混合物中的乙醇、1-癸烯以及萘3种组分的信号在扩散维上轻易实现了基线分离[如图 1(b)所示],而在不含C18填料的DOSY实验中,混合物中的这3个组分则没有明显分开[如图 1(a)所示].

|
| 图 1 含有乙醇、1-癸烯和萘的氘代乙醇溶液中添加C18填料前(a)和后(b)的1H DOSY谱图(来自文献[1]) Fig. 1 (a) 1H DOSY spectrum of sample (ethanol,naphthalene and dec-1-ene,dissolved in deuterated ethanol-d6). (b) 1H DOSY spectrum of the same mixture as in (a),but in the presence of functionalized silica gel (C18 Chromabond,Macherey& Nagel) (from ref. [1]) |
随后,他们将乙醇、3,5-二氯苯酚以及正庚烷3种组分溶于氘代环己烷中作为分析物,在转子中加入空白硅胶(230~400 mesh)填料后进行DOSY分析,同样获得了比较理想的分离效果.这表明该方法能够很好地实现CNMR技术在混合物分离分析中的应用.但是,由于魔角旋转探头的固有灵敏度及分辨率相对于液体NMR探头低很多,因此该方法在实际应用中存在着较大限制[11].
Hoffman等人[12]则在盛有CDCl3和CH2I2的NMR样品管中直接加入硅胶,然后在液体NMR谱仪中对系列物质进行了DOSY实验,结果发现,乙醇、丙二醇和乙二醇,乙酸、柠檬酸和己烷,以及TSP、TMS和DSS这3组混合物均能得到较好的分离效果.并且还发现,在与硅胶或功能化硅胶作用后,大多数物质的D都减小了,这主要是由于分析物分子和硅胶之间氢键等相互作用力所造成的.
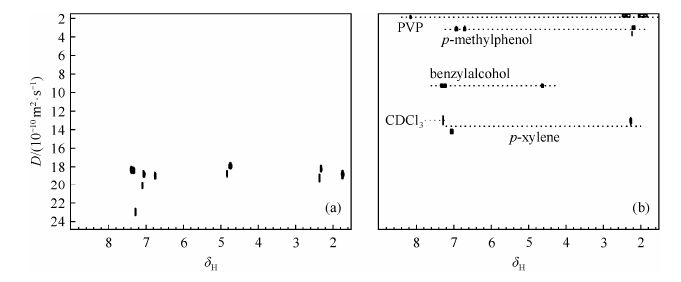
1.2 高分子类基质Heikkinen等人[13]将聚乙烯吡咯烷酮(Polyvinylpyrrolidone,PVP)作为VSP加入到NMR样品管中进行CNMR实验,研究PVP对苯甲醇、对甲基苯酚和对二甲苯混合物的分离效果,结果发现这3种分子量大小相近且D差不多的组分在DOSY谱图上得到了完美的分离(如图 2所示).该实验选择双极性受激回波脉冲序列BPPSTE[14],使用T2过滤法(Carr-Purcell-Meiboom-Gill spin-echo train,CPMG)[15, 16]脉冲来压制PVP大分子的出峰,有效减少了PVP对混合物组分信号的影响.Heikkinen等人[13]也研究了其他一些分析物在氯仿溶液中加入PVP前后D的变化,结果发现PVP对极性物质的作用要强于非极性物质.由于PVP的分子结构较复杂,在1H NMR谱图上δ 1.5~2.5处和δ 3.0~ 4.0处有较明显的宽峰,即使使用T2过滤法进行压制,也无法完全去除该处信号,因此对混合物组分信号会存在一定程度的影响.
Heikkinen等人[17]根据PVP的不足,寻找出另外一种高分子—聚乙二醇(Polyethylene glycol,PEG)作为VSP.PEG的分子结构较简单,于1H NMR谱图中只在δ 3.55处出现单一信号,对大部分分析物信号几乎没有干扰.该研究者选取了7-甲氧基黄酮、6-羟基黄酮和3-羟基-7-甲氧基黄酮3种黄酮类天然产物作为分析物,结果发现PEG对酚类或羧酸类分子具有很好的亲和力,能将这类组分信号与非多酚类物质很好地进行分离 . 另外,Heikkinen等人[17]还考察了PEG对性激素中的雌二醇和睾酮的分离效果,结果表明,PEG能够较易将上述两种分析物实现基线分离.这可能由于PEG与酚类组分雌二醇之间有较强的亲和力,使得雌二醇的扩散系数接近PEG,因此能与睾酮组分分离开来.上述结果说明,PEG作为VSP对酚类物质信号的分离具有较明显的效果.
本课题组[18, 19]经过研究,发现了一类分离性能非常好的VSP—聚二甲基硅氧烷(PDMS).PDMS结构简单,在NMR谱中只有单一信号,其化学位移与内标物TMS接近,几乎不影响任何分析物的NMR信号;并且价格便宜,使得分析成本比较低;另外,PDMS粘度适合,不会引起实验所用溶剂粘度有太大改变;最重要的是,PDMS对大部分类型有机分析物都具有比较显著的分离能力.因此,PDMS是一个理想的、具有通用性的高分子类VSP.
1.3 表面活性剂类基质Zielinski等人[20]探讨了表面活性剂十二烷基磺酸钠(Sodium Dodecyl Sulfate,SDS)作为VSP分离肽类物质的能力,结果发现当于混合物中加入SDS时,原先于DOSY谱图中没有分离开的组分信号实现了基线分离.这是由于组份分子与胶束相互作用,改变了组份的D,达到分离分析的目的.由于SDS的结构复杂,其NMR信号会与待分析组分的信号产生重叠.为了避免这种影响,研究者在实验中采用了氘代SDS作为VSP,胶束SDS在1H NMR谱图中不出现信号.研究者选取了几种小肽作为分析物,对加入SDS-d25前后各个分析物D的变化进行了研究(如图 3所示).结果发现上述混合物于CNMR中实现了基线分离.该方法的优点在于所选取的VSP为全氘代表面活性剂,能够避免VSP对分析物NMR信号的干扰,得到质量较高的谱图.但是氘代SDS价格较高,较大限制了此类VSP的应用.

|
| 图 3 5.0 mg/mL tryptophylglycine和5.0 mg/mL leucylmethioninne在D2O溶液中加入25.0 mmol/L SDS-d25前(a)和后(b)的1H DOSY谱(来自文献[20]) Fig. 3 1H DOSY spectra of a mixture before (a) and after (b) the addition of 25.0 mmol/L SDS-d25. Sample consisted of 5 mg/mL of tryptophylglycine and leucylmethioninne (each) in D2O (from ref. [20]) |
在分离分析领域,同分异构体的分离是一项较困难也是非常有意义的工作.2009年,Evans等人[21]尝试运用基于SDS的CNMR技术于D2O中成功基线分离了3种苯二酚异构体(邻苯二酚,间苯二酚和对苯二酚)的信号,另外还利用双(2-乙基己基)琥珀酸酯磺酸钠表面活性剂(Aerosol OT,AOT)作为VSP在CDCl3中对上述3种同分异构体信号也成功实现基线分离,并且对这两种分离模式的分离效果进行了比较研究.随后,Evans等人[22]又考察了AOT对1,2-、1,3-和1,4-二甲氧基苯酚3种同分异构体的分离效果,同时考察了SDS对丁醇和戊醇的几种同分异构体的分离效果,并且将上述两种VSP的分离能力进行了比较,结果表明AOT具有较好的分离能力.同年,Chaudhari等人[23]也以AOT和SDS作为VSP,考察了它们对马来酸和富马酸这两种顺反异构体的分离性能,结果令人惊讶地发现AOT能够较好地基线分离上述两种异构体,其分离能力优于SDS.
1.4 其他类型的基质Hoffman等人[24]以微乳液[氘代异丙醇、重水、全氟己烷和全氟十二烷酸锂盐(质量比为28.47∶61.67∶1.89∶7.97)的混合物]作为VSP,以镇痛解热药扑热息痛(化学名为对乙酰氨基酚)作为分析物进行了分离研究.结果发现该药中赋形剂、硬脂酸镁、药用聚乙二醇和对乙酰氨基酚得到了较好的分离.同时研究者也对布洛芬和双氯芬酸钠药剂进行了CNMR分析,结果发现微乳液对这两种药剂也具有较好的分离效果.继而,Hoffman等人[25]又在微乳液条件下对香料类混合物组分进行了DOSY实验,并成功地分离了几种不同组分的NMR信号.2011年,Rogerson等人[26]则采用化学位移试剂Eu(fod)3作为VSP,对正己烷、正己醇和正庚烷混合物于CDCl3溶液中进行了CNMR实验,结果发现Eu(fod)3能够较好地对上述混合物实现基线分离,是一种比较理想的VSP.
1.5 分离影响因素的研究在经典色谱分离中,溶剂组成和柱温等因素通常对分离结果有着较大的影响[27, 28].
这些因素理应对CNMR技术也存在相关影响,所以有必要对这些影响因素开展相关研究.Carrara等人[29]用空白硅胶作VSP,利用魔角旋转探头分别考察了不同溶剂D2O和CDCl3对分离性能的影响,结果表明,此种分离模式下的分离效率主要依赖于分子对硅胶的亲和力,而与溶剂的种类没有关系.Tormena等人[30]用SDS作为VSP,考察了SDS和分析物的浓度以及它们之间的比例对分离效果的影响,尽管此种CNMR模式具有很好的分离效果,但这3个因素对分离结果没有太大影响.Joyce等人[31]用葡聚糖凝胶作为VSP,考察了不同分子量的聚苯乙烯磺酸酯对分离效果的影响,结果表明分子量增大的同时分子扩散系数减小,但在分离效果上却明显降低.本课题组[32]对PVP分离苯甲醇、对甲基苯酚和对二甲苯混合物进行分析时,较系统考察了PVP分子量和浓度、溶剂粘度以及实验温度等因素对分离结果的影响,结果发现PVP分子量增大或浓度增加能够在一定范围内增加分析物的分离度,增加溶剂粘度对分离度影响有限.另外,实验温度升高有利于组分信号的分离.
2 结论与展望与传统的分离技术相比较,CNMR技术不需要经过物理分离就可以定性、定量分析混合物中的各个组分,因此该技术在复杂混合物分离和有机合成化学产物鉴定方面具有独特的优势.从已报道文献结果来看,对于某些简单混合物体系已找到分离性能较好的VSPs,实现了CNMR技术在这些混合物体系中的应用,但是仍没有找到适用于复杂体系且分离能力强的通用性VSPs,这表明寻找性能优异基质的研究还处于初期的探索阶段,有较大空间值得被探究发现.另外,CNMR技术分离机理研究仍然处于空白阶段.综上所述,目前和未来CNMR技术的发展任务是:一方面要发现对复杂体系具有较强分离能力的基质,积累相关研究数据,为机理研究笃实基础;另一方面,对已有CNMR分离体系进行深入研究,考察浓度、温度、溶剂和pH值等因素对分离性能的影响,探索基质辅助CNMR技术的分离理论及模型,从而更好地指导VSP的寻找或制备.
| [1] | Viel S, Ziarelli F, Caldarelli S. Enhanced diffusion-edited NMR spectroscopy of mixtures using chromatographic stationary phases[J]. Proc Natl Acad Sci USA, 2003, 100(17): 9 696-9 698. |
| [2] | Albert K. On-Line LC-NMR and Related Techniques[M]. West Sussex: John Wiley & Sons, Ltd, 2002. |
| [3] | Mao X(毛希安). Practical Techniques and Application in Modern Nuclear Magnetic Resonanc(现代核磁共振实用技术及应用)[M]. Beijing(北京): Science and Technology Literature Press(科学技术文献出版社), 1999. |
| [4] | Johnson C S. Diffusion ordered nuclear magnetic resonance spectroscopy: principles and applications[J]. Prog Nucl Magn Reson Spectrosc, 1999, 34(3-4): 203-256. |
| [5] | Price K E, Lucas L H, Larive C K. Analytical applications of NMR diffusion measurements[J]. Anal Bioanal Chem, 2004, 378(6): 1 405-1 407. |
| [6] | Gounarides J S, Chen A D, Shapiro M J. Nuclear magnetic resonance chromatography: Applications of pulse field gradient diffusion NMR to mixture analysis and ligand-receptor interactions[J]. J Chromatogr B, 1999, 725(1): 79-90. |
| [7] | Stockman B J, Dalvit C. NMR screening techniques in drug discovery and drug design[J]. Prog Nucl Magn Reson Spectrosc, 2002, 41(3, 4): 187-231. |
| [8] | Caldarelli S. Chromatographic NMR: A tool for the analysis of mixtures of small molecules[J]. Magn Reson Chem, 2007, 45(S1): S48-S55. |
| [9] | Novoa-Carballal R, Fernandez-Megia E, Jimenez C, et al. NMR methods for unravelling the spectra of complex mixtures[J]. Nat Prod Rep, 2011, 28(1): 78-98. |
| [10] | Pages G, Delaurent C, Caldarelli S. Simplified analysis of mixutres of small molecules by chromatographic NMR Spectroscopy[J]. Angew Chem Int Ed, 2006, 45(36): 5 950-5 953. |
| [11] | Hoffman R E, Arzuan H, Pemberton C, et al. High-resolution NMR “chromatography” using a liquids spectrometer[J]. J Magn Reson, 2008, 194(2): 295-299. |
| [12] | Li G B, Yu X Y, Zheng B S, et al. NMR studies on interactions between diperoxovanadate and N-substituted picolinamide[J]. Acta Chim Sin, 2007, 65(21): 2 357-2 362. |
| [13] | Kavakka J S, Kilpelainen I, Heikkinen S. General chromatographic NMR method in liquid state for synthetic chemistry: Polyvinylpyrrolidone assisted DOSY experiments[J]. Org Lett, 2009, 11(6): 1 349-1 352. |
| [14] | Pelta M D, Barjat H, Morris G A, et al. Pulse sequences for high-resolution diffusion-ordered spectroscopy (HR-DOSY) [J]. Magn Reson Chem, 1998, 36(10): 706-714. |
| [15] | Carr H Y, Purcell E M. Effects of diffusion on free precession in nuclear magnetic resonance experiments[J]. Phys Rev, 1954, 94(3): 630-638. |
| [16] | Meiboom S, Gill D. Modified spin-echo method for measuring nuclear relaxation times[J]. Rev SciInstrum 1958, 29(8): 688-691. |
| [17] | Kavakka J S, Parviainen V, Wahala K, et al. Enhanced chromatographic NMR with polyethyleneglycol. A novel resolving agent for diffusion ordered spectroscopy[J]. Magn Reson Chem, 2010, 48(10): 777-781. |
| [18] | Huang S, Gao J, Wu R, et al. Polydimethylsiloxane: A general matrix for high-performance chromatographic NMR spectroscopy[J]. Angew Chem Int Ed, 2014, 53(9): 11 582-11 595. |
| [19] | Wu Rui(吴瑞), Bai Zheng-wu(柏正武), Yang Ying(杨盈), et al. Study of the separation performance of PDMS matrixed chromatographic NMR technique(基于PDMS的NMR中色谱技术的分离性能研究)[J]. Chinese J Magn Reson(波谱学杂志), 2015, 32(3): 511-517. |
| [20] | Zielinski M E, Morris K F. Using perdeuterated surfactant micelles to resolve mixture components in diffusion-ordered NMR spectroscopy[J]. Magn Reson Chem, 2009, 47(1): 53-56. |
| [21] | Evans R, Haiber S, Nilsson M, et al. Isomer resolution by micelle-assisted diffusion-ordered spectroscopy[J]. Anal Chem, 2009, 81(11): 4 548-4 550. |
| [22] | Chaudhari S R, Suryaprakash N. Diffusion ordered spectroscopy for resolution of double bonded cis, trans-isomers[J]. J Mol Struct, 2012, 1 017: 106-108. |
| [23] | Tormena C F, Evans R, Haiber S, et al. Matrix-assisted diffusion-ordered spectroscopy: application of surfactant solutions to the resolution of isomer spectra[J]. Magn Reson Chem, 2012, 50(6): 458-465. |
| [24] | Pemberton C, Hoffman R E, Aserin A, et al. NMR chromatography using microemulsion systems[J]. Langmuir, 2011, 27(8): 4 497-4 504. |
| [25] | Hoffman R E, Aserin A, Garti N. New insights into the microemulsion-based chromatographic NMR resolution mechanism and its application to fragrance/flavor molecules[J]. J Magn Reson, 2012, 220: 18-25. |
| [26] | Rogerson A K, Aguilar J A, Nilsson M, et al. Simultaneous enhancement of chemical shift dispersion and diffusion resolution in mixture analysis by diffusion-ordered NMR spectroscopy[J]. Chem Commun, 2011, 47(25): 7 063-7 064. |
| [27] | Zhan F P, Yu G Y, Yao B X, et al. Solvent effect in the chromatographic enantioseparation of 1,1-bi-2-naphthol on a polysaccharide-based chiral stationary phase[J]. J Chromatogr A, 2010, 1 217: 4 278-4 284. |
| [28] | Paglia G, D’Apolito O, Tricarico F, et al. Evaluation of mobile phase, ion pairing, and temperature influence on an HILIC-MS/MS method for L-arginine and its dimethylated derivatives detection[J]. J Sep Sci, 2008, 31(3): 2 424-2 429. |
| [29] | Carrara C, Viel S, Delaurent C, et al. Chromatographic NMR in NMR solvents[J]. J Magn Reson, 2008, 194(2): 303-306. |
| [30] | Tormena C F, Evans R, Haiber S, et al. Matrix-assisted diffusion-ordered spectroscopy: mixture resolution by NMR using SDS micelles[J]. Magn Reson Chem, 2010, 48(7): 550-553. |
| [31] | Joyce R E, Day I J. Chromatographic NMR with size exclusion chromatography stationary phases[J]. J Magn Reson, 2012, 220: 1-7. |
| [32] | Huang S H, Wu R, Bai Z W, et al. Evaluation of the separation performance of polyvinylpyrrolidone as a virtual stationary phase for chromatographic NMR[J]. Magn Reson Chem, 2014, 52(9): 486-490. |
 2015, Vol. 32
2015, Vol. 32