文章信息
- 魏 莹, 章文军, 薛 蓉, 李晓晶, 裴奉奎
- WEI Ying, ZHANG Wen-jun, XUE Rong, LI Xiao-jing, PEI Feng-kui
- 基于1H NMR谱的给药赭石大鼠血清代谢组学研究
- A 1H NMR-Based Metabonomic Study on the Serum of Haematitum-Treated Rats
- 波谱学杂志, 2015, 32(4): 628-636
- Chinese Journal of Magnetic Resonance, 2015, 32(4): 628-636
- http://dx.doi.org/10.11938/cjmr20150408
-
文章历史
- 收稿日期:2014-12-04
- 收修改稿日期:2015-10-23
2. 中国科学院 长春应用化学研究所,吉林 长春 130022
2. Changchun Institute of Applied Chemistry, Chinese Academy of Sciences, Changchun 130022, China
赭石(Haematitum)又名代赭石,味苦、性寒,具有平肝潜阳、降逆和止血功效,为临床上应用广泛的矿物中药,主要用于治疗眩晕耳鸣、呕吐、噫气、呃逆、喘息和吐血等症[1].赭石的主要成分为Fe2O3,并含有Ca、Mn、Ni、Zn、Co、Cu及As等多种矿物元素[3, 4].近年来,赭石的炮制方法[5]和临床应用[6]的研究非常广泛,但其作用机理尚不清楚,对其安全性还未作出科学评价.
自从1999年Nicholson等人第一次提出代谢组学(metabonomics)的概念[13]以来,代谢组学迅猛发展.代谢组学方法主要是利用现代分析技术结合模式识别方法,目的在于找出组间的差异性代谢物,分析这种差异性变化与生物体受到环境、疾病和药物等刺激之间的关系,进而确定生物标记物,阐述生物体对相应刺激的应答反应.如今代谢组学在疾病诊断、药物安全评价、毒理学研究、食品营养学研究、植物研究等多个领域[14, 15]都发挥着重要作用.目前应用于代谢组学的现代分析技术手段有核磁共振(NMR)、液相色谱-质谱联用(LC-MS)、二级质谱(MS/MS)和气相色谱-四极杆飞行时间质谱(GC-TOF/MS)等技术.NMR具有能在接近生理条件下进行实验且无损伤性、样品处理简单、所需样品量少、检测时间短等优点,被广泛应用于代谢组学的研究[16],是目前代谢组学中最常用的分析技术手段之一.
主成分分析(PCA)得分图能够直观地描述生物体在不同刺激后的代谢模式变化[18, 19].
每一个样本在主成分(PC)得分图上的位置取决于生物体的代谢反应,处于相似生理病理状态下的个体代谢物成分和浓度相似,所以它们在PC得分图上的位置相近.因此主成分分析是药物机理研究和安全评价中最为常用的模式识别方法之一.本文采用基于1H NMR的代谢组学方法结合主成分分析的模式识别方法[20],从分子水平上对赭石的急性生物效应进行了研究.
1 实验部分 1.1 化学试剂和实验动物 1.1.1 化学试剂及药品的配制磷酸氢二钠(Na2HPO4),分析纯,北京化工厂;磷酸二氢钠(NaH2PO4),分析纯,北京化工厂;重水(D2O),99.9%,美国剑桥同位素实验室;生理盐水,长春达兴药业股份有限公司;生化试剂,长春汇力生物技术有限公司;赭石,长春铭泰大药房;羧甲基纤维素钠(CMC),国药集团化学试剂有限公司.
用0.5% CMC配成浓度为0.5 g/mL和1.25 g/mL的赭石悬浊液.
1.1.2 实验动物成年雄性Wistar大鼠(250 ± 20 g,n = 30)购于吉林大学基础医学院.
1.2 动物模型的建立严格按照要求饲养,环境温度控制在22 ± 2 ℃,相对湿度RH保持在50 ± 10%,昼夜循环,自由摄食饮水.30只成年雄性Wistar大鼠,随机分为3组,每组10只.大鼠在饲养笼内适应7天后,实验组分别一次灌胃给药(4 mL/kg)浓度为0.5 g/mL和1.25 g/mL的赭石悬浊液,即2 g/kg、5 g/kg体重(BW)剂量的赭石;对照组灌胃(4 mL/kg) 0.5%羧甲基纤维素纳(CMC-Na).54 h后,每组随机处死5只大鼠,收集血液.126 h后每组所剩大鼠处死取血.所得血液于4 ℃静置1 h后,以4 000 rpm离心10 min,取上层清液得到血清样品,于液氮下冷冻保存,供NMR测试.
1.3 核磁共振测试将血清样品解冻,取0.4 mL血清于离心管中,加入0.2 mL浓度为0.2 mol/L的磷酸盐缓冲溶液(pH 7.38)及0.06 mL D2O,于4 ℃静置10 min,以4 000 rpm离心5 min;取上层清液0.55 mL于5 mm NMR 样品管中,于25 ℃进行测试.
血清的1H NMR谱图在Bruker AVIII 600 MHz型NMR谱仪上测试,质子共振频率为600.13 MHz,采用CPMG自旋回波序列结合预饱和方法采集信号,FID采集次数64,数据点16 k,延迟时间为6 s,90°偏转角为13.5 ms,采样时间为1.022 4 s,谱宽8 992.8 Hz.
1.4 血清的生化指标检测血清的生化指标在松上A-6半自动生化分析仪上测试.测试项目有:乳酸脱氢酶(LDH)、天门冬氨酸转氨酶(AST)、谷丙转氨酶(ALT)、胆碱酯酶(CHE)、碱性磷酸酶(ALP)、g-谷氨酰转肽酶(GGT)、尿素氮(BUN)、甘油三酯(TG)、总胆固醇(T-CHO).
1.5 血清样品的1 H NMR 数据处理采用MestRe-C版本软件(http://qobrue.usc.es/jsgroup/MestRe-C,共享软件)进行手动相位调整和基线校正.以肌酸d 3.04的甲基峰(单峰)为内标;除去残余水峰信号(d 4.60~5.10);谱图按自适区间段[21]积分,d 2.00~3.00采用24 Hz积分,其余谱图按6 Hz积分.为消除样本之间的浓度差异,将所得的积分数据进行概率商归一化处理,对每个新变量进行中心化处理,然后对所得数据进行主成分分析.主成分得分的统计分析采用方差分析(analysis of variance,ANOVA)与多重比较检验.
2 结果与讨论 2.1 血清的1 H NMR 谱图归属及多元统计血清几乎包含了血液中所有的小分子化合物,并且均一性很高,但也有少量的大分子,通过CPMG序列得到的谱图减弱了生物大分子的干扰,从而能够很好地研究血清中小分子代谢物浓度变化.图 1为对照组和赭石给药2 g/kg及5 g/kg体重剂量后54 h血清的1H NMR谱图,参考文献[15, 17]进行谱峰归属.

|
| 图 1 对照组和赭石给药54 h后血清的1H NMR谱图. (a) 对照组,(b) 2 g/kg体重剂量给药组,(c) 5 g/kg体重剂量给药组 Fig. 1 1H NMR spectra of serum from (a) control,(b) 2 g/kg body weight,(c) 5 g/kg body weight haematitum treatment at 54 h post dose TMAO: Trimethylamine-N-oxide; NAG: N-Acetyl glycoprotein; LDL: Low density lipoprotein; VLDL: Very low density lipoprotein; b-HB: b-Hydroxybutyate; GPG: Glycerophosphorylcholine |
对2 g/kg组及对照组的血清1H NMR谱图处理后的数据进行PCA分析,得到PCA得分图和载荷图(图 2).从图 2(a)中可以看出给药54 h组与对照组在PC1方向上显著分类(ANOVA,0.001<p<0.01),给药126 h组与对照组在PC1、PC2方向上分类不明显(ANOVA,p>0.1).这说明2 g/kg组给药赭石54 h后对大鼠机体造成较大损伤,126 h后对大鼠机体造成的损伤明显恢复.
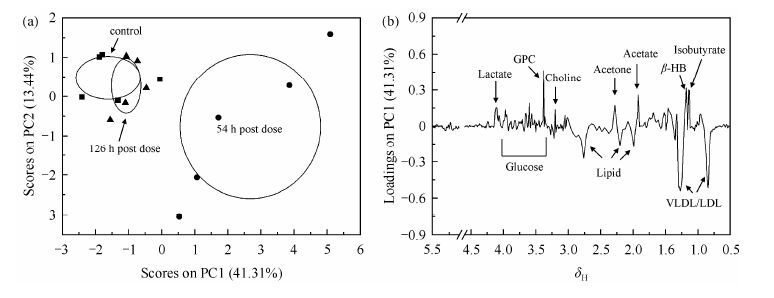
|
| 图 2 对照组和灌胃给药2 g/kg赭石组不同时间大鼠血清1H NMR谱PCA分析得分图(a)与载荷图(b),椭圆为每组的平均值±标准偏差 Fig. 2 PCA scores (a) and loadings (b) plots based on 1H NMR spectroscopy of serum from control and 2 g/kg body weight haematitum treatment rats,the ellipses represent mean ± standard deviation |
通过2 g/kg组的PC载荷图[图 2(b)]分析发现,2 g/kg组对PCA分类具有较大贡献的内源性代谢物质中浓度显著升高的有异丁酸(Isobutyrate)、b-羟基丁酸(b-HB)、乙酸(Acetate)、丙酮(Acetone)、胆碱(Choline)、甘油磷脂酰胆碱(Glycerophosphoryl choline,GPC)、葡萄糖(Glucose)和乳酸(Lactate);浓度显著降低的有极低密度脂蛋白(Very low density lipoprotein,VLDL)、低密度脂蛋白(Low density lipoprotein,LDL)和脂质.
对5 g/kg组及对照组的血清1H NMR谱图处理后进行PCA分析,得到PCA得分图和载荷图(图 3).从图 3(a)中可以看出给药54 h组对照组在PC1方向上显著分类(ANOVA,0.001< p <0.01);给药126 h组与对照组PC1方向上分类不明显(ANOVA,p>0.1),PC2方向上分类(ANOVA,0.01< p <0.05),而给药126 h组与给药54 h组显著分类(ANOVA,0.001< p <0.01).这说明5 g/kg组给药赭石54 h后大鼠血清中内源性代谢物含量变化较大,126 h后血清代谢物浓度呈现出恢复的趋势.
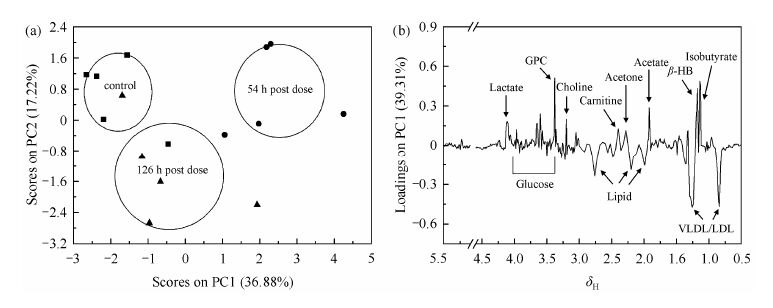
|
| 图 3 对照组和灌胃给药5 g/kg赭石组不同时间大鼠血清1H NMR谱PCA分析得分图(a)与载荷图(b),椭圆为每组的平均值±标准偏差 Fig. 3 PCA scores (a) and loadings (b) plots based on 1H NMR spectroscopy of serum from control and 5 g/kg body weight haematitum treatment rats,the ellipses represent mean ± standard deviation |
通过5 g/kg组的PC载荷图[图 3(b)]分析发现,5 g/kg组对PCA分类具有较大贡献的内源性代谢物质中浓度显著升高的有异丁酸、b-HB、乙酸、丙酮、肉碱、胆碱、甘油磷脂酰胆碱、葡萄糖和乳酸浓度显著降低的有VLDL、LDL和脂质.
对2 g/kg和5 g/kg给药组以及对照组在给药54 h后和126 h后的血清1H NMR谱图数据分别进行PCA分析,得到PCA得分图(图 4).从图 4(a)中可以看出给药54 h后两个剂量组均与对照组在PC1方向上显著分类(ANOVA,0.001< p <0.01),说明两组剂量的赭石均对大鼠造成较大的损伤.从图 4(b)中可以看出给药126 h后两个剂量组均有一定的恢复,但恢复程度明显不同,2 g/kg组恢复趋势明显,5 g/kg组恢复程度不高,这说明较高剂量的赭石在126 h后对大鼠代谢仍有一定的影响,能否完全恢复需要进一步的研究.

|
| 图 4 对照组和不同剂量赭石组灌胃给药54 h和126 h后大鼠血清1H NMR谱PCA分析得分图(a)和得分图(b),椭圆为每组的平均值±标准偏差 Fig. 4 PCA scores (a) and scores (b) plots based on 1H NMR spectroscopy of Serum from control,2 g/kg and 5 g/kg body weight haematitum treatment rats after 54 h and 126 h,the ellipses represent mean ± standard deviation |
从表 1可以看出灌胃给药不同剂量的赭石54 h后,大鼠血清中一些重要的生化指标发生明显的变化.乳酸脱氢酶(LDH)、谷丙转氨酶(ALT)、天门冬氨酸转氨酶(AST)、碱性磷酸酶(ALP)、胆碱酯酶(CHE)、甘油三酯(TG)和总胆固醇(T-CHO)含量显著下降.
| 生化指标 | 对照组 | 赭石(2 g/kg BW) | 赭石(5 g/kg BW) | ||
| 给药后54 h | 给药后126 h | 给药后54 h | 给药后126 h | ||
| LDH(U/L) | 1051.18±377.31 | 663.04±194.95* | 1013.14±297.40 | 790.28±249.93 | 817.02±238.50 |
| ALT(U/L) | 90.90±13.44 | 56.99±10.84** | 98.15±22.72 | 67.37±19.08* | 81.51±6.78 |
| AST(U/L) | 223.64±28.88 | 149.66±26.39** | 228.48±59.02 | 183.55±15.41* | 207.75±50.87 |
| ALP(U/L) | 225.78±35.92 | 170.24±20.05* | 249.74±34.22 | 174.40±47.43* | 227.62±69.44 |
| GGT(U/L) | 7.86±4.43 | 5.57±1.76 | 8.48±2.41 | 5.41±2.39 | 8.94±2.18 |
| CHE(U/L) | 3.01±0.10 | 0.86±0.19** | 0.73±0.07** | 0.59±0.09** | 0.81±0.28** |
| BUN(mmol/L) | 8.30±1.19 | 8.62±0.55 | 8.23±0.53 | 8.14±1.24 | 9.56±0.72 |
| TG(mmol/L) | 1.15±0.16 | 0.37±0.27** | 0.72±0.10** | 0.70±0.27* | 0.80±0.33* |
| T-CHO(mmol/L) | 1.41±0.35 | 0.85±0.30* | 1.21±0.17 | 0.89±0.10* | 1.29±0.32 |
126 h后,上述生化指标恢复到正常范围,而胆碱酯酶(CHE)、甘油三酯(TG)含量仍然显著下降.
LDH,乳酸脱氢酶(Lactate dehydrogenase);ALT,谷丙转氨酶(Alanine aminotransferase);AST,天门冬氨酸转氨酶(Aspartate transaminase);ALP,碱性磷酸酶(Alkaline phosphat ase);GGT,g-谷氨酰转肽酶(g-Glutamyltransferase);CHE,胆碱酯酶(Cholinesterase);BUN,尿素氮(Blood urea nitrogen);TG,甘油三酯(Triglycerides);T-CHO,总胆固醇(Total cholesterol);数据显示,平均值±标准偏差;显著性检验(t-test),*p < 0.05;**p < 0.005
2.3 生物学分析2 g/kg和5 g/kg组中均观察到葡萄糖浓度升高,这说明2 g/kg和5 g/kg体重剂量的赭石引起体内糖有氧代谢异常.体内铁过载对机体损伤的靶向性是线粒体[22],Bacon等人[23]在对大鼠口服过量的羰基铁实验中观察到肝铁浓度过高可以引发线粒体脂质过氧化,从而对线粒体造成氧化损伤.本实验观察到的大鼠体内有氧代谢异常有可能是赭石引起线粒体氧化损伤而造成的.葡萄糖有氧代谢产生大量的三磷酸腺苷(AT P),为机体迅速补充能量,体内糖有氧代谢异常会引起能量代谢异常.
当机体能量不足时,糖酵解反应就会加强,葡萄糖在糖酵解过程中产生乳酸,导致乳酸含量上升.而在糖异生过程中乳酸在乳酸脱氢酶的作用下生成丙酮酸,结合表 1中发现乳酸脱氢酶浓度降低,这暗示乳酸的浓度升高也有可能是由于2 g/kg和5 g/kg体重剂量赭石影响了乳酸脱氢酶活性而造成的.
Warburg等人[24]研究发现癌细胞的能量代谢异常,即使在有氧的条件下,癌细胞优先进行糖酵解反应,并产生大量的乳酸,称之为Warburg效应,被认为是癌细胞所具有的普遍特征.本研究观察到大鼠体内糖酵解加强,但是否与赭石致癌有关需要进一步的研究.
当糖酵解和脂质b氧化产生的乙酰CoA超过了三羧酸循环消耗能力时,乙酰CoA就会在肝脏中经过缩合、裂解产生酮体(乙酰乙酸、b-羟基丁酸、丙酮)[25].过量的乙酰CoA通过乙酰CoA水解酶水解产生乙酸[20].因此给药2 g/kg和5 g/kg组均观察到b-HD、乙酸、丙酮的浓度升高,说明脂质发生了过氧化,这与表 1中甘油三酯含量降低相符.
胆碱酯酶和胆固醇在肝脏中合成,是反映肝脏合成功的重要指标.表 1中血清胆碱酯酶和总胆固醇降低,并结合酮体含量的升高,这可能暗示着2 g/kg和5 g/kg体重剂量赭石对肝脏的合成功能造成了影响,并且这种影响在126 h后未恢复.
胆碱类代谢物(胆碱、磷酸胆碱、甘油磷酸胆碱)是磷脂代谢的重要产物,它们在维持细胞膜的完整性上发挥着重要作用[26].Griffin等人[1]研究表明胆碱类代谢物水平上升与药物诱导细胞膜损害有关.2 g/kg和5 g/kg组均观察到VLDL、LDL和脂质浓度降低以及胆碱、甘油磷酸胆碱浓度上升,这进一步说明赭石给药后引发脂质过氧化,并损害了细胞膜的完整性.铁过载可诱导产生大量的活性氧化物(ROS)[2],造成很强的脂质过氧化[3].由此推测,当给药2 g/kg和5 g/kg体重剂量赭石后,赭石引起线粒体过氧化,生成大量的活性氧化物,当这些活性氧化物的生成量超过机体抗氧化防御系统的消耗能力时,细胞膜的完整性就会由于脂质过氧化而受到损伤.
3 结论通过对给药赭石Wistar大鼠血清的1H NMR谱图分析及对所得数据进行多元统计分析,发现赭石能够引起代谢水平的变化.研究结果表明,大鼠体内内源性代谢物水平明显升高的有b-HB、乙酸、丙酮、胆碱、甘油磷脂酰胆碱、葡萄糖和乳酸;内源性代谢物水平显著降低的有VLDL、LDL和脂质,可作为赭石的特征代谢物.
通过对相应代谢途径的分析可知2 g/kg和5 g/kg体重剂量的赭石对大鼠机体造成过氧化损伤并导致糖代谢、能量代谢紊乱,糖酵解反应增强,并对肝功能造成了影响.在给药2 g/kg和5 g/kg体重剂量 54 h后对大鼠具有较大的毒性,在给药126 h后均有不同程度的恢复;2 g/kg组赭石对大鼠的毒性在给药126 h后明显恢复,而5 g/kg组在给药126 h后有恢复趋势,但仍对大鼠有一定的毒性,能否完全恢复需要进一步的研究.实验结果表明基于1H NMR的代谢组学方法可以有效地运用到矿物药的研究中,为矿物药的研究提供了新思路.
| [1] | Chinese Pharmacopoeia Commission(国家药典委员会). Chinese Pharmacopoeia(中国药典)[M]. Beijing(北京): ChinaMedical Science Press(中国医药科技出版社), 2012. |
| [2] | Liu Shu-hua(刘淑花), Bi Jun-ying(毕俊英). The investigation of trace element and pharmacological action of ocher orcalcined ocher (生或煅赭石微量元素含量及药理作用比较)[J]. Stud Trace Elem Health(微量元素与健康研究), 2003,20(1): 6―7. |
| [3] | Zheng Jian-han(郑建涵), Wu Zhen-hua(吴振华). Discussoin of best ways of processnig ruddle(中药代赭石最佳炮制方法探讨)[J]. CATCM(中医药学刊), 2006, 24(8): 1 559―1 560. |
| [4] | Liu Dan(刘丹), Li Jun-song(李俊松), Li Wei-dong(李伟东), et al. Studies on changes of content of eleven elements incrude and calcined ochre(赭石炮制前后11 种元素的含量变化研究)[J]. CATCM(中华中医药学刊), 2008, 26(12):2 577―2 578. |
| [5] | Li Hong-liang(李红亮). The study of Fu-xuan-dai-zhe-tang in treatment of post-stroke hiccup(旋覆代赭汤治疗中风后呃逆浅析)[J]. World Chinese Med(世界中医药), 2013, 8(1): 65―66. |
| [6] | Nicholson J K, Lindon J C, Holmes E. 'Metabonomics': understanding the metabolic responses of living systems topathophysiological stimuli via multivariate statistical analysis of biological NMR spectroscopic data [J]. Xenobiotica, 1999,29(11): 1 181―1 189. |
| [7] | Duarte I F, Diaz S O, Gil A M. NMR metabolomics of human blood and urine in disease research[J]. J Pharmaceut Biomed,2014, 93(S1): 17―26. |
| [8] | Liu S, Wang W, Zhou X Y, et al. Dose responsive effects of cisplatin in L02 cells using NMR-based metabolomics[J].Environ Toxicol Phar, 2014, 37(1): 150―157. |
| [9] | Li M H, Wang J S, Lu Z G, et al. NMR-based metabolomics approach to study the toxicity of lambda-cyhalothrin togoldfish (Carassius auratus)[J]. Aquat Toxicol, 2014, 146: 82―92. |
| [10] | Anni L, Riikka J, Jari S, et al. Postprandial response on fatty meal is affected by sea buckthorn (Hippophaë rhamnoides)supplementation: NMR metabolomics study[J]. Food Res Int, 2014, 58: 23―34. |
| [11] | Ernst M, Silva D B, Silva R R, et al. Mass spectrometry in plant metabolomics strategies: from analytical platforms to dataacquisition and processing[J]. Nat prod Rep, 2014, 31 (6): 784―806. |
| [12] | Feng J H, Zhao J, Tang H R, et al. NMR-based metabonomic analyses of the effects of ultrasmall superparamagneticparticles of iron oxide (USPIO) on macrophage metabolism[J]. J Nanopart Res, 2011, 13(5): 2 049―2 062. |
| [13] | Qiu Yu-jie(邱玉洁), Xia Sheng-an (夏圣安), Liu Mai-li(刘买利), et al. Pattern recognition methods in biomedicalmagnetic resonance(生物医学核磁共振中的模式识别方法)[J]. Chinese J Magn Reson(波谱学杂志), 2005, 22(1): 99―111. |
| [14] | Zhang Pan-pan(张盼盼), Zhang Wen-jun(章文军), Li Xiao-jing(李晓晶), et al. Studies on the serum of arsenic trionxidetreated rats by 1H NMR based metabonomics(基于1H NMR 的代谢组学方法对大鼠砒霜给药后血清的研究)[J]. ChineseJ Anal Chem (分析化学), 2013, 41(9): 1 434―1 438. |
| [15] | Wei L, Liao P Q, Li X J, et al. Metabolic profiling studies on the toxicological effects of realgar in rats by 1H NMRspectroscopy[J]. Toxicol Appl Pharm, 2009, 234(3): 314―325. |
| [16] | Dong Ji-yang(董继扬), Xu Le(徐乐), Xu Jing-jing(许晶晶), et al. Adaptive binning method for NMR spectroscopicmetabonmics data preprocessing(核磁共振代谢组学数据处理中的自适应分段积分方法)[J]. Chem J of Chinese U(高等学校化学学报), 2009, 30(6): 1 101―1 108. |
| [17] | Zheng X F, Tian J S, Liu P, et al. Analysis of the restorative effect of Bu-zhong-yi-qi-tang in the spleen-qi deficiency ratmodel using 1H NMR-based metabonomics[J]. J Ethnopharmacol, 2014, 151(2): 912―920. |
| [18] | Eaton J W, Qian M. Molecular bases of cellular iron toxicity[J]. Free Radical Bio Med, 2002, 32(9): 833―840. |
| [19] | Hershko C, Link G, Ioav C. Pathophysiology of iron over load[J]. Ann NY Acad Sci, 1998, 850(1): 191―201. |
| [20] | Bacon B R, Tavill A S, Brittenham G M, et al. Hepatic lipid peroxidation in vivo in rats with chronic iron overload[J]. JClin Invest, 1983, 71(3): 429―439. |
| [21] | Warburg O, Wind F, Negelein E. The metabolism of tumors in the body[J]. J Gen Physiol, 1927, 8(6): 519―530. |
| [22] | McGarry J D, Foster D W. Regulation of hepatic fatty acid oxidation and ketone body production[J]. Annu Rev Biochem,1980, 49: 395―420. |
| [23] | Knowles S E, Jarrett I G, Filsell O H, et al. Production and utilization of acetate in mammals[J]. Biochem J, 1974, 142(2):401―411. |
| [24] | Zeisel S H. Dietary choline: biochemistry, physiology, and pharmacology[J]. Annu Rev Nutr, 1981, 1(1): 95―121. |
| [25] | Griffin J L, Mann C J, Scott J, et al. Choline containing metabolites during cell transfection: an insight into magneticresonance spectroscopy detectable changes[J]. FEBS Lett, 2001, 509(2): 263―266. |
| [26] | Peters T J, Selden C, Seymour C A. Lysosomal disruption in the pathogenesis of hepatic damage in primary and secondaryhaemochromatosis[J]. Ciba Found Symp, 1976, 51: 317―329. |
 2015, Vol. 32
2015, Vol. 32




