文章信息
- 张 苗, 卢建华, 蔡聪波, 蔡淑惠
- ZHANG Miao, LU Jian-hua, CAI Cong-bo, CAI Shu-hui
- 7 T下脂肪对基于NOE的磁共振对比成像的影响
- Effects of Lipids Signals on Nuclear Overhauser Enhancement Contrast Imaging at 7 T
- 波谱学杂志, 2015, 32(4): 606-617
- Chinese Journal of Magnetic Resonance, 2015, 32(4): 606-617
- http://dx.doi.org/10.11938/cjmr20150406
-
文章历史
- 收稿日期:2015-02-04
- 收修改稿日期:2015-10-25
2. Department of Physics and Astronomy, Louisiana State University, Baton Rouge, LA 70803, USA;
3. 厦门大学 通信工程系,福建 厦门 361005
2. Department of Physics and Astronomy, Louisiana State University, Baton Rouge, LA 70803, USA;
3. Department of Communication Engineering, Xiamen University, Xiamen 361005, China
化学交换饱和转移(CEST)为核磁共振(NMR)提供了一种新的对比增强机制[6, 7].随着研究的发展,这种源于磁化率转移的特殊机制逐渐在多个领域得到应用.例如,在低场位置(偏离水$\delta $ 3.5)来自蛋白质和多肽的酰胺质子转移(APT)成像技术[8, 9],测量软骨位置的糖胺技术[10]及谷氨酸盐检测技术[11, 12]等等.
在CEST成像中,一般都需要涉及磁化转移(MT)谱或Z谱.Z谱是水信号的归一化强度关于饱和共振偏置(w)的函数,需通过采集一系列不同程度偏离水的共振频率的饱和信号[]绘制得到.通常情况下,CEST效应出现在低场位置,在没有其他干扰的情况下通过不对称相减即可得到对应频率的效应值.但是,如果高场位置存在明显的MT效应,采用不对称分析的结果是不准确的.这种存在于高场位置且表现明显的MT效应在活体中非常常见[13, 14].该现象的产生主要源自Z谱上偏离水$\delta $ -5~0的脂肪族和烯族质子,这种现象称为NOE效应.NOE效应在核磁共振波谱学上很常见,但在低磁场下很难体现出来,因此在CEST成像中经常被忽略[9]或被视为负的背景信号.然而,近期一些超高场下(³ 7.0 T)的研究[18]表明,Z谱上存在这种NOE效应,且在复杂的组织中可形成一个强而宽的不对称磁化转移.这种现象可能源自不可交换的质子与可交换的质子之间的某些机制,如偶极-偶极相互作用,或者是通过可交换质子间的交换中继作用[19]形成的.
MRI在脑成像方面已广泛应用.由于NOE效应在Z谱上的特殊表现,高场下基于NOE的对比成像也逐渐引起人们的研究兴趣并有所发展.一般认为脑组织中脂肪含量较少,因此在MRI脑成像中通常不对脂肪进行特殊处理.然而研究表明,脑白质脂肪含量比较丰富,其1H NMR谱中许多脂肪信号清晰可见[20],且脂肪信号对脑白质及头皮等脂肪含量较高的组织的NOE效应确实存在影响[21].但脑组织内脂肪的存在不限于白质及头皮,NOE信号在Z谱上与脂肪信号的重叠引起的量化误差随着脂肪含量的差异而变化,进而影响基于NOE效应的对比成像的结果.本文首先对鸡蛋模型进行了脂肪压制对比实验,初步分析了脂肪含量较高组织内脂肪信号对NOE效应的影响,而后对健康大鼠鼠脑及颅内肿瘤大鼠鼠脑进行脂肪压制实验,分析了脂肪对脑部NOE对比成像及基于NOE对比成像的疾病诊断的影响.
1 理论与实验 1.1 理论为了衡量饱和转移量,常用Z谱来表征.在不考虑其他干扰和误差的情况下,一般使用不对称分析$(MT{R_{asym}})$对CEST效应进行量化:

其中${M_{sat}}( - \omega )$、${M_{sat}}( + \omega )$分别是偏离水峰位置的对称共振偏置点的水饱和信号强度,M0为未施加任何饱和所采集到的水信号强度.在强磁场下NOE效应表现明显,会导致不对称分析的负背景信号.Jones等人在7.0 T人脑NOE研究中,认为不对称分析应修改为:
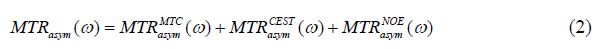
即Z谱的不对称应包含常规半固体磁化转移对比(MTC)、CEST效应及NOE效应,其中MTC在Z谱高场及低场位置广泛存在[20].无论是对CEST效应还是对NOE效应进行定量,都需要将MTC分离.在Z谱的拟合处理中,洛伦兹拟合简单易行并可得到良好的结果:
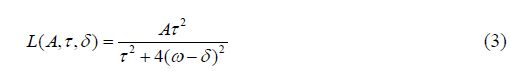
其中L是洛伦兹函数值,A是洛伦兹线型幅度,$\tau $ 是水峰宽度,$\delta $ 为水峰由于场不均匀等因素的频率偏移.Dewey通过对含有大分子、水和氨基酸的三池模型进行分析发现,MTC表现为洛伦兹线型上一个全局的基线偏移[9, 19, 20].因此,(3)式可增加一个常量b进行修正:

此外,Jones等人研究指出,使用低功率的饱和脉冲可使NOE效应的量化掺杂尽量少的MTC效应[19].因此,在CEST效应仅存在于低场位置,而NOE效应出现在高场位置,并使用低功率饱和脉冲减少MTC效应的情况下,我们可通过洛伦兹拟合进一步去除MTC偏移,获得理想水峰信号L(w),从而近似计算出高场NOE效应(NOE效应存在范围$\delta $ -5 ~ 0[1]):
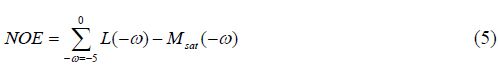
并进一步获得基于NOE对比的图像.
1.2 实验材料鸡蛋:鸡蛋具有和组织类似的信息,蛋黄中脂类物质的含量达到37%,适合进行脂肪相关的研究.我们选用鸡蛋(3个)作为研究脂肪信号对脂肪含量较高组织NOE效应影响的模型.
大鼠:体重约350 g的正常Wistar雄性大鼠和颅内植入胶质瘤的雄性大鼠各3只.
我们通过对正常大鼠脑部进行脂肪压制对比实验来分析脂肪对脑组织NOE对比成像的影响,同时通过对植入胶质瘤的肿瘤大鼠进行脂肪压制对比实验来研究NOE效应在肿瘤和正常组织间的差异,进而分析脂肪对基于NOE对比成像的疾病诊断的影响.
肿瘤大鼠的准备:
(1) 麻醉固定消毒:大鼠称重,10%水合氯醛腹腔注射(300 mg/kg),剔除额顶部毛发,头部固定在大鼠脑立体定位仪上,调整门齿杆及双侧耳杆保持大鼠头顶部水平位,碘伏常规消毒铺巾;
(2) 体位与暴露:取前至眉弓中点,后进对耳线,头顶正中切口,沿正中线切开头皮约1 cm,钝性分离皮下组织,暴露前囟;
(3) 穿刺点选择:按照大鼠解剖图谱及标本实测结果定位尾状核进针点,冠状缝后0.8 mm,中线右侧2.5 mm,钻孔至硬脑膜;
(4) 入路与注射:微量进样器吸取u87胶质瘤细胞悬液20 mL,固定于立体定向仪上,垂直进针硬膜下3.7 mm,以2 mL/min速率注入,骨蜡封闭骨孔,缝合头皮;
(5) 术后处理:布托啡诺0.05 mg/kg皮下注射减轻动物疼痛,阿莫西林1片/饮水瓶抗炎.术后呼吸困难或颅高压危象的动物甘露醇1.5 g/kg通过尾静脉点滴;
(6) 在术后每日观察行为改变,称重,术后15天开始进行MRI检测.
1.3 序列设计与数据采集本文采用的脉冲序列为基于快速自旋回波(FSE)的CEST成像序列,如图 1所示.
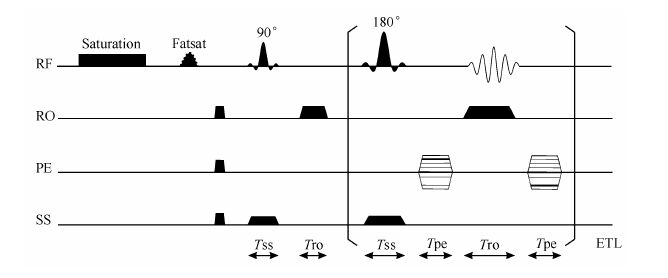
|
| 图 1 基于快速自旋回波的CEST-MRI序列 Fig. 1 FSE-based CEST-MRI sequence |
序列包含3个部分,分别是饱和脉冲、脂肪压制及信号采集,其中饱和脉冲持续时间为3 s,饱和场强(B1)为1.47 mT,脂肪压制部分是基于化学位移进行压制并可控的,持续时间为6 ms,基本上不会影响水信号,信号采集为传统的快速自旋回波.
所有实验均在25 ℃下在Varian system 7.0 T成像仪上进行,采用63/95 mm鸟笼线圈.活体实验中,大鼠被放置在动物床上并使用麻醉机进行麻醉,麻醉机气体成分为异氟烷及氧气,其中异氟烷体积占比5%时为快速麻醉,2%时为维持麻醉.所有操作均遵循厦门大学实验动物管理和使用委员会的规定.实验参数如下:成像视野FOV = 75 mm×75 mm(鸡蛋)、50 mm×50 mm(鼠脑),片选层厚Thickness = 2 mm,成像矩阵Matrix = 128×128,重复时间TR = 6 s,快速自旋回波回波链长ETL = 8.在采集Z谱过程中,饱和脉冲频率以$\delta $ 0.5为步长共采集偏离水$\delta $ -6 ~ 6间25幅图像,并以偏离水$\delta $ 40处图像信号强度作为归一化参考(一般认为偏离超过$\delta $ 10的频点处图像信号强度已趋于稳定,可作为饱和参考值).
1.4 数据分析所有数据拟合及计算均使用基于Matlab软件(MathWorks Inc.,Natick,MA,USA)的自编程序.所有线型均使用Origin软件(OriginLab Corporation,Northampton,MA,USA)绘制.无论是高场位置的NOE效应还是低场位置的CEST效应,在偏离水峰位置及时都基本可以忽略,因此拟合时我们采用的是在频率偏置为处采集的数据.经过洛伦兹拟合,得到的数据点扩充到2 500点,最低值即为校正后的水频率点,使用拟合数据及高场位置上采集的数据进行计算叠加即可得到一个Z谱的NOE效应值.为了获得不同区域准确的NOE值,洛伦兹拟合是对图像逐点进行的,而为了避免单像素点数据噪声对区域NOE值的整体性影响,定量线型分析采用的是各个感兴趣区域内多点的平均数据.
2 结果与讨论 2.1 鸡蛋样品结果在鸡蛋中,脂肪主要存在于蛋黄中,因此,脂肪压制的主要作用对象也是蛋黄.这里主要对脂肪压制前后蛋黄的NOE效应进行对比,并通过对鸡蛋NOE对比图像的对比直观了解脂肪对NOE效应的影响.使用如图 1所示脉冲序列,调整脂肪压制部分,在相同的实验参数下,采集一系列MRI图像并进行计算,得到的NOE对比图像及NOE效应显示在图 2.图 2(b)和(c)分别为脂肪压制前后鸡蛋的NOE对比图像.从图上看,当不进行脂肪压制时,蛋黄区域的NOE效应在图像上显示出高亮度,而脂肪压制后NOE对比图像内蛋黄的亮度明显下降.图 2(a)上椭圆形内为用于定量分析的蛋黄区域,图 2(d)为相应区域内压脂前后的Z谱,虚线为高场位置的拟合曲线,上下误差线为标准偏差.在以$\delta $ -3.5为中心的高场频率范围内两条曲线有不同程度的下凹现象.相比于压脂后较平滑的过度,脂肪压制前的曲线由于大量的脂肪信号出现了明显的谷值,与图 2(e)显示的定量NOE效应对应,脂肪压制前的NOE效应明显高于压脂后的结果.可见,脂肪对鸡蛋的NOE效应产生了较大的影响,使Z谱增加了伪NOE效应,并影响了NOE对比图像的准确性.由此,我们推测组织中脂肪含量较高区域的NOE效应及图像会受到脂肪信号的影响.
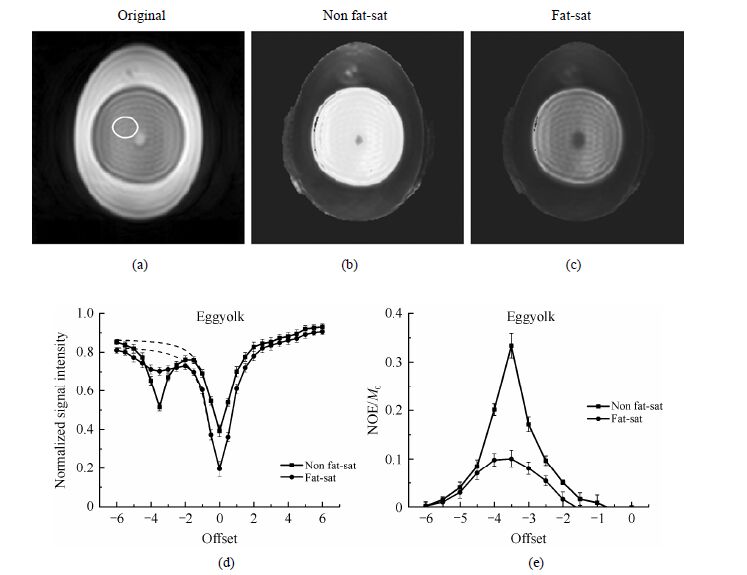
|
| 图 2 鸡蛋的MRI像及脂肪压制前后的NOE对比图像NOE效应.(a) 原始图像;(b) 压脂前NOE对比图像;(c) 压脂后NOE对比图像;(d),(e) 压脂前后蛋黄[图(a)椭圆标示] Z谱及NOE效应 Fig. 2 MRI images of an egg and NOE effects before and after fat saturation. (a) Original image; (b) NOE image before fat saturation; (c) NOE image after fat saturation; (d),(e) Z-spectra and NOE effects of yolk [marked with an ellipse in (a)] before and after fat saturation |
MRI在脑成像方面已广泛应用.一般认为脑组织中脂肪含量较少,因此在脑成像中通常不对脂肪进行特殊处理.然而,研究表明脑部某些区域,如脑白质,脂肪含量较丰富.随着CEST及其相关技术在成像方面的应用,基于CEST和NOE效应的脑部MRI也成为研究热点.由于NOE效应与某些脂肪信号交叉存在的特殊机制,不排除脂肪对脑部NOE效应存在影响.
我们首先对3只正常大鼠的脑部进行了实验,得到的代表性结果如图 3所示.图 3(b)和(c)分别是脂肪压制前后的NOE对比图像.从图中可以看出,相比于脂肪压制前脑区的统一偏高的亮度,脂肪压制后的NOE对比图像整体的亮度变低,并且某些区域亮度变化较明显,从而形成了更多的细节体现.为了精确了解脂肪压制前后NOE效应的变化,我们选取脑白质[图 3(a)中不规则形状区域]及另一亮度变化较明显的区域A [图 3(a)中方形区域]进行了定量的NOE效应分析.图 3(d)和(f)为脑白质及区域A的Z谱,虚线为高场位置的拟合曲线,图 3(e)和(g)表示相应的NOE效应,上下误差线为标准偏差.与文献[2]一致,从Z谱可以看出,脂肪压制前后脑白质的MRI信号在高场处有微小变化,并相应地体现在NOE效应曲线上,从而造成了NOE对比图像上信号强度的变化.可见,脑白质中脂肪的存在确实造成了伪NOE效应.而特别的是,在其它脑区,如区域A,脂肪同样对其NOE效应产生了影响,阻碍了NOE对比图像的细节体现.由此可见,即使是脂肪含量不高的脑组织,在进行NOE对比成像时仍需对脂肪进行处理以得到准确的结果.
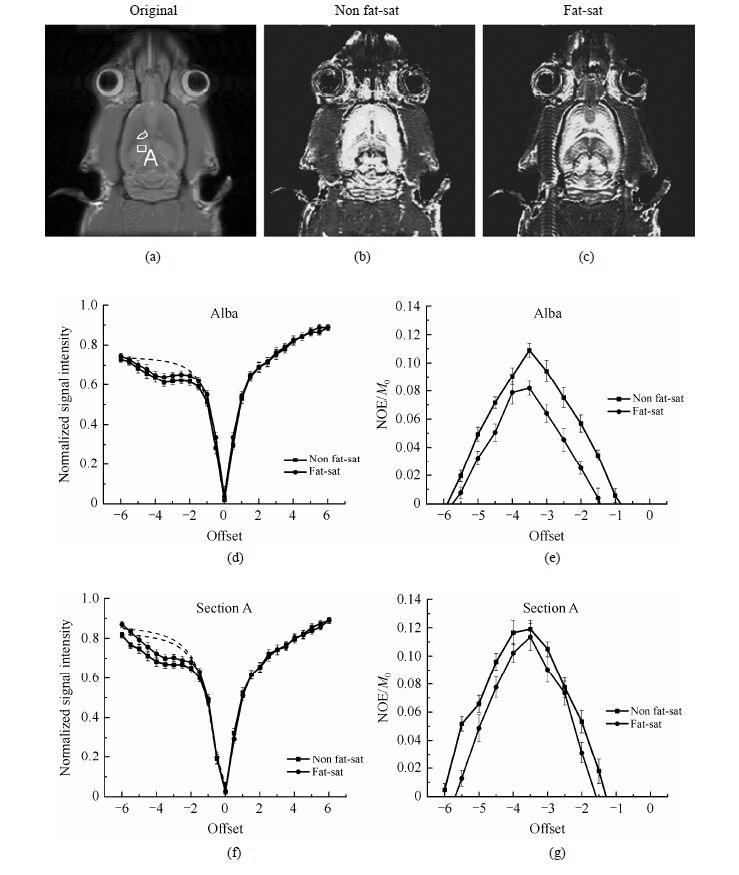
|
| 图 3 正常鼠脑的MRI像及脂肪压制前后的NOE对比图像NOE效应.(a) 原始图像;(b) 压脂前NOE对比图像;(c) 压脂后NOE对比图像;(d)~(g) 压脂前后脑白质[图(a)不规则框标示]及区域A [图(a)方框标示]的Z谱及NOE效应 Fig. 3 MRI images of a normal rat brain and NOE effects before and after fat saturation. (a) Original image; (b) NOE image before fat saturation; (c) NOE image after fat saturation; (d)~(g) Z-spectra and NOE effects of alba [marked with an irregular frame in (a)] and section A [marked with a square in (a)] before and after fat saturation |
为了解基于NOE效应的对比图像如何判别病灶区域,我们将大鼠脑部植入肿瘤,并在中后期肿瘤大小合适并界限明显时对3只老鼠进行了对比实验,代表性的实验结果如图 4所示.图 4(b)和(c)分别是脂肪压制前后的NOE对比图像.对比两幅图可以发现,脂肪压制前NOE对比图像的脑区具有与上文正常大鼠一致的整体性低细节亮度,而相比于正常区域,无论是否进行脂肪压制,肿瘤区域在NOE对比图像上始终表现为较低的亮度,且界限清晰可辨.我们对肿瘤区[图 4(a)中椭圆形区域]及正常组织[图 4(a)中方形区域]的NOE效应进行了定量分析.图 4(d)为肿瘤及正常组织的Z谱,虚线为高场位置的拟合曲线,图 4(e)为相应的NOE效应曲线,上下误差线为标准偏差.对比两个区域的Z谱可知,肿瘤区域在MRI图像上具有比正常组织更高的亮度;相反,在NOE效应上却得到比正常组织更低的值,对应于NOE对比图像上较暗的亮度.需要注意的是,无论是肿瘤还是正常组织,脂肪的压制对Z谱及NOE效应的强度都有些微小的影响,并有可能对更细微的病变的判断造成影响.
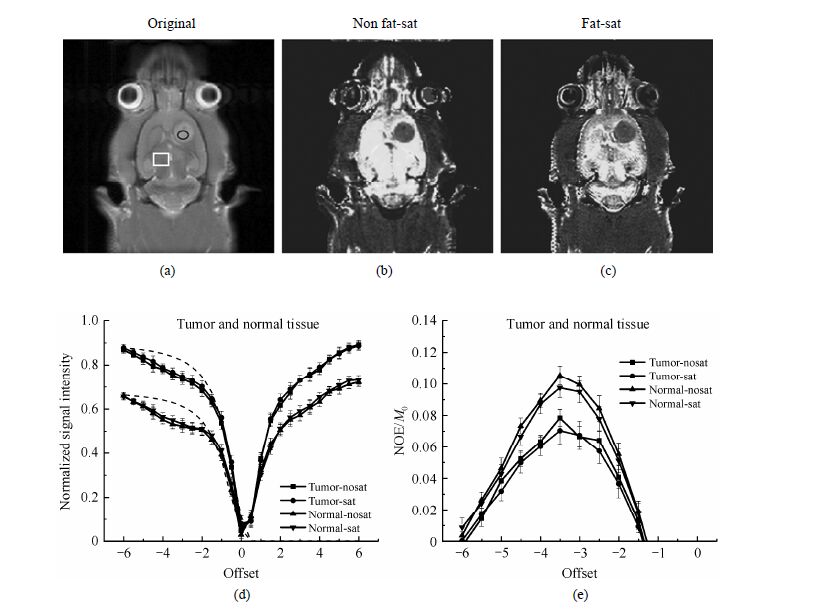
|
| 图 4 长有界限明显肿瘤的鼠脑MRI像及脂肪压制前后的NOE对比图像NOE效应.(a) 原始图像;(b) 压脂前NOE对比图像;(c) 压脂后NOE对比图像;(d),(e) 压脂前后肿瘤[图(a)椭圆形标示]及正常组织[图(a)方框标示]的Z谱及NOE效应 Fig. 4 MRI images of a rat brain with a distinguishable tumor and NOE effects before and after fat saturation. (a) Original image by FSE; (b) NOE image before fat saturation; (c) NOE image after fat saturation; (d),(e) Z-spectra and NOE effects of tumor [marked with an ellipse in (a)] and normal tissue [marked with a square in (a)] before and after fat saturation |
为考察脂肪在脑组织NOE对比成像中对病变判别的影响,我们对3只植入脑肿瘤后的中前期大鼠进行了对比实验,代表性结果如图 5所示.图 5(a)为注射了0.5 mol/L的钆喷酸葡胺造影剂(2 mL/kg)后使用传统多扫描梯度回波序列(GEMS)采集的对照图,成像矩阵Matrix = 256×256,为避免钆对比剂对实验结果的影响,对照图于CEST实验后采集.图 5(b)和(c)分别是脂肪压制前后的NOE对比图像.对比两幅NOE对比图像可得,与上文脂肪压制前得到的NOE对比图像的整体性亮度相似,肿瘤大鼠脑部在脂肪压制前的结果同样具有较统一的亮度及难以区分的细节.值得注意的是,脂肪压制前后的NOE对比图像在病灶区域具有不大相同的轮廓.与对照图比较可知,脂肪压制后的NOE对比图像在病灶区域的判别上匹配度高,而脂肪压制前的NOE对比图像显示的病灶区域扩大,给直观的病变判断造成误导.针对两幅图的变化,我们对肿瘤区[图 5(a)中椭圆形区域]、正常组织[图 5(a)中圆形区域]及强度变化较大的区域B [图 5(a)中方形区域]的NOE效应进行了定量分析.图 5(d)、(f)、(h)为肿瘤、正常组织及区域B的Z谱,虚线为高场位置的拟合曲线,图 5(e)、(g)、(i)为相应的NOE效应曲线,上下误差线为标准偏差.从图上可以看出,无论是MRI信号强度还是NOE效应,脂肪压制前后肿瘤及正常组织的结果与图 4肿瘤中后期的结果相近,整体变化不大.区域B的MRI信号及NOE效应线变化较明显,表明脂肪对脑部某些区域的NOE效应存在影响.此外,比较肿瘤区域的NOE效应线可以发现,脂肪压制前的NOE信号线具有不同于其他效应线的双凸起,而脂肪压制后的结果相对比较稳定,这可能是由于病变初期肿瘤尚未成型,与正常组织相混杂.由于此时肿瘤尚处于初期阶段,引起效应不稳定的因素尚不能确定.可见,当脑组织内存在初期病变且病变位置较特殊时,脂肪的存在对使用NOE对比成像进行病灶判断存在不完全确定的消极影响.
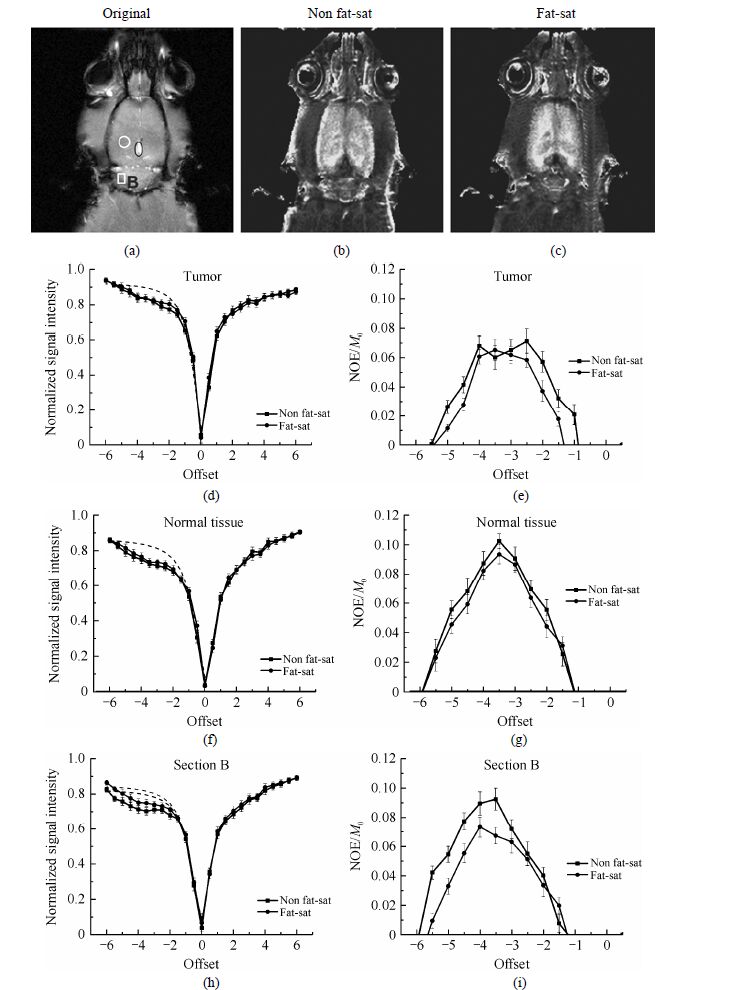
|
| 图 5 小肿瘤鼠脑的MRI像NOE对比图像及NOE效应.(a) 注射钆喷酸葡胺造影剂后的GEMS图像;(b) 压脂前NOE对比图像;(c) 压脂后NOE对比图像;(d)~(i) 压脂前后肿瘤[图(a)椭圆形标示]、正常组织[图(a)圆形标示]及区域B [图(a)方框标示]的Z谱及NOE效应 Fig. 5 MRI images of a rat brain with a small tumor and NOE effects before and after fat saturation. (a) Original image acquired by GEMS sequence after the injection of Gadolinium contrast agent; (b) NOE image before fat saturation; (c) NOE image after fat saturation; (d)~(i) Z-spectra and NOE effects of tumor [marked with an ellipse in (a)],normal tissue [marked with a circle in (a)],and section B [marked with a square in (a)] before and after fat saturation |
本文通过采用低强度饱和脉冲序列结合洛伦兹拟合方法对鸡蛋、健康大鼠鼠脑、颅内肿瘤大鼠鼠脑等模型进行了脂肪压制的对比实验,分析了脂肪对组织内基于NOE效应的磁共振对比成像的影响并对具体区域的NOE效应进行了定量分析.结果表明脂肪含量较高的组织内脂肪信号会引起伪NOE效应,并影响NOE对比图像的准确性.正常大鼠脑内的实验结果表明,在对脑部进行NOE对比成像时需要对脂肪进行处理以得到更准确的结果.肿瘤大鼠的实验结果进一步表明,当脑组织内存在初期病变且病变位置较特殊时,脂肪的存在对使用NOE对比图像进行诊断存在不完全确定的消极影响.
| [1] | Ward K, Aletras A, Balaban R, et al. A new class of contrast agents for MRI based on proton chemical exchange dependentsaturation transfer (CEST)[J]. J Magn Reson, 2000, 143(1): 79-87. |
| [2] | Zhou J, Van Zijl P C. Chemical exchange saturation transfer imaging and spectroscopy[J]. Prog Nucl Magn ResonSpectrosc, 2006, 48(2-3): 109-136. |
| [3] | Sherry A D, Woods M. Chemical exchange saturation transfer contrast agents for magnetic resonance imaging[J]. AnnuRev Biomed Eng, 2008, 10: 391-411. |
| [4] | Vinogradov E, Sherry A D, Lenkinski R E, et al. CEST: From basic principles to applications, challenges andopportunities[J]. J Magn Reson, 2013, 229: 155-172. |
| [5] | Kogan F, Hariharan H, Reddy R, et al. Chemical exchange saturation transfer (CEST) imaging: Description of techniqueand potential clinical applications[J]. Curr Radiol Rep, 2013, 1(2): 102-114. |
| [6] | Solomon I. Relaxation processes in a system of two spins[J]. Phys Rev, 1955, 99(2): 559-565. |
| [7] | Jin T, Wang P, Zong X, et al. MR imaging of the amide-proton transfer effect and the pH-insensitive nuclear Overhausereffect at 9.4 T[J]. Magn Reson Med, 2013, 69(3): 760-770. |
| [8] | Ling W, Regatte R R, Navon G, et al. Assessment of glycosaminoglycan concentration in vivo by chemicalexchange-dependent saturation transfer (gagCEST)[J]. Proc Natl Acad Sci USA, 2008, 105(7): 2 266-2 270. |
| [9] | Jones C K, Huang A, Xu J, et al. Nuclear Overhauser enhancement (NOE) imaging in the human brain at 7 T[J].NeuroImage, 2013, 77: 114-124. |
| [10] | Cai K, Haris M, Singh A, et al. Magnetic resonance imaging of glutamate [J]. Nat Med, 2012, 18(2): 302-306. |
| [11] | Hua J, Jones C K, Blakeley J, et al. Quantitative description of the asymmetry in magnetization transfer effects around thewater resonance in the human brain[J]. Magn Reson Med, 2007, 58(4): 786-793. |
| [12] | Van Zijl P C, Zhou J, Mori N, et al. Mechanism of magnetization transfer during on-resonance water saturation. A newapproach to detect mobile proteins, peptides, and lipids[J]. Magn Reson Med, 2003, 49(3): 440-449. |
| [13] | Zhou J, Blakeley J O, Hua J, et al. Practical data acquisition method for human brain tumor amide proton transfer (APT)imaging[J]. Magn Reson Med, 2008, 60(4): 842-849. |
| [14] | Zhou J, Hong X, Zhao X, et al. APT-weighted and NOE-weighted image contrasts in glioma with different RF saturationpowers based on magnetization transfer ratio asymmetry analyses[J]. Magn Reson Med, 2013, 70(2): 320-327. |
| [15] | Mougin O E, Coxon R C, Pitiot A, et al. Magnetization transfer phenomenon in the human brain at 7 T[J]. NeuroImage,2010, 49(1): 272-281. |
| [16] | Liu D, Zhou J, Xue R, Zuo Z, et al. Quantitative characterization of nuclear Overhauser enhancement and amide protontransfer effects in the human brain at 7 T[J]. Magn Reson Med, 2013, 70(4): 1 070-1 081. |
| [17] | Zaiss M, Kunz P, Goerke S, et al. MR imaging of protein folding in vitro employing Nuclear-Overhauser-mediatedsaturation transfer[J]. NMR Biomed, 2013, 26(12): 1 815-1 822. |
| [18] | Behar K L, Rothman D L, Spencer D D, et al. Analysis of macromolecule resonances in 1H NMR spectra of humanbrain[J]. Magn Reson Med, 1994, 32(3): 294-302. |
| [19] | Lu J, Zhou J, Cai C, et al. Observation of true and pseudo NOE signals using CEST-MRI and CEST-MRS sequences withand without lipid suppression[J]. Magn Reson Med, 2014, doi:10.1002/mrm.25277. |
| [20] | Jones C K, Polders D, Hua J, et al. In vivo three-dimensional whole-brain pulsed steady state chemical exchange saturationtransfer at 7 T[J]. Magn Reson Med, 2012, 67(6): 1 579-1 589. |
| [21] | Dewey B. Simulation and Optimization of Pulsed Chemical Exchange Saturation Transfer for Clinical Application at 3 T[D]. Nashville, Tennessee, USA: Vanderbilt University, 2013. |
 2015, Vol. 32
2015, Vol. 32




