文章信息
- 张竹伟, 陈录广, 裴孟超, 李建奇
- ZHANG Zhu-wei, CHEN Lu-guang,PEI Meng-chao, LI Jian-qi
- GABA-MRS中回顾性运动校正方法研究
- Retrospective Motion Correction in GABA-Editing Magnetic Resonance Spectroscopy Using the Residual Water Signals
- 波谱学杂志, 2015, 32(4): 596-605
- Chinese Journal of Magnetic Resonance, 2015, 32(4): 596-605
- http://dx.doi.org/10.11938/cjmr20150405
-
文章历史
- 收稿日期:2014-12-02
- 收修改稿日期:2015-10-23
2. 第二军医大学 附属长海医院放射科,上海 200433;
3. 上海卡勒幅磁共振技术有限公司,上海 201614
2. Department of Radiology, Changhai Hospital of Shanghai, The Second Military Medical University, Shanghai 200433, China;
3. Shanghai ColorfulMagnetic Resonance Co. Ltd., Shanghai 201614, China)
g-氨基丁酸(g-Aminobutyric Acid,GABA)是中枢神经系统中主要的抑制性神经递质[33],其存在于人体大脑皮质、海马、丘脑、基底神经节等区域,对人脑的发育发挥着重要的作用,对机体的多种功能也具有调节作用[2, 4, 5].癫痫、抑郁症、精神分裂症和焦虑症等多种神经和精神类疾病都与GABA的代谢异常有关[6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17],GABA含量的变化也受药物治疗(例如抗癫痫药)、大脑发育及年龄的影响[18, 19, 20].因此,人脑中的GABA含量的准确测量对于神经科学研究及精神疾病研究非常重要.
活体磁共振波谱(Magnetic Resonance Spectroscopy,MRS)是唯一在体测量人脑中GABA含量的无创伤技术,它能为临床诊断提供很多重要的信息,可为肿瘤及精神类疾病的检测提供定量信息[3, 21, 22].然而,GABA在正常人脑中含量相当低(0.5 ~ 1 mmol/L)[1, 2, 3],且其所有的共振峰都与谷氨酸盐(Glutamate,Glu)、天门冬氨酸(N-acetyl aspartate,NAA)和肌酸(Creatine,Cr)等代谢产物的共振峰重叠,所以采用常规MRS方法很难检测出[2].幸运的是,现在有多种研究方法可用来测量GABA含量,常用的有3类方法:J差分谱编辑技术、多量子滤波技术和二维谱技术[9, 12, 22, 23, 24].J差分谱编辑技术尤其是MEGA-PRESS(Mescher-Garwood Point-Resolved Spectroscopy)序列原理简单且相对易于实现,同时该方法测量出的GABA含量的信噪比相较于其它方法最高,因此其在人脑GABA测量中应用最为广泛[12, 22, 23].
被试的生理运动(主要是心脏跳动和呼吸运动)和头部运动都会对磁共振波谱质量产生影响.在单体素波谱中,头部运动会导致测得的波谱并非全部来自预定的区域.被试的运动对J差分谱编辑技术产生的影响更为显著,因为被试运动会导致谱峰位置错位,使得作差不完全,引起波谱定量的误差[25, 26, 27].由于脑代谢产物的浓度比较低,在活体磁共振波谱中需要多次重复测量以获得更高的信噪比,这样会使得扫描时间相对较长,从而增加了被试在扫描中运动的可能性.目前主要有两种用于MRS的运动校正方法:其一为利用交替导航回波在累加平均前对单次扫描进行运动检测,如果发生运动,则将其后的所有数据舍弃,用未受影响的数据进行重建[28];其二是利用外加设备,对运动状态进行实时监控,并实现实时运动校正[29].然而,这些运动校正方法共同的缺点是在获取运动信息的同时增加了扫描时间,并且在有些情况下,数据的质量和分辨率受到一定限制,或者额外增加的梯度脉冲导致磁场的不稳定性增加.
本文报道了在GABA磁共振活体波谱测量中回顾性运动校正后处理方法.该后处理方法通过残余水峰来判断被试扫描过程中的头部运动,重建时只采用未受运动影响的数据,从而改善最终得到的编辑谱的质量.这种运动校正方法还被集成到MEGA- PRESS序列的重建模块中,得到具有运动校正功能的MEGA-PRESS序列,使得扫描完成后能直接得到运动校正后的编辑谱并可采用模型线性组合(Linear Combination of Model,LCModel)[30, 31]对编辑谱进行定量分析.
1 材料和方法6名男性健康被试参与该项研究,实验前被试认真阅读并填写磁共振检查知情同意书.所有扫描均在西门子3.0 T磁共振成像设备(Siemens 3.0 T MAGNETOM Trio a Tim)上完成,系统软件版本为syngo MR B17.头部扫描采用大体线圈作为信号发射线圈,采用12通道头线圈作为信号接收线圈.
1.1 运动校正后处理方法研究 1.1.1 被试头部运动训练5名被试参与后处理方法研究.在波谱扫描实验前对被试进行头部运动训练,并用回波平面成像扫描(EPI)对被试的头部运动过程进行监测.EPI扫描参数为:重复时间/回波时间(TR/TE)= 2 000 ms/30 ms,视野(FOV) = 230×230 mm2,层厚 = 4 mm,层数 = 33,扫描矩阵(matrix) = 256×256,测量次数 = 96.被试在扫描过程中进行一段时间的点头运动,每次点头运动后都尽量回到初始位置.被试经多次训练后,EPI扫描监控显示头部运动的幅度相近,运动后能基本回到初始位置.
1.1.2 数据采集波谱扫描定位像扫描采用三维磁化准备快速扰相梯度回波(MP-RAGE),其扫描参数为:TR/TE= 2 000 ms/2.65 ms,反转恢复时间(T1) = 900 ms,FOV = 240×240 mm2,层厚 = 1 mm,翻转角(FA) = 9°,matrix = 256×256,平均次数 = 1,扫描时间为5 min.波谱感兴趣区域扫描定位均以大脑纵裂轴对称,扫描部位为枕叶.测量人脑GABA含量的序列为在西门子公司序列集成开发平台(IDEA)上实现的MEGA-PRESS序列[32],其扫描参数为:TR/TE = 2 000 ms/68 ms,体素容积(VOI) = 30×30×30 mm3,谱宽= 1 200 Hz,射频激发频率(delta-frequency) = -d 1.7(相对于水峰的共振频率),平均次数= 256,预扫描次数= 4,编辑脉冲的中心频率在奇数次扫描和偶数次扫描分别为d 1.90和d 7.50,选择性反转射频脉冲脉宽14.0 ms,激发带宽60 Hz,在激发之前使用化学位移选择(CHEmical Shift Selective,CHESS)技术进行水抑制,扫描时间为520 s.每位被试完成两次波谱数据采集,第一次扫描时要求被试保持静止不动,第二次扫描则要求被试在扫描中进行持续时间约2 min的点头运动,扫 描参数均与第一次保持一致.
1.1.3 数据后处理和分析采用SPM8(http://www.fil.ion.ucl.ac.uk)软件对被试的EPI数据进行分析,量化被试的运动情况.在MATLAB 7.11.0 (R2010b)上对5名被试在扫描过程中有运动和保持静止情况下得到的原始数据进行分析,以频域的幅值最大的点为残余水峰信号,分别对各次扫描的残余水峰相位、幅值等方面与头部运动的相关性进行分析.在被试保持静止的情况下,各次扫描间的残余水峰幅值变化较小;而在被试头部小幅运动时,运动阶段的残余水峰的幅值变化较大,因此残余水峰的幅值能够反映单次扫描的运动状态.以第一次扫描的残余水峰的幅值为参考,采用后续扫描的残余水峰的幅值与参考水峰幅值的比值进行运动状态检测,设定阈值以舍弃运动阶段采集的数据.为避免得到的编辑谱出现偏差,若某奇数次扫描处于运动阶段,则将其后的偶次扫描数据一并舍弃,以改善波谱质量.将上述的校正方法实现在IDEA的图像重建环境模块(ICE)上,并用该后处理方法对5名被试的原始数据进行重建.使用MATLAB 7.11.0 (R2010b)将重建的结果转化为LCModel可识别的ASCII (.rda)文件.5名被试各得到3类编辑谱:被试保持静止、被试运动未经运动校正处理、被试运动经运动校正处理.
在LCModel(http://s-provencher.com)[30, 31]中采用包含NAA、Glu、GABA及大分子和脂肪峰的3.0 T基础谱来完成对所有的MEGA-PRESS编辑谱的脑代谢产物波谱定量分析.定量分析前没有进行基线校正、添零和滤波等预处理过程.LCModel的波谱分析拟合范围为d 0.20~4.00.
1.2 运动校正后处理方法实验验证在IDEA上将整合有运动校正后处理功能的ICE文件集成于MEGA-PRESS序列中,实现具有运动校正功能MEGA-PRESS序列.一名被试参与后处理方法的实验验证,其波谱扫描序列是具有运动校正功能的MEGA-PRESS序列.被试进行两次波谱扫描,第一次扫描为被试保持静止,第二次扫描为被试在扫描过程中发生持续约2 mi n的如前文所述的点头运动,定位像参数和波谱扫描参数与后处理方法研究阶段相同.扫描结束后可直接得到被试静止和被试在扫描过程中有运动且经运动校正后的波谱数据,同样采用LCModel进行波谱分析.
2 结果与讨论图 1为一名被试EPI扫描数据使用SPM8处理得到的运动状态图.由图中可以看出,被试经过运动训练后,运动幅度比较一致,平动均<6 mm,转动角度均<5°,被试头部运动后可以基本回到初始位置.5名被试的运动均能满足预期运动后基本回到初始位置的要求.
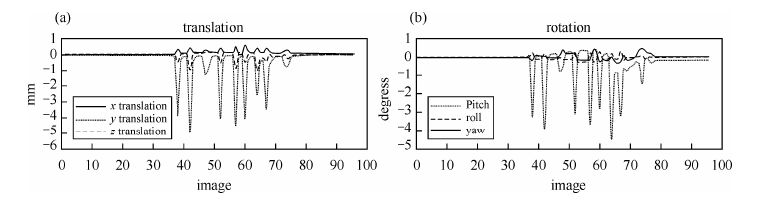
|
| 图 1 EPI扫描过程中被试头部运动的(a)平动和(b)转动情况 Fig. 1 Time courses of the head translation (a) and rotation (b) fluctuation during EPI scan |
图 2是被试在EPI扫描过程中头部静止时和运动时采集的影像数据.与头部静止时的图像[图 2(a)]相比,点头运动时采集的图像[图 2(b)]有明显的伪影.说明被试这种运动形式会导致扫描数据产生明显的劣化,所以同样的运动形式出现在波谱扫描中也会对波谱数据产生严重的影响.
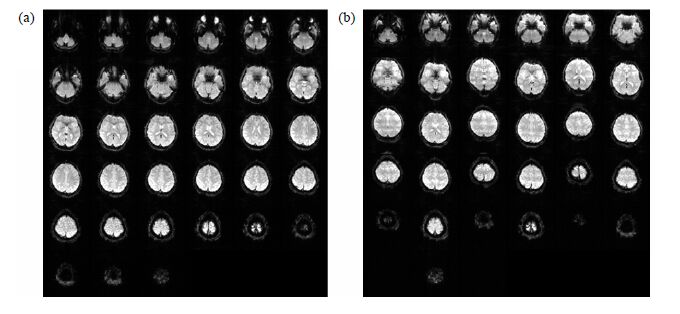
|
| 图 2 被试EPI扫描过程中 (a) 静止时采集的影像数据;(b) 运动时采集的影像数据 Fig. 2 The EPI images while the subject kept static (a) and moved his head (b) |
图 3显示了一名健康被试头部保持静止和扫描过程中有约2 min的点头运动时残余水峰的幅值随时间的波动情况.图 3中横坐标是扫描次数,纵坐标是单次扫描的残余水峰幅值与第一次扫描的残余水峰幅值的比值.由图 3可知,当被试保持静止时,残余水峰的幅值较为稳定[图 3(a)],而当被试在扫描过程中头部运动时,受运动影响的单次扫描残余水峰幅值则发生突变[图 3(b)],水峰幅值降低.运动使得感兴趣区域处于不均匀的B0和B1场中,这样会引起相位和频率的偏移.这种由B0和B 1场的空间差异性引起的频率和相位的偏移会导致谱线变宽和水及其他共振峰信号值降低[1].
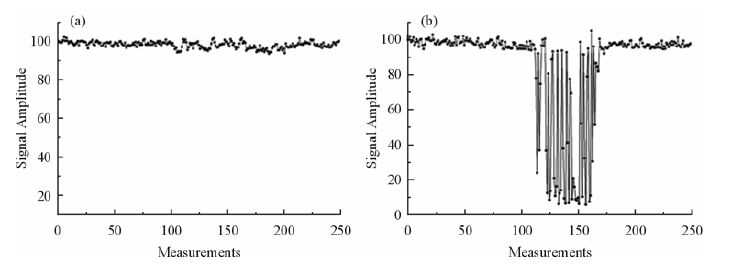
|
| 图 3 (a)被试保持静止和(b)被试在扫描过程中发生持续约2 min的点头运动情况下残余水峰幅值随时间的变化曲线 Fig. 3 Time courses of the amplitude fluctuation of residual water signal while the subject kept static (a) and moved his head about two minutes (b) during scan,respectively. A drop in signal amplitude in (b) is indicative of subject’s motion |
图 4是被试在扫描过程中保持静止不动和发生持续约2 min的点头运动的数据运动校正前后的枕叶部位GABA-MRS波谱.与被试在扫描过程中保持静止不动得到的波谱[图 4(b)]相比,扫描过程中发生点头运动的数据质量明显下降.未经运动校正直接重建得到的波谱[图 4(c)]基线明显变形、峰宽变宽、噪声偏大、谱峰的区分度下降、谱峰位置也有所偏移;而经过运动校正后的重建编辑谱[图 4(d)]较校正前基线变形有了很大的改善,峰宽变窄、谱线拟合情况较好、谱图质量显著提高.5名被试均得到相似的结果.
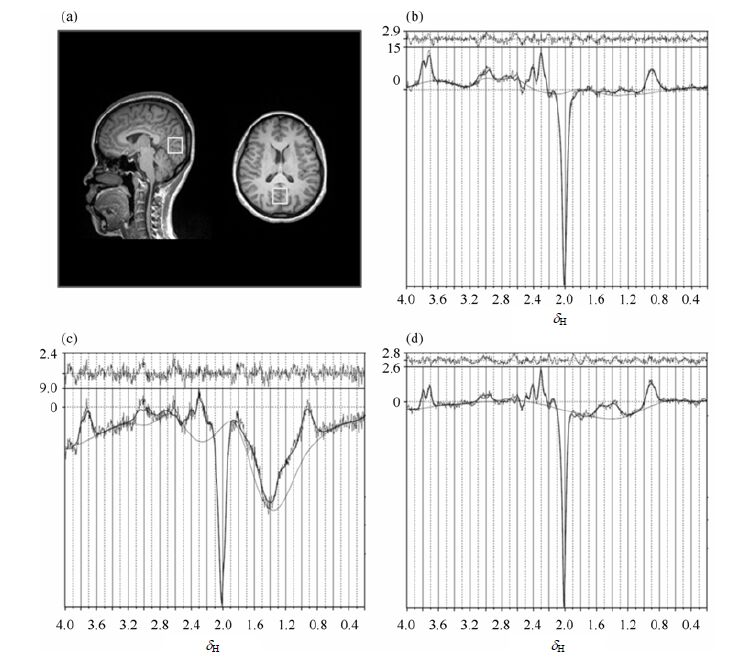
|
| 图 4 一被试在扫描过程中保持静止不动和在扫描过程中发生持续约2 min的点头运动情况下得到的枕叶部位GABA-MRS波谱.(a) 定位像;(b) 被试保持静止不动得到的编辑谱;(c) 被试在扫描过程中发生持续约两分钟的点头运动未经运动校正得到的编辑谱;(d) 被试在扫描过程中发生持续约2 min的点头运动经运动校正处理得到的编辑谱 Fig. 4 The MEGA-PRESS spectra in occipital lobe of one subject. (a) The scout image; (b) The MEGA-PRESS spectra while the subject kept static during scan; (c) The MEGA-PRESS spectra while the subject moved his head about two minutes during scan and the data was processed without correction; (d) The MEGA-PRESS spectra while the subject moved his head about two minutes during scan and the data was processed with correction |
图 5所示的是被试在保持静止和在扫描过程中发生持续约2 min的点头运动情况下,采用集成了运动校正后处理方法的MEGA-PRESS序列扫描得到的枕叶部位GABA-MRS波谱.从图中可以看出,除信噪比外,这两种情况下重建出的波谱差异性较小,说明本文提出的运动校正后处理方法在3.0 T磁共振成像扫描设备中很好的实现,并能达到预期的改善谱图质量的效果.
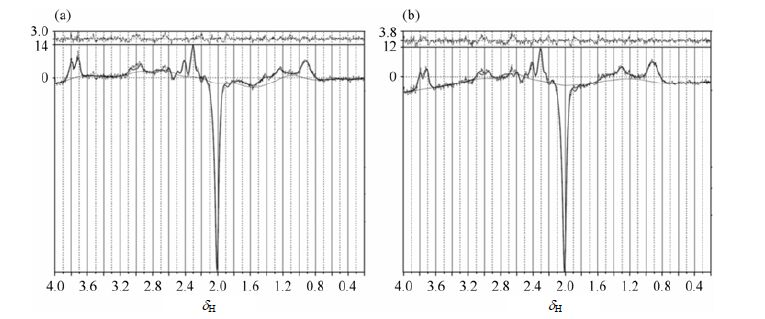
|
| 图 5 被试由整合了运动校正后处理功能的MEGA-PRESS序列扫描得到的编辑谱. (a) 被试在扫描过程中保持不动;(b) 被试在扫描过程中发生持续约2 min的点头运动 Fig. 5 The edited spectra acquired with motion corrected MEGA-PRESS sequence. (a) The subject kept static during scan; (b) The subject moved his head about two minutes during scan |
本文报道了通过残余水峰对波谱扫描中被试的头部运动加以识别,并通过舍弃受运动影响的数据改善波谱质量的后处理方法.该方法被集成于扫描序列的重建模块中,其优点在于:不需要在脉冲序列中额外添加射频脉冲和梯度脉冲,避免了因增加梯度脉冲而引起的磁场的不稳定性[2];不需要增加特殊的外部装置对被试的运动进行实时追踪,减少了操作员的工作量及时间消耗[37, 38].
目前临床上有多种用于磁共振波谱定量研究的后处理软件,如LCModel、jMRUI (java-based Magnetic Resonance User Interface)、SAGE (Spectroscopy Analysis by General Electric)、Functool和GAMMA等等[31].LCModel是一种磁共振波谱绝对定量的软件,使用的是通过模拟或者大量实验得到的基础谱作为拟合线,能够更加准确地拟合谱线,并能通过与基线组的相互校正模拟来获取谱线中各种代谢物的峰值[22, 30, 31].此外,LCModel软件还有自动进行去涡流效应、自动选择拟合线形及基线等功能,避免由于少参数模型所引起的偏倚或者多参数模型引起的过度拟合.在拟合定量的过程中,LCModel引入人为因素较少,这样就减少了定量中因人为操作产生的误差,得出更为标准的谱线和准确的代谢物浓度[22, 30].该软件对测量GABA这种含量较低的代谢产物,有很好的效果,可以使定量结果更加准确,有利于临床研究.本文报道的方法能获得编辑谱并可直接用LCModel进行定量分析.
本文方法的不足之处在于研究的运动情况较为特殊,要求运动后又回到原来的位置.这样的运动设定主要是针对被试在扫描中咳嗽、打哈欠等类似的短暂且易复位的运动情况.实验结果说明对于这类运动,校正效果较好.在以后的研究中应对多种不同的运动情况加以研究,进一步分析运动校正方法的有效性并改进方法.
3 结论GABA-MRS扫描过程中被试的运动会影响波谱的质量.本研究通过残余水峰判断被试扫描过程中的头部运动,并且在数据重建时舍弃受运动影响的数据,有效改善了重建的波谱质量,为医学诊断和研究提供便利.
| [1] | Agarwal N, Renshaw P F. Proton MR spectroscopy-detectable major neurotransmitters of the brain: biology and possibleclinical applications[J]. AJNR Am J Neuroradiol, 2012, 33(4): 595-602. |
| [1] | Agarwal N, Renshaw P F. Proton MR spectroscopy-detectable major neurotransmitters of the brain: biology and possibleclinical applications[J]. AJNR Am J Neuroradiol, 2012, 33(4): 595-602. |
| [3] | Novotny E J, Jr, Fulbright R K, Pearl P L, et al. Magnetic resonance spectroscopy of neurotransmitters in human brain[J].Ann Neurol, 2003, 54(S6): S25-31. |
| [4] | McCormick D A. GABA as an inhibitory neurotransmitter in human cerebral cortex[J]. J Neurophysiol, 1989, 62(5): 1 018-1 027. |
| [5] | Boy F, Evans C J, Edden R A, et al. Dorsolateral prefrontal gamma-aminobutyric acid in men predicts individualdifferences in rash impulsivity[J]. Biol Psychiatry, 2011, 70(9): 866-872. |
| [6] | Petroff O A, Hyder F, Rothman D L, et al. Homocarnosine and seizure control in juvenile myoclonic epilepsy and complexpartial seizures[J]. Neurology, 2001, 56(6): 709-715. |
| [7] | Levy L M, Ziemann U, Chen R, et al. Rapid modulation of GABA in sensorimotor cortex induced by acutedeafferentation[J]. Ann Neurol, 2002, 52(6): 755-761. |
| [8] | Brambilla P, Perez J, Barale F, et al. GABAergic dysfunction in mood disorders[J]. Mol Psychiatry, 2003, 8(8): 721-737. |
| [9] | Du F, Chu W J, Yang B, et al. In vivo GABA detection with improved selectivity and sensitivity by localized doublequantum filter technique at 4.1 T [J]. Magn Reson Imaging, 2004, 22(1): 103-108. |
| [10] | Epperson C N, Gueorguieva R, Czarkowski K A, et al. Preliminary evidence of reduced occipital GABA concentrations inpuerperal women: A 1H-MRS study[J]. Psychopharmacology (Berl), 2006, 186(3): 425-433. |
| [11] | Yoon J H, Maddock R J, Rokem A, et al. GABA concentration is reduced in visual cortex in schizophrenia and correlateswith orientation-specific surround suppression[J]. J Neurosci, 2010, 30(10): 3 777-3 781. |
| [12] | Puts N A, Edden R A. In vivo magnetic resonance spectroscopy of GABA: a methodological review[J]. Prog Nucl MagnReson Spectrosc, 2012, 60: 29-41. |
| [13] | Song Zhe(宋哲), Huang Pei-yu(黄沛钰), Qiu Li-hua(邱丽华), et al. Decreased occipital GABA concentrations in patientswith first-episode major depressive disorder: A magnetic resonance spectroscopy study(重性抑郁症首发未用药患者的枕叶GABA 波谱研究)[J]. Journal of Biomedical Engineering(生物医学工程学杂志), 2012, 29(2): 233-236. |
| [14] | Long Z, Medlock C, Dzemidzic M, et al. Decreased GABA levels in anterior cingulate cortex/medial prefrontal cortex inpanic disorder[J]. Prog Neuro-Psychoph, 2013, 44: 131-135. |
| [15] | Shaw A, Brealy J, Richardson H, et al. Marked reductions in visual evoked responses but not gamma-aminobutyric acidconcentrations or gamma-band measures in remitted depression[J]. Biol Psychiatry, 2013, 73(7): 691-698. |
| [16] | Bai X, Edden R A, Gao F, et al. Decreased gamma-aminobutyric acid levels in the parietal region of patients withAlzheimer's disease[J]. J Magn Reson Imaging, 2014, 41(5): 1 325-1 331. |
| [17] | Coyle J T. The GABA-glutamate connection in schizophrenia: which is the proximate cause?[J]. Biochem Pharmacol, 2004,68(8): 1 507-1 514. |
| [18] | Petroff O A, Rothman D L, Behar K L, et al. Effects of valproate and other antiepileptic drugs on brain glutamate,glutamine, and GABA in patients with refractory complex partial seizures[J]. Seizure, 1999, 8(2): 120-127. |
| [19] | Gao F, Edden R A, Li M, et al. Edited magnetic resonance spectroscopy detects an age-related decline in brain GABAlevels[J]. Neuroimage, 2013, 78: 75-82. |
| [20] | Pouwels P J, Brockmann K, Kruse B, et al. Regional age dependence of human brain metabolites from infancy toadulthood as detected by quantitative localized proton MRS[J]. Pediatr Res, 1999, 46(4): 474-485. |
| [20] | Pouwels P J, Brockmann K, Kruse B, et al. Regional age dependence of human brain metabolites from infancy toadulthood as detected by quantitative localized proton MRS[J]. Pediatr Res, 1999, 46(4): 474-485. |
| [22] | Mullins P G, McGonigle D J, O'Gorman R L, et al. Current practice in the use of MEGA-PRESS spectroscopy for thedetection of GABA[J]. Neuroimage, 2014, 86: 43-52. |
| [23] | Waddell K W, Avison M J, Joers J M, et al. A practical guide to robust detection of GABA in human brain by J-differencespectroscopy at 3T using a standard volume coil[J]. Magn Reson Imaging, 2007, 25(7): 1 032-1 038. |
| [24] | Keltner J R, Wald L L, Frederick B D, et al. In vivo detection of GABA in human brain using a localized double-quantumfilter technique[J]. Magn Reson Med, 1997, 37(3): 366-371. |
| [25] | Rothman D L, Behar K L, Hetherington H P, et al. Homonuclear 1H double-resonance difference spectroscopy of the ratbrain in vivo[J]. Proc Natl Acad Sci USA, 1984, 81(20): 6 330-6 334. |
| [26] | de Graaf R A, Luo Y, Terpstra M, et al. Spectral editing with adiabatic pulses[J]. J Magn Reson B, 1995, 109(2): 184-193. |
| [27] | Hetherington H P, Avison M J, Shulman R G. 1H homonuclear editing of rat brain using semiselective pulses[J]. Proc NatlAcad Sci USA, 1985, 82(10): 3 115-3 118. |
| [28] | Bhattacharyya P K, Lowe M J, Phillips M D. Spectral quality control in motion-corrupted single-voxel J-difference editingscans: an interleaved navigator approach[J]. Magn Reson Med, 2007, 58(4): 808-812. |
| [29] | Bogner W, Gagoski B, Hess A T, et al. 3D GABA imaging with real-time motion correction, shim update and reacquisitionof adiabatic spiral MRSI[J]. Neuroimage, 2014, 103C: 290-302. |
| [30] | Provencher S W. Automatic quantitation of localized in vivo 1H spectra with LCModel[J]. NMR Biomed, 2001, 14(4): 260-264. |
| [31] | Provencher S W. Estimation of metabolite concentrations from localized in vivo proton NMR spectra[J]. Magn Reson Med,1993, 30(6): 672-679. |
| [32] | Chen Lu-guang(陈录广), Li Jian-qi(李建奇), Wang Qian-feng(王前锋). Detection of GABA in human brain on clinical 3TMRI scanner(人脑GABA 测量在临床3T 磁共振成像系统上的实现)[J]. Chinese J Magn Reson(波谱学杂志), 2013,30(3): 345-353. |
| [33] | Star-Lack J M, Adalsteinsson E, Gold G E, et al. Motion correction and lipid suppression for 1H magnetic resonancespectroscopy[J]. Magn Reson Med, 2000, 43(3): 325-330. |
| [34] | Dong Fang(董芳), Pei Meng-chao(裴孟超), Wang Qian-feng(王前锋), et al. Respiration-induced artifacts and navigatorecho correction in gradient echo imaging on human brain(颅脑梯度回波成像: 呼吸伪影和导航回波矫正)[J]. Chinese JMagn Reson(波谱学杂志), 2014, 31(3): 321-330. |
| [35] | Maas L C, Frederick B D, Renshaw P F. Decoupled automated rotational and translational registration for functional MRItime series data: the DART registration algorithm[J]. Magn Reson Med, 1997, 37(1): 131-139. |
| [36] | Thesen S, Heid O, Mueller E, et al. Prospective acquisition correction for head motion with image-based tracking forreal-time fMRI[J]. Magn Reson Med, 2000, 44(3): 457-465. |
| [37] | Tremblay M, Tam F, Graham S J. Retrospective coregistration of functional magnetic resonance imaging data usingexternal monitoring[J]. Magn Reson Med, 2005, 53: 141-149. |
| [38] | Zaitsev M, Dold C, Sakas G, et al. Magnetic resonance imaging of freely moving objects: prospective real-time motioncorrection using an external optical motion tracking system[J]. Neuroimage, 2006, 31: 1 038-1 050. |
 2015, Vol. 32
2015, Vol. 32




