文章信息
- 宋爱华, 张延峰, 沙沂, 高源, 李宁, 马跃平
- SONG Ai-hua, ZHANG Yan-feng, SHA Yi, GAO Yuan, LI Ning, MA Yue-ping
- 富马酸替诺福韦二吡呋酯波谱数据与结构确证
- Spectral Analysis and Structural Elucidation of Tenofovir Disoproxil Fumarate
- 波谱学杂志, 2015, 32(3): 542-550
- Chinese Journal of Magnetic Resonance, 2015, 32(3): 542-550
- http://dx.doi.org/10.11938/cjmr20150315
-
文章历史
- 收稿日期: 2014-10-11
- 收修改稿日期: 2015-07-21
2. 石药集团中诺药业(石家庄)有限公司,河北石家庄 050000;
3. 沈阳药科大学中药学院,辽宁 沈阳 110016
2. Shijiazhuang Pharm. Group Zhongnuo Pharmaceutical (Shijiazhuang) Co. Ltd., Shijiazhuang 050000, China;
3. School of Traditional Chinese Materia Medica, Shenyang Pharmaceutical University, Shenyang 110016, China
富马酸替诺福韦二吡呋酯(tenofovir disoproxil fumarate),化学名为9-[(R)-2-[[双[[(异丙氧基羰基)氧基]甲氧基]氧膦基]甲氧基]-丙基]腺嘌呤富马酸盐(1∶1),其结构式见图 1,是美国Gilead公司开发的一种新型核苷酸类逆转录酶抑制剂,于2002年在欧盟上市,用于治疗HIV-1感染和慢性乙型肝炎[1],具有耐受性好、耐药率低、停药反弹率低、肾毒性小等特点.目前有关于富马酸替诺福韦二吡呋酯的合成[2]、药代动力学[3, 4]、质谱分析及1H NMR数据归属[5]等方面的文献报道,而尚未见富马酸替诺福韦二吡呋酯较为完整的UV、IR和13C NMR数据解析归属等相关文献报道.本文结合文献[6, 7, 8]方法,对富马酸替诺福韦二吡呋酯进行了较全面的波谱表征,测定了富马酸替诺福韦二吡呋酯的紫外吸收光谱(UV)、红外吸收光谱(IR)、核磁共振谱(1H NMR,13C NMR,31P NMR,DEPT-135,1H-1H COSY,HSQC和HMBC)、质谱(ESIMS和HRMS),对其所有的1H和13C NMR信号进行了归属,讨论了红外特征吸收峰所对应的官能团的振动形式以及质谱的主要碎片离子的可能的裂解方式,同时也进行了差热分析(DSC)和热重分析(TGA),从而提供了较完备的富马酸替诺福韦二吡呋酯的结构和光谱、波谱信息,为其质量研究提供参考依据.

|
| 图 1 富马酸替诺福韦二吡呋酯的结构式 Fig. 1 The structure of tenofovir disoproxil fumarate |
紫外光谱用岛津2201紫外可见分光光度计(日本岛津)测定;红外光谱用Bruker IFS55付立叶变换红外分光光度计测定,KBr压片;1H NMR,13C NMR,31P NMR,DEPT-135,COSY,HSQC和HMBC均用Bruker Avance-600型核磁共振谱仪测定,样品溶于D2O,以TMS为内标,1H NMR谱的实验工作频率为600.13 MHz,13 C NMR谱的实验工作频率为150.92 MHz,1H NMR谱的谱宽6 009.6 Hz,13 C NMR谱的谱宽45 454.5 Hz.二维谱包括2D梯度场1H-1H COSY,HSQC,HMBC均采用瑞士Brucker公司标准脉冲序列.1H-1H COSY的F1维的谱宽为6 009.6 Hz,F2维的谱宽为6 009.6 Hz,F1域零填充至1 024进行FT变换,F1,F2域均采用Qsine bell窗函数处理谱图,采样数矩阵为1 024×512.HSQC的F1(13C)和F2(1H)维的谱宽分别为45 454.5 Hz和 6 009.6 Hz,F1域零填充至1 024进行FT变换,F1,F2域均采用Qsine bell窗函数处理谱图,采样数矩阵为1 024×384.HMBC的F1(13C)和F2(1H)维的谱宽分别为45 454.5 Hz和6 009.6 Hz,F1域零填充至1 024进行FT变换,F1,F2域均采用Sine bell窗函数处理谱图,采样数矩阵为2 048×162.脉冲间隔为2 s,1JCH = 140 Hz.HMBC实验选取nJCH = 5.0 Hz;ESIMS用Agilent 1100 系列SL离子阱质谱仪测定;HRMS用Bruker micrOTOF质谱仪测定,ESI源;热差分析用日本岛津DSC-60型差示扫描量热仪测定,参数设置:起始温度:35 ℃;升温速率:5 ℃/min;终止温度:150 ℃;氛围:氮气30 mL/min.仪器校正标准物质:磺胺二甲嘧啶(中国食品药品检定研究院),熔点200 ℃,实测200.47 ℃;热重分析用日本岛津TGA-50型热重分析仪测定,参数设置:升温速率:10 ℃/min;终止温度:150 ℃;氛围:氮气.
1.1.2 试剂氘代试剂D2O (Cambridge Isotope Laboratories,Inc);其他试剂均为分析纯.
1.2 化合物制备 1.2.1 替诺福韦二吡呋酯制备反应方程式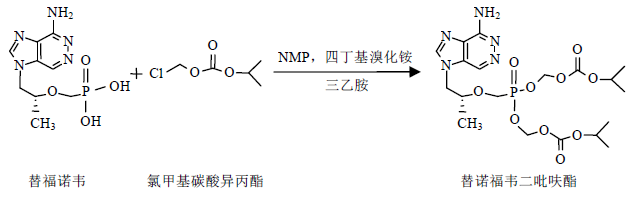
在样品的中性溶液(134.7 mg/mL MeOH溶液)紫外光谱中lmax 260 nm,吸收强度(摩尔吸收系数e)为2×103,是结构中腺嘌呤的K带吸收.lmax 207 nm,吸收强度(摩尔吸收系数e)为2×103,是结构中嘧啶的E2带吸收,其酸性(0.1 mol/L HCl/MeOH溶液)和碱性溶液(0.1 mol/L NaOH/MeOH溶液)的紫外光谱与中性溶液紫外光谱基本一致.
2.2 IR富马酸替诺福韦二吡呋酯的IR吸收光谱中,1 626 cm-1,1 579 cm-1,1 506 cm-1(nC=C nC=N),3 108 cm-1,3 051 cm-1(n=CH ArH),1 185 cm-1,1 159 cm-1(d=CH ArH面内),890 cm-1(d=CH ArH面外)表明有一个孤立的五取代芳杂环,说明邻三取代嘧啶基团的存在.
1 268 cm-1 (nP=O P(OR)2),984 cm-1(nP-O-C P(OR)2)为膦酸酯的高度特征峰.富马酸替诺福韦二吡呋酯的红外吸收光谱数据及归属见表 1.
| Absorption band/cm-1 | Mode of vibration | Group | Intensity | Remarks |
| 3231,2686 | νN+H3 | N+H3 | m. w | 铵谱带 |
| 3108,3050 | ν=CH | =CH | w. w | |
| 2987,2918,2850 | νCH | CH3 CH2 | m. w. w | |
| 2534 | νN+H | N+ H | m | 铵谱带 |
| 1762 | νC=O | COOR | s | |
| 1679 | νC=N | C=N | s | |
| 1626 | δN+H3 νC=C |

|
m | 铵谱带 |
| 1579 | νC=C νCOO- |

|
w | |
| 1506 | νC=C δN+H3 |

|
m | |
| 1471 | δCH | CH3 CH2- | m | |
| 1421 | νCOO- | COO- | m | |
| 1381 | νCH | CH3- | m | |
| ~1280,1032 | νC-O-C | COOR | s. m | 酯谱带 |
| 1268 | νP=O | P(OR)2 | s | 膦谱带 |
| 1185,1159 | δ=CH | =CH- | w. w | |
| 1101 | νC-O-C | P-O-C- | m | 醚键 |
| 984 | νP-O-C | P(OR)2 | s | 膦谱带 |
| 890 | δ=CH | =CH- | m | 五取代芳杂环上孤立氢 |
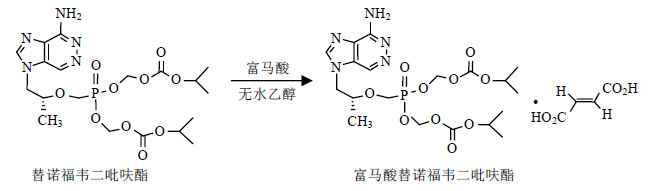
因富马酸替诺福韦酯为有机盐,所以采用ESI质谱仪,测得正离子扫描的准分子离子m/z 520 [M-116+H]+,其精确分子量为520.182 7,推算出去碱基部分分子式为C19H31N5O10P,碱基部分的分子式为C19H30N5O10P.按正离子方式检测的一级全扫描质谱中可看到替诺福韦二吡呋酯的准分子离子峰m/z 520和m/z 542 [M-116+Na]+.在该供试品按正离子方式检测的二级全扫描质谱中,可以看到4个主要碎片离子峰,其主要碎片的可能裂解途径见图 2.
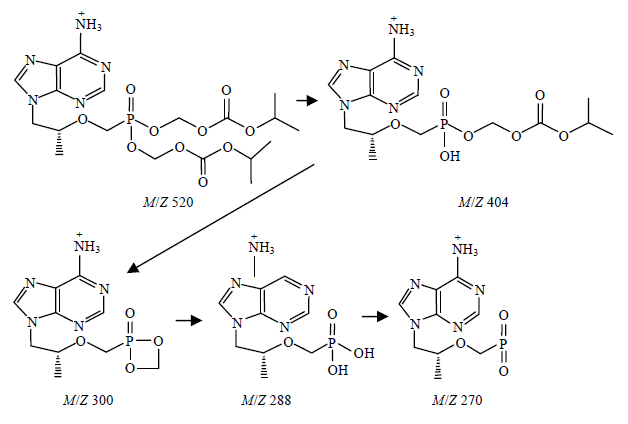
|
| 图 2 富马酸替诺福韦二吡呋酯的碎片裂解图 Fig. 2 Pyrolysis fragments of tenofovir disoproxil fumarate |
1H NMR谱中给出13组质子信号,结合1H-1H COSY,HSQC,HMBC谱综合分析和文献[5]比对,可知高场区d 1.28 (3H,d,J = 6.0 Hz,H-14)、1.29 (6H,d,J = 6.0 Hz,H-21,22)、1.30 (6H,d,J = 6.0 Hz,H-29,30)为与次甲基相连的5个甲基质子信号.d 3.98 (1H,m,H-11)、4.89 (1H,m,H-20)、4.92 (1H,m,H-28)为3个次甲基质子信号.d 4.27 (1H,dd,J = 14.4,8.4 Hz,H-10a)和4.46(1H,dd,J = 14.4,3.0 Hz,H-10b)为1组亚甲基质子信号.δ 3.86 (1H,dd,J = 14.4,JPH = 9.0 Hz)、4.12 (1H,dd,J = 14.4,JPH = 6.6 Hz)为与P原子相连的亚甲基质子信号.d 6.70(2H,s)为烯氢质子的信号.d 8.27(1H,s) 和8.38(1H,s)为五取代芳杂环上两个质子信号.综上所述,结合1H-1H COSY谱提供的信息,我们对化合物的1H NMR数据进行了归属,并与文献进行了对比,见表 2.
2.4.2 13C NMR,DEPT,HSQC和HMBC测试样品的13C NMR谱中出现17组碳信号,分别对应结构中的23个碳原子,依据氢谱解析结果和HSQC、HMBC谱中的相关信号可对结构中所有碳信号进行归属,其13 C NMR,DEPT,HSQC和HMBC数据见表 3.
HMBC谱中,可见dH 8.27(H-8)、8.38(H-2)与dC 151.9 (C-4)相关,另有dH 8.27(H-8)与dC 120.9 (C-5)、dH 8.38(H-2)与dC 154.5 (C-6)分别相关,结合IR可推断该化合物结构中存在多取代嘌呤结构片段A.在1H-1H COSY中,质子dH 3.98 (H-11)分别与dH 4.27、4.46 (H-10)和1.28 ( H-14)相关,HSQC谱中上述质子分别与碳信号dC 80.1 (C-11)、51.5 (C-10)、18.5 (C-14)相关,可知存在结构片段B.HMBC谱中片段B中的质子dH 4.27、4.46 (H-10)与片段A的碳信号dC 151.9 (C-4)、147.7 (C-8)有远程相关,(见图 3),可确定A、B片段连接方式.在31P NMR谱中的信号d 23.4可证明该化合物结构中存在磷酸酯结构片段.从连氧叔碳信号dC 80.1(JPC = 10.9 Hz) (C-11)的磷碳偶合常数值判断,该碳与磷原子隔三键相连.HSQC谱中亚甲基质子dH 3.86,4.12 (H-13)与连氧碳信号dC 64.8 (JPC = 165.1 Hz)相关,从该亚甲基的磷氢、磷碳偶合常数判断,其与磷酸酯结构片段的磷原子直接相连.HSQC谱中,质子dH 5.44,5.48~5.51和5.55 (H-16、H-24)与碳信号d87.8 (C-16、C-24)相关,从碳、氢化学位移值及磷氢偶合常数判断,两仲碳均与磷酸酯结构片段的氧原子相连,存在结构片段C.HSQC谱中4个甲基信号dH1.29 (H-21、22),1.30 (H-29、30)与dC 23.7(C-21,22、C-29,30)直接相关,dH 4.89 (H-20),4.92 (H-28)与叔碳信号dC 78.0 (C-20),78.7 (C-28)直接相关,结合碳氢数据可推断结构中存在两个化学环境相近的异丙基,HMBC谱中质子dH 4.89 (H-20),4.92 (H-28)分别与两个羧酸酯基碳信号dC 156.3 (C-18),156.4 (C-26)有远程相关,构成两个化学环境相同的结构片段D.而片段C中质子dH 5.44 (H-16a)、5.48~5.51(H-16b或H-24a)、5.55(H- 24b)和4.88(H-20)与片段D中季碳信号dC 156.3 (C-18),156.4 (C-26)有远程相关,从而构成了替诺福韦二吡呋酯的结构.在HMBC谱中dC 174.0 (C-1',4')与烯氢质子dH 6.70(H-2',3')有远程相关,可推断富马酸结构的存在.综上可确定测试样品结构为富马酸替诺福韦二吡呋酯.此外,C-16,C-24及其所连支链的结构相同,化学环境相似,两支链对应位置的1H和13C数据归属可以互换.
| Position | dH | dH (Ref.[5]) | Multiplicity | Proton number | 1H-1H COSY |
| 2 | 8.38 | 8.23 | s | 1 | / |
| 8 | 8.27 | 8.14 | s | 1 | / |
| 10a | 4.27 | 4.23 | dd,J = 14.4,8.4 Hz | 1 | H-10b |
| 10b | 4.46 | 4.39 | dd,J = 14.4,3.0 Hz | 1 | H-10a |
| 11 | 3.98 | 3.98 | m | 1 | H-10,H-14 |
| 13a | 3.86 | 3.85 | dd,J = 14.4,JPH = 9.0 Hz | 1 | H-13b |
| 13b | 4.12 | 4.04 | dd,J = 14.4,JPH = 6.6 Hz | 1 | H-13a |
| 14 | 1.28 | 1.22 | d,J = 6.0 Hz | 3 | H-11 |
| 16a | 5.44 | 5.51 | dd,J = 12.6,JPH = 6.0 Hz | 1 | H-16b |
| 16b | 5.48~5.51 | 5.59 | overlapped | 1 | H-16a |
| 20 | 4.89 | 4.88 | m | 1 | H-21,H-22 |
| 21,22 | 1.29 | 1.28 | d,J=6.0 Hz | 6 | H-20 |
| 24a | 5.48~5.51* | 5.59 | overlapped | 1 | H-24b |
| 24b | 5.55* | 5.59 | dd,J = 13.2,JPH = 7.2 Hz | 1 | H-24a |
| 28 | 4.92** | 4.88 | m | 1 | H-29,H-30 |
| 29,30 | 1.30 | 1.28 | d,J = 6.0 Hz | 6 | H-28 |
| 2',3' | 6.70 | 6.76 | s | 2 | / |
| *为文献中未明确归属的氢信号;**为文献中归属错误的氢信号 | |||||
| Position | dC | DEPT | HSQC | HMBC |
| 2 | 149.7 | CH | + | / |
| 4 | 151.9 | C | / | H-2,H-8,H-10 |
| 5 | 120.9 | C | / | H-8 |
| 6 | 154.5 | C | / | H-2 |
| 8 | 147.7 | CH | + | H-10 |
| 10 | 51.5 | CH2 | + | H-14 |
| 11 | 80.1,JPC = 10.9 Hz | CH | + | H-10,H-14 |
| 13 | 64.8,JPC = 165.1 Hz | CH2 | + | / |
| 14 | 18.5 | CH3 | + | / |
| 16 | 87.8 | CH2 | + | / |
| 18 | 156.3 | C | / | H-16,H-20 |
| 20 | 78.0 | CH | + | / |
| 21,22 | 23.7 | CH3 | + | H-20 |
| 24 | 87.8 | CH2 | + | / |
| 26 | 156.4 | C | / | H-24,H-28 |
| 28 | 78.1 | CH | + | / |
| 29,30 | 23.7 | CH3 | + | H-28 |
| 1',4' | 174.0 | C | / | H-2',H-3' |
| 2',3' | 137.6 | CH | + | / |

|
| 图 3 富马酸替诺福韦二吡呋酯的结构片段及HMBC相关信号 Fig. 3 Fragments structure and HMBC correlations of the tenofovir disoproxil fumarate |
在富马酸替诺福韦二吡呋酯供试品的31P NMR谱中,d 23.35按磷化学位移规律,应归属为该化合物结构中唯一的一个磷原子.
2.5 热分析差热分析(DSC)测试结果:114.61 ℃、117.64 ℃有吸热峰;热重分析(TGA)测试结果:150 ℃内无失重.
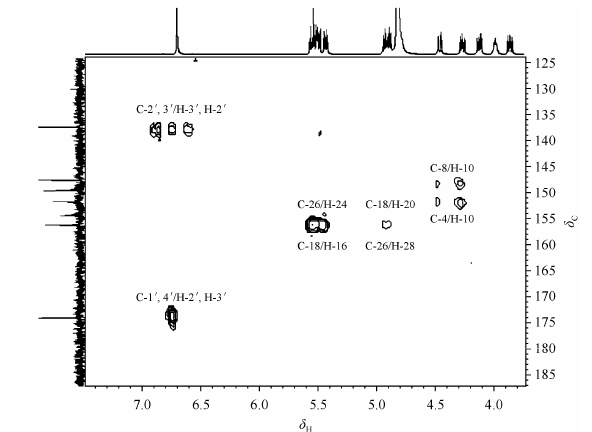
|
| 图 4 富马酸替诺福韦二吡呋酯的HMBC谱图 Fig. 4 HMBC spectrum of tenofovir disoproxil fumarate |
本文通过UV,IR,MS,1H NMR,13C NMR,31P NMR,DEPT,COSY,HSQC和HMBC谱的测定和解析,对富马酸替诺福韦二吡呋酯的结构进行了全面分析与验证,通过ESIMS、HRMS确定了富马酸替诺福韦二吡呋酯的分子式,结合红外光谱给出各基团的特征吸收,1H NMR,13C NMR,31P NMR,DEPT,COSY,HSQC和HMBC谱的测定和解析确证了化合物的氢信号归属,同时对碳信号进行了全归属,补充了相关数据,并根据以上综合确证了富马酸替诺福韦二吡呋酯的化学结构.同时对该化合物进行了热分析,为化合物提供更完备的信息.
| [1] | Michailidis E, Kirby Ka, Hachiya A, et al. Antiviral therapies: focus on hepatitis Breverse transcriptase[J]. Int J BiochemCell B, 2012, 44(7): 1 060-1 071. |
| [2] | Yan Nan (严楠), Lin Chun-hua(林春花), Liao Wei-lin(廖维林), et al. Synthesis of tenofovir disoproxil fumarate(富马酸替诺福韦二吡呋酯的合成)[J]. Fine Chemicals(精细化工), 2014, 31(8): 983-987. |
| [3] | Gong Xu(宫旭), Imene Adouani, Hang Tai-jun(杭太俊), et al. Pharmacokinetics and bioequivalence of tenofovir disoproxil fumarate tablets in healthy Chinese volunteers(富马酸替诺福韦二吡呋酯片在健康国热体内的药动学及生物等效性研究)[J]. Chinese Journal of New Drugs(中国新药杂志), 2013, 22(6): 686-690. |
| [4] | Jiang Li-yuan(姜莉苑), Ding Li(丁黎), Zhong Shui-sheng(钟水生), et al. Pharmacokinetics of tenofovir disoproxil fumarate capsule in Chinese volunteers (富马酸替诺福韦二吡呋酯胶囊在中国人体内的药代动力学)[J]. Journal ofChina Pharmaceutical University(中国药科大学学报), 2013, 44(4): 348-351. |
| [5] | Zhou Hai-yun(周海云), Chen Xiao-hong(陈晓红), Li Wei(李玮), et al. Mass analysis of tenofovir disoproxil fumarate and determination of fumarate combination ratio by NMR(富马酸替诺福韦二吡呋酯的质谱分析及NMR测定富马酸相对含量)[J]. Chinese Journal Pharmaceutical Analysis(药物分析杂志), 2012, 32(12): 2 180-2 183. |
| [6] | Wu Chun-li(吴春丽), Li Jie-ming(李杰明), Wei Hui-jie(魏会杰), et al. Spectral analysis and structural elucidation of atorvastatin lactone(阿托伐他汀内酯的波谱学数据与结构确证)[J]. Chinese J Magn Reson(波谱学杂志), 2014, 31(2):268-277. |
| [7] | Yuan Yun-fei(袁云飞), Hong Hai(洪海), Yang Xiao-yun(杨晓云), et al. Spectroscopic data of fluacrypyrim and interpretations(嘧螨酯波谱学数据全归属)[J]. Chinese J Magn Reson(波谱学杂志), 2013, 30(4): 567-575. |
| [8] | Song Ai-hua(宋爱华), Sha Yi(沙沂), Xu Xiao-xue(徐晓雪), et al. Differentiating Bupleurum bicaule from Bupleurum chinense using 1H NMR spectroscopy(基于1H NMR 技术的锥叶柴胡与北柴胡鉴别研究)[J]. Chinese J Magn Reson(波谱学杂志), 2014, 31(2): 214-221. |
 2015, Vol. 32
2015, Vol. 32




