文章信息
- 宋艳红, 刘文卿, 姚叶锋
- SONG Yan-hong, LIU Wen-qing, YAO Ye-feng
- 仲氢诱导极化增强的核磁共振实验条件优化
- Gaining Higher NMR Signal Enhancement with Parahydrogen-Induced Polarization
- 波谱学杂志, 2015, 32(3): 470-480
- Chinese Journal of Magnetic Resonance, 2015, 32(3): 470-480
- http://dx.doi.org/10.11938/cjmr20150308
-
文章历史
- 收稿日期: 2014-10-31
- 收修改稿日期: 2015-07-22
氢气有两种不同的核自旋态,即正氢和仲氢[1].仲氢对应于单线态,自旋量子数I= 0;正氢对应于三线态,自旋量子数I = 1.常温常压下,普通氢气中仲氢与正氢的组成之比约为1∶3[2] .仲氢与正氢之间可以相互转化,普通氢气在液氮中冷却至77 K,选用活性炭或者氧化铁催化,就可以得到50%仲氢富集的氢气[3].仲氢诱导极化(Parahydrogen Induced Polarization,PHIP)技术是一种基于化学反应的核磁共振超极化 技术[4, 5],其原理是将仲氢加成到不饱和化合物上来得到核磁共振(NMR)信号增强,在具体实验中分为PASADENA (Parahydrogen and Synthesis Allow Dramatically Enhanced Nuclear Alignment)[6, 7]和ALTADENA (Adiabatic Longitudinal Transport After Dissociation Engenders Nuclear Alignment)[8]两种方法.ALTADENA实验中加氢反应是在地磁场下进行,而PASADENA实验是在核磁共振仪器磁体腔内进行,场强高低的不同会导致NMR信号上的差异.这两种方法各有优点:ALTADENA实验设置简单,同时可以比较容易实现1H到其他核自旋(如13C,15N,31P等)的极化传递[9];PASADENA实验则可以实现氢气加成反应的原位检测,在一定时间内获得较为稳定的PHIP信号.文献中已有很多PHIP技术在各领域应用的报道:PHIP技术可以检测反应中含量极少的催化剂的中间体,研究催化机理[10, 11, 12, 13];可以通过极化转移实现13C、15N等稀核的信号增强[14, 15],研究代谢反应和生物过程;可以发展新的造影剂,提高磁共振成像检测的速度与灵敏度[16, 17, 18, 19].此外,文献中还有关于低场[20]、超低场以及零场[21, 22]下将PHIP技术应用于痕量分析、化学指纹以及反应监控等方面的报道[23].
理论上PHIP技术可以实现NMR信号最大增强达105,但在实际实验中PHIP技术对NMR信号的增强倍数要低于这个数值.通常1H信号的增强倍数为几千倍,13C信号的增强倍数为几万倍[24].如何优化PHIP实验条件获得更高的信号增强倍数一直是PHIP研究领域的研究热点.本文中我们在实验中实现了PASADENA/ALTADENA实验,获得了PHIP信号增强,并通过PASADENA方法研究了反应温度、反应压力以及氢气通入方式对PHIP信号增强倍数的影响.这些实验为PHIP技术的应用研究提供了一定的实验基础.
1 实验部分 1.1 仪器及试剂 1.1.1 仲氢富集氢气(上海浦江特种气体有限公司,99.999%)通过液氮温度下的催化剂FeO (OH)(Sigma,30~50目)富集仲氢.利用仲氢本身无NMR信号的性质,对比仲氢富集前后在溶剂中的1H NMR信号强度确定本实验中仲氢含量为44%.
1.1.2 仪器Bruker Avance III 300型NMR谱仪,10 mm液体BBO探头.1H NMR工作频率为300.15 MHz,90°脉宽为10 μs,采样时间为0.6 s,谱宽为6 009 Hz.文中NMR实验使用Bruker Avance III 500型NMR谱仪,5 mm液体BBO探头.1H NMR工作频率为500.15 MHz,90°脉宽为9.6 μs,采样时间为2 s,谱宽为8 223 Hz.
1.1.3 试剂己炔(Sigma,AR)、催化剂[Rh(COD) (dppb)] BF4 (Sigma,AR)、氘代丙酮(CIL,99.9%氘代)、己烯(Sigma,AR).
1.2 PHIP实验 1.2.1 样品准备在手套箱内将50.0 mg己炔、5.0 mg催化剂溶于装有3.0 mL氘代丙酮的NMR样品管(Wilmad,10 mm)中,密封后取出.在PASADENA实验中,我们将玻璃管固定在NMR样品管的螺纹帽上,下端连接聚丙烯中空纤维膜(杭州昊天膜科技有限公司,内径320 μm ~350 μm,微孔尺寸0.02 μm~0.2 μm),上端连接通入仲氢的PU管.改装后的样品管如图 1.

|
| 图 1 PHIP实验所用NMR样品管 Fig. 1 The photo of the NMR tube for PHIP experiments |
ALTADENA实验:338 K水浴加热样品管,控制氢气压力为0.3 MPa,在地磁场下通过注射器向样品管中注入富集的氢气后加氢反应进行,迅速将样品管放入NMR谱仪腔体内进行采样.1H NMR信号使用单脉冲90°激发[25].
PASADENA实验:将一端连接氢气瓶的样品管放入NMR谱仪腔体内,在NMR实验过程中,NMR样品管内保持一定的仲氢气体压强.1H NMR信号使用单脉冲45°激发[25].
参考图谱:在ALTADENA/PASADENA实验采样结束后,将样品放入冰水中,待淬灭反应并消除PHIP信号后,将样品转移到NMR谱仪内进行采样.1H NMR信号使用单脉冲90°激发.
ALTADENA与PASADENA实验过程如图 2所示.
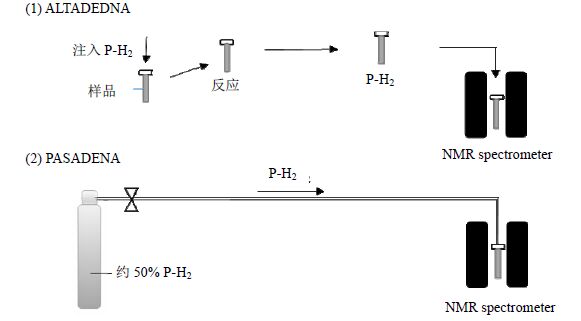
|
| 图 2 PHIP实验过程示意图. (1) ALTADENA;(2) PASADENA Fig. 2 Schematic diagram of (1) the ALTADENA experiment and (2) the PASADENA experiment |
取100 μL己炔和己烯分别溶于0.5 mL的氘代丙酮中.单脉冲90°激发进行1H NMR信号采集,如图 3.己炔与己烯的信号归属如表 1[26, 27].

|
| 图 3 己炔与己烯在氘代丙酮中的1H NMR谱. (a) 己炔;(b) 己烯 Fig. 3 1H NMR spectra of: (a) 1-hexyne; (b) 1-hexene,in δ6-acetone acquired at room temperature |
| Position | 己炔δH | 己烯δH |
| 1 | 0.90(t,7.29 Hz) | 0.89(t,7.23 Hz) |
| 2 | 1.39~1.44(m) | 1.29~1.38(m) |
| 3 | 1.45~1.50(m) | 1.29~1.38(m) |
| 4 | 2.15~2.17(m) | 2.02~2.05(m) |
| 5 | 2.27(t,2.67 Hz) | 5.77~5.83(m) |
| 6 | 4.89~4.91(m) | |
| 7 | 4.96~4.99(m) |
在己炔的氢化反应中,生成的己烯在δ 4.5~6.0处有双键上的1H NMR信号且这些信号不与己炔、催化剂等的质子信号重叠.我们利用此处信号来计算PHIP实验信号增强倍数.(1)式给出了计算PHIP实验信号增强倍数(SE)的表达式:

对于AX型自旋系统,普通自旋在αα,αβ,βα和ββ四个能级上遵循Boltzmann分布.仲氢作为氢气的一种自旋异构体,转移到AX型自旋系统时所占据的能级与此不同[25].在PASADENA实验中仲氢只占据中间的αβ和βα两个能级,所以PASADENA实验获得的谱图中仲氢信号均为色散形的峰,如图 4(b).而ALTADEN实验中仲氢只占据αβ或βα其中一个能级,加成后双键上的两个仲氢信号为一个正峰,一个倒峰[25],如图 4(a).在ALTADENA实验中,因为在地磁场下进行加氢反应,自旋系统强偶合使得仲氢极化能够通过J偶合或者自旋扩散传递到其他核上,从而导致在δ 0.5~2处的高场信号呈现信号增强的倒峰,δ 4.88处呈现为增强的正峰.
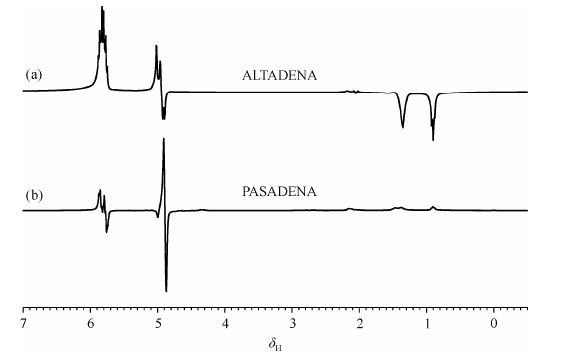
|
| 图 4 仲氢与己炔反应的1H NMR谱:(a) ALTADENA实验谱图;(b) PASADENA实验谱图.ALTADENA实验中通过单脉冲90°激发后采样,实验温度为338 K,氢气压力为0.3 MPa.PASADENA实验中通过单脉冲45°激发后采样,实验温度为343 K,仲氢压力为0.2 MPa.上述谱图均由单次采样获得 Fig. 4 1H NMR spectra of hyperpolarized 1-hexene from: (a) ALTADENA experiment,(b) PASADENA experiment. The ALTADENA 1H NMR spectrum was acquired at 338 K under a pressure of 0.3 MPa,using a single pulse of 90°. The PASADENA 1H NMR spectrum was acquired at 343 K under the pressure of 0.2 MPa,using a single pulse of 45°. All spectra were acquired by a single scan |
ALTADENA图谱如图 5所示,${A_{{\text{(P - }}{{\text{H}}_{\text{2}}}{\text{)}}}} = 290$,${B_{{\text{(reference)}}}} = 1$,注射3次氢气,估算${\alpha _{{\text{(reference)}}}}$与${\alpha _{{\text{(p - }}{{\text{H}}_{\text{2}}}{\text{)}}}}$的比值为3,则ALTADENA方法NMR信号增强倍数约为870倍.

|
| 图 5 仲氢与己炔反应的1H NMR 图谱:(a) ALTADENA实验谱图;(b) 参考图谱.ALTADENA实验中通过单脉冲90°激发后采样,实验温度为338 K,氢气压力为0.3 MPa.参考图谱由ALTADENA实验采样结束后,单脉冲90°激发后采样.上述图谱均为单次采样 Fig. 5 (a) 1H NMR spectrum of hyperpolarized 1-hexene from the ALTADENA experiment. (b) The reference 1H NMR spectrum. The ALTADENA 1H NMR spectrum was acquired at 338 K under a pressure of 0.3 MPa,using a single pulse of 90°. The reference spectrum was acquired after the ALTADENA experiment,using a single pulse of 90°. All spectra were acquired by a single scan |
PASADENA方法中仲氢与己炔反应的实验图谱如图 6,通入仲氢压力为0.2 MPa,反应温度为343 K.${A_{{\text{(P - }}{{\text{H}}_{\text{2}}}{\text{)}}}} = 1.5118$,${B_{{\text{(reference)}}}} = 1$,$n{s_{{\text{(reference)}}}} = 204$,$n{s_{{\text{(P - }}{{\text{H}}_{\text{2}}}{\text{)}}}} = 1$,总反应时间约为20 min,PHIP信号的采样间隔为30 s,若反应速率的不变,${\alpha _{{\text{(reference)}}}}$与${\alpha _{{\text{(p - }}{{\text{H}}_{\text{2}}}{\text{)}}}}$的比值约为40,则PASADENA实验NMR信号增强倍数约为864倍.考虑到反应过程中反应速率的降低,实际信号增强倍数要低于这个数值.

|
| 图 6 仲氢与己炔反应的1H NMR图谱:(a) PASADENA实验图谱,单次采样;(b) 参考图谱,累加204次.PASADENA实验中通过单脉冲45°激发后采样,实验温度为343 K,氢气压力为0.2 MPa.参考图谱由ALTADENA实验采样结束后,单脉冲90°激发后采样 Fig. 6 (a) 1H NMR spectra of hyperpolarized 1-hexene from PASADENA experiment by a single scan. (b) The reference 1H NMR spectrum by 204 scans. The PASADENA 1H NMR spectrum was acquired at 343 K under a pressure of 0.2 MPa,using a single pulse of 45°. The reference spectrum was acquired after the ALTADENA experiment,using a single pulse of 90° |
单位时间内加氢反应转化率越高,加成到己炔上仲氢越多,那么单次采样检测到的PHIP信号越强.下面我们将利用PASADENA实验能够长时间采集信号的优势,主要从以下3个方面来提高转化率:一是增大氢气与底物的接触;二是提高反应温度;三是增大反应压强.
2.2.1 优化氢气通入方式文献中PASADENA实验有两种不同的实验方法,一种是将样品在通入氢气后冷冻,放入预热的NMR探头内,样品溶化后检测NMR信号[10];另一种是用一根玻璃管直接将氢气通入NMR样品管内鼓泡的方法[3].采用鼓泡的方法,气泡的产生会降低谱图中信号的分辨率.为了避免气泡的影响,Roth提出用中空纤维膜导入氢气[28].但中空纤维膜的材质、孔径都会对PHIP信号产生影响.在本工作中我们选取了杭州昊天膜科技有限公司生产的聚丙烯中空纤维膜(内径320 μm~350 μm,微孔尺寸0.02 μm~0.2 μm),实验中获得了较强的PHIP信号增强[图 7(a)].通过比较发现,我们实验信号增强倍数(864)要低于文献报道值(2 000).我们认为此PHIP信号低于预期的原因可能来源于所选取的中空纤维膜外壁孔径较小,导致单位时间内溶于反应体系的氢气量较低.为了增加单位时间内溶入反应体系的氢气量,我们尝试将中空纤维膜剪断以增加氢气流量.图 7(b)给出了通过这一方式所获得的PHIP谱图.实验过程中,控制反应温度为55 ℃,氢气压力为0.15 MPa且使用相同数目的中空纤维膜(7根).对比图 7(a)和7(b),我们发现通过第二种方式所获得的谱图中PHIP信号更强,这验证了我们的上述猜测.所以,增加单位时间内溶入反应体系的氢气量有助于提高PASADENA实验过程中 PHIP信号的强度.
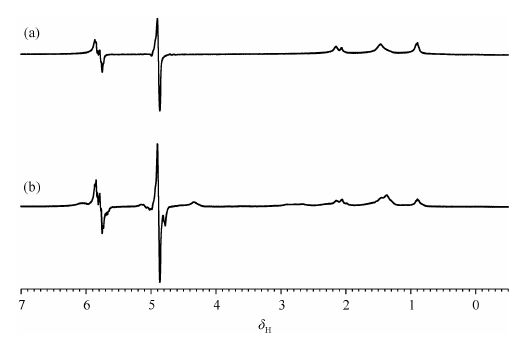
|
| 图 7 仲氢与己炔反应的1H NMR图谱:(a) 使用完整中空纤维膜导入氢气的PASADENA实验图谱;(b) 使用末端剪断的中空纤维膜导入氢气的PASADENA图谱.上述图谱均由PASADENA实验中通过单脉冲45°激发后单次采样获得,实验温度为328 K,仲氢压力为0.15 MPa Fig. 7 PASADENA 1H NMR spectra of parahydrogenation of 1-hexyne using: (a) normal hollow fiber membrance; (b) cuted hollow fiber membrance. These PASADENA 1H NMR spectra were acquired by a single scan at 328 K under a pressure of 0.15 MPa,using a single pulse of 45° |
我们在实验过程中发现通过剪断的中空纤维膜通入氢气会导致反应液中出现内密集的小气泡.这一现象的出现会导致样品匀场变差,谱图中信号分辨率降低.同时,我们也发现过多的使用中空纤维膜会降低谱图分辨率.另外值得注意的是,对于样品管内有限的反应底物来说,反应效率的提高将会导致实验中PHIP信号观测时间的缩短.
2.2.2 优化反应温度在这一部分我们主要研究反应温度对PHIP信号的影响.图 8是改变反应温度得到的一系列图谱.实验过程中,控制PASADENA实验中通入氢气的压力为0.3 MPa.从图中可以看出,293 K时PHIP信号微弱,这可能是因为催化剂在此温度下催化效率较低.温度上升至313 K时,出现明显PHIP信号.之后随着温度的进一步升高,PHIP信号继续增强并在333 K时达到最强.而在343 K时PHIP信号稍有减弱,这可能是因为随着反应进行催化剂效率降低或者底物浓度降低引起的.

|
| 图 8 仲氢与己炔反应的1H NMR图谱,实验温度范围为293 K~343 K.所有谱图均由PASADENA实验中通过单脉冲45°激发后单次采样获得,仲氢压力为0.15 MPa Fig. 8 The temperature dependent PASADENA 1H NMR spectra of 1-hexene over the temperature range of 293 K~343 K. These PASADENA 1H NMR spectra were acquired by a single scan under a pressure of 0.15 MPa,using a single pulse of 45° |
理论上,实验过程中升高温度,谱峰线宽会随着分子运动加快而变窄,而在我们实验中并没有观察到明显的谱峰线宽变窄现象.这可能是由于样品管内仲氢的通入以及反应的进行对磁场均匀性造成的影响.高场处己炔谱峰的线宽也表现出类似的行为,在温度升高后没有发生明显的谱峰线宽变窄现象.我们还须指出的是,PHIP实验变温时必须考虑反应体系的沸点,温度过高将引起反应液在NMR样品管内沸腾,影响信号分辨率.
2.2.3 优化反应压力图 9是在PASADENA实验中改变反应压力得到的一组图谱,考虑到体系密封性我们将最高压力设为0.35 MPa.实验过程中控制反应温度为65 ℃.从图中可以看出,通入0.15 MPa仲氢富集的氢气时,出现明显的PHIP信号.之后随着压力进一步增大,PHIP信号明显增强并在0.35 MPa时达到最强.我们认为,加压可以促进加氢反应的进行,提高单位时间内的反应转化率,所以PHIP实验中能够采集到更强的PHIP信号.

|
| 图 9 左图为仲氢与己炔反应的1H NMR图谱,右图为PHIP信号增强倍数随氢气压力的变化图.实验压力范围为0.15 MPa~0.35 MPa.所有谱图均由PASADENA实验中通过单脉冲45°激发后单次采样获得,实验温度为338 K Fig. 9 Left: PASADENA 1H NMR spectra of 1-hexene at different H2 pressures,ranging from 0.15 MPa to 0.35 MPa. Right: The values of 1H NMR signal enhancement ratio plotted agains the reaction pressures. These PASADENA 1H NMR spectra were acquired by a single scan at 338 K,using a pulse of 45° |
图 9可以看出随着压力增大,谱线宽度略有增加,这可能是因为加压后氢气扩散速率和反应速率的加快引起了溶液扰动.值得注意的是,加压的同时要考虑NMR样品管以及整个反应体系的密封性.
3 结论从上述实验和讨论可以看出,实验条件对PHIP实验具有明显的影响.通过中空纤维膜导入氢气,可以提高PHIP实验中信号增强倍数,但使用多束中空纤维膜也可能会导致信号分辨率下降;提高反应温度也可以明显提高PHIP实验的信号增强倍数,同时要考虑加压后反应液的沸点,如本实验中应用的最高温度为70 ℃(丙酮溶液的沸点为55.5 ℃,但在外压作用下沸点有所增加);增加反应压力,可以明显提高PHIP实验的信号增强倍数,但增加压力必须考虑体系的密封性.上述一系列PHIP实验条件的优化工作为我们进一步研究PHIP的应用提供了一定的实验基础.
| [1] | Bonhoeffer K F, Harteck P. Experiments on para and ortho hydrogen[J]. Naturwissenschaften, 1929, 17(11): 182. |
| [2] | Bradshaw T W, Norris J O W. Observations on the use of a thermal conductivity cell to measure the para hydrogen concentration in a mixture of para and ortho hydrogen gas[J]. Rev Sci Instrum, 1987, 58(1): 83-85. |
| [3] | Jankowiak J T, Schwartz J M, Barrett P A. Advanced adsorbents for the separation of the ortho- and para-hydrogen spin isomers at cryogenic temperatures[J]. Adsorption, 2014, 20(1): 173-188. |
| [4] | Chen M J, Liao S H, Yang H C, et al. Nuclear magnetic resonance and imaging of hyperpolarized 3He using high-Tc superconducting quantum interference device in microtesla magnetic fields[J]. Chinese J Magn Reson, 2010, 27(3): 386-394 |
| [5] | Li Hai-dong(李海东), Zhang Zhi-ying(张智颖), Han Ye-qing(韩叶清), et al. Lung MRI using hyperpolarized gases(超极化气体肺部磁共振成像)[J]. Chinese J Magn Reson(波谱学杂志), 2014, 31(3): 307-320. |
| [6] | Bowers C R, Weitekamp D P. Parahydrogen and synthesis allow dramatically enhanced nuclear alignment[J]. J Am Chem Soc, 1987, 109(18): 5541-5542. |
| [7] | Eisenschmid T C, kirss R U, Deutsch P P, et al. Para hydrogen induced polarization in hydrogenation reactions[J]. J Am Chem Soc, 1987, 109(26): 8089-8091. |
| [8] | Pravica M G, Weitekamp D P. Net NMR alignment by adiabatic transport of parahydrogen addition products to high magnetic field[J]. Chem Phys Lett, 1988, 145(4): 255-258. |
| [9] | Adams R W, Duckett S B, Green R A, et al. A theoretical basis for spontaneous polarization transfer in non-hydrogenative parahydrogen-induced polarization[J]. J Chem Phys, 2009, 131(19): 186. |
| [10] | Duckett S B, Newell C L, Eisenberg R. Observation of new intermediates in hydrogenation catalyzed by wilkinson's catalyst, RhCl(PPh3)3, using parahydrogen-induced polarization[J]. J Am Chem Soc, 1994, 116(23): 10548-10556. |
| [11] | Blazina D, Duckett S B, Dyson P J, et al. Catalytic hydrogenation by triruthenium clusters: A mechanistic study with parahydrogen-induced polarization[J]. Chem-Eur J, 2003, 9(5): 1045-1061. |
| [12] | Colebrooke S A, Duckett S B, Lohman J A B, et al. Hydrogenation studies involving halobis(phosphine)-rhodium(I) dimers: Use of parahydrogen induced polarisation to detect species present at low concentration[J]. Chem-Eur J, 2004, 10(10): 2459-2474. |
| [13] | Godard C, Duckett S B, Henry C, et al. New perspectives in hydroformylation: A para-hydrogen study[J]. Chem Commun, 2004, 16: 1826-1827. |
| [14] | Kuhn L T, Bargon J. Transfer of Parahydrogen-Induced Hyperpolarization to Heteronuclei[M]. Berlin: Springer-Verlag Berlin, 2007. |
| [15] | Shchepin R V, Coffey A M, Waddell K W, et al. Parahydrogen induced polarization of 1-13C-phospholactate-d2 for biomedical imaging with >30000000-fold NMR signal enhancement in water[J]. Anal Chem, 2014, 86(12): 5601-5605 |
| [16] | Dechent J F, Buljubasich L, Laura M S, et al. Proton magnetic resonance imaging with para-hydrogen induced polarization[J]. Phys Chem Chem Phys, 2012, 14(7): 2346-2352. |
| [17] | Goldman M, Jóhannesson H, Axelsson O, et al. Hyperpolarization of 13C through order transfer from parahydrogen: A new contrast agent for MRI[J]. Magn Reson Imaging, 2005, 23(2): 153-157. |
| [18] | Goldman M, Jóhannesson H, Axelsson O, et al. Design and implementation of 13C hyper polarization from para-hydrogen, for new MRI contrast agents[J]. Comptes Rendus Chimie, 2006, 9(3, 4): 357-363. |
| [19] | Bhattacharya P, Chekmenev E Y, Perman W H, et al. Towards hyperpolarized 13C-succinate imaging of brain cancer[J]. J Magn Reson, 2007, 186(1): 150-155. |
| [20] | Gong Q X, Gordji-Nejad A, Blümich B, et al. Trace analysis by low-field NMR: Breaking the sensitivity limit[J]. Anal Chem, 2010, 82(17): 7078-7082. |
| [21] | Theis T, Ganssle P, Kervern G, et al. Parahydrogen-enhanced zero-field nuclear magnetic resonance[J]. Nat Phys, 2011, 7(7): 571-575. |
| [22] | Butler M C, Kervern G, Theis T, et al. Parahydrogen-induced polarization at zero magnetic field[J]. J Chem Phys, 2013, 138(23): 21. |
| [23] | Glöggler S, Colell J, Appelt S. Para-hydrogen perspectives in hyperpolarized NMR[J]. J Magn Reson, 2013, 235: 130-142. |
| [24] | Barkemeyer J, Haake M, Bargon J. Hetero-NMR enhancement via parahydrogen labeling[J]. J Am Chem Soc, 1995, 117(10): 2927-2928. |
| [25] | Natterer J, Bargon J. Parahydrogen induced polarization[J]. Prog Nucl Mag Res Sp, 1997, 31(4): 293-315. |
| [26] | Larsen C R, Erdogan G, Grotjahn D B. General catalyst control of the monoisomerization of 1-alkenes to trans-2-alkenes[J]. J Am Chem Soc, 2014, 136(4): 1226-1229. |
| [27] | Schwieger S, Herzog R, Wagner C, et al. Platina-β-diketones as catalysts for hydrosilylation and their reactivity towards hydrosilanes[J]. J Organomet Chem, 2009, 694(22): 3548-3558. |
| [28] | Roth M, Kindervater P, Raich H, et al. Continuous 1H and 13C signal enhancement in NMR spectroscopy and MRI using parahydrogen and hollow-fiber membranes[J]. Angew Chem Int Ed, 2010, 49(45): 8358-8362. |
 2015, Vol. 32
2015, Vol. 32




