文章信息
- 黄 微,曹子玉
- HUANG Wei, CAO Zi-yu
- STZ诱导大鼠1型糖尿病进行性脑萎缩的磁共振成像及组织化学研究
- STZ-Induced Progressive Brain Atrophy Studied by Magnetic Resonance Imaging and Histochemical Staining
- 波谱学杂志, 2015, 32(3): 439-449
- Chinese Journal of Magnetic Resonance, 2015, 32(3): 439-449
- http://dx.doi.org/10.11938/cjmr20150305
-
文章历史
- 收稿日期:2014-05-26
- 收修改稿日期:2015-07-29
2. 中国科学院大学,北京 100049
2. University of Chinese Academy of Sciences, Beijing 100049, China
糖尿病是一种因体内胰岛素绝对或者相对不足所导致的一系列临床综合症.随着生活水平的提高、生活行为方式的改变以及社会老龄化程度的提高,糖尿病的患病率正在呈快速上升的趋势,成为继心血管疾病和肿瘤之后的另一个严重危害人类健康的重要慢性非传染性疾病.世界卫生组织2010年的报告指出全世界有3.46亿人患有糖尿病,估计有340万人死于高血糖引起的并发症,超过80%的糖尿病死亡发生在低收入和中等收入国家[1].糖尿病一般分为4种类型:1型糖尿病、2型糖尿病、妊娠期糖尿病和其他类型糖尿病.虽然每种类型的糖尿病的症状都是相似甚至相同的,但是导致疾病的原因和它们在不同人群中的分布却不同.T1DM是一种由胰岛素分泌不足而引起代谢紊乱的慢性疾病,主要引起肾、眼睛、神经系统的综合症[2],通常在临床上以儿童及青少年患者最为常见.
自从Nielsen于1965年提出糖尿病脑病的概念[3]用于描述由T1DM所诱发的中枢神经系统的病理变化以后,关于糖尿病脑病的研究就一直没有停止过.早期的研究工作主要集中在分子、细胞以及生化的层面,对T1DM所引起的神经系统病变进行了大量详细的记录和分析.多项研究均表明:长期暴露于高血糖的环境中会造成神经元胞体中的线粒体功能出现异常并导致氧化应激,进而引起相关脑区的神经元出现大量非正常情况的凋亡[4, 5, 6].关于T1DM动物模型的研究,发现高血糖浓度会引起发育中的大脑出现神经元脱髓鞘现象[7].而另一些研究,则发现在T1DM患者[8, 9]和动物模型[10, 11, 12, 13]中均存在着神经元的凋亡,并认为兴奋性毒性和细胞程序性死亡可能是造成这种现象的原因[14, 15, 16].还有研究发现糖尿病模型大鼠血浆中不饱和脂肪酸的含量显著上升[17].近年来,伴随着核磁共振技术的不断进步,MRI作为一种无损 的、多功能性的检测手段,在糖尿病脑病的临床诊断和研究中被广泛的应用,越来越多的文章采用了MRI的方法来观察糖尿病脑病在大脑解剖结构,微观病理改变以及代谢异常方面的信息[18].在Tiehuis的研究中,对血糖浓度和糖尿病病龄进行了定量的统计和分析,发现更高的血糖浓度和更长的糖尿病病龄对应更为严重的脑萎缩程度[19].在Ferguson等人[20]的研究中发现,儿童期(平均年龄5岁)的T1DM会造成显著的智力下降和轻度的脑萎缩.而在Pell等人的研究中,对年青的T1DM患者(平均年龄20岁)的观察发现,在岛叶、豆状核、中央前回、中央后回、海马、丘脑、颞叶、扣带和壳核等多个脑区,均存在脑萎缩和T2值的下降,并认为这些脑结构的改变可能是由于T1DM对大脑发育造成影响,导致在青少年晚期和成年早期出现了异常[21].另外在Brands等人[22]的研究中,发现年龄较大的T1DM患者(年龄>50岁)并没有表现出显著性的脑萎缩,但却表现出轻微的认知功能障碍.
T1DM对大脑的影响是广泛的,前人的工作涵盖了分子、细胞、生化以及影像、临床心理学和行为学等多个层面的探讨和分析,对T1DM所引起的脑功能和结构的改变进行了详细的研究.基于前人的研究成果,我们将MRI和组织化学染色的方法结合起来分析STZ诱导的T1DM大鼠模型的脑萎缩情况,并纵向的从发病时间的角度观察糖尿病引起的脑萎缩随着病程延长所发生的改变.而临床上关于糖尿病患者进行性脑萎缩的研究非常少见,这对于控制糖尿病脑萎缩的进一步发展具有重要意义,因此我们的研究结果对于进一步的临床研究和糖尿病脑萎缩的控制具有一定的指导作用.
1 实验部分 1.1 动物模型的建立和筛选实验全部采用雄性SD大鼠(购买于武汉中南医院动物实验中心),年龄约8周龄,体重在300~350 g范围内.在实验开始前均在SPF级动物房(温度为24±2 ℃,相对湿度50±5%,光照条件为12 h光照/12 h黑暗)饲养一周,以适应实验环境,期间给予啮齿动物饮食.关于大鼠的所有实验操作均符合中国实验动物使用伦理委员会的要求.
25只大鼠分为2组,分别是注射生理盐水的正常对照组10只和注射STZ的糖尿病模型组15只.在注射前一天对所有大鼠空腹处理(禁食14~16 h),注射前测量体重和血糖并作记录,对正常对照组大鼠进行一次性腹腔注射0.9% NaCl溶液(剂量:0.55 mL/只),糖尿病模型组则根据体重一次性腹腔注射链脲佐菌素溶液(剂量:62 mg/kg,溶液浓度为30 mg/mL).腹腔注射后3天测量空腹体重和血糖,模型组大鼠以空腹血糖浓度大于13 mmol/L判定为初步造模成功,空腹血糖浓度低于13 mmol/L的2只大鼠被剔除掉,之后分别于第2周、4周、8周和12周监测所有大鼠的空腹血糖和体重.到第12周通过剔除血糖回落(空腹血糖浓度低于13 mmol/L)的1只大鼠和感染死亡的2只大鼠,模型组和对照组大鼠分别剩下10只用于MRI,成像数据采集完成后分别取5只对照组大鼠和2只模型组大鼠用于组织化学染色实验.之后继续于第16周和20周检测所有大鼠的空腹血糖和体重,到第20周通过剔除感染死亡的 1只大鼠,模型组剩下7只而对照组剩下5只大鼠分别用于MRI,成像数据采集完成后,分别取对照组大鼠和模型组大鼠各3只用于组织化学染色实验.
1.2 MRIMRI在配备有直径为20 cm的梯度线圈的瑞士Bruker公司生产的Biospec 7 T/20 cm动物成像仪上完成.用体线圈作为发射线圈,以及单通道表面线圈作为信号接收线圈.成像使用RARE序列获得高分辨的解剖结构像,参数设置如下:视野大小为3.5 cm×3.5 cm,采集矩阵为512×384,片厚为0.58 mm,片数为54,TR = 5 800 ms,T2eff = 40 ms,RARE因子为4.
数据处理步骤如下:1) 使用MatLAB程序将原始IMG图像进行裁剪,矩阵大小由512×384×54变为312×184×54,分辨率保持不变:0.68×0.91×5.8;2) 使用SPM工具箱中的segment工具,将裁剪后的IMG图像进行分割,得到了灰质、白质、脑脊液概率密度图像,并利用得到的结果将IMG图像进行“剥皮”;3) 使用SPM工具箱中的DARTEL工具,将上面得到的灰质、白质、脑脊液概率密度图像配准到标准空间,图像矩阵变为313×245×461,分辨率变为0.68×0.68×0.68;4) 对配准后的灰质、白质、脑脊液概率密度图像进行平滑,平滑尺度为原分辨率0.68×0.68×0.68的3倍左右,即2×2×2;5) 对上面平滑后得到的图像进行方差分析(ANOVA),得到年龄、疾病、年龄×疾病等因素的统计结果.
统计分析使用SPSS 18(已购买使用版权),数据结果以平均值±标准误差(mean ± SD)的形式表示,组间的统计差异用方差分析(ANOVA)检验来分析.当p < 0.05时,结果被认为具有显著性差异.所有的数据使用origin 8.5(已购买使用版权)作图.另外所有基于体素的形态学分析(voxel-based morphometry,VBM)的结果均做了全脑斜变量分析.
1.3 组织化学染色对用于组织化学染色的大鼠进行灌流,并断头取脑,将新鲜的脑组织置于4%多聚甲醛固定液中固定3天,然后将固定后的脑组织进行石蜡包埋和切片.根据MRI的结果选取相应脑区的切片,并分别进行尼氏染色和HE染色.
尼氏染色步骤如下:1) 组织切片脱蜡并复水;2) 放进甲苯胺蓝液中染色30 min;3) 蒸馏水水洗;4) 放进冰醋酸液进行分化;5) 蒸馏水水洗,并吹干;6) 二甲苯透明,中性树胶封片.
HE染色步骤如下:1) 组织切片脱蜡并复水;2) 蒸馏水水洗,放入苏木精溶液中染色数分钟;3) 放入酸水及氨水中进行分色,时间各数秒钟;4) 用流水冲洗1 h后放入蒸馏水中片刻;5) 放在70%和90%酒精中脱水各10 min;6) 放入酒精伊红染色液中染色2~3 min;7) 放入纯酒精脱水,二甲苯透明;8) 将已透明的切片滴上加拿大树胶,盖上盖玻片封固.待树胶略干后,贴上标笺,切片标本就可使用.
2 结果与讨论 2.1 空腹血糖和体重的监测如图 1所示,通过对所有大鼠的空腹血糖浓度和体重的持续监测,我们发现:从造模第3天开始,STZ模型组大鼠的体重出现持续性的下降,而正常对照组大鼠的体重则表现为持续的上升,两组大鼠的体重相比具有显著性的差异;同时从造模第3天开始,STZ模型组大鼠的血糖浓度均处于较高的水平(≥20 mmol/L),而正常对照组大鼠的血糖浓度在整个实验过程中均处于正常范围内(维持在5 mmol/L左右),两组大鼠的血糖浓度值相比具有显著性的差异.

|
| 图 1 STZ模型组(STZ)和正常对照组(Con)大鼠的体重(a)及空腹血糖浓度(b)对比,图中*表示:p<0.05 Fig. 1 Comparison of body weight (a) and fasting blood glucose level (b) between the control group (Con)and the STZ-treated group (STZ). *p<0.05,two-sample t-tests |
从这个结果中,我们可以明确的看到STZ模型组大鼠表现出典型的1型糖尿病特征:远远高于正常水平的血糖浓度(≥20 mmol/L),同时持续下降的体重也排除了2型糖尿病的可能性.这个结果表明:在整个实验周期中,腹腔注射STZ的建模结果是合格的,糖尿病模型组大鼠能够有效的模拟1型糖尿病的病理特征.
2.2 全脑体积、脑灰质和脑白质体积的变化如图 2所示,通过对大鼠的全脑体积、脑灰质体积和脑白质体积的统计和分析,我们发现:不论是在12周(w)还是20周的时候,相比于正常对照组,糖尿病模型组大鼠的全脑体积、脑灰质和脑白质体积均表现出显著性的下降.其中在12周的时候,糖尿病大鼠相比于对照组大鼠表现出的白质体积下降的程度较轻(p < 0.05).而不管是糖尿病模型组还是正常对照组,对比12周和20周两个时间点,全脑体积、脑灰质和脑白质体积都没有发生显著性的改变.
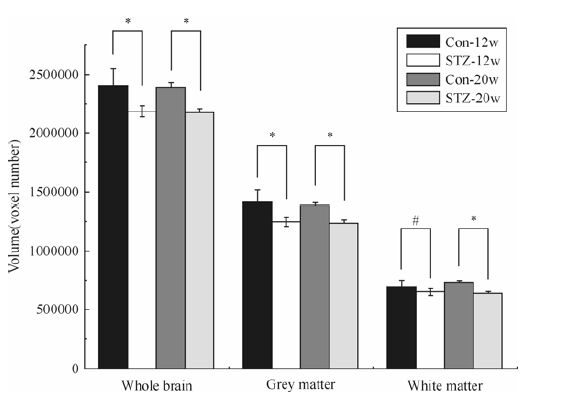
|
| 图 2 全脑体积、脑灰质和脑白质体积的变化,图中*表示p<0.005,#表示p<0.05 Fig. 2 Comparison of whole brain volume,grey matter volume and white matter volume between control group and STZ-treated group at 12th and 20th week,*p<0.005 and #p<0.05,two-sample t-tests |
在前人的研究中,曾报道过糖尿病患者相比于正常人出现了显著的全脑体积、脑灰质和脑白质体积的萎缩[23],而本实验的结果在大鼠上进一步验证了这一现象.同时,前人的研究成果也反过来证明了本实验中腹腔注射STZ建立糖尿病模型大鼠是成功的,STZ模型组大鼠不仅能有效的模拟1型糖尿病的生理生化指标,同时在MRI成像结果上与糖尿病患者也有着一定程度的相似性.
2.3 糖尿病萎缩脑区的分布如图 3所示,在体素水平上的T检验结果显示出STZ诱导的糖尿病模型组大鼠相比于正常对照组大鼠在全脑的多个脑区中均表现出显著性的萎缩.萎缩的脑区即包括白质脑区也包括灰质脑区.
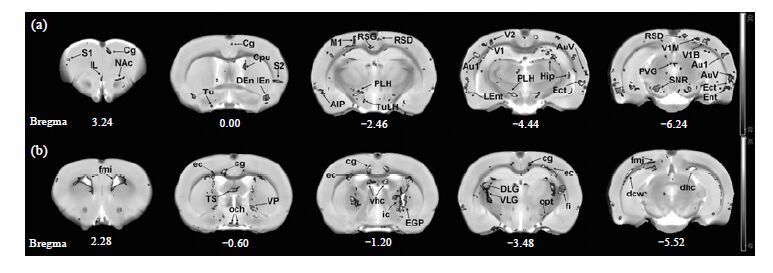
|
| 图 3 疾病因素对大脑不同脑区的影响.(a) 表示灰质萎缩脑区;(b) 表示白质萎缩脑区(p<0.005,未矫正,团簇尺寸为50) Fig. 3 Comparison between control group and STZ-treated group at various grey matter (a) and white matter (b) brain regions (p<0.005,uncorrected,cluster size=50). Grey matter regions include: primary motor cortex (M1),primary somatosensory cortex (S1),secondary somatosensory cortex (S2),infralimbic cortex (IL),cingulate cortex (Cg),nucleus accumbens (NAc),caudate putamen (striatum,CPu),endopiriform nucleus (En),olfactory tubercle (Tu),retrosplenial granular cortex (RSG),retrosplenial dysgranular cortex (RSD),peduncular part of lateral hypothalamus (PLH),tuberal region of lateral hypothalamus (TuLH),agranular insular cortex,posterior part (AIP),primary auditory cortex (Au1),secondary auditory cortex,ventral area (AuV),ectorhinal cortex (Ect),lateral entorhinal cortex (LEnt),hippocampus (Hip),secondary visual cortex (V2),primary visual cortex (V1),primary visual cortex,binocular area (V1B),primary visual cortex,monocular area (V1M),endohinal cortex (Ent),periventricular gray (PVG),substantia nigra,reticular part (SNR); White matter regions include: cingulum (cg),external capsule (ec),internal capsule (ic),fimbria of the hippocampus (fi),forceps minor of the corpus callosum (fmi),forceps major of the corpus callosum (fmj),dorsal lateral geniculate nucleus (DLG),optic chiasm (och),optic tract (opt),external globus p allidus (EGP),ventral hippocampal commissure (vhc),ventral pallidum (VP),ventral lateral geniculate nucleus (VLG),triangular septal nucleus (TS),deep cerebral white matter (dcw),dorsal hippocampal commissure (dhc) |
在前人的研究中,发现1型糖尿病患者相比于正常人群在双侧颞叶上回、左侧角回、左侧颞叶中间回、左侧额叶中间回和左侧丘脑多个脑区均表现出显著性的萎缩[24].相比于前人的结果,STZ模型组大鼠出现萎缩的脑区的数量更多,分布范围更广,在多个灰质脑区和白质脑区均出现了显著性的萎缩.分析产生这种差异的因素,一个可能的原因是本实验中STZ模型组大鼠的血糖浓度没有得到控制,一直维持在一个较高的水平(≥20 mmol/L).而临床上的糖尿病患者,一般会采用口服降糖药或注射胰岛素来维持血糖浓度在一个相对正常的范围内,因此STZ模型组大鼠表现出的脑萎缩更为严重.尽管存在着差异,在糖尿病患者脑萎缩的报道中比较常见的海马、运动皮层、体感皮层和丘脑等脑区,在STZ模型组大鼠中均表现出了显著性的萎缩.基于这一点,本实验中STZ模型组大鼠在MRI上的脑萎缩模式与临床上的糖尿病患者具有一定程度的可比性.
2.4 糖尿病萎缩脑区随病程的进行性改变如图 4所示,在体素水平上的双因素交叉分析结果表明,在多个灰质脑区和白质脑区均表现出显著的年龄和疾病的交叉效应,即伴随着糖尿病所出现的脑萎缩会随着病程的增加发生显著的改变.

|
| 图 4 疾病因素和年龄因素的交叉效应.(a) 表示灰质脑区;(b) 表示白质脑区(p<0.005,未矫正,团簇尺寸为50) Fig. 4 Voxel-wise two-way ANOVA of group×time interaction in multiple grey matter (a) and white matter (b) regions (p<0.005,uncorrected,cluster size=50). Grey matter regions include: infralimbic cortex (IL),ventral orbital cortex (VO),secondary motor cortex (M2),nucleus accumbens (NAc),primary somatosensory cortex barrel field (S1BF),primary somatosensory cortex hindlimb region (S1HL),retrosplenial cortex (RSG),caudate putamen (Cpu),hippocampus (Hip),dorsomedial periaqueductal gray (DMPAG) and ectorhinal cortex (Ect); White matter regions include: cingulum (cg),forceps minor of the corpus callosum (fmi),optic chiasm (och),olfactory tubercle (Tu),corpus callosum (cc),external capsule (ec),dorsal lateral geniculate nucleus (DLG),ventral lateral geniculate nucleus (VLG),ventral hippocampal commissure (vhc),stria terminalis (st),internal capsule (ic),fimbria (fi),optic tract (opt),dorsal hippocampal commissure (dhc) and deep cerebral white matter (dcw) |
从结果中,我们可以看到并不是所有在STZ模型组大鼠中出现萎缩的脑区都会随着病程的增加而出现萎缩程度的进一步加重,事实上只有一些特定的脑区才会表现出萎缩程度随病程延长而改变,而其它的脑区则对病程的增加表现得较为不敏感.这个结果表明:在动物模型上,对伴随着糖尿病所出现的脑萎缩进行干预是有必要的,以防止某些特定脑区的萎缩程度随着病程的增加而进一步加重.而这些特定脑区的萎缩程度加重会对其功能产生何种影响仍需进一步研究.将这些对病程较为敏感的特定脑区列举出来,并与前人的研究结果进行对比分析,我们发现了一些有意思的特点.在STZ模型组大鼠中,扣带(cg)、伏隔核(NAc)、初级感觉皮层(S1)和导水管周围灰质(PVG)均表现出随着病程增加而出现萎缩程度的显著加重,这几个脑区是典型的慢性痛相关脑回路中最常被报道的几个脑区[25].而这与临床上所熟知的慢性非控制糖尿病通常会导致慢性疼痛症状的情况恰好也是一致的.对比以上的相关研究,我们推测在STZ诱导的糖尿病大鼠中可能存在着慢性痛的现象,同时在整个病程中持续存在的慢性痛,可能是造成MRI上看到这种进行性萎缩的原因之一.另外,海马(Hip)、海马伞(fi)、海马腹侧联合(vhc)和海马背侧联合(dhc)这几个脑区也表现出进行性萎缩现象.研究表明:海马参与记忆的形成,海马受损会导致人和动物的短期记忆能力严重下降[26, 27].在临床上,长期慢性糖尿病会导致患者出现海马脑区的显著性萎缩以及认知能力的下降[28].结合前人的研究结果,海马脑区的进行性萎缩暗示了本实验中STZ诱导的糖尿病大鼠可能存在短期记忆力或认知能力的下降.
2.5 组织化学染色依据MRI的结果,在表现出显著的进行性萎缩的脑区中,我们选取了最为感兴趣的几个脑区分别进行尼氏染色和HE染色,结果如图 5所示:STZ诱导的1型糖尿病大鼠在运动皮层[图 5(a)]、体感皮层[图 5(b)]和海马CA3区[图 5(c)]中出现明显的神经元萎缩现象,而且这种神经元的萎缩现象在Nissl染色和HE染色中的结果是一致的;而对照组大鼠在相应脑区均没有出现大量明显的神经元萎缩现象.同时,在海马CA3区,STZ诱导的1型糖尿病大鼠的神经元数量明显少于对照组大鼠.
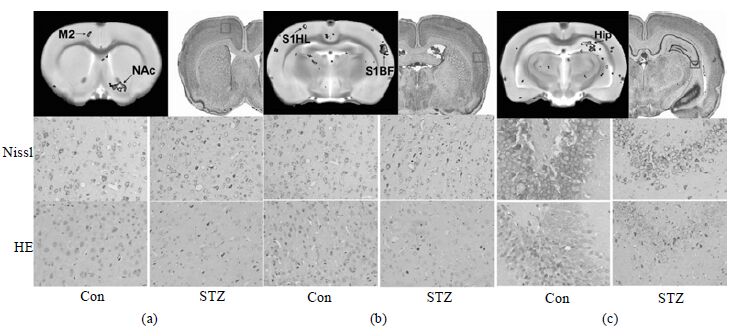
|
| 图 5 3个不同脑区的尼氏染色和HE染色结果.图中(a)为运动皮层,(b)为体感皮层,(c)为海马CA3区 Fig. 5 Result of Nissl and HE staining in somatosensory cortex (a),motor cortex (b) and CA3 region of hippocampus (c) |
尼氏染色和HE染色的结果,虽然不能作为典型的判断神经元凋亡的指标,但是可以反应出神经元中存在的一些功能异常和病理改变,在一定程度上提示神经元出现凋亡的可能性.我们在运动皮层、体感皮层和海马CA3区所看到的这种明显的神经元萎缩现象,表示STZ模型组大鼠在这些脑区中出现了神经元的功能异常和病理改变.这个结果和我们在MRI上看到的这些脑区所表现出的进行性萎缩现象是一致的.因此我们推测:在MRI上出现的进行性萎缩背后的生物学原因,可能是在这些脑区中出现了神经元的功能异常和病理改变.
3 结论我们采用腹腔定量注射链脲佐菌素的方法,成功的建立了1型糖尿病大鼠的动物模型,对体重和空腹血糖浓度长达5个月的监测结果显示出,模型组大鼠能有效的模拟临床上人类1型糖尿病的基本体征和生理生化指标.然后运用MRI的方法对糖尿病模型大鼠的脑萎缩分布情况进行仔细的定位,相比于临床上通常采用的手动绘制感兴趣区域(region of interest,ROI)对单个脑区进行一一定位和分析,基于体素的形态学分析(VBM)结果显示出更为广泛的脑萎缩分布区域,而对比在糖尿病中比较常见的萎缩脑区,模型组大鼠与临床上的糖尿病患者有较好的相似性,因此从MRI影像的角度建立了可比性.在此基础上,采用双因素交叉分析的方法对糖尿病大鼠随病程的增加所出现的改变进行分析,发现一些特定的脑区会随着病程的延长出现萎缩程度的进一步加重.最后我们选取了3个感兴趣脑区进行尼氏染色和HE染色,发现在这3个脑区中存在明显的神经元萎缩现象,提示神经元的功能异常和病理改变可能是导致MRI上出现进行性萎缩现象背后的生物学原因.
| [1] | Alberti K, Zimmet P, Shaw J. A consensus statement from the International Diabetes Federation[J]. Diabet Med, 2010, 23(5): 469-480. |
| [2] | Brownlee M. Biochemistry and molecular cell biology of diabetic complications[J]. Nature, 2001, 414(6 865): 813-820. |
| [3] | Reske-Nielsen E, Lundbaek K. Pathological changes in the central and peripheral nervous system of young long-term diabetics. II. The spinal cord and peripheral nerves[J]. Diabetologia, 1968, 4(1): 34-43. |
| [4] | Di Marzio D, Mohn A, Mokini Z H, et al. Macroangiopathy in adults and children with diabetes: from molecular mechanisms to vascular damage (part 1)[J]. Horm Metab Res, 2006, 38(11): 691-705. |
| [5] | Folli F, Guzzi V, Perego L, et al. Proteomics reveals novel oxidative and glycolytic mechanisms in type 1 diabetic patients’ skin which are normalized by kidney-pancreas transplantation[J]. PLoS One, 2010, 5(3): e9923. |
| [6] | Rask-Madsen C, King G L. Mechanisms of disease: endothelial dysfunction in insulin resistance and diabetes[J]. Nat Clin Pract Endocrinol Metab, 2007, 3(1): 46-56. |
| [7] | Vlassara H, Brownlee M, Cerami A. Excessive nonenzymatic glycosylation of peripheral and central nervous system myelin components in diabetic rats[J]. Diabetes, 1983, 32(7): 670-674. |
| [8] | Auer R N, Siesjö B K. Biological differences between ischemia, hypoglycemia, and epilepsy[J]. Ann Neurol, 1988, 24(6): 699-707. |
| [9] | Auer R N, Olsson Y, Siesjö B K. Hypoglycemic brain injury in the rat. Correlation of density of brain damage with the EEG isoelectric time: a quantitative study[J]. Diabetes, 1984, 33(11): 1 090-1 098. |
| [10] | Auer R N, Hugh J, Cosgrove E, et al. Neuropathologic findings in three cases of profound hypoglycemia[J]. Clin Neuropathol, 1989, 8(2): 63-68. |
| [11] | Fujioka M, Okuchi K, Hiramatsu K I, et al. Specific changes in human brain after hypoglycemic injury[J]. Stroke, 1997, 28(3): 584-587. |
| [12] | Kalimo H, Olsson Y. Effects of severe hypoglycemia on the human brain. Neuropathological case reports[J]. Acta Neurol Scand, 1980, 62(6): 345-356. |
| [13] | Sieber F E, Traystman R J. Special issues: glucose and the brain[J]. Crit Care Med, 1992, 20(1): 104-114. |
| [14] | McCall A L. The impact of diabetes on the CNS[J]. Diabetes, 1992, 41(5): 557-570. |
| [15] | Wieloch T. Hypoglycemia-induced neuronal damage prevented by an N-methyl-D-aspartate antagonist[J]. Science, 1985, 230(4 726): 681-683. |
| [16] | Ouyang Y B, He Q P, Li P A, et al. Is neuronal injury caused by hypoglycemic coma of the necrotic or apoptotic type[J]? Neurochem Res, 2000, 25(5): 661-667. |
| [17] | Xu Wen-xin(徐雯欣), An Yan-peng(安艳捧), Tang Hui-ru(唐慧儒). NMR studies of Streptozotocin effects on rat plasma fatty acids(链脲佐菌素影响大鼠脂肪酸代谢的NMR研究)[J]. Chinese J Magn Reson(波谱学杂志) , 2013, 30(2): 204-212. |
| [18] | Huang Ming-ming(黄明明), Lin Fu-chun(林富春), Gao Li-feng(高丽凤), et al. Diabetic encephalopathy studied by magnetic resonance imaging and spectroscopy(糖尿病脑病的磁共振研究)[J]. Chinese J Magn Reson(波谱学杂志) , 2012, 29(3): 446-456. |
| [19] | Tiehuis A M, van der Graaf Y, Visseren F L, et al. Diabetes increases atrophy and vascular lesions on brain MRI in patients with symptomatic arterial disease[J]. Stroke, 2008, 39(5): 1 600-1 603. |
| [20] | Ferguson S C, Blane A, Wardlaw J, et al. Influence of an early-onset age of type 1 diabetes on cerebral structure and cognitive function[J]. Diabetes Care, 2005, 28(6): 1 431-1 437. |
| [21] | Pell G S, Lin A, Wellard R M, et al. Age-related loss of brain volume and T2 relaxation time in youth with type 1 diabetes[J]. Diabetes Care, 2012, 35(3): 513-519. |
| [22] | Brands A M, Kessels R P, Hoogma R P, et al. Cognitive performance, psychological well-being, and brain magnetic resonance imaging in older patients with type 1 diabetes[J]. Diabetes, 2006, 55(6): 1 800-1 806. |
| [23] | Falvey C M, Rosano C, Simonsick E M, et al. Macro- and micro-structural magnetic resonance imaging indices associated with diabetes among community-dwelling older adults[J]. Diabetes Care, 2013, 36(3): 677-682. |
| [24] | Musen G, Lyoo I K, Sparks C R, et al. Effects of type 1 diabetes on gray matter density as measured by voxel-based morphometry[J]. Diabetes, 2006, 55(2): 326-333. |
| [25] | Schweinhardt P, Bushnell M C. Pain imaging in health and disease—how far have we come[J]? J Clin Invest, 2010, 120(11): 3 788-3 797. |
| [26] | Scoville W B, Milner B. Loss of recent memory after bilateral hippocampal lesion[J]. J Neurol Neurosurg Psychiatry, 1957, 20(1): 11-21. |
| [27] | Zola-Morgan S M, Sguire L R. The primate hippocampal formation: evidence for a time-limited role in memory storage[J]. Science, 1990, 250(4 978): 288-290. |
| [28] | Gaudieri P A, Chen R, Greer T F, et al. Cognitive function in children with type 1 diabetes: a meta-analysis[J]. Diabetes Care, 2008, 31(9): 1 892-1 897. |
 2015, Vol. 32
2015, Vol. 32




