文章信息
- 唐新启, 张正逢, 杨俊
- TANG Xin-qi, ZHANG Zheng-feng, YANG Jun
- 生物固体核磁共振中样品发热的研究进展
- Heating of Biological Samples in Studies of MAS Solid-State NMR
- 波谱学杂志, 2015, 32(1): 123-140
- Chinese Journal of Magnetic Resonance, 2015, 32(1): 123-140
- http://dx.doi.org/10.11938/cjmr20150114
-
文章历史
收稿日期: 2014-04-17
收修改稿日期: 2015-01-11


DOI:10.11938/cjmr20150114
2. 中国科学院大学,北京 100049
2. University of Chinese Academy of Science, Beijing, 100049, China
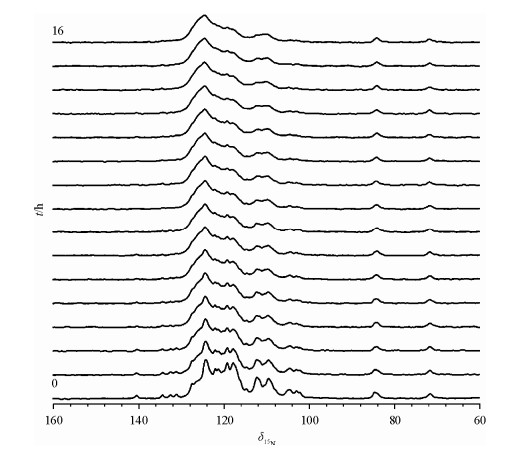
近年来,固体核磁共振(Solid-state Nuclear Magnetic Resonance, Solid-state NMR)被广泛应用于生物大分子结构和功能的研究[1, 2].膜蛋白、纤维蛋白等生物大分子的理化性质大多与温度密切相关--只有在适宜温度下采集的实验数据,才能真实地反映生物大分子在生理活性状态下的结构和功能信息.因此,维持样品的温度十分重要.但是,在生物固体NMR实验中,魔角旋转、射频场等将导致样品发热,使样品温度上升,导致NMR实验数据不能准确反映生物大分子的真实状态.例如,动力学参数往往依赖于样品所处的温度,而在动力学参数的测量过程中[3-5],未知的加热效应将使样品的实际温度高于目标温度,从而影响实验的预期结果.更为严重的是,样品发热可能改变生物大分子的生理活性,甚至造成不可逆的结构破坏.水、盐或者磷脂等是维持蛋白样品生理活性的必要条件,但是它们的存在将加剧固体NMR实验中样品的发热,导致样品温度快速上升,有研究显示该温度升高可达到30℃[6].图 1是泛素(Ubiquitin)蛋白微晶样品的1D 15N CP/MAS谱.尽管样品的盐浓度仅为0.008 mol/L,但随着实验的进行,谱图的分辨率由于样品发热而逐渐下降;在16 h之后,样品分辨率已严重恶化,表明发热效应已经破坏了样品.由此可见,在生物固体NMR实验中,抑制样品发热非常重要.
|
| 图 1 泛素微晶蛋白1D 15N CP/MAS谱随时间变化示意图.15N标记的蛋白样品约5 mg,pH为4.0,样品的盐浓度为0.008 mol/L.实验使用500 MHz谱仪、3.2 mm转子,旋转速率为13.333 kHz;CP期间的1H、15N射频场强度分别为43 kHz、30 kHz,接触时间为2 ms;采样期间去耦的射频场强度为75 kHz,去耦时间为120 ms,循环延迟为1.5 s.样品每隔1 h检测一次,其谱图按照时间顺序从下到上排列[6] Fig. 1 Time-dependent 1D 15N spectra of microcrystalline ubiquitin. The 15N protein (~5 mg) was precipitated with methylpentanediol at pH 4.0 with a final salt (sodium citrate and citric acid) concentration of 0.008 mol/L, and packed into an air-tight 3.2 mm rotor. The MAS rate was 13.333 kHz. 1D 15N CP/MAS acquisition parameters were: 2 ms 1H-15N CP (at~43 kHz 1H, 30 kHz 15N with a tangent ramp), 75 kHz decoupling for 120 ms, 1.5 s pulse delay. The stacked spectra were acquired during an overnight run (1 h per spectrum)[6] |
样品发热将限制NMR实验条件设置.在固态样品中,由于分子的运动受限,偶极-偶极相互作用较大,固体NMR实验需要使用高功率去耦(High power decoupling, HPDEC)技术,即利用1H射频场照射以消除偶极耦合导致的谱线增宽.此外,交叉极化(Cross polarization, CP)、偶极重耦(Dipolar recoupling)等技术也需要使用较强的射频场.这些高功率射频脉冲的使用,可能使样品产生严重的发热效应,造成NMR谱峰的线型扭曲[7, 8]、信噪比降低[9]等不良后果.因此,人们或避免使用高功率射频脉冲,或使用较长的实验循环延迟时间(Recycle delay)等措施以降低样品发热,但是,这些措施将极大降低NMR数据的质量或实验的效率.
决定生物固体NMR实验成败的关键因素是谱的分辨率和信噪比.为了提高谱图的质量,生物大分子的固体NMR研究趋于使用高磁场[10]、高转速[11, 12]和高功率[13]等实验条件.然而,在这些实验条件下,样品的发热效应将更为显著.因此,了解样品发热的原因,优化样品制备条件、发展新的NMR实验方法和改进谱仪硬件设计以降低样品发热,对于生物固体NMR研究具有重要意义.
1 样品发热的影响因素在魔角旋转固体NMR实验中,样品的温度(设定温度)是通过调节变温气流的温度和流量来控制的.探头中的热电偶与转子(样品管)距离约数毫米,因此热电偶检测到的温度与转子的实际温度存在一定的温度差,即设定温度与样品的实际温度并不一致.该温度差取决于多个因素[14],与实验相关的因素,包括旋转速率、Bearing气流、转子形状、射频场等;与样品相关的因素,主要包括蛋白质分子的极性、盐浓度、水含量、及其它内含物以及样品本身的物理状态等.这些因素造成的温度上升不能通过谱仪的变温控制单元监测.
1.1 魔角旋转如图 2所示,魔角旋转是指转子在Drive气体的作用下在与主磁场呈54.7°的方向上旋转;在旋转过程中,Bearing气体起到承载转子的作用,使转子在定子内处于中轴位置,不与定子发生摩擦.在旋转过程中,转子将与Bearing气体发生摩擦,从而导致样品发热[15].在低转速下( < 8 kHz),旋转导致的加热效应并不明显[16];在中等转速下( < 15 kHz),当其它实验条件固定时,因旋转造成的温度上升幅度与转速的平方成正比[17].当魔角旋转速率进一步增大时,因摩擦造成的加热效应将更为显著.例如,对于2.5 mm转子,35 kHz转速造成的温差可达55 K[18].当未施加射频照射时,魔角旋转导致的加热不受样品中盐或磷脂等带电组分的影响[19].Grimmer等人研究了样品实际温度与魔角旋转速率及Bearing气体温度的关系[18].当Bearing气的温度一定时,随着转速的增加,样品温度将单调上升[图 3(a)];当魔角旋转转速一定时,样品温度与Bearing气体温度呈线性相关[图 3(b)].

|
| 图 2 魔角旋转示意图 Fig. 2 Schematic of magic angle spinning (MAS) |
魔角旋转造成的样品加热效应还与转子的尺寸相关[17].在相同转速下,若不考虑射频脉冲的加热效应,样品的实际温度与变温单元出口气体(或Bearing气体)的温差与转子的半径的平方成正相关.Grimmer等人研究了含水DMPC磷脂样品在不同尺寸的转子中的温度,发现在同等实验条件下(射频场强度和照射时间均一致),魔角旋转和射频脉冲在4 mm转子中产生的加热效应仅有6 mm转子中加热效应的约1/3[16].
1.2 射频场由射频场引起的加热效应,可以归结于三大物理现象:一、根据焦耳定律,当样品内有电荷流通时,例如当发射线圈发出射频脉冲时,放大器将产生电流,接收线圈也会产生涡流(快速切换磁场梯度时更明显),样品将被加热,这种现象可以叫做传导损耗[20];二、当样品受到震荡电场E1作用时,样品中带电粒子将产生感生电流,从而导致样品发热,通常可以将这种现象称作介电损耗.当带电粒子电荷为永久性时例如极性分子,这种介电损耗又可以叫做偶极损耗[16, 21, 22];三、核自旋自身对磁场的吸收(核磁共振)也会造成磁场的损耗及样品的发热,但在常温下这种损耗通常可以忽略不计[23].
研究射频脉冲对样品的影响时,通常只考虑激发的震荡磁场B1产生的扰动而忽略激发电场E1的影响.近年欧洲陆续装备了1.0 GHz (23.5 T)、1.2 GHz (28.2 T)高场核磁共振谱仪,下一代核磁共振谱仪,即1.5 GHz,1.6 GHz也在计划中.因此,在高场下,激发电场E1的影响已不容忽视[24],样品发热现象会更加严重,对样品发热的研究需求也愈发迫切.
固态粉末样品中通常没有自由的带电粒子,也没有可引起传导损耗或偶极损耗的流动液体.但是,对于高场下的生物固态样品研究[25, 26],由于样品中通常含有水、盐以及其它内含物(去垢剂、冷冻保护剂)等,射频场导致的加热效应较为显著.普通固体NMR探头在设计上并没有考虑对高盐样品的耐受性.当样品的盐浓度达到0.1 mol/L,许多探头的1H或19F通道将无法满足有效的调谐匹配;即使能够满足调谐匹配,该通道的射频场输出功率和灵敏度也将极大地衰减.在射频场造成的震荡电场作用下,样品中水分子以及溶解在水中的离子组分和极性组分将产生传导损耗和介电损耗(偶极损耗)[27],从而造成严重的发热效应.研究发现,样品的升温与射频场功率(kHz)的平方成正比,与射频照射时间呈线性相关[10].
李从刚等人研究了静态条件下磷脂样品的发热效应与水含量、盐浓度的关系[26].其中,功率损耗表示线圈的射频功率损耗,即被样品吸收的能量(造成样品发热)占射频脉冲总能量的百分比.由表 1可以看出:样品对能量的吸收及其温度的上升与盐浓度(0~0.08 mol/L)或水含量(0~98%,相对湿度)呈线性相关.从表 1中的前4行可以看出,当水含量从32%增加到67%时,质子通道功率损耗也增加到2倍,即从0.06增加到0.13;而当水含量增加到97%时,功率损耗增加到0.18.由此可见,水含量的增加将造成射频损耗单调上升,并使样品温度也随之上升.该研究同时表明,射频功率损耗及温度变化还与盐浓度正相关.
| 磷脂组成 | 盐浓度/(10-3mol/L) | 水含量/% | 1H通道功率损耗 | 稳态温度/℃ |
| 参照物(水和载玻片) | 0 | 100 | 0.01 | 35±6 |
| DOPC | 0 | 32 | 0.06 | 35±6 |
| DOPC | 0 | 67 | 0.13 | 44.5±2.5 |
| DOPC | 0 | 97 | 0.18 | 57±4 |
| DOPC/DOPG=9:1 | 5 | 0 | 0.03 | 35±6 |
| DOPC/DOPG=9:1 | 5 | 67 | 0.12 | 47.5±2.5 |
| DOPC/DOPG=9:1 | 5 | 86 | 0.17 | 51.5±3.5 |
| DOPC/DOPG=9:1 | 5 | 98 | 0.22 | 57±4 |
| DOPC/DOPG=9:1 | 5 | 97 | 0.19 | 57±4 |
| DOPC/DOPG=9:1 | 10 | 97 | 0.22 | 57±4 |
| DOPC/DOPG=9:1 | 20 | 97 | 0.24 | 57±4 |
| DOPC/DOPG=9:1 | 40 | 97 | 0.26 | 62.5±3.5 |
| DOPC/DOPG=9:1 | 80 | 97 | 0.29 | 68±4 |
为了研究射频场所导致的样品加热效应,人们需要对使用的脉冲序列进行相应的设计,例如Temperature Calibration Under Pulseload (TCUP)[19].事实上,任何感兴趣的脉冲序列都可以被修改以用于检测样品温度.如图 4所示,修改1H单脉冲序列,在90°脉冲之前添加一段射频照射(用于模拟去耦模块的作用),可用于研究射频场的加热效应:即保持转速和Bearing气体温度等参数恒定,改变τ1的长度和射频功率和τ2的长度,然后根据1H化学位移的变化确定样品的实际温度.该实验方法可以系统地测试1H射频场的强度和作用时间与样品加热效应的关系.
除了使用相关的脉冲序列,标定样品温度还需要“温度指示剂”.其中一种“温度指示剂”是不可逆的温度显示条.将温度显示条绑定/黏贴在样品管管壁(或转子管壁)上,当温度超过某一温度值时,显示条上相应的白点变成黑色,从而指示该样品温度[26].同一样品中可以同时使用多种温度范围不同的显示条,使温度显示更加精细.但是,该方法对温度的检测精度较低,不能准确地反映样品内部实际温度,并且只适用于静态实验条件.因此,人们更多地利用特定化合物的某些NMR参数对温度变化的敏感性,实现对样品温度的准确检测.这些化合物之所以能够用来检测温度,是因为它们的某些NMR参数,如化学位移、弛豫时间[28]等与温度呈确定的函数关系.此外,某些NMR信号的化学位移或线型对物质的相态变化极其敏感,借助这一特性,人们可根据已知的相转变温度来确定样品的实验温度[29-33].
弛豫时间虽然可以表征样品温度的变化,但其使用范围往往比较狭窄,例如7Li纵向弛豫时间在1 200 K以上才与样品温度的对数值呈明显的线性相关关系[28].因此,在常规实验中,以化学位移标定样品温度的方法成为主流.对于不含水的粉末样品,可以加入硝酸铅[34],或者将甲醇、乙二醇乙醚、方形酸等吸附在某种固体材料上[33, 35, 36],根据其化学位移与温度相关性标定温度.某些固体材料如塑性晶体能发生固-固相变,因而在NMR谱图上会出现显著的变化,例如化学位移值的改变等,可以利用这种特殊的相变性质来标定样品和探头温度[30, 31, 37].对于生物样品,水的质子信号可在一定温度范围内作为温度指示剂[16].此外,利用119Sn的化学位移对温度变化敏感的特性,可以在样品中加入不溶于水的Sm2Sn2O7粉末,作为温度内标[38-41].表 2列出了多种常见的温度指示剂,并简要归纳了其化学位移与样品温度的函数关系,或分子发生固-固相变时对应的温度.
| (a)以化学位移值指示温度变化 | ||
| 温度指示剂 | 化学位移与样品温度函数关系 | |
| 化学位移 | 1H2O | δ=a+0.0090*T[16] |
| K79Br | δ=a-0.0250*T [12] | |
| 207Pb(NO3)2 | δ=a+0.7750*T [34] | |
| Sm2119Sn2O7 | δ=223-9.53×104/T [38-41] | |
| (b)以固-固相变指示温度变化 | ||
| 温度指示剂 | 相变温度 | |
| 固-固相变 | 31P4S3 | 314 K[40] |
| 87RbNO3 | 437 K[40] | |
| Li23NaSO4 | 791 K[42] | |
| Hexamethylbenzene(HMB), 13C | 115~120 K[20] | |
| TTMSS, 13C | 238~241 K[37] | |
| d-camphor, 13C | 238 K[20] | |
| DMPD, 13C | 315 K[43] | |
| 13CBr4 | 320 K[40] | |
| δ为化学位移值,a为常数,TTMSS: Tris(trimethysilyl)silane, d-camphor: 2-Bornanone 2-Camphanone, DMPD: n, n-dimethyl-p-phenylenediamin | ||
大多数用于标定温度的化合物都是水溶性的离子化合物,如KBr、Pb(NO3)2等.这些化合物在含水的样品中将溶解并分散,从而加剧加热效应,主要是由于:一、离子浓度将大大增加,从而导致传导损耗和介电损耗的增加[6];二、当这些离子化合物加入到样品中时,样品的熔点将下降,导致样品吸热速率提高.将温度指示剂与样品分离(例如在转子中加小包密封的KBr),可以避免上述弊端[12],但如果样品中存在温度梯度或者其热传导性较差,该方法不能准确地反映样品的实际温度.因此,对于生物固体NMR研究,Sm2Sn2O7等顺磁化合物因其具有不溶于水、纵向弛豫时间较短、对温度变化较为敏感等特点而常常被用于标定温度.
3 减小样品发热的方法降低生物样品发热有3种方法,包括:一、优化样品制备条件,包括水含量、盐浓度等;二、优化NMR实验条件,包括降低射频场强度和缩短照射时间,提高样品冷却效率等;三、改进NMR硬件设计,主要是探头的设计.下面我们对以上3种方法分别介绍.
3.1 优化样品制备条件低含水量有助于减少样品中带电组分(如离子)的运动性,从而降低样品发热效应[44].但是,蛋白质样品通常需要一定的含水量以保持其结构和功能,即降低含水量可能不利于获取有效的信息.杨俊等人的研究发现[45],大肠杆菌二酯酰甘油激酶(Diacylglycerol kinase,DAGK)需要约30%(水和样品干重的质量比,w:w)的含水量,才能保证其固体NMR谱图的分辨率和信噪比.
降低盐浓度能大大降低样品发热[46].如前文所述,样品中带电组分将在射频场的震荡电场E1作用下,导致传导损耗和介电损耗(偶极损耗),使得探头功率降低,导致样品被加热升温.但对于蛋白质样品,盐和冷冻保护剂等带电组分的存在,对于维持其生理活性的起重要作用.另外,盐浓度还可以维持蛋白质与其配体之间的联系.因此,在样品中保持一定的盐浓度对于生物样品是至关重要的,而通过降低盐浓度来减轻样品发热的可操作性非常有限.
3.2 优化NMR实验设置在生物固体NMR实验中,高功率射频场作用是造成样品发热的主要因素.在实验参数设置中,减少高功率射频脉冲的使用、缩短射频照射时间能有效减弱样品的发热效应.
在较低转速下,通过选择合适的脉冲序列方法,可以降低射频场功率,从而减小样品发热效应.以去耦模块为例,当前在固体NMR领域应用较广的异核去耦方法,主要包括连续波去耦CW[47],XiX[48],TPPM[49],SPINAL-64[50]等.不同的去耦方法有不同的适用范围,其最佳参数也不尽相同.当实验条件一致时(包括设定温度、循环延迟、采样次数、去耦功率和时间等),各种方法的去耦效果有显著的差别.如图 5所示,Dvinskikh等人比较了CW,XiX,TPPM,SPINAL-64在低转速下(5 kHz)的去耦效果,发现相对于SPINAL-64,其它去耦方法需要使用更高的射频功率才能获得较好的去耦效果[16].这意味着:在获得相同的实验效果时,由于使用了更低的射频场,优化的脉冲方法可以有效地减少射频场导致的样品发热.

|
| 图 5 DMPC样品在不同去耦方式下的CP/MAS谱.魔角旋转转速为5 kHz,实验设定温度为33℃,去耦功率均为26 kHz.每个实验脉冲延迟均为10 s,各采64次(空扫8次).对于所有的去耦方式,其相应的参数均已优化到最佳条件[16] Fig. 5 13C CP/MAS spectra of DMPC measured with different heteronuclear decoupling sequences (ωr/2π=5 kHz). The set temperature and decoupler strenhth were 33℃ and 26 kHz, respectively. The recycle delay was 10 s and 64 scans were recorded for each spectrum. For each scheme, the relevant parameters were optimized to obtain the best resolution[16] |
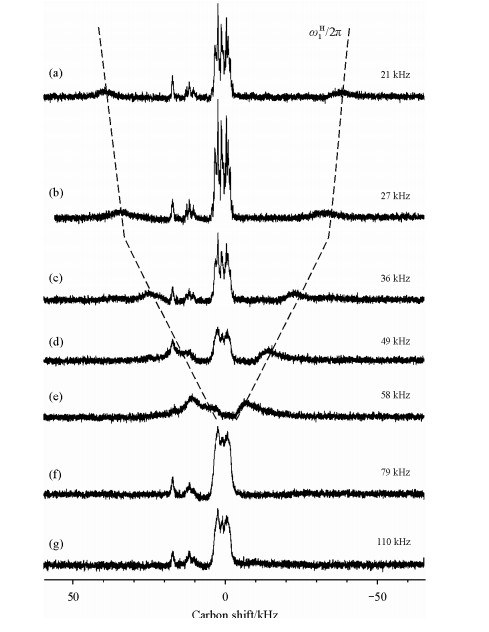
在超快魔角旋转( > =60 kHz)条件下,由于1H-1H同核去耦被有效地削弱,CP实验能使用较弱的射频场实现有效的Hartmann-Hahn匹配[51, 52].同时,由于弱射频场的频率选择性,CP能选择性地增强蛋白质中的羰基信号[52].同样地,在超高转速下,组合脉冲去耦方法在使用弱射频场时也能获得理想的去耦效果[53, 54].如图 6所示,在60 kHz的魔角旋转下,使用27 kHz的低功率去耦(b)能获得较高的谱图分辨率和信噪比,优于高功率如79 kHz (f),110 kHz (g)的去耦效果.因此,在超快魔角旋转条件下,可以使用低功率射频脉冲,有效地减小样品的加热.
|
| 图 6 U-13C,15N同位素标记的超氧化物歧化酶(Superoxide dismutase,SOD)的13C CP谱.魔角旋转转速为60 kHz,去耦功率为(a) 21 kHz,(b) 27 kHz,(c) 36 kHz,(d) 49 kHz,(e) 58 kHz,(f) 79 kHz,(g) 110 kHz.其它实验条件均一致;图中虚线代表丙氨酸脂肪链信号的去耦旋转边带(first order rotational decoupling sideband,出现在ωr-ω1H和-ωr+ω1H处)[54] Fig. 6 13C CP/MAS spectra of fully (15N, 13C)-labeled, oxidized human SOD recorded at 60 kHz MAS under CW heteronuclear decoupling, with different values of the decoupling rf-field ω1H(a) 21 kHz, (b) 27 kHz, (c) 36 kHz, (d) 49 kHz, (e) 58 kHz, (f) 79 kHz, (g) 110 kHz[54] |
除CP和异核去耦方法外,偶极重耦也是最常用的脉冲技术之一.针对实验体系的需要,偶极重耦方法往往需要使用一定强度的重耦功率及质子去耦功率,从而易造成样品发热.针对这一问题,人们对使用低功率、短照射时间的重耦技术表现出极大的兴趣.例如Nielsen等人[55]设计的EXPORT (EXPonentially mOdulated Recoupling Technique)方法可以在重耦阶段不施加1H异核去耦而实现高效的13C-15N异核重耦.相对于TEDOR (Transferred Echo DOuble Resonance)方法[56],Griffin等人提出的PAINCP (Proton Assisted Insensitive Nuclein Cross Polarization)方法[57],能够在较短的混合时间内获得长程13C-15N距离约束.
通过提高NMR谱仪系统的热交换效率,例如增加冷却时间或提高冷却气体流速,同样能够减弱样品发热.在相关研究中[19],样品温度在受到单次脉冲照射(1H去耦)的初期上升了约1.5 K,在之后10 s的恢复期(循环延迟)慢慢降低,这说明样品发热不是由单次脉冲导致的,而是在快速重复的射频脉冲照射下、热量不断累积造成的结果.因此,通过改善制冷系统,使样品能在脉冲间隙得到冷却,防止热量的过度积累,可以缓解样品发热.如图 7所示,DMPC样品在经过高功率射频场照射后,样品温度将迅速上升(0~2 scans);随着累积次数( > 2 scans)的增加,热量的累积将逐渐减缓;循环延迟时间越长,热量的积累越慢.对比循环延迟5 s和20 s的结果可以看出:长的冷却时间有利于热量的散失,从而避免温度随实验累加次数增加而明显上升.增加冷却气体流速能提高冷却效率,从而减少热量的累积:在冷却气体流速为100 scfh(Standard cubic foot per minute, 标准立方英尺每分钟)时,射频场对样品造成温度升高达23 K,而在流速为180 scfh时,温度升高仅为12 K;同时,后者(180 scfh)造成的样品内温度梯度为11 K,也小于前者(100 scfh)的17 K.需要指出的是,由于冷却系统的限制,冷却气体流速不可能一直增加.而通过改进转子,如增加转子热交换表面积,减小转子厚度或使用导热性更好的材料,能进一步提高冷却效率,减小样品发热.

|
| 图 7 样品加热与采样次数关系示意图.图中循环延迟为5 s (○)、10 s (□)、20 s (△).样品为DMPC,所用NMR实验方法见图 4[16] Fig. 7 Plot of accumulated sample heating versus number of scans for three recycle delays: 5 s (circles), 10 s (squares) and 20 s (triangles). The r.f. field strength, τ1 and τ2 were 35 kHz, 80 ms and 300 ms, respectively. The solid line are drawn to guide the eye[16] |
在射频照射下,生物样品中水、盐等必需组分都是导致样品发热的因素;固体NMR实验本身需要足够的射频场强度以满足去耦或重耦的效率.因此通过优化样品制备条件或NMR实验设置以减小样品发热存在较大的局限性.改进硬件设计,尤其是改进探头对生物样品中水和盐的耐受性,已经成为目前减小样品发热的主要方法.
盐将导致传导损耗和介电损耗,从而导致样品发热并降低探头的性能.通过改进探头线圈,增加其对高盐样品的耐受性,可以极大减少射频场对样品产生的加热.目前,针对样品中含盐问题而设计的低热探头主要有两种,即由安捷伦公司(Agilent Technologies Inc.)生产的BioMAS探头[6]和布鲁克公司(Bruker)生产的E-free探头[58, 59].
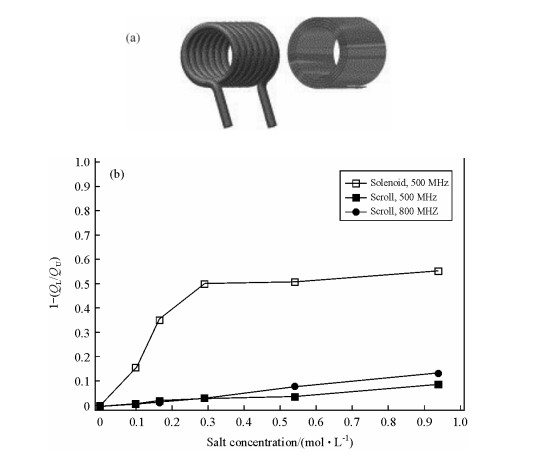
普通固体探头采用螺线管形线圈[图 8(a)].通过减少线圈的匝数可以减弱线圈的电感,从而减弱样品的发热效应.但是,对于多通道探头,低频通道(31P,13C,15N等)的效率和总体灵敏度与线圈的电感呈线性相关;并且其射频场均匀度也会随着线圈匝数的减小而降低,因此普通线圈的设计不能在保证探头效率的同时减弱样品发热[6].
|
| 图 8 (a)螺线管型线圈(左)和卷轴型线圈(右)示意图;(b)射频损耗(纵轴)与样品盐浓度的关系,分别为500 MHz谱仪螺线管型线圈(□)、500 MHz谱仪卷轴型线圈(■),800 MHz谱仪卷轴型线圈(●)[6] Fig. 8 (a) Schematic drawings of solenoid and scroll coil resonator with similar geometrical parameters. (b) Effects of dielectric loading on the quality factor of scroll and solenoid coils. The parameters [1-(QL/QU)] (where QL is the loaded Q and QU the unloaded Q) is plotted as a function of salt concentration (aqueous NaCl). Data at 500 MHz are presented for both the scroll(■) and solenoid(□), and at 800 MHz for scroll(●) only, as indicated in the legend[6] |
BioMAS探头线圈的设计灵感来自于LGR (Loop Gap Resonator)线圈[60].LGR线圈最早起源于电子顺磁共振(Electron Paramagnetic Resonance, EPR)[61],因其能提供极其优异的射频场均匀度,并能与常规螺线管(提供低频通道)联用,从而应用于多通道核磁实验[62].但LGR线圈的电感极小,从而需要极高的电容(~50 pF)才能激发高频的射频脉冲,这是当前硬件技术无法满足的.
安捷伦公司在BioMAS探头中将LGR线圈和常规螺线管线圈结合在一起,设计了卷轴型线圈(“Scroll coil”或“Swiss roll”)[57] [图 8(a)右],获得了许多优于普通探头的性能.卷轴型线圈能LGR线圈一样,提供高均匀度的高频射频场,但其电感比LGR线圈高,电容也在正常范围,能轻易提供需要的质子射频场(500~900 MHz).由于卷轴型线圈具有较大的电感,因此其低频通道的表现与常规螺线管相当,即在低频通道13C和15N等也具有较高的效率和灵敏度.
相对于常规螺线管型线圈,卷轴型线圈电感较小,因而介电损耗较小,对高盐样品具有更好的耐受性.图 8(b)为两线圈电介质负载系数[1-(QL/QU)]与样品盐浓度的关系图,其中QL即加载品质因数(质子脉宽与1/QL的开方值正相关),QU为无载品质因数.从图中可以看出,当盐浓度从0.1 mol/L上升到0.9 mol/L时,螺线管型线圈加载品质因数QL值减小了约50%,而卷轴型线圈QL值只减小了约10%;对于常规螺线管型线圈,当样品盐浓度大于0.150 mol/L时,线圈QL值急剧减小,探头将失去调谐;而对于卷轴型线圈,即使当样品盐浓度在1 mol/L左右,线圈功能也未受较大影响.
E-free探头是另一种在生物固体NMR中应用广泛的探头.图 9是1H-15N E-free探头Low-E线圈的设计原理示意图.在这种探头中,15N观测线圈正交地插入1H loop-gap结构线圈(a),而质子线圈侧面开口,便于样品进入(b),并在质子线圈顶部切开形成狭槽,以减弱15N通道的涡流(c);这种构造将不同通道的共振线圈分开,使匹配更简单有效;质子通道线圈独特的loop-gap结构可以产生均匀的射频场,同时其电场较小,从而削弱1H射频场造成的样品加热效应[52].

|
| 图 9 1H-15N Low-E探头的设计原理示意图:(a) 15N观测线圈被正交地插入1H loop-gap共振器;(b)在1H共振器侧面开口,以方便放入样品;(c)在1H共振器顶部开口,以削弱15N观测线圈涡旋电流[58] Fig. 9 Mechanical design of the 1H-15N Low-E flat-coil assembly: (a) 15N observe solenoid is orthogonally inside the 1H loop-gap resonator; (b) side windows are cut in the loop-gap resonator for sample insertion along x-axis; (c) a slot is cut on top of the 1H loop-gap resonator to reduce 15N eddy currents[58] |
相对于常规螺线管线圈,Low-E线圈能显著降低样品发热.表 3对比了400 MHz和600 MHz谱仪常规探头(4-turn),以及600 MHz和900 MHz核磁共振谱仪上配制的E-free探头的性能,所有加入对比的探头都有非常接近的样品容量.实验中所用到的样品包括普通固体样品(不造成射频场损耗)和磷脂样品.实验用强的1H射频照射和较短的循环延迟(2 s)以加剧样品发热.从表中数据可以看出:当1H射频场的频率均为600 MHz时,Low-E线圈的qheat值仅约为螺线管线圈9%,Low-E线圈的|Δƒ/ƒ|值也远小于螺线管型线圈,说明E-free探头电场所受的样品造成的干扰较小.
| Field/ MHz | Probe | 1H | 15N | ||||||
|
τ90nl/μs (65 W) |
τ90bio/μs (65 W) |
αheat | qheat/ mW/kHz2 | Δf/f ×10-3 |
f1limit/ kHz |
f1/kHz (700 W) |
|||
| 400 | solenoid | 4.75 | 7.10 | 55% | 28.7 | -4.2 | 103a | 58 | |
| 600 | solenoid | 5.05 | 9.55 | 72% | 68.2 | -8.3 | 100a | 54 | |
| 600 | Low-E coil | 5.75 | 6.23 | 15% | 6.1 | -1.5 | 100 | 71 | |
| 900 | Low-E coil | 6.88 | 8.45 | 34% | 25.4 | -3.6 | 60 | 70 | |
| τ90nl代表无损耗样品(non-lossy)在65 W时对应的90°脉宽;τ90bio代表生物样品在65 W时对应的90°脉宽;表中αheat是1H通道因对磷脂双分子层样品加热而造成入射功率的损失;qheat是累积样品热量与射频场能量的比值,即射频功率损耗率;Δƒ/ƒ是质子共振频率的相对漂移,能有效地标定样品中电场的变化;ƒ1limit代表1H去耦场能维持的最大功率,ƒ1代表当15N通道在入射功率为700 W时能提供射频频率. a表示只能在非损耗性样品测试所得参数[58] | |||||||||
在膜蛋白或纤维蛋白固体NMR使用中,可能用到的质子去耦时间长达50 ms,去耦功率也较高,例如4 mm探头质子去耦功率常在70 kHz左右,循环延迟时间一般为1.5~3 s.在此实验条件下,对于盐浓度为0.16 mol/L的样品,普通螺线管线圈将使样品产生55℃的升温.如图 1所示,泛素微晶蛋白样品甚至在盐浓度仅为0.008 mol/L时,样品一小时之内就出现损坏迹象,即信号出现明显增宽;而对于BioMAS探头,即使样品盐浓度为0.04 mol/L,样品在受到相同功率射频照射时,样品也能在数小时、数天内保持稳定[6].由于这些新型探头对盐浓度和水含量等具有较强的耐受性,因此,在生物固体核磁共振中,新型探头的应用有着广泛的应用前景[63-65].
在硬件设计方法对样品发热问题的解决方案还包括转子的改进,即使用更小尺寸的转子,如JEOL公司的0.7 mm转子和Bruker公司的1.3 mm转子等[52].低温探头例如低温DNP技术[66]等也是控制生物样品发热的方法.
4 结论与展望固体NMR已经在膜蛋白和纤维化蛋白等生物大分子的研究中显示出独特优势.样品发热在固体NMR实验中是一种普遍存在的现象,其影响不容忽视:样品发热不仅导致动力学参数测量出现偏差,而且将导致谱图信噪比、分辨率的下降,严重时甚至导致样品遭受不可逆的损害.通过优化样品制备条件、改进射频脉冲技术、改进探头技术,均可以减小样品发热,使样品温度保持平稳,从而保证固体NMR实验的效率、稳定性和可靠性.但是,这些方法并不能完全消除样品发热.同时,高转速、高磁场的使用逐渐成为今后的发展趋势,而高功率射频脉冲的使用亦在所难免.因此,样品发热问题将继续困扰着整个生物固体NMR研究领域.进一步研究样品发热的原因和检测方法,发展新的、能广泛应用的脉冲实验方法和谱仪技术,是生物固体NMR研究的重要课题.
| [1] | ZHANG Zhen-feng(张正逢), Yang Jun(杨俊) . Solid-state NMR studies on amyloid fibrils: recent progresses(固体核磁共振研究淀粉样蛋白纤维的进展)[J]. Chinese J Magn Reson(波谱学杂志) , 2013, 30 (2) : 157-174 |
| [2] | Fu Ri-qiang(傅日强) . High-resolution solid-state NMR spectroscopy of membrane bound proteins and peptides aligned in hydrated lipids(水化磷脂层中蛋白质和多肽的高分辨固体核磁共振波谱学)[J]. Chinese J Magn Reson(波谱学杂志) , 2009, 26 (4) : 437-456 |
| [3] | Ladizhansky V, Vega S . Polarization transfer dynamics in Lee-Goldburg cross polarization nuclear magnetic resonance experiments on rotating solids[J]. J Chem Phys , 2000, 112 (16) : 7158-7168 DOI:10.1063/1.481281 |
| [4] | Dvinskikh S V, Zimmermann H, Maliniak A et al . Heteronuclear dipolar recoupling in liquid crystals and solids by PISEMA-type pulse sequences[J]. J Magn Reson , 2003, 164 (1) : 165-170 DOI:10.1016/S1090-7807(03)00180-0 |
| [5] | Oldfield E, Meadows M, Rice D et al . Spectroscopic studies of specifically deuterium labeled membrane systems. Nuclear magnetic resonance investigation of the effects of cholesterol in model systems[J]. Biochemistry , 1978, 17 (14) : 2727-2740 DOI:10.1021/bi00607a006 |
| [6] | Stringer J A, Bronnimann C E, Mullen C G et al . Reduction of RF-induced sample heating with a scroll coil resonator structure for solid-state NMR probes[J]. J Magn Reson , 2005, 173 (1) : 40-48 DOI:10.1016/j.jmr.2004.11.015 |
| [7] | Wu Z, Ding S . Prevention of spinning induced sample deterioration during long time solid-state NMR experiments of quadrupolar spin systems[J]. Solid State Nucl Magn Reson , 2009, 35 (4) : 214-216 DOI:10.1016/j.ssnmr.2009.03.002 |
| [8] | Wang A C, Bax A . Minimizing the effects of radio-frequency heating in multidimensional NMR experiments[J]. J Biomol NMR , 1993, 3 (6) : 715-720 |
| [9] | Kugel H . Improving the signal-to-noise ratio of NMR signals by reduction of inductive losses[J]. J Magn Reson , 1991, 91 (1) : 179-185 |
| [10] | Led J J, Petersen S B . Heating effects in 13C NMR spectroscopy on aqueous solutions caused by proton noise decoupling at high frequencies[J]. J Magn Reson , 1978, 32 (1) : 1-17 |
| [11] | Br us, J . Heating of samples induced by fast magic-angle spinning[J]. Solid State Nucl Magn Reson , 2000, 16 (3) : 151-160 DOI:10.1016/S0926-2040(00)00061-8 |
| [12] | Thurber K R, Tycko R . Measurement of sample temperatures under magic-angle spinning from the chemical shift and spin-lattice relaxation rate of 79Br in KBr powder[J]. J Magn Reson , 2009, 196 (1) : 84-87 DOI:10.1016/j.jmr.2008.09.019 |
| [13] | Dillmann B, Elbayed K, Zeiger H et al . A novel low-E field coil to minimize heating of biological samples in solid-state multinuclear NMR experiments[J]. J Magn Reson , 2007, 187 (1) : 10-18 DOI:10.1016/j.jmr.2007.02.018 |
| [14] | Neue G, Dybowski C . Determining temperature in a magic-angle spinning probe using the temperature dependence of the isotropic chemical shift of lead nitrate[J]. Solid State Nucl Magn Reson , 1997, 7 (4) : 333-336 DOI:10.1016/S0926-2040(96)01291-X |
| [15] | Grimmer A R, Kretschmer A, Cajipe V B . Influence of magic angle spinning on sample temperature[J]. Magn Reson Chem , 1997, 35 (2) : 86-90 DOI:10.1002/(ISSN)1097-458X |
| [16] | Dvinskikh S V, Castro V, Sandstr m D . Heating caused by radiofrequency irradiation and sample rotation in 13C magic angle spinning NMR studies of lipid membranes[J]. Magn Reson Chem , 2004, 42 (10) : 875-881 DOI:10.1002/(ISSN)1097-458X |
| [17] | Mildner T, Ernst H, Freude D . 207Pb NMR detection of spinning-induced temperature gradients in MAS rotors[J]. Solid State Nucl Magn Reson , 1995, 5 (3) : 269-271 DOI:10.1016/0926-2040(95)01189-1 |
| [18] | Langer B, Schnell I, Spiess H W et al . Temperature calibration under ultrafast MAS conditions[J]. J Magn Reson , 1999, 138 (1) : 182-186 DOI:10.1006/jmre.1999.1717 |
| [19] | Fowler D J, Harris M J, Thompson L K . Heat management strategies for solid-state NMR of functional proteins[J]. J Magn Reson , 2012, 222 : 112-118 DOI:10.1016/j.jmr.2012.06.010 |
| [20] | Haw J F, Campbell G C, Crosby R C . Experimental considerations in variable-temperature solid-state nuclear magnetic resonance with cross polarization and magic-angle spinning[J]. Anal Chem , 1986, 58 (14) : 3172-3177 DOI:10.1021/ac00127a056 |
| [21] | Chattah A K, Cucchietti F M, Hologne M et al . Radiofrequency-induced temperature increase as a function of cross polarization contact time in 8CB[J]. Magn Reson Chem , 2002, 40 (12) : 772-776 DOI:10.1002/(ISSN)1097-458X |
| [22] | Fung B . The effect of radiofrequency heating in 13C NMR studies of liquid crystals[J]. J Magn Reson , 1990, 86 (1) : 160-163 |
| [23] | Shellock F G . Radiofrequency energy-induced heating during MR procedures: A Review[J]. J Magn Reson Imaging , 2000, 12 (1) : 30-36 DOI:10.1002/(ISSN)1522-2586 |
| [24] | d'Espinose de Lacaillerie J B, Jarry B, Pascui et al . "Cooking the sample": Radiofrequency induced heating during solid-state NMR experiments[J]. Solid State Nucl Magn Reson , 2005, 28 (2) : 225-232 |
| [25] | Zhou Z, Sayer B G, Stark R E et al . High-resolution magic-angle spinning 1H nuclear magnetic resonance studies of lipid dispersions using spherical glass ampoules[J]. Chem Phys Lipids , 1997, 90 (1-2) : 45-53 DOI:10.1016/S0009-3084(97)00082-0 |
| [26] | Nicholls A W, Mortishire-Smith R J . Temperature calibration of a high-resolution magic-angle spinning NMR probe for analysis of tissue samples[J]. Magn Reson Chem , 2001, 39 (12) : 773-776 DOI:10.1002/(ISSN)1097-458X |
| [27] | Marassi F M, Crowell K J . Hydration-optimized oriented phospholipid bilayer samples for solid-state NMR structural studies of membrane proteins[J]. J Magn Reson , 2003, 161 (1) : 64-69 DOI:10.1016/S1090-7807(02)00182-9 |
| [28] | van Wüllen L, Schwering G, Naumann E et al . MAS NMR at very high temperatures[J]. Solid State Nucl Magn Reson , 2004, 26 (2) : 84-86 DOI:10.1016/j.ssnmr.2004.03.001 |
| [29] | Limbach H H, Hennig J, Kendrick R et al . Proton-transfer kinetics in solids: tautomerism in free base porphines by nitrogen-15 CPMAS NMR[J]. J Am Chem Soc , 1984, 106 (14) : 4059-4060 DOI:10.1021/ja00326a044 |
| [30] | Haw J F, Crook R A, Crosby R C . Solid-solid phase transitions for temperature calibration in magic-angle spinning[J]. J Magn Reson , 1986, 66 (3) : 551-554 |
| [31] | Bjorholm T, Jakobsen H J . 31P MAS NMR of P4S3. Crystalline-to-plastic phase transition induced by MAS in a double air-bearing stator[J]. J Magn Reson , 1989, 84 (1) : 204-211 |
| [32] | Anderson-Altmann K L, Grant D M . A solid-state 15N NMR study of the phase transitions in ammonium nitrate[J]. J Phys Chem , 1993, 97 (42) : 11096-11102 DOI:10.1021/j100144a033 |
| [33] | Klymachyov A N, Dalal N S . Squaric acid as an internal standard for temperature measurements in 13C MAS NMR[J]. Solid State Nucl Magn Reson , 1996, 7 (2) : 127-134 DOI:10.1016/S0926-2040(96)01245-3 |
| [34] | Bielecki A, Burum D P . Temperature dependence of 207Pb MAS spectra of solid lead nitrate. An accurate, sensitive thermometer for variable-temperature MAS[J]. J Magn Reson , 1995, 116 (2) : 215-220 DOI:10.1006/jmra.1995.0010 |
| [35] | Ferguson D B, Haw J F . Transient methods for in situ NMR of reactions on solid catalysts using temperature jumps[J]. Anal Chem , 1995, 67 (18) : 3342-3348 DOI:10.1021/ac00114a034 |
| [36] | Aliev A E, Harris K D . Simple technique for temperature calibration of a MAS probe for solid‐state NMR spectroscopy[J]. Magn Reson Chem , 1994, 32 (6) : 366-369 DOI:10.1002/(ISSN)1097-458X |
| [37] | Aliev A E, Harris K D M, Apperley D C . High-resolution solid-state 13C and 29Si NMR investigations of the dynamic properties of tetrakis (trimethylsilyl) silane[J]. J Chem Soc, Chem Commun , 1993 (3) : 251-253 DOI:10.1039/c39930000251 |
| [38] | Campbell G C, Crosby R C, Haw J F . 13C Chemical shifts which obey the Curie Law in CP/MAS NMR spectra. The first CP/MAS NMR chemical-shift thermometer[J]. J Magn Reson , 1986, 69 (1) : 191-195 |
| [39] | Grey C P, Cheetham A K, Dobson C M . Temperature-dependent solid-state 119Sn MAS NMR of Nd2Sn2O7, Sm2Sn2O7, and Y1.8Sm0.2Sn2O7. Three sensitive chemical-shift thermometers[J]. J Magn Reson , 1993, 101 (3) : 299-306 DOI:10.1006/jmra.1993.1046 |
| [40] | Vanmoorsel G J M P, Vaneck E R H, Grey C P . Pr2Sn2O7 and Sm2Sn2O7 as high-temperature shift thermometers in variable-temperature 119Sn MAS NMR[J]. J Magn Reson , 1995, 113 (2) : 159-163 DOI:10.1006/jmra.1995.1075 |
| [41] | Pan H, Gerstein B C . NMR of 31P in (VO)2P2O7 as an internal temperature standard in high-temperature NMR[J]. J Magn Reson , 1991, 92 (3) : 618-619 |
| [42] | Massiot D, Bessada C, Echegut P et al . High temperature NMR study of lithium sodium sulfate[J]. Solid State Ionics , 1990, 37 (2-3) : 223-229 DOI:10.1016/0167-2738(90)90248-P |
| [43] | Aliev A E, Harris K D M . Simple technique for temperature calibration of a MAS probe for solid-state NMR spectroscopy[J]. Magn Reson Chem , 1994, 32 (6) : 366-369 DOI:10.1002/(ISSN)1097-458X |
| [44] | Li C G, Mo Y M, Hu J et al . Analysis of RF heating and sample stability in aligned static solid-state NMR spectroscopy[J]. J Magn Reson , 2006, 180 (1) : 51-57 DOI:10.1016/j.jmr.2006.01.013 |
| [45] | Chen Y, Zhang Z, Tang X et al . Conformation and topology of diacylglycerol kinase in E. colimembranes revealed by solid-state NMR spectroscopy[J]. Angew Chem Int Edit , 2014, 53 (22) : 5624-5628 DOI:10.1002/anie.v53.22 |
| [46] | McDermott A, Polenova T, Bockmann A et al . Partial NMR assignments for uniformly (13C, 15N)-enriched BPTI in the solid state[J]. J Biomol NMR , 2000, 16 (3) : 209-219 DOI:10.1023/A:1008391625633 |
| [47] | Mehring M. High Resolution NMR in Solids[M]. Springer, 1976. |
| [48] | Detken A, Hardy E H, Ernst M et al . Simple and efficient decoupling in magic-angle spinning solid-state NMR: the XiX scheme[J]. Chem Phys Lett , 2002, 356 (3-4) : 298-304 DOI:10.1016/S0009-2614(02)00335-4 |
| [49] | Bennett A E, Rienstra C M, Auger M et al . Heteronuclear decoupling in rotating solids[J]. J Chem Phys , 1995, 103 (16) : 6 951-6 958 DOI:10.1063/1.470372 |
| [50] | Fung B M, Khitrin A K, Ermolaev K . An improved broadband decoupling sequence for liquidcrystals and solids[J]. J Magn Reson , 2000, 142 (1) : 97-101 DOI:10.1006/jmre.1999.1896 |
| [51] | Meier B H . Cross polarization under fast magic angle spinning: thermodynamical considerations[J]. Chem Phys Lett , 1992, 188 (3-4) : 201-207 DOI:10.1016/0009-2614(92)90009-C |
| [52] | Laage S, Marchetti A, Sein J et al . Band-selective 1H-13C cross-polarization in fast magic angle spinning solid-state NMR spectroscopy[J]. J Am Chem Soc , 2008, 130 (51) : 17216-17217 DOI:10.1021/ja805926d |
| [53] | Ernst M, Samoson A, Meier B H . Low-power decoupling in fast magic-angle spinning NMR[J]. Chem Phys Lett , 2001, 348 (3-4) : 293-302 DOI:10.1016/S0009-2614(01)01115-0 |
| [54] | Laage S, Sachleben J R, Steuernagel S et al . Fast acquisition of multi-dimensional spectra in solid-state NMR enabled by ultra-fast MAS[J]. J Magn Reson , 2009, 196 (2) : 133-141 DOI:10.1016/j.jmr.2008.10.019 |
| [55] | Nielsen A B, Straas L A, Nieuwkoop A J et al . Broadband heteronuclear solid-state NMR experiments by exponentially modulated dipolar recoupling without decoupling[J]. J Phys Chem Lett , 2010, 1 (13) : 1952-1956 DOI:10.1021/jz100564j |
| [56] | Jaroniec C P, Filip C, Griffin R G . 3D TEDOR NMR experiments for the simultaneous measurement of multiple carbon-nitrogen distances in uniformly 13C, 15N-labeled solids[J]. J Am Chem Soc , 2002, 124 (36) : 10728-10742 DOI:10.1021/ja026385y |
| [57] | Lewandowski J R, De Pa pe G, Griffin R G . Proton assisted insensitive nuclei cross polarization[J]. J Am Chem Soc , 2007, 129 (4) : 728-729 DOI:10.1021/ja0650394 |
| [58] | Gor'kov P L, Chekmenev E Y, Li C et al . Using Low-E resonators to reduce RF heating in biological samples for static solid-state NMR up to 900 MHz[J]. J Magn Reson , 2007, 185 (1) : 77-93 DOI:10.1016/j.jmr.2006.11.008 |
| [59] | Gor'kov P L, Witter R, Chekmenev E Y et al . Low-E probe for 19F-1H NMR of dilute biological solids[J]. J Magn Reson , 2007, 189 (2) : 182-189 DOI:10.1016/j.jmr.2007.09.008 |
| [60] | Froncisz W, Hyde J S . The loop-gap resonator: a new microwave lumped circuit ESR sample structure[J]. J Magn Reson , 1982, 47 (3) : 515-521 |
| [61] | Alecci M, Nicholson I, Lurie D J . A novel multiple-tuned radiofrequency loop-gap resonator for use in PEDRI[J]. J Magn Reson , 1996, 110 (1) : 82-86 DOI:10.1006/jmrb.1996.0012 |
| [62] | Cory D G, Lewandowski J T, Maas W E. INMR Probe for CP2: USA, 5, 539, 315[P]. 1996. |
| [63] | Tang M, Comellas G, Mueller L et al . High resolution 13C-detected solid-state NMR spectroscopy of a deuterated protein[J]. J Biomol NMR , 2010, 48 (2) : 103-111 DOI:10.1007/s10858-010-9442-8 |
| [64] | Nadaud P S, Helmus J J, Kall S L et al . Paramagnetic ions enable tuning of nuclear relaxation rates and provide long-range structural restraints in solid-state NMR of proteins[J]. J Am Chem Soc , 2009, 131 (23) : 8108-8120 DOI:10.1021/ja900224z |
| [65] | Lopez J J, Kaiser C, Asami S et al . Higher sensitivity through selective 13C excitation in solid-state NMR spectroscopy[J]. J Am Chem Soc , 2009, 131 (44) : 15970-15971 DOI:10.1021/ja904963n |
| [66] | Thurber K R, Yau W M, Tycko R . Low-temperature dynamic nuclear polarization at 9.4 T with a 30 mW microwave source[J]. J Magn Reson , 2010, 204 (2) : 303-313 DOI:10.1016/j.jmr.2010.03.016 |
 2015, Vol. 32
2015, Vol. 32





