文章信息
- 姜丹, 徐佳
- JIANG Dan, XU Jia
- 一维NOE NMR技术用于蒂巴因衍生物的立体结构研究
- Stereochemistry and Spectral Assignment of Thebaine Derivatives: A 1D NOESY NMR Study
- 波谱学杂志, 2015, 32(1): 95-104
- Chinese Journal of Magnetic Resonance, 2015, 32(1): 95-104
- http://dx.doi.org/10.11938/cjmr20150111
-
文章历史
收稿日期: 2014-06-17
收修改稿日期: 2015-01-12


DOI:10.11938/cjmr20150111
2. 北京协和医院,北京100730
2. Peking Union Medical College Hospital, Beijing 100730, China
C-7取代C-6,14-桥蒂巴因衍生物在医学上具有重要用途[1].这类化合物的结构比较复杂,由多个脂环交错并合而成,分子骨架含有7个季碳,孤立的自旋体系和重叠的自旋多重峰比较多.根据C-7取代基的空间取向不同,有α和β差向异构体,它们的生物活性存在差异.国外作者曾经对这类化合物的1H和13C NMR谱的信号归属和α和β差向异构体的鉴别进行过研究,但存在部分信号归属尚不明确,有些信号归属不一致[1-4],且需要标准品或者数据对照,在实际应用受到一定限制.本文以高效镇痛剂双氢埃托啡游离碱,N-甲基-7α[(S)-1-羟基-1-甲基丁基]-6,14-桥亚乙基-6,7,8,14-四氢东罂粟碱(化合物1,如图 1所示)为研究样品,采用多频率位移激发双梯度自旋回波1D NOESY与2D NMR相结合的方法进行研究,取得满意结果.重叠和构型差别引起的复杂谱峰得以分离和辨认,并且在阐明溶液构象的基础上,提出鉴别C-7α和β差向异构体的新方法.
|
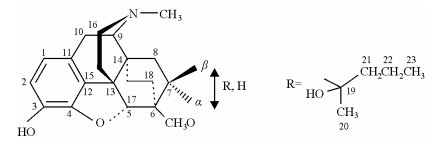
| 图 1 化合物1的化学结构 Fig. 1 The structure of compound 1 |
本文所有NMR实验是在JEOL 400 MHz JNM-ECA系列仪器上完成.该仪器配有产生选择脉冲的Laminal波形发生器和5 mm z-轴梯度脉冲多核探头(TH5AT/FG).所有脉冲序列都是通过仪器Delta脉冲编制软件操作得到.
1.2 实验条件1H和13C NMR的工作频率分别为400 MHz和100 MHz.实验温度为25 ℃,约4 mg游离碱样品溶解在0.5 mL氘代氯仿溶剂中,TMS为化学位移内标.1H NMR的谱宽9.18 kHz,数据点32 768,90°脉冲宽度11 μs,弛豫延迟1.2 s.13C NMR的谱宽为31.4 kHz,90°脉冲宽度8.8 μs,数据点16 384,弛豫延迟1.2 s,载频置于谱的中央,采用WALTZ质子宽带去偶法测定.2D 1H-1H COSY谱采用DQF-COSY脉冲序列测定,1H谱宽为3.12 kHz,累加次数2,空扫次数2,采样数据点阵t1×t2=1 024×256,零填充后FT变换数据点阵F1×F2=1 024×1 024.二维相敏HSQC谱测定,1H谱宽为3.22 kHz,13C NMR的谱宽为16.47 kHz,13C-1H偶合常数设定为140 Hz,累加次数8,空扫次数4,采样数据点阵t1×t2=2 048×256,零填充后FT变换数据点阵F1×F2=1 024×1 024.单晶X线衍射实验用Necolet R3 m/E四圆衍射仪收集数据.1D NOESY谱采用多频率位移激发双梯度自旋回波1D NOESY方法测定,其细节见前文讨论[5],180°高斯软脉冲宽度一般为40 ms,混合时间见正文讨论.
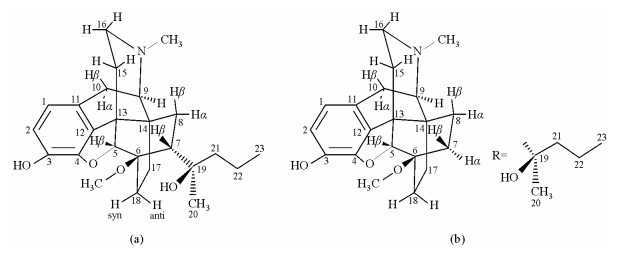
2 结果与讨论在化合物1中一部分1H和13C NMR信号归属利用2D NMR方法可以确定.困难主要来自不同脂环构像信号的辨别和复杂重叠多重峰的归属.研究表明,1D NOESY实验方法用于解决这些困难有独到之处,结果见表 1.根据图 2中显示的1D NOE实验证据,被测样品确定为7α差向异构体(取代基R位于α键),其立体结构如[图 3(a)]所示.
|
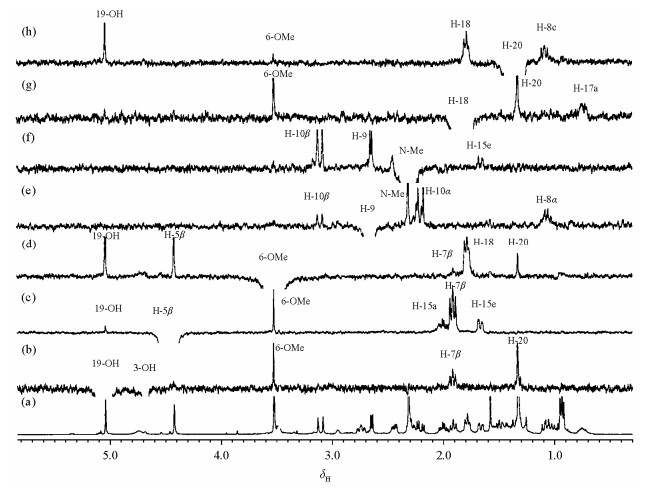
| 图 2 化合物1的NMR谱:(a) 1H谱;(b)~(h)为1D NOE谱,分别选择激发19-OH,H-5β,6-OMe,H-9,N-Me,H-18和H-20,用多频率位移选择激发1D NOESY方法[5]测定 Fig. 2 NMR spectra of the compound 1: (a) normal spectrum; (b)~(h) 1D NOE spectra with selective excitation of the 19-OH, H-5β, 6-OMe, H-9, N-Me, H-18 and H-20, respectively, obtained by the multiple-frequency selective excitation double pulsed field gradient spin echo 1D NOESY method[5] |
|
| 图 3 化合物1的两种立体异构体的结构 Fig. 3 Molecular structure of the two stereoisomeric forms of compound 1 |
| 13C NMR | 1H NMR | |||||
| Position | δC | Type | Position | δH | J/Hz | |
| 1 | 119.4 | CH | 1 | 6.54d | J(1, 2)=7.7 | |
| 2 | 116.7 | CH | 2 | 6.71d | J(2, 1)=7.7 | |
| 3 | 137.6 | C | 3 | - | ||
| 4 | 145.6 | C | 4 | - | ||
| 5 | 97.10 | CH | 5 | 4.43bs | ||
| 6 | 80.40 | C | 6 | - | ||
| 7 | 45.40 | CH | 7β | 1.92t | J(7β, 8α)=9.7 | |
| 8 | 31.70 | CH2 | 8α | 1.08dt | J(8α, 8β)=11.0 | |
| J(8α, 7β)=9.7 | ||||||
| 8β | 2.74dt | J(8β, 8α)=11.0 | ||||
| J(8β, 7β)=9.7 | ||||||
| 9 | 61.30 | CH | 9α | 2.66d | J(9α, 10α)=5.8 | |
| 10 | 21.90 | CH2 | 10α | 2.22dd | J(10α, 9α)=5.8 | |
| J(10α, 10β)=-17.1 | ||||||
| 10β | 3.10d | J(10β, 10α)=-17.1 | ||||
| 11 | 127.7 | C | 11 | - | ||
| 12 | 132.0 | C | 12 | - | ||
| 13 | 46.30 | C | 13 | - | ||
| 14 | 36.10 | C | 14 | - | ||
| 15 | 35.40 | CH2 | 15a | 2.02dt | J(15a, 15e)=-12.2 | |
| J(15a, 16a)=11.2 | ||||||
| 15e | 1.66d | J(15a, 15e)=-12.2 | ||||
| J(15a, 16e)=5.3 | ||||||
| 16 | 45.20 | CH2 | 16a | 2.30dd | J(16a, 16e)=-11.7 | |
| J(16a, 15e)=11.2 | ||||||
| 16e | 2.44dd | J(16e, 16a)=-11.7 | ||||
| J(16e, 15a)=5.3 | ||||||
| 17 | 29.80 | CH2 | 17syn* | 1.02m | ||
| 17anti** | 0.78m | |||||
| 18 | 17.90 | CH2 | 18 | 1.78bt | ||
| 19 | 76.10 | C | 19 | - | ||
| 20 | 23.40 | CH3 | 20 | 1.33s | ||
| 21 | 43.70 | CH2 | 21 | 1.30~1.60m | ||
| 22 | 15.90 | CH2 | 22 | 1.30~1.60m | ||
| 23 | 14.70 | CH3 | 23 | 0.90t | J(23, 22)=7.0 | |
| N-CH3 | 43.50 | CH3 | N-CH3 | 2.31s | ||
| O-CH3 | 52.60 | CH3 | O-CH3 | 3.53s | ||
| 3-OH | 4.74bs | |||||
| 19-OH | 5.08bs | |||||
| * syn to the aromatic ring ** anti to the aromatic ring *** The abbreviations, s (singlet), d (doublet), t (triplet), q (quartet), m (multiplet), bs (broad singlet), are used | ||||||
图 2所用方法的基本脉冲序列与2D NOESY相同,即由3个90°硬脉冲组成,目标信号采用多频率位移双梯度自旋回脉冲进行选择激发.在混合时间(mixing time)相同时,此方法得到的NOE信息与二维相敏NOESY方法测定的结果相类似.在C-7取代C-6,14-桥蒂巴因衍生物实验中,混合时间一般采用600 ms.但对于强偶合体系自旋多重峰的选择激发,混合时间需较长一些,一般为800~1 400 ms,且对自旋多重峰中每个谱线进行选择激发.本方法的主要特点:一、可以得到高质量的1D NOE谱;二、强偶合体系自旋多重峰的选择性粒子转移(Selective populatio transfer, SPT)影响可得到有效抑制;三、自旋多重峰信号的相对强度不发生畸变,NOE大小可以正确测定,微弱信号可以辨认.图 2(c)中的19-OH,图 2(d)中的H-7β、H-20,图 2(e)中的H-10β,图 2(f)中的H-15e以及图 2(h)中的6-OMe均为远程NOE信号,它们的相对强度都小于0.3%.
在图 2的1D NOE谱中,被选择激发信号与NOE信号的相位相反.常规1D 1H NMR谱中的积分方法可用于测定NOE信号的相对强度.本文报道的NOE信号强度是以被选择激发信号的一个质子的积分面积定为100来表达的.分子中存在多个活泼氢的化合物,在1D NOE实验中往往会出现类似于经典差谱方法中的饱和转移效应,选择激发其中一个信号,与它有化学交换的分子内其它活泼氢一般也出现相位相同的信号,例如图 2(b)中,被选择激发信号是19-OH,而饱和转移信号是3-OH.甲基单峰产生的NOE信号比较强,用于选择激发的180°高斯软脉冲宽度可适当加宽,一般为80~100 ms,并且1D NOE谱的累加次数可比其它信号减半,这样有助于观测重叠谱峰中的甲基单峰产生的NOE信号.
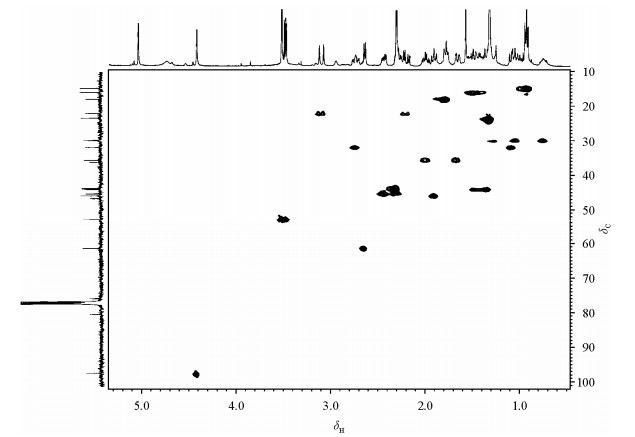
图 3显示,化合物1中两种7取代立体结构体的H-5β与H-7的空间取向不同.根据NOE与核间距关系,在7α差向异构体[图 3(a)]中二者是同向,有NOE效应,而在7β差向异构体[图 3(b)]中二者是反向,则无NOE效应.实验显示,通过选择激发H-5β,观测H-7的NOE实验非常容易鉴别这两种差向异构体.由于氧原子的强电负性影响,H-5β和C-5信号都出现在较低磁场处.下列证据说明,图 2中δ 4.43半峰宽较大的单峰属于H-5β信号:一是在2D HSQC谱(图 4)中,它的偶合相关碳信号(C-5)出现在δ 97.10,说明带氧的碳;二是在HMBC谱(未显示)中,它与苯环C-4 (δ 145.6)显示远程偶合.图 2(c)的NOE谱显示,选择激发H-5β (δ 4.43)信号,产生5个NOE信号,分别出现在δ 1.66,1.92,2.02,3.53和5.08.其中δ 1.92三重峰的强度最大,为6.8%.NOE信号来是自相隔0.5 nm的质子间空间效应,其强度随着距离的增加而迅速减弱,一般认为其临界间距为0.5 nm,因此δ 1.92三重峰相距H-5β信号最近,一定是H-7β信号.该结果与后面图 6中化合物1的单晶X线衍射的分子结构一致.在7α差向异构体中,H-7α的空间位置与H-18anti(anti和syn分别表示与苯环反式和顺式)接近,而与H-5β不在同一个面,选择激发H-5β不产生H-7β NOE信号.研究表明,H-5β和H-7β信号的基本特征在不同样品浓度中测定得结果几乎没有变化,H-5β出现在δ4.43,为半峰宽较大的单峰,H-7β出现在δ1.90为三重峰,裂距为9.7 Hz.因此H-5β和H-7β信号的辨认比较容易.在1D NOESY实验中,混合时间在600~800 ms范围内,H-7β的NOE信号强度基本相同.由于H-5β附近没有其它信号,选择激发比较方便,180°高斯软脉冲宽度在20~60 ms都可以得到满意结果.因此,选择激发H-5β,观测H-7β NOE信号是鉴别两种7取代差向异构体的有效方法,不需要标准品对照,结果准确可靠.
|
| 图 4 化合物1的HSQC谱 Fig. 4 HSQC spectrum of the compound 1 |

|
| 图 6 X线衍射测定的化合物1分子结构 Fig. 6 Molecular structure of the compound 1 determinied by the X-ray diffraction |
DQF-COSY谱(图 5)显示,H-7β具有两个邻位偶合相关峰,一个出现在δ 2.74,另外一个重叠在δ 1.00附近的其它信号中,它们为AMX三旋体系.由于H-7β为三重峰,说明J(7β,8β)与J(7β,8α)值基本相同,不需要利用偶合常数鉴别H-8α和H-8β.在图 3(a)显示的立体结构中,H-20或者H-9与H-8α空间接近.根据NOE信号强度与核间距关系,推测对H-20或者H-9进行选择激发,H-8α都可产生NOE信号,据此可鉴别H-8α和H-8β.实验结果与此推测一致.图 2(h)显示,对H-20的选择激发,产生4个NOE信号,分别是19-OH、6-OMe,H-18anti和H-8α (δ 1.08).而图 2(e)显示,对H-9进行选择激发,也产生4个NOE信号,分别是H-10β,N-Me,H-10α和H-8α (δ 1.08).实验显示,如果在氘代甲醇溶液,由于活泼氢被交换,观测不到H-20与H-8α之间的NOE关系.说明在氘代氯仿溶液中C-19上羟基与6-甲氧基的氧原子之间可形成稳定的五元环型分子内氢键,致使C-7-C-19单键不能自由旋转,C-20(甲基)被锁定在H-18anti的方向,与H-8α空间接近.
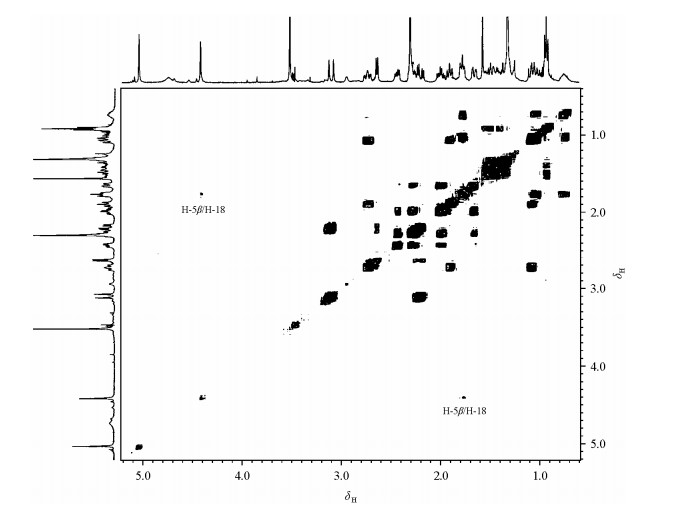
|
| 图 5 化合物1的DQFG-COSY谱 Fig. 5 DQFG-COSY spectrum of the compound 1 |
C-7取代C-6,14-桥蒂巴因衍生物的13C NMR,国外作者曾经进行过研究.报道的数据显示,部分信号归属不一致.例如对于C-17和C-18的信号归属,按Mazza等人[2]数据,C-17和C-18信号分别出现在δ28.0~30.0和δ 17.0~24.0范围,而Uff等人[3]报道的数据则相反,C-17和C-18信号则分别出现δ 17.0~24.0和δ 28.0~29.0范围.根据化合物1的结构,确认C-18信号归属有下列方法:一是H-5β与C-18相隔3个化学键,有远程13C-1H远程偶合,而H-5β与C-17则通过HMBC谱确认没有;二是H-5β与H-18anti之间具有W型远程偶合关系,可通过DQF-COSY谱(图 5)确认;三是在氘代氯仿溶液中,由于分子内氢键作用,6-OMe和H-20与H-18anti之间的空间接近,首先通过NOE实验[图 2(d)和(h)]确认H-18anti信号,然后通过2D HSQC谱(图 4)确认C-18信号.结果显示,C-18信号是出现在δ17.0~24.0范围,而C-17信号则出现在δ28.0~30.0范围,与Mazza等人的数据一致.
图 6显示化合物1的单晶X射线衍射的分子结构.可见,分子中基本骨架的质子间空间取向与图 2中NOE信号强度的基本特征是一致的.例如,图 2(c)中,选择激发δ 4.43 (H-5β)信号,产生5个NOE信号:H-15e (1.8%),H-7β
1D NOE实验是在溶液中进行,得到的是溶液构象的信息,其中有些信息在单晶X线衍射的分子结构中不容易得到.例如,在图 2(b)中,选择激发δ 5.08单峰(19-OH),产生3个NOE信号:H-20,H-7β和6-OMe,说明在溶液中C-19羟基与6-甲氧基的氧原子之间可产生稳定的五环型分子内氢键,C-7-C-19单键不能自由旋转,C-20(甲基)被限制在H-18anti附近.这些信息在图 6的单晶X射线衍射的分子结构中是不容易得到的.图 2(c)显示,选择激发H-5β,δ 1.66和δ 2.02产生的NOE信号,它们的同碳偶合常数为-12.2 Hz,邻位偶合常数分别为11.2和5.3 Hz,表明存在aa型邻位偶合,氮杂六元环为椅式构象,并且δ 1.66为H-15e,而δ 2.02为H-15a.H-16e和H-16a在DQF-COSY谱(图 5)中利用与H-15e和H-15a的偶合相关信号可得到确认.另外,图 2(e)显示,对H-9(δ 2.66双峰)进行选择激发,氮甲基(δ 2.31单峰)产生强度为(5.2%)的NOE信号,说明二者空间接近.以上事实与其立体结构[图 3(a)]和图 6中单晶X线衍射的测定结果一致.
3 结论在C-7取代C-6,14-桥蒂巴因衍生物的NMR谱中,不同键型信号的辨别和裂分及复杂的重叠信号的归属存在一定困难.本文应用多频率位移选择激发1D NOESY技术与2D NMR相结合的方法进行了研究,取得满意结果.结果表明,对于C-7α和β差向异构体的测定,1D NOE谱是简单而可靠的方法,不受样品浓度影响和杂质信号干扰,也不需要标准品对照,使用方便,对H-5β(δ 5.00附近)半峰宽较大的单峰进行选择激发,观测H-7βNOE信号,在30 min内就可得到结果.在氘代氯仿溶液中化合物1的C-19羟基与6-甲氧基的氧原子之间可产生稳定的五元环型分子内氢键,在1D NOESY实验中,通过选择激发H-20或者6-OMe可以得到单晶X射线衍射的结果难以得到的溶液构象信息.
| [1] | Fulmor W, Lancaster J E, Morton G O et al . Nuclear magnetic resonance sduties in the 6, 14-endo-ethenotetrahydrothebaine series[J]. J Am Chem Soc , 1967, 89 (13) : 3 322-3 325 DOI:10.1021/ja00989a601 |
| [2] | Mazza S M . Determining C-7 stereochemistry in C-7-substituted 6a, 14a-endo-ethano-and 6a-14a-endo-ethenotetrahydrothebaines by 13C NMR[J]. Magn Reson Chem , 1993, 31 : 444-446 DOI:10.1002/(ISSN)1097-458X |
| [3] | Uff B C, Mallard A S, Davis J A et al . NMR spectra and stereochemistry of some 7-substituted 6, 14-bridged thebaine derivatives[J]. Magn Reson Chem , 1985, 23 : 454-459 DOI:10.1002/(ISSN)1097-458X |
| [4] | Mazza S M, Erickson R H, Blake P R et al . Two-dimensional homonuclear and hetreonuclear correlation NMR diprenorphine a ptrotopic 6α-14α-endo-ethenotetrahydrothebaine[J]. Magn Reson Chem , 1990, 28 : 675-681 DOI:10.1002/(ISSN)1097-458X |
| [5] | Jiang Dan(姜丹), Miao Zhen-chun(缪振春) . NMR study on 1, 2-substituted ethylene derivatives(1, 2-二取代苯乙烯衍生物的NMR研究)[J]. Chinese J Magn Reason(波谱学杂志) , 2013, 30 (1) : 121-130 |
 2015, Vol. 32
2015, Vol. 32



