文章信息
- 戴晨晔, 刘买利, 李从刚
- DAI Chen-ye, LIU Mai-li, LI Cong-gang
- 低盐和高盐环境下α-Synuclein构象的19F NMR研究
- Salt Content-Dependent Conformational Changes of α-Synuclein Studied by 19F NMR
- 波谱学杂志, 2015, 32(1): 33-40
- Chinese Journal of Magnetic Resonance, 2015, 32(1): 33-40
- http://dx.doi.org/10.11938/cjmr20150104
-
文章历史
收稿日期: 2014-05-05
收修改稿日期: 2015-01-11


DOI:10.11938/cjmr20150104
2. 中国科学院大学,北京 100049
2. University of Chinese Academy of Sciences, Beijing 100049, China
帕金森病是主要的神经退行性疾病之一,其患者大脑内会出现特征性标志物,路易小体(Lewy body).由140个氨基酸所组成的突触核蛋白α-synuclein(AS)因大量存在于路易小体内而被广泛认为与帕金森病相关[1].
AS在溶液中为天然无结构蛋白,可以分为3个部分:N端,第1~60位氨基酸残基,包含4个不完全重复的保守片段(KTKEGV);NAC区域(NAC region),中间的第61~95位氨基酸残基,这一区域有3个上述的保守KTKEGV重复片段;C端,第96~140位氨基酸残基,富含酸性氨基酸和脯氨酸,带有大量的负电荷.N端和NAC区域很容易形成α-螺旋(α-helix)类型的二级结构,是其与生物膜相互作用的区域;NAC区域在AS纤维化的过程中作为疏水中心,对AS的聚集至关重要[2];酸性的C端则表现了极强的亲水性,在水溶液、膜环境及纤维中都没有稳定的二级结构.
最近的一项研究发现在低盐和高盐两种环境下AS会聚集形成不同形态的不溶聚合物.在低盐环境下会形成带状(ribbon)不溶聚合物,其结构比较松散,耐受蛋白酶K的时间为5 min;而高盐环境下会形成纤维状(fibril)不溶聚合物,其结构较为紧密,耐受蛋白酶K的时间为30 min.这两种不溶聚合物的细胞毒性也有差异,高盐环境下所形成的纤维状不溶聚合物细胞毒性更强[3].
有研究者发现盐浓度的不同会影响AS的聚集速率.全长AS在高盐环境下的聚集速率要高于低盐环境下的聚集速率.而切除AS的C端或者加入精胺(spermine)之后,盐浓度的变化对AS的聚集速率影响不大[4].同时另一项研究发现AS及其常见突变体在溶液中存在长程的相互作用[5, 6],C端与N端以及NAC区域都存在相互作用[7, 8].所以低盐和高盐环境下AS聚集速率的不同或许和蛋白质分子内相互作用有关[9].
核磁共振(NMR)方法能够提供生物大分子不同态之间的动态转变过程的信息,并且可以从原子水平上对生物大分子的结构进行表征,能够提供蛋白质分子内不同部位的变化信息,因此NMR是研究天然无结构蛋白的理想工具之一.近年来,研究发现19F NMR对其所处的环境非常敏感[10-12],加上其天然丰度高(100%)、具有很高的旋磁比、背景信号少这些特性,19F NMR已成为研究蛋白质结构变化的灵敏探针.当蛋白质的结构发生变化,19F探针的化学位移会相应地发生改变[13].通过生物合成的方法将氟代酪氨酸、苯丙氨酸或色氨酸引入蛋白质的表达中,就可以实现对应芳香氨基酸位点的19F标记.通过19F NMR方法,可以观察不同功能状态下蛋白质结构的变化[14].
本文对AS进行3-氟代酪氨酸标记,通过19F NMR对其处在不同溶液环境下的构象进行研究,发现AS在低盐和高盐环境构象不同,AS在低盐中的构象比较紧密,而在高盐下比较松散.我们同时在低盐环境下通过19F NMR谱观察到样品有两种不同构象共存,而其它方法却没有观察到这样的现象,这表明19F NMR是研究天然无结构蛋白构象变化的灵敏探针.
1 实验部分 1.1 AS的表达和纯化 1.1.1 15N标记AS的表达将含有整合AS基因序列的pT7-7质粒的大肠杆菌(BL21DE3)单克隆菌株接种于15N标记氯化铵的基本培养基(M9)中.37℃下培养至OD(opticaldensity)值为0.6,加入异丙基硫代半乳糖苷(IPTG)至终浓度为0.5 mmol/L,于37℃条件下诱导6 h.7 000 g离心10 min后去上清,收集沉淀[15].
1.1.2 15N和19F特殊标记的双标AS的表达将含有整合AS基因序列的pT7-7质粒的大肠杆菌(BL21 DE3)单克隆菌株接种于TY培养基中37℃培养2 h,之后离心,将菌转入15N标记氯化铵的基本培养基(M9)中.37℃下培养至OD值为0.4,加入草甘膦(0.5 g/L)、L-苯丙氨酸(60 mg/L)、L-色氨酸(60 mg/L)、3-氟代酪氨酸(70 mg/L).37℃下培养至OD值为0.6,加入异丙基硫代半乳糖苷(IPTG)至终浓度为0.5 mmol/L,于37℃条件下诱导6 h.7 000 g离心10 min后去上清,收集沉淀[10].
1.1.3 AS的纯化将细菌超声裂解后,煮沸细胞匀浆,使大部分细胞蛋白沉淀;取上清液,加入硫酸链霉素(10 mg/mL)沉淀球蛋白;再取上清液,加入大量硫酸铵(360 mg/mL)使溶液中余下蛋白沉淀[16].溶解沉淀,用DEAE柱通过缓冲液20 mmol/L Tris (pH=7.7)在0~500 mmol/L氯化钠梯度下洗脱纯化.取含有AS的流出液(通过SDS-PAGE判断)用S100分子筛柱(SephacrylTM S-100 GE Healthcare)进一步纯化.将纯化好的蛋白质冻干备用.
1.2 核磁共振实验 1.2.1 1H-15N HSQC实验HSQC实验在Bruker Avance 850 MHz谱仪上完成.将冻干样品分别溶于低盐缓冲溶液(20 mmol/L磷酸缓冲液,10%重水,pH=6.0)和高盐缓冲溶液(20 mmol/L磷酸缓冲液,200 mmol/L氯化钠,10%重水,pH=6.0);实验温度为288 K;实验条件为:谱宽均为7 653 Hz×2 240 Hz,采样数据点阵t2×t1=2 048×256,累加次数ns=16,弛豫等待时间d1=1.0 s.谱图化学位移归属来源于BioMagResBank (BMRB entry number 16543).
1.2.2 1D 19F NMR实验1D 19F NMR实验Bruker 600 MHz谱仪(Oxford磁体)上完成.将冻干样品分别溶于低盐缓冲溶液(20 mmol/L磷酸缓冲液,10%重水,pH=6.0)和高盐缓冲溶液(20 mmol/L磷酸缓冲液,200 mmol/L氯化钠,10%重水,pH=6.0);实验温度为288 K;实验条件为:累加次数ns=720,谱宽sw=11 kHz,采样时间aq=0.72 s,弛豫等待时间d1=2.0 s.
1.2.3 溶剂诱导的同位素效应将完成核磁共振实验的样品直接冻干,之后加入相应重水含量的水和重水混合液,以保持体系中pH,离子强度等条件完全一致.之后采集氟谱,对不同重水含量下的氟谱进行分析[14, 17].
文中的溶剂诱导的同位素效应由如下等式算出:
| $ \Delta \delta = \delta ({{\rm{D}}_{\rm{2}}}{\rm{O}}) - \delta ({{\rm{H}}_{\rm{2}}}{\rm{O}}) $ | (1) |
另外也可以通过加入一个内标,从而获得一个相对的位移值以说明对应位点的暴露程度:
| $ \Delta {\delta ^*} = \frac{{\delta {{({{\rm{D}}_{\rm{2}}}{\rm{O}})}_{{\rm{protein}}}} - \delta {{({{\rm{H}}_{\rm{2}}}{\rm{O}})}_{{\rm{protein}}}}}}{{\delta {{({{\rm{D}}_{\rm{2}}}{\rm{O}})}_{{\rm{stan}}{\rm{dard}}}} - \delta {{({{\rm{H}}_{\rm{2}}}{\rm{O}})}_{{\rm{stan}}{\rm{dard}}}}}} $ | (2) |
AS包含4个酪氨酸残基,分别处于蛋白质的39、125、133和136位,其中39位酪氨酸残基处于蛋白质的N端;125、133和136位酪氨酸残基处于蛋白质的C端.我们分别采集了低盐环境下(20 mmol/L磷酸缓冲溶液pH=6.0)和高盐环境下(20 mmol/L磷酸缓冲溶液,200 mmol/L氯化钠pH=6.0) 3FY标记的AS的19F NMR谱[图 1(a)]以及相应条件下1H-15N HSQC谱图[图 1(b)].游离的3-氟代酪氨酸(3FY)被加入到样品中作为内标对19F NMR的化学位移进行定标,其化学位移为δF -135.28 [图 1(a)].谱图中除去内标的信号之外,能够十分清晰地看到4个峰,它们分表代表了AS上4个酪氨酸残基的信号.4个谱峰的归属在图中标出[图 1(a)][10].
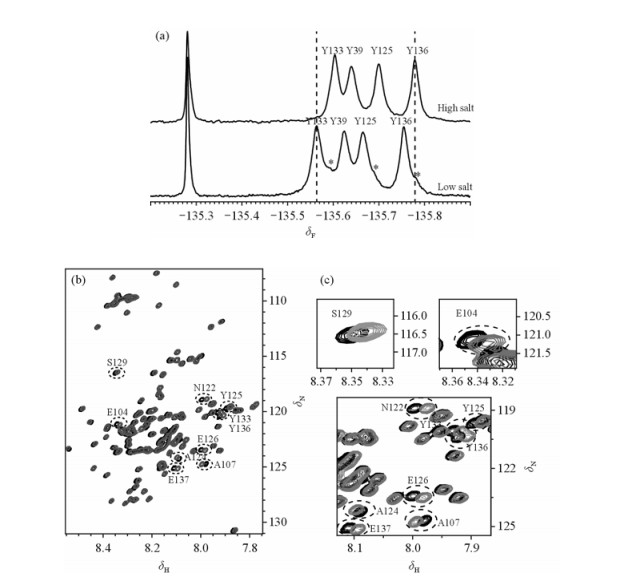
|
| 图 1 (a)图为不同盐浓度下氟标AS氟谱,化学位移δF-135.28为加入的内标自由3-氟代酪氨酸信号,其中低盐环境下的2态由*号标记;(b)图为低盐(黑色)和高盐(灰色)环境下1H-15N HSQC谱图叠加;(c)图为低盐(黑色)和高盐(灰色)环境下1H-15N HSQC谱图叠加局部放大图 Fig. 1 (a) Comparison of fluorine spectra of low salt condition and high salt condition; (b) overlay of HSQC spectra at low salt (black) and high salt (gray) conditions; (c) partial enlarged view of HSQC spectra overlay at low salt (black) and high salt (grey) conditions |
高盐环境与低盐环境相比,AS上4个酪氨酸残基的氟信号都明显向高场移动,其移动的程度分别为:22 Hz (Y133),9 Hz (Y39),19 Hz (Y125),13 Hz (Y136),而相应情况下1H-15N HSQC谱图观察到的谱峰的变化不如19F NMR谱明显.通过1H-15N HSQC谱图我们也能够看出AS在高盐环境中部分的谱峰发生了移动,其中以104, 107, 122, 124, 125, 126, 129, 133, 136, 137位氨基酸残基最为显著[图 1(b)及图 1(c)].这些位点都处于AS的C端,可以看出随着盐浓度的升高,C端的构象发生了一定的变化.
另外,在低盐环境下的19F NMR谱图[图 1(a)]中,明显存在另一套强度较小的谱峰(*标记),预示AS在低盐溶液中存在两种构象,我们将这两种构象称为1态和2态.然而同样在低盐环境下通过1H-15N HSQC谱图却只能观察到一套谱峰的存在,这表明构象交换速率在不同的核的化学位移时间尺度上相对速率不一样,在19F NMR谱上表现为慢交换,而在1H与15N NMR谱上表现为快交换.因此,19F NMR谱对蛋白质的构象变化更为敏感.
2.2 溶剂诱导的同位素效应提供不同溶液环境下蛋白质的结构信息通过氟标AS 1D 19F NMR实验,我们发现AS在低盐环境下存在两种构象,其中低丰度构象的19F NMR化学位移与高盐环境下构象的19F NMR的化学位移相近,但是两套谱峰所对应的构象还需要进行进一步表征.通过检测氟标蛋白质的溶剂暴露情况可以确定蛋白质不同区域下亲水疏水的情况,能够了解蛋白质的折叠情况,同时也可以观测到蛋白质构象的变化.
溶剂诱导的同位素效应(Solvent Induced Isotropic Shift, SIIS)能够为我们提供区分蛋白质标记位点的溶剂暴露程度的信息,可以用来确定蛋白质构象的松散或紧密程度.随着溶液中重水含量的升高,19F NMR谱中的信号都会向高场移动.标记位点氟原子的暴露程度越高,其19F NMR信号的化学位移的移动就越大.换句话说,通常情况下当氟原子所处的区域越接近无规结构,其信号的移动就会越明显,反之亦然[14].
我们将两个3FY标记的AS样品分别溶于含有10%和95% (V/V)重水的溶液中.随着重水含量的提高,这两组样品的信号都向高场移动,不过移动的幅度却有所不同(图 2,表 1).并且由于化学位移变化的差别,原来部分重叠的两个Y136的信号在重水中完全分开了,我们能够更清晰的看到前文中所提到的2态的信号(由于谱峰重叠只观察到了Y136对应的两套峰),明显地反映了低盐环境下AS存在不同构象.
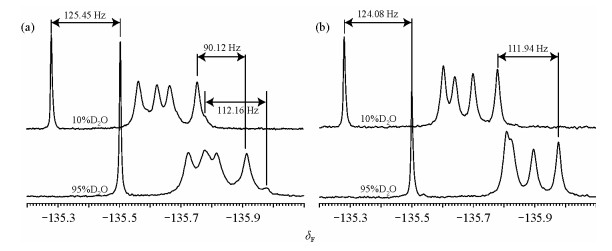
|
| 图 2 (a)低盐环境不同重水含量氟谱谱峰的移动情况;(b)高盐环境不同重水含量氟谱谱峰的移动情况 Fig. 2 (a) SIIS under low salt condition; (b) SIIS under high salt condition |
| Y133 | Y39 | Y125 | Y136 | Free Tyr | ||
| 低盐环境 | 1态Δδ | 90.87 | 86.59 | 85.16 | 90.12 | 125.45 |
| 1态Δδ* | 0.724 | 0.690 | 0.679 | 0.718 | - | |
| 2态Δδ | - | - | - | 112.16 | 125.45 | |
| 2态Δδ* | - | - | - | 0.894 | - | |
| 高盐环境 | Δδ | 115.78 | 102.58 | 111.16 | 111.94 | 124.08 |
| Δδ* | 0.933 | 0.827 | 0.896 | 0.902 | - | |
| *表示相对位移程度,数值越小表示溶剂暴露程度越低.其定义见(2)式 | ||||||
从表 1中可以看出:加入的内标3-氟代酪氨酸在溶液中暴露程度最高,因此在溶液诱导的同位素效应实验中产生了最大的位移(约125 Hz).在低盐环境下AS的两种构象的暴露程度并不相同,一种构象的位移较小(约90 Hz),而另一种的位移较大(约110 Hz).相应而言高盐环境下AS几个峰的位移也比较大(约110 Hz).如前文所说,蛋白质的结构越暴露,溶剂诱导的同位素效应所造成的位移就越大,所以我们可以进一步确定,在低盐的环境下两种状态的AS共存,一种相对更加打开,而另一种则更加紧密.
近年来人们发现AS在高盐和低盐的环境下形成了不同形态的不溶聚集物,其中高盐环境下形成的不溶聚集物装配更加紧密.不过研究者认为这两种不同环境下形成的不溶聚集物有着同样的前体(same precursor AS)[3].我们的研究发现AS在这两种环境下的构象并不相同,低盐环境下AS的构象相对紧密,高盐环境下的构象相对暴露.
研究发现高盐环境下的聚集速率高于低盐环境,这与蛋白质分子内相互作用有关.在低盐环境下AS的C端会和N端有相互作用,将疏水区NAC区域保护起来,从而降低了聚集速率[4, 7].高盐环境下AS的结构更加暴露,使得NAC区域能够更加充分地参与聚集,所生成的不溶聚集物能更紧密地装配;而低盐环境下结构相对紧密,NAC区域被保护起来,不能充分参与AS纤维化过程中的装配,所以在此环境下形成的不溶聚集物更加松散.这一点在溶剂诱导的同位素效应中也得到了证明:C端在高盐环境下溶剂诱导的同位素效应所导致的化学位移移动更大,因而高盐环境更加暴露.我们19F NMR的研究结果,很好地解释了低盐和高盐环境下所形成的不溶聚集物形态的差异.
我们发现19F是研究天然无结构蛋白质构象变化的高灵敏探针,其化学位移对于蛋白质结构的微小改变十分敏感,本实验中在低盐环境下能够观察到AS的两种构象就是一个有力的证据.通过标记蛋白质中的芳香氨基酸,或者将所需位点突变为芳香氨基酸后再进行标记,就可以很方便的将这种高灵敏性的探针引入蛋白质,并应用于天然无结构蛋白的研究中.
3 结论我们对天然无结构蛋白AS进行3-氟代酪氨酸标记,运用19F NMR的方法证实了AS在溶液中具有两种状态,证明了19F NMR的方法对于天然无结构蛋白构象研究的优越性.通过19F NMR方法,我们发现AS在低盐环境中的构象比较紧密,而在高盐环境下比较松散,这种在溶液中起始的构象差异可能是导致最终AS纤维结构与生物效应不同的根本原因.
| [1] | Spillantini M G, Schmidt M L, Lee V M Y et al . α-Synuclein in Lewy bodies[J]. Nature , 1997, 388 (6645) : 839-840 DOI:10.1038/42166 |
| [2] | Giasson B I, Murray I V J, Trojanowski J Q et al . A hydrophobic stretch of 12 amino acid residues in the middle of α-synuclein is essential for filament assembly[J]. J Biol Chem , 2001, 276 (4) : 2380-2386 DOI:10.1074/jbc.M008919200 |
| [3] | Bousset L, Pieri L, Ruiz-Arlandis G et al . Structural and functional characterization of two α-synuclein strains[J]. Nature communications , 2013, 4 (2575) : 1-13 |
| [4] | Hoyer W, Cherny D, Subramaniam V et al . Impact of the acidic C-terminal region comprising amino acids 109-140 on α-synuclein aggregation in vitro[J]. Biochemistry , 2004, 43 (51) : 16233-16242 DOI:10.1021/bi048453u |
| [5] | Dedmon M M, Lindorff-Larsen K, Christodoulou J et al . Mapping long-range interactions in α-synuclein using spin-label NMR and ensemble molecular dynamics simulations[J]. J Am Chem Soc , 2004, 127 (2) : 476-477 |
| [6] | Bertoncini C W, Fernandez C O, Griesinger C et al . Familial mutants of α-synuclein with increased neurotoxicity have a destabilized conformation[J]. J Biol Chem , 2005, 280 (35) : 30649-30652 |
| [7] | Bertoncini C W, Jung Y S, Fernandez C O et al . Release of long-range tertiary interactions potentiates aggregation of natively unstructured α-synuclein[J]. P Natl Acad Sci USA , 2005, 102 (5) : 1430-1435 DOI:10.1073/pnas.0407146102 |
| [8] | Bussell R, Eliezer D . Residual structure and dynamics in parkinson's disease-associated mutants of α-synuclein[J]. J Biol Chem , 2001, 276 (49) : 45996-46003 DOI:10.1074/jbc.M106777200 |
| [9] | Fernández C O, Hoyer W, Zweckstetter M et al . NMR of α-synuclein-polyamine complexes elucidates the mechanism and kinetics of induced aggregation[J]. EMBO J , 2004, 23 (10) : 2039-2046 DOI:10.1038/sj.emboj.7600211 |
| [10] | Li C, Lutz E A, Slade K M et al . 19F NMR studies of α-synuclein conformation and fibrillation[J]. Biochemistry , 2009, 48 (36) : 8578-8584 DOI:10.1021/bi900872p |
| [11] | Wang G F, Li C, Pielak G J . 19F NMR studies of α-synuclein-membrane interactions[J]. Protein Science , 2010, 19 (9) : 1686-1691 DOI:10.1002/pro.449 |
| [12] | Wang G F, Li C, Pielak G J . Probing the micelle-bound aggregation-prone state of α-synuclein with 19F NMR spectroscopy[J]. Chem Bio Chem , 2010, 11 (14) : 1993-1996 DOI:10.1002/cbic.v11:14 |
| [13] | Cobb S L, Murphy C D . 19F NMR applications in chemical biology[J]. J Fluorine Chem , 2009, 130 (2) : 132-143 DOI:10.1016/j.jfluchem.2008.11.003 |
| [14] | Kitevski-LeBlanc J L, Prosser R S . Current applications of 19F NMR to studies of protein structure and dynamics[J]. Prog Nucl Magn Reson Spectr , 2012, 62 : 1-33 DOI:10.1016/j.pnmrs.2011.06.003 |
| [15] | Zhang Z, Dai C, Bai J et al . Ca2+ modulating α-synuclein membrane transient interactions revealed by solution NMR spectroscopy[J]. Biochimica et Biophysica Acta (BBA) -Biomembranes , 2014, 1838 (3) : 853-858 DOI:10.1016/j.bbamem.2013.11.016 |
| [16] | Hoyer W, Antony T, Cherny D et al . Dependence of α-synuclein aggregate morphology on solution conditions[J]. J Mol Biol , 2002, 322 (2) : 383-393 DOI:10.1016/S0022-2836(02)00775-1 |
| [17] | Gerig J . Fluorine NMR of proteins[J]. Prog Nucl Magn Reson Spectr , 1994, 26 : 293-370 DOI:10.1016/0079-6565(94)80009-X |
 2015, Vol. 32
2015, Vol. 32



