文章信息
- 李楠, 孙鹏, 刘买利, 张许
- LI Nan, UN Peng, LIU Mai-li, ZHANG Xu
- 磷脂酰胆碱SUV的NMR研究
- An NMR Study of Phosphatidylcholine Small Unilamellar Vesicles
- 波谱学杂志, 2014, 31(4): 572-578
- Chinese Journal of Magnetic Resonance, 2014, 31(4): 572-578
-
文章历史
收稿日期: 2014-04-24
收修改稿日期: 2014-10-28


2. 中国科学院大学,北京 100049
2. University of Chinese Academy Sciences, Beijing 100049, China
磷脂是非常重要的脂质体,是细胞膜的重要组成部分[1-9],具有维持细胞内外物质交换的平衡,以及保证细胞内代谢活动和功能正常等功能.磷脂在生物体很多关键组织,如脑[3]、卵细胞、肝脏等中广泛存在,具有乳化、活化细胞等功能.磷脂还是神经髓鞘的重要组成部分,人体神经细胞和大脑细胞膜主要就是由磷脂所构成,磷脂膜受损将可能造成智力减退.
在人的血液中,占磷脂总含量的50%左右磷脂酰胆碱和鞘磷脂[10-12]具有非常重要的功能,是脂蛋白的主要骨架成分,他们通过形成胶束以转运脂类等难溶于水的代谢物组分.脂蛋白的通常结构是:外面包围着由PC和SM(sphingmyelin)构成的单层磷脂膜的胶束,载脂蛋白B100分布在球状结构的表面占30%左右的区域,非极性的甘油三酯和胆固醇酯构成疏水核心.少量的甘油三酯和胆固醇也会分布或者伸展至表面区域[13].
研究表明,脂蛋白中磷脂的组成和形态变化与某些疾病的发生和发展密切相关,如动脉粥样硬化[15],癌症和老年痴呆等.因为不同密度脂蛋白具有不同的功能.血液中的脂蛋白根据密度,颗粒大小和化学组成的不同可分为[16]:乳糜微粒,VLDL(very low density lipoprotein),LDL(low density lipoprotein),IDL(intermediate density lipoprotein),HDL(high density lipoprotein).低密度脂蛋白的主要功能是转运胆固醇至其他细胞或者组织,而高密度脂蛋白则负责将其他细胞或者组织中的胆固醇运输到肝脏等组织中进行分解[17-22],以清扫血管,使血管循环顺畅,被认为是“血管清道夫”.因此,不同高密度脂蛋白在血液中的含量已经成为目前心血管疾病临床诊断的一个重要的参考指标,血清高密度脂蛋白胆固醇的降低,或者低密度脂蛋白含量的增加,预示着心血管疾病的危险性增加.
因此,明确磷脂的组成形态对于明确磷脂的生物化学作用,包括建立细胞膜及其调节功能[23]、体内平衡、新陈代谢和信号传导[10]、增强人体的免疫力和再生力,都具有重要的意义.
本文以人体中最常见的磷脂-磷脂酰胆碱为模型,研究磷脂酰胆碱(Phosphatidyl-choline,PC)形成的单室小脂质体(small unilamellar vesicle,SUV)的形态,以明确磷脂酰胆碱可能形成的胶束形态,理解脂蛋白中磷脂酰胆碱的作用.
1 实验部分 1.1 SUV的制备实验所用PC (99%)、重水(99.99%)和Centricon-100透析管均购买于Sigma公司.SUV制备过程以文献[13]所提供的标准程序进行,具体如下:首先将PC溶于氯仿或甲醇中,所得溶液通过旋转蒸发仪得到单层薄膜,把这个薄膜放入干燥箱中烘干12 h,再把这个脂质膜在脱氧的50 mmol/L KCl (99%D2O)溶液中重悬浮,把这个悬浮液放入超声仪中,在功率260 W超声3~4 h到溶液澄清.得到SUV溶液,再经过超速离心得到2/3的上清液.最后拿Centricon-100通过50 mmol/L KCL溶液,透析得到较纯的SUV[13]放入4℃冰箱中待进行NMR实验.
1.2 SUV形态分析方法常规检测磷脂的方法有薄膜色谱法[24],高效液相层析[25]和核磁共振技术(NMR)[13, 14]等.磁共振所需样品量少,可以提供原子水平胶束的形态结构信息,因此是明确胶束形成微观机制的重要方法.我们将采用一维(1D)和二维(2D) NMR技术分析PC所形成的SUV形态.
所有实验均在Bruker AVANCE 500型核磁共振谱仪上进行,测试温度为310.5 K,对应的质子共振频率为500.13 MHz.
1.2.1 1D 1H NMR谱样品的1D 1H NMR采用WATERGATE W5进行溶剂抑制.谱宽5 000 Hz,采样点数64 k,累加次数256,恢复时间为1 s.
1.2.2 2D NMR实验由于一维氢谱的分辨率不高,且SUV的谱线较宽,谱峰重叠严重,因此无法得到更为详细的胶束微观结构信息,因此我们采用了1D 1H-14N HSQC谱来直接检测氮甲基的部分可以得到分辨率较高的谱图.1H-14N HSQC可以选择性检测胆碱氮甲基-N+(CH3)3信号,而PC就是胆碱的一种衍生物,因此采用这一方法将可以选择性检测其磷脂亲水端氮甲基信号[26, 27],有助于我们了解其囊泡的结构.
样品的2D HSQC实验采样直接维(1H维)和间接维(14N维)谱宽分别为5 000 Hz和144 Hz,采样点数分别为2 k和48,累加次数128,用于相干路径选择的梯度比例为:80:5.78,同时起到抑制水峰的作用[28].
2 结果与讨论 2.1 PC所形成的SUV的1D 1H NMR谱图 1是25 mmol/L PC所形成的SUV的1D 1H NMR谱,图 1(b)是放大的相应谱的氮甲基区域信号.从图中可发现,一维谱均具有较宽的谱线,表明PC已经聚集形成了SUV.但是由于谱线的重叠使得我们无法明确SUV的形态,但是,在对氮甲基区域的分析可以发现,该基团存在3个不同化学位移的谱线,如图 1(b)所示.带电的氮甲基具有亲水性,通常处在胶束的表面的亲水区域.3种不同的信号存在表明PC在SUV中可能存在几种不同的形式(Lysophosphatidylcholine或者phosphatidylcholine)或者处在不同的微观结构.

|
| 图 1 310.5 K时PC所形成的SUV样品的1H NMR谱.(a)全谱;(b)放大的氮甲基区域的谱图 Fig. 1 1H NMR spectra of SUV formed by PC at 310.5 K (a) and expanded (-N+(CH3)3 region) region (b) |
为了进一步明确该区域信号的具体信息,我们采用2D 1H-14N HSQC谱选择性观测氮甲基信号的特点,对PC的微观形态进行了进一步分析.结果如图 2所示.从图中可看出:在310.5 K,PC所形成的SUV在HSQC谱图中具有比一维谱更高的分辨率,谱中存在两组明显不同的氮甲基信号,分别对应一维谱中高场区域的两个信号.而与一维谱不同,一维谱中低场区域信号较强且较宽的谱线在二维谱中并没有信号产生,表明这一信号可能来源于PC的支链或者是PC中的杂质Phosphatidylethanolamine,而不是来自于-N+(CH3)3.另外,两组不同的磷脂分子极性头-N+(CH3)3信号也与常见的磷脂胆碱所在区域1H的横向弛豫时间测定结果相符合,有研究表明,该区域1H的(T2)衰减曲线呈双指数变化模式[13],因此,我们的研究结果进一步证明了磷脂分子可能存在两种不同的表现形式,即可能存在两种不同的环境.
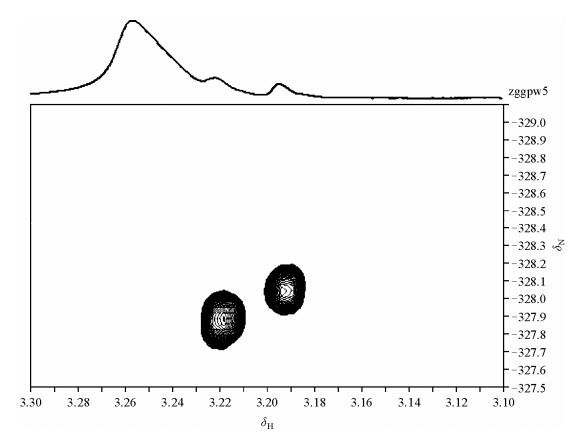
|
| 图 2 310.5 K时PC所形成的SUV的2D 1H-14N HSQC谱.二维谱上是其对应的一维氢谱 Fig. 2 1H-14N HSQC spectrum of SUV formed by PC at 310.5 K. the top spectrum is the corresponding 1D spectrum |
为了明确SUV中不同形态PC来源,我们利用顺磁离子的环境效应对SUV的形态进行了进一步分析.我们往PC所形成的SUV溶液中加入了不同浓度的顺磁Mn2+离子[29].由于Mn2+的顺磁效应,其加入将使得与其空间距离较近的信号表观弛豫速率加快,信号衰减加剧,强度消弱,且消弱效应与其空间距离相关.
结果如图 3所示,在加入0.145 mmol/L顺磁Mn2+时,高场区δ 3.175处的信号首先强度减弱,而低场区δ3.21处的信号强度没有明显变化,到顺磁Mn2+浓度达0.254 mmol/L时,两组信号同时减弱.表明两个氮甲基信号在胶束中不同位置,其所形成的胶束可能是一种双层胶束,而高场区δ3.175处的信号为外层信号,因其更加靠近胶束表面,故此受到溶剂顺磁效应的影响更大,信号随着Mn2+离子浓度的增加不断减小,而内层信号所受影响较小,只有在高浓度顺磁离子浓度时强度才减弱.

|
| 图 3 310.5 K时5 mmol/L PC所形成的SUV的2D 1H-14N HSQC谱.(a)是未加入Mn2+离子的SUV的谱图,(b)和(c)分别是加入了0.145 mmol/L和0.254 mmol/L Mn2+离子的SUV的谱图 Fig. 3 2D 1H-14N HSQC spectra of SUV formed by 5 mmol/L PC at 310.5 K. without Mn2+ ion (a), with 0.145 mmol/L ion (b), and 0.254 mmol/L ion (c), respectively |
脂蛋白中磷脂的组成和形态变化与某些疾病,如动脉粥样硬化,癌症和老年痴呆等的发生和发展密切相关.因此明确磷脂的组成形态将有助于明确磷脂的生物化学作用.本研究采用1D和2D NMR技术对PC所形成的SUV形态进行了分析,利用2D 1H-14N HSQC能够选择性检测PC氮甲基信号的特点,我们发现PC所形成的SUV为较为稳定的双层结构,这表明通常的磷脂脂蛋白可能是一种双层膜结构,而非我们通常所认为的单层结构.
| [1] | Filippov A, Munavirov B, Grobner G et al . Lateral diffusion in equimolar mixtures of natural sphingomyelins with dioleoylphosphatidylcholine[J]. Magn Reson Imaging , 2012, 30 (3) : 413-421 DOI:10.1016/j.mri.2011.12.010 |
| [2] | Smaby J M, Brockman H L, Brown R E . Cholesterol's interfacial interactions with sphingomyelins and phosphatidylcholines: hydrocarbon chain structure determines the magnitude of condensation[J]. Biochemistry , 1994, 33 (31) : 9 |
| [3] | Slotte J P . Sphingomyelin-cholesterol interactions in biological and model membranes[J]. Chem Phys Lipids , 1999, 102 (1-2) : 13-27 DOI:10.1016/S0009-3084(99)00071-7 |
| [4] | Ramstedt B, Slotte J P . Interaction of cholesterol with sphingomyelins and acyl-chain-matched phosphatidylcholines: a comparative study of the effect of the chain length[J]. Biophys J , 1999, 76 (2) : 908-915 DOI:10.1016/S0006-3495(99)77254-1 |
| [5] | Brown D A, London E . Structure and function of sphingolipid-and cholesterol-rich membrane rafts[J]. J Biol Chem , 2000, 275 (23) : 17 |
| [6] | Edidin M . The state of lipid rafts: from model membranes to cells[J]. Annu Rev Biophys Biomol Struct , 2003, 32 : 257-283 DOI:10.1146/annurev.biophys.32.110601.142439 |
| [7] | Mayor S, Rao M . Rafts: Scale-dependent, active lipid organization at the cell surface[J]. Traffic , 2004, 5 (4) : 231-240 DOI:10.1111/j.1600-0854.2004.00172.x |
| [8] | Pike L J . Lipid rafts: heterogeneity on the high seas[J]. Biochem J , 2004, 378 : 281-292 DOI:10.1042/bj20031672 |
| [9] | Simons K, Ikonen E . Functional rafts in cell membranes[J]. Nature , 1997, 387 (6633) : 569-572 DOI:10.1038/42408 |
| [10] | Niemela P, Hyvonen M T, Vattulainen I . Structure and dynamics of sphingomyelin bilayer: Insight gained through systematic comparison to phosphatidylcholine[J]. Biophys J , 2004, 87 (5) : 2 976-2 989 DOI:10.1529/biophysj.104.048702 |
| [11] | Niemela P S, Hyvonen M T, Vattulainen I . Influence of chain length and unsaturation on sphingomyelin bilayers[J]. Biophys J , 2006, 90 (3) : 851-863 DOI:10.1529/biophysj.105.067371 |
| [12] | Barenholz Y, Thompson T E . Sphingomyelin: biophysical aspects[J]. Chem Phys Lipids , 1999, 102 (1-2) : 29-34 DOI:10.1016/S0009-3084(99)00072-9 |
| [13] | Murphy H C, AlaKorpela M, White J J et al . Evidence for distinct behaviour of phosphatidylcholine and sphingomyelin at the low density lipoprotein surface[J]. Biochem Bioph Res Co , 1997, 234 (3) : 733-737 DOI:10.1006/bbrc.1997.6634 |
| [14] | Bi Yun-chen(毕允晨), Wang Yu-juan(王玉娟), Wang Jun-feng(王俊峰) . The nanodics: A novel tool to study membrane protein structure and function(Nanodisc体系在膜蛋白结构与功能研究中的应用)[J]. Chinese J Magn Reson(波谱学杂志) , 2011, 28 (2) : 177-189 |
| [15] | Campos H, Genest Jr J J, Blijlevens E et al . Low density lipoprotein particle size and coronary artery disease[J]. Arterioscler Thromb , 1992, 12 (2) : 187-195 DOI:10.1161/01.ATV.12.2.187 |
| [16] | Havel R J . Citation classic -the distribution and chemical-composition of ultracentrifugally separated lipoproteins in human-serum[J]. Cc/Life Sci , 1983 (46) : 23-23 |
| [17] | Tall A R . Plasma high density lipoproteins. Metabolism and relationship to atherogenesis[J]. J Clin Invest , 1990, 86 (2) : 379-384 DOI:10.1172/JCI114722 |
| [18] | Reichl D, Miller N E . The anatomy and physiology of reverse cholesterol transport[J]. Clin Sci , 1986, 70 (3) : 221-231 DOI:10.1042/cs0700221 |
| [19] | Gordon D J, Rifkind B M . High-density lipoprotein -the clinical implications of recent studies[J]. New Engl J Med , 1989, 321 (19) : 1 311-1 316 DOI:10.1056/NEJM198911093211907 |
| [20] | Miller N E . HDL metabolism and its role in lipid transport[J]. Eur Heart J , 1990, 11 : 1-3 DOI:10.1093/eurheartj/11.suppl_E.1 |
| [21] | Johnson W J, Mahlberg F H, Rothblat G H et al . Cholesterol transport between cells and high-density-lipoproteins[J]. Biochimica et biophysica Acta , 1991, 1 085 (3) : 273-298 |
| [22] | Huang Y D, Voneckardstein A, Assmann G . Cell-derived unesterified cholesterol cycles between different HDLs and LDL for its effective esterification in plasma[J]. Arterioscler Thromb , 1993, 13 (3) : 445-458 DOI:10.1161/01.ATV.13.3.445 |
| [23] | Fajardo V A, McMeekin L, LeBlanc P J . Influence of phospholipid species on membrane fluidity: a meta-analysis for a novel phospholipid fluidity index[J]. J Membr Biol , 2011, 244 (2) : 97-103 DOI:10.1007/s00232-011-9401-7 |
| [24] | Schneider P B . Permanent sensitive stain for choline-containing phospholipids on thin-layer chromatograms[J]. J Lipid Res , 1966, 7 (1) : 169-170 |
| [25] | Jungalwala F B, Evans J E, McCluer R H . High-performance liquid chromatography of phosphatidylcholine and sphingomyelin with detection in the region of 200 nm[J]. Biochem J , 1976, 155 (1) : 55-60 DOI:10.1042/bj1550055 |
| [26] | Mallol R, Rodriguez M A, Brezmes J et al . Human serum/plasma lipoprotein analysis by NMR: application to the study of diabetic dyslipidemia[J]. Prog Nucl Magn Reson Spectr , 2013, 70 : 1-24 DOI:10.1016/j.pnmrs.2012.09.001 |
| [27] | Mao J, Jiang L, Jiang B et al . 1H-14N HSQC detection of choline-containing compounds in solutions[J]. J Magn Reson , 2010, 206 (1) : 157-160 DOI:10.1016/j.jmr.2010.06.003 |
| [28] | Mao Xi-an(毛希安) . A simple method for clean water signal suppression(一个获得压水峰良好效果的简单方法)[J]. Chinese J Magn Reson(波谱学杂志) , 2014, 31 (1) : 1-6 |
| [29] | Schmidt C F, Barenholz Y, Thompson T E . A nuclear magnetic resonance study of sphingomyelin in bilayer systems[J]. Biochemistry , 1977, 16 (12) : 2 649-2 656 DOI:10.1021/bi00631a011 |
 2014, Vol. 31
2014, Vol. 31



