文章信息
- 马敏山, 雷新响
- MA Min-shan, LEI Xin-xiang
- 手性硫脲在DMAP条件下对布洛芬类药物的NMR手性识别
- Chiral Recognition of Ibuprofen Enatiomers by a Chiral Thiourea in the Presence of DMAP Using NMR
- 波谱学杂志, 2014, 21(4): 564-571
- Chinese Journal of Magnetic Resonance, 2014, 21(4): 564-571
-
文章历史
收稿日期: 2014-02-17
收修改稿日期: 2014-10-29


众所周知,手性是自然界的基本属性,自然界的基本生命现象和定律由手性产生.目前,药物大部分都是具有手性的,而手性药物对映异构体常常表现出不同的生理和治疗效果.一般来说,只有一种形式的对映体有药物活性,而另一种的药物活性很小或作用不同甚至截然相反[1, 2].据统计,已知药物中有30~40%是手性的,单一对映体制剂的市场份额逐年增加,手性分析和分离已成为药理学研究和制药工业日益迫切的课题[3].布洛芬[图 1(a)]是一种重要的非甾体类抗炎药(NSAIDs),具有抗炎、镇痛作用,是治疗类风湿关节炎和骨关节炎的主要药物之一,广泛应用于临床,并且对动脉粥样硬化有潜在的积极作用[4].布洛芬分子是含有一个手性中心的羧酸,有两个对映体[图 1(b),(c)].研究发现,(S)-(+)-布洛芬为主要活性成分,而(R)-(-)-对映体为非活性成分,仅有很少量的(R)-(-)-对映体在代谢过程中可以转换成(S)-(+)-对映体[5].并且,(R)-(-)-对映体可以在脂肪组织丙三醇酯中储存,具有多种潜在的毒副作用,包括胃肠道毒性、水钠潴留、肾灌注降低及过敏反应等[6-8].
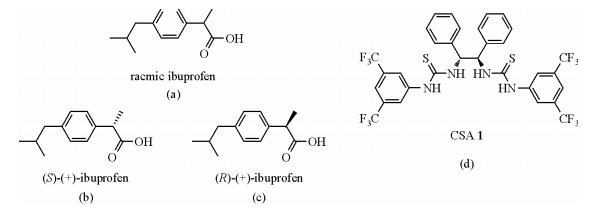
|
| 图 1 外消旋布洛芬(a)、右旋布洛芬(b)、左旋布洛芬(c)和CSA 1(d)结构图 Fig. 1 Structure of racemic ibuprofen (a), its enantiomers (b), (c) and CSA 1(d) |
目前,色谱法和核磁共振(NMR)法为常用的手性分析方法,色谱法过程烦琐费时,成本较高,而核磁共振(NMR)法具有快速、方便等特点.核磁共振研究手性化合物的方法主要有3种:第一种是应用手性衍生化试剂的NMR分析,衍生化反应使对映异构体转化为非对映异构的衍生物,Katarzyna Błazewska[9]通过衍生化的方法对布洛芬进行了分析识别,但是该方法操作过程复杂、耗时,不能快速测定;第二种是手性位移试剂的NMR分析,这类配位化合物为弱Lewis酸,具有顺磁性,往往会造成NMR谱峰增宽,而且价格昂贵;第三种是手性溶剂化试剂(Chiral Solvating Agent, CSA)的NMR分析法.在溶剂中手性溶剂化试剂与两个对映异构体通过非共价键、范德华力、氢键等作用力生成非对映络合物,从而使NMR信号有所区别.该方法操作简单,适用范围广,成为了普遍使用的手性分析方法[10-13].
近年来,布洛芬的多种手性溶剂化试剂被相继报道,例如,β-环糊精[14],手性氨基醇[15, 16],大环化合物[17]等,然而大部分的手性溶剂化试剂效果不佳,α-H化学位移差值(ΔΔδ)最大仅为0.045.另外,少数手性溶剂化试剂对布洛芬有一定的识别效果[18-20],但对该“家族”的其它化合物进行有效分析的研究尚未见文献报道.因此发展结构简单、高效、广谱的布洛芬类化合物的手性溶剂化试剂是非常需要的.本文以手性硫脲[图 1(d)]为CSA 1,在4-二甲氨基吡啶(4-dimethylaminopyridine, DMAP)参与下,对布洛芬等手性非甾体类抗炎药的对映体识别进行了分析,同时为了考察CSA 1分析布洛芬对映体纯度的能力,测定了6个含有CSA 1/DMAP且具有不同ee.值布洛芬的CDCl3溶液,实验表明运用NMR分析的结果与理论值十分吻合.
1 实验部分 1.1 仪器及试剂布洛芬、(S)-(+)-布洛芬、氟比洛芬、萘普生、酮洛芬和吲哚洛芬均购自百灵威科技有限公司;CSA1试剂购自大赛璐药物手性技术(上海)有限公司;DMAP购自安耐吉化学;CDCl3购自青岛腾龙微波科技有限公司.
采用Bruker Avance 500型核磁共振波谱仪完成所有的NMR测试,质子共振频率为500.13 MHz.实验所用溶剂均为CDCl3,TMS为外标物,实验温度均为25℃.
1.2 实验配制CSA 1、DMAP、消旋布洛芬的CDCl3溶液,浓度均为25 mmol/L,分别测定1H NMR谱.按照CSA 1、DMAP和布洛芬浓度比为1:0:1,1:1:1,2:1:1,3:1:1,4:1:1,5:1:1,分别配制600 μL混合溶液,置于Φ 5 mm NMR样品管中,测定1H NMR,通过对比,确定最佳比为3:1:1.
将氟比洛芬、萘普生、酮洛芬和吲哚洛芬分别配制成25 mmol/L的CDCl3溶液,按照最佳比例与DMAP和CSA 1混合,进行手性识别实验.
配制(S)-(+)-布洛芬的CDCl3溶液,浓度为25 mmol/L,配制ee.值为0, 10, 30, 50, 70, 100%的溶液[以(S)-(+)-布洛芬计],按照CSA 1、DMAP、布洛芬最佳比配制混合溶液,进行1H NMR实验.
2 结果与讨论 2.1 化学计量关系为了考察手性溶剂化试剂CSA 1在DMAP存在下对布洛芬类药物的识别能力.首先将消旋布洛芬与CSA1按体积比为1:1混合,进行1H NMR实验,发现消旋布洛芬的α-H信号基本没有变化[图 2(a)],在上述比例溶液中,加入当量的DMAP,发现α-H的NMR信号发生裂分[图 2(b)],并且裂分效果非常好,可以准确积分,结果表明加入DMAP能够使CSA1对布洛芬进行有效识别.
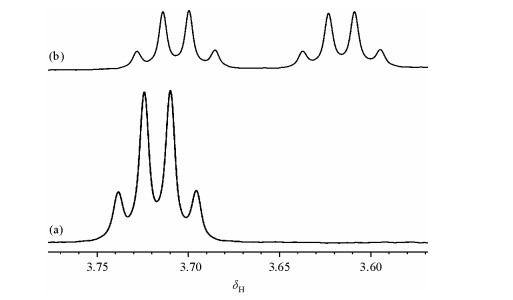
|
| 图 2 消旋布洛芬在CSA 1的条件(体积比1:1混合)下α-H的1H NMR,(a)不含DMAP,(b) 1当量DMAP Fig. 2 1H NMR spectra corresponding to α-H of rac-ibuprofen in the presence of one equivalent of CSA 1, (a) without and (b) with one equivalent of DMAP |
众所周知,手性分析过程中,识别效果与CSA的浓度有关,并且化合物的NMR信号是平衡存在于溶液中的络合和未络合状态下物种的加权平均值.因此,不同浓度的CSA对手性化合物的识别能力也会有所不同.同时,为了避免络合物在DMAP较高浓度情况下可能产生不稳定性,在布洛芬/DMAP体积比为1:1的条件下进行手性识别实验.
不同浓度的CSA 1对布洛芬的识别效果如图 3所示.通过对比,我们发现,当CSA 1与布洛芬的比例为1:1时α-H裂分ΔΔδ为32.96 Hz,随着CSA 1的比例不断增大,ΔΔδ也越来越大,当CSA 1与布洛芬的比例由1:1变为2:1,3:1时,ΔΔδ分别增加了12.40 Hz和15.20 Hz,而CSA 1与布洛芬的比例由3:1增加到4:1,乃至5:1,ΔΔδ共增加了6.15 Hz.出于对实验效果和药品用量等方面的考虑,确定CSA 1与布洛芬比为3:1为最佳比例.
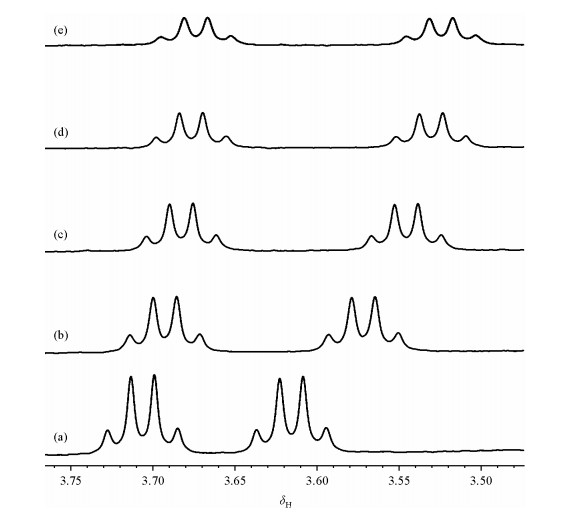
|
| 图 3 DMAP存在下,不同浓度CSA 1对布洛芬识别的1H NMR;CSA 1与布洛芬比例:(a) 1:1, (b) 2:1, (c) 3:1, (d) 4:1, (e) 5:1 Fig. 3 1H NMR spectra of rac-ibuprofen in the presence of one equivalent of DMAP and at different concentrations of CSA 1; (a) 1 equivalent, (b) 2 equivalent, (c) 3 equivalent, (d) 4 equivalent and (e) 5 equivalent |
在确定了最佳计量比之后,我们测试了CSA1/DMAP对布洛芬系列化合物的识别能力.如表 1所示,在CSA 1的作用下,化合物2~5的α-H信号均有不同程度的裂分,ΔΔδ值在0.133~0.202之间,氟比洛芬的α-H裂分值最小(entry 4),吲哚洛芬最大(entry 3).
| entry | carboxylic acid | ΔΔδ | ΔΔδ/Hz | spectra |
| 1 | 0.140 | 70.02 | ||
| 2 | 0.178 | 89.02 | ||
| 3 | 0.202 | 101.03 | ||
| 4 | 0.133 | 66.52 | ||
| 5 | 0.166 | 83.02 |
为了检测CSA1分析手性布洛芬对映体纯度的能力,配制了6个含有CSA1/DMAP且具有不同ee.值的布洛芬(0,10,30,50,70,100%,以S构型为参考计算)CDCl3溶液(图 4).通过1H NMR实验,积分计算所得实际ee.与理论ee.误差在±2%以内.图 4右图为积分所得ee.(y)与理论ee.(x)之间的曲线图,线性方程为y=0.998 5x-0.131 9,且线性关系R2=0.999 9.

|
| 图 4 左侧为6个不同ee.值的布洛芬在CSA 1/DMAP/布洛芬为1:1:3条件下测得的1H NMR部分对比谱图.右侧为理论ee.值与实际积分值的线性关系图(以(S)-(+)-布洛芬计) Fig. 4 Partial 1H NMR spectra of 1:1:3 mixtures of CSA 1, DMAP and ibuprofen (at six different ee. values). Linear correlation betweenee. values determined gravimetrically and by integration of signals shown on left side; ee. defined in terms of (S)-(+)-Ibuprofen |
经核磁共振实验结果表明,在DMAP的参与下,CSA 1对手性布洛芬类药物识别效果显著,与常规的手性色谱比较:节约色谱溶剂、操作简单、方便快速、准确有效,为手性药物的识别研究提供了新的途径.
| [1] | Williams K, Lee E . Importance of drug enantiomers in clinical pharmacology[J]. Drugs , 1985, 30 (4) : 333-354 DOI:10.2165/00003495-198530040-00003 |
| [2] | Islam M R, Mahdi Dr J G, Bowen I D . Pharmacological importance of stereochemical resolution of enatiomeric drugs[J]. Drug Safety , 1997, 17 (3) : 149-165 DOI:10.2165/00002018-199717030-00002 |
| [3] | You Qi-dong(尤启冬), Lin Guo-qiang(林国强) . Chiral Drug-Research and Application(手性药物:研究与应用)[M]. Beijing(北京): Chemical Industry Press(化学工业出版社), 2004 . |
| [4] | Du Yuan-yuan(杜媛媛), Ji Zhu-sheng(纪竹生), Liu Mai-li(刘买利) . Effects of NMR parameters on study of individual variations of plasma-ibuprofen interactions(NMR实验参数对IBP-血浆相互作用个性化差异研究的影响)[J]. Chinese J Magn Reson(波谱学杂志) , 2012, 29 (2) : 216-223 |
| [5] | Kaiser D G, Vangiessen G J, Reische R J et al . Isomeric inversion of ibuprofen (R)-enantiomer in humans[J]. J Pharm Sci , 1976, 65 (2) : 269-273 DOI:10.1002/jps.2600650222 |
| [6] | Wang Hong-lin(王洪林), Dong Shi-chang(董世昌), Li Li-wei(李立威) . A improved resolution process of ibuprofen(布洛芬的拆分工艺改进)[J]. Journal of Jing chu University of Technology(荆楚理工学院学报) , 2010, 25 (9) : 9-11 |
| [7] | Adams S S, Bresloff P, Masson C G . Pharmacological differences between the optical isomers of ibuprofen: evidence for Metabolic inversion of the (-)-isomer[J]. J Pharm Pharmacol , 1976, 28 (3) : 256-257 DOI:10.1111/jphp.1976.28.issue-3 |
| [8] | Shen Hao(沈颢) . Clinical application of dexibuprofen(右旋布洛芬的临床应用)[J]. Mod Diagn Treat(现代诊断与治疗) , 2003, 14 (3) : 175-177 |
| [9] | Błazewska K, Gajda T . (S)-Naproxen and (S)-Ibuprofen chlorides-convenient chemical derivatizing agents for the determination of the enantiomeric excess of hydroxy and aminophosphonates by 31P NMR[J]. Tetrahedron: Asymmetry , 2002, 13 : 671-674 DOI:10.1016/S0957-4166(02)00186-6 |
| [10] | Wenzel T J, Chisholm C D . Using NMR Spectroscopic Methods to Determined Enatiomeric Purity and Asign Absolute Stereochemstry[J]. Prog Nucl Magn Reson Spectros , 2011, 59 : 1-63 DOI:10.1016/j.pnmrs.2010.07.003 |
| [11] | Lei X X, Liu L, Chen X J et al . Pattern-Based Recognition for Determination of Enantiomeric Excess, Using Chiral Auxiliary Induced Chemical Shift Perturbation NMR[J]. Org Lett , 2010, 12 (11) : 2 540-2 543 DOI:10.1021/ol100773s |
| [12] | Liu L, Ye M D, Hu X G et al . Chiral solvating agents for carboxylic acids based on salan moiety[J]. Tetrahedron: Asymmetr , 2011, 22 : 1667-1671 DOI:10.1016/j.tetasy.2011.09.022 |
| [13] | Ma Q Z, Ma M S, Tian H Y et al . A novel amine receptor based on the binol scaffold functions as a highly effective chiral shift reagent for carboxylic acids[J]. Org Lett , 2012, 14 (23) : 5 813-5 815 DOI:10.1021/ol3027686 |
| [14] | Wang En-ju(王恩举), Chen Guang-ying(陈光英), Peng Ming-sheng(彭明生) . NMR study of chiral discrimination of ibuprofen enatiomers in β-Cyclodextrin inclusion complexes(NMR研究β-环糊精对布洛芬的手性识别)[J]. Chinese J Magn Reson(波谱学杂志) , 2009, 26 (2) : 216-221 |
| [15] | Liu Feng-liang(刘丰良), Li Yuan-yuan(李媛媛), Wang Wen-ge(王文革) et al . Synthesis of chiral amino alcohols from L-leucine and their chiral recognition of enantiomers of ibuprofen and mandelic acid(L-亮氨酸衍生物手性氨基醇的合成及其对布洛芬和扁桃酸对映异构体的手性识别)[J]. Chinese J Org Chem(有机化学) , 2011, 31 (5) : 747-751 |
| [16] | Liu Feng-liang(刘丰良), Yin Jun(尹军), Xiao Qing-bo(肖清波) et al . Synthesis of new chiral amino alcohol polydentate ligand and its chiral recognition for enantiomers of ibuprofen(新型手性氨基醇的合成及其对布洛芬对映异构体的手性识别)[J]. Guangzhou Chemistry(广州化学) , 2012, 37 (1) : 19-22 |
| [17] | Gospodarowicz K, Hołlyńska M, Paluch M et al . Novel chiral hexaazamacrocycles for the enantiodiscrimination of carboxylic acids[J]. Tetrahedron , 2012, 68 : 9 930-9 935 DOI:10.1016/j.tet.2012.09.093 |
| [18] | Moon L S, Pal M, Kasetti Y et al . Chiral solvating agents for cyanohydrins and carboxylic acids[J]. J Org Chem , 2010, 75 : 5 487-5 498 DOI:10.1021/jo100445d |
| [19] | Bian G L, Fan H J, Yang S W et al . A Chiral bisthiourea as a chiral solvating agent for carboxylic acids in the presence of DMAP[J]. J Org Chem , 2013, 78 (18) : 9 137-9 142 DOI:10.1021/jo4013546 |
| [20] | Chaudhari S R, Suryaprakash N . Ternary ion-pair complexation: A protocol for chiral discrimination and the assignment of absolute configuration of chiral hydroxy acids[J]. New J Chem , 2013, 37 : 4 025-4 030 DOI:10.1039/c3nj00779k |
 2014, Vol. 21
2014, Vol. 21



